La infección por Helicobacter pylori (H. pilory) afecta al 50% de la población mundial. Se dispone actualmente de métodos menos complejos para su detección.
ObjetivosIdentificar H. pylori mediante coproantígeno monoclonal y adicionalmente, su relación con gastropatías familiares.
Material y métodosEn 110 pacientes de edades entre 1 y 18 años, consideramos: antecedentes familiares de gastropatía, edad, género, síntomas gastrointestinales; también en sujetos aparentemente sanos. La prueba de coproantígeno monoclonal se realizó en muestras de materia fecal. Se compararon 2 grupos: I) sintomáticos (n=29), y II) asintomáticos (n=81), mediante estadística paramétrica y no paramétrica.
ResultadosDe la muestra, 59 (54%) fueron pacientes masculinos. La asociación entre antecedentes familiares de gastritis y positividad por H. pylori fue significativa, para: madres (p<0.0005), padres (p<0.0001), y abuelos paternos (p<0.0001); para cáncer gástrico fue significativa para abuelos maternos (p=0.0178), y para abuelos paternos (p=0.0092). La prueba de coproantígeno monoclonal fue positiva en 31 (28.2%) de los sujetos, en el grupo I todos resultaron positivos y en el grupo II, solo 2. Se observaron asociaciones significativas entre la positividad a H. pylori y diversos signos y síntomas, como: dolor epigástrico (p<0.001), dolor periumbilical recurrente (p<0.001), distensión abdominal (p=0.016), pirosis (p=0.0007), náuseas (p=0.0061), diarrea (p=0.0389), y estreñimiento (p=0.0019).
ConclusionesLa prueba de coproantígeno monoclonal resultó positiva para H. pylori en el 28% de los sujetos examinados y mostró asociaciones significativas con gastropatías familiares y sintomatología digestiva.
Infection by Helicobacter pylori (H. pilory) affects 50% of the world population. Simple methods for its detection are now available.
ObjectivesTo identify H. pylori by using a monoclonal coproantigen technique in paediatric patients, and to determine its association with gastrointestinal diseases.
Materials and methodsThe study included a total of 110 subjects aged 1 to 18 years. The study variables included: Family history of gastrointestinal disease, age, gender, gastrointestinal symptoms, as well as apparently healthy (asymptomatic) subjects. The monoclonal coproantigen test was performed on stool samples. Two groups, I symptomatic (n=29), and II asymptomatic (n=81) were compared using parametric and non-parametric statistics.
ResultsOf the 110 patients, 59 (54%) were male. The relationship between a family history of gastritis and a positive for H. pylori, was significant for mothers (p<0.0005), fathers (p<0.0001), and paternal grandfathers (p<0.0001). It was significant for gastric cancer in maternal grandparents (p<0.0178) and paternal grandparents (p<0.0092). The monoclonal coproantigen test was positive in 31 (28.2%) of the subjects. All were positive in group I, and only 2 in group II. A significant positive association was observed between H. pylori and various signs and symptoms, such as epigastric pain (p<0.001), recurrent peri-umbilical pain (p<0.001), bloating (p=0.016), heartburn (p=0.0007), nausea (P=0.0061), diarrhoea (p=0.0389), and constipation (p=0.0019).
ConclusionsH. pylori detection, was positive in 28% of both groups, and showed significant relationships with family gastrointestinal diseases and gastrointestinal symptoms.
Se estima que la infección por Helicobacter pylori (H. pilory) afecta al 50% de la población mundial1; en los países subdesarrollados y en desarrollo el 80% de los adultos y el 50% de los niños están colonizados. En México se conoce que el 30% de los niños de un año, y aun menores, se colonizan. La cifra se incrementa con la edad hasta alcanzar el 50% antes de los 10 años. En la actualidad, en muchos países no está aclarada cuál es la prevalencia de infección por H. pylori1–3.
La agresividad de la infección y el daño a la mucosa gástrica están determinados por diversos factores, entre ellos: la virulencia de la cepa de H. pylori, el gen citotóxico asociado A (cagA), la respuesta inflamatoria, las características bacterianas, la condición del huésped, los factores ambientales. En edades pediátricas, especialmente en menores de 5 años, los patrones clínicos son variables y algunos se distinguen con más precisión a mayor edad, e incluyen: desde un estadio asintomático hasta dolor epigástrico, distensión abdominal, diarrea alternante con periodos de estreñimiento, pirosis o dolor periumbilical recurrente2,4–7.
No existe en los niños un estándar de oro en las pruebas de detección de H. pylori; no obstante, la prueba de 13C Urea Breath Test (13C-UBT, por sus siglas en inglés), se ha categorizado así, ya que hasta ahora es la más sensible y específica, pero de alto costo, y su implementación en niños menores de 3 años no está exenta de problemas. Actualmente están disponibles para apoyo diagnóstico diversos métodos, incluidos los invasivos, como: la biopsia de mucosa gástrica para histología y cultivo, la determinación de anticuerpos en suero, la reacción en cadena de la polimerasa y la prueba de la ureasa. Entre los no invasivos están la detección de antígenos y anticuerpos contra H. pylori en saliva, orina y heces fecales (coproantígeno) y el cultivo de H. pylori en materia fecal. En fechas recientes se ha considerado que la detección de coproantígeno monoclonal para H. pylori es una prueba adecuada para estudios clínicos y epidemiológicos en los niños1,4,8–13.
En los niños se recomienda utilizar pruebas de más fácil aplicación, de menor costo y que no requieran la colaboración del niño, especialmente de aquellos que se encuentran en edades entre lactantes mayores y preescolares5,8–10. Hay 2 pruebas disponibles con estas características: una es el cultivo de H. pylori que encontraría viable o estaría en forma cocoide, y la otra es la detección de antígeno de H. pylori en materia fecal mediante anticuerpos mono- y policlonales. Recientemente se ha encontrado evidencia de que la prueba de coproantígeno monoclonal (CAM) constituye un método válido para el diagnóstico de infecciones por H. pylori en niños1,2,4,5,8,13–19, pero no hay evidencia reciente de su uso ni utilidad en niños mexicanos, al menos en la región noroeste.
ObjetivoEl propósito de este estudio fue identificar la presencia de H. pylori mediante CAM en pacientes con síntomas definidos, y en otros aparentemente sanos, de la consulta ambulatoria del Hospital Infantil del Estado de Sonora, así como, su relación con gastropatías en sus familiares.
Material y métodosSe seleccionó a pacientes en edades de 1 a 18 años que asistían a la consulta ambulatoria del sitio de estudio, entre los meses de enero de 2013 y junio de 2015 y se incluyó de manera secuencial a quienes manifestaban signos y síntomas sugestivos de estados dispépticos específicos como: dolor epigástrico y también dolor recurrente, gastritis, duodenitis y a aquellos que acudían al hospital a consulta de seguimiento del niño sano, es decir, aparentemente asintomáticos. Se excluyó a pacientes que tenían evidencia de enfermedad crónica, tratamiento con esteroides o de inmunosupresores, parasitosis agregadas, y a los que no desearan continuar en el estudio.
El estudio recibió aprobación bioética para su ejecución en el Hospital Infantil del Estado de Sonora y del Departamento de Medicina y Ciencias de la Salud de la Universidad de Sonora, con el consentimiento informado.
Variables de estudio: edad, sexo, antecedentes familiares de padres y abuelos (historia de gastritis e infección por H. pylori demostrada, úlcera gástrica, duodenal y cáncer gástrico). Se formaron 2 grupos: el grupo I fue conformado con sujetos sintomáticos y el II con sujetos que acudían a control del niño sano y se encontraban aparentemente asintomáticos al momento del estudio.
En los sujetos del grupo I, se identificaron mediante la aplicación de un cuestionario estructurado, para manifestaciones gastrointestinales como: dolor epigástrico, vómito, náuseas, distensión abdominal, pirosis, ardor gástrico o duodenal, diarrea, hiporexia, anorexia, sangrado de tubo digestivo alto, dolor abdominal recurrente, con las siguientes características: difuso o periumbilical, varias veces al día, matutino o durante el horario escolar, que fuese de corta duración, sin interferencia de apetito o actividad normal, y si ocurrió pérdida de peso. Los mismos datos se buscaron en los sujetos del grupo II.
Los sujetos fueron estratificados de acuerdo con su edad en: lactantes mayores, preescolares, escolares y adolescentes. A todos los integrantes del estudio se les efectuaron 3 coproparasitoscópicos de concentración mediante procedimiento de Stoll, y en una de las muestras se determinó coproantígeno para H. pylori, usando el reactivo Amplified IDEIATM Hp StAR, 2013. Las muestras fecales (0.1 g) se almacenaron a −70°C o bien se procesaron de inmediato. Se utilizaron 500μl de heces, homogenizadas por 15s en un vórtex y se centrifugaron por 5 min a 2,500rpm, y 50μl del sobrenadante se trasladaba a una microcelda y se le adicionaban control positivo y negativo y 50μl de enzima conjugada, tras lo cual, la microplaca se cubría e incubaba entre 18 y 27°C durante una hora. El reactivo complejo de anticuerpo conjugado determina la presencia de antígenos de H. pylori (complejo de emparedado). Después del proceso de lavado automático para remover anticuerpos no adheridos, se adicionaron 100μl de sustrato que se incubaron a 20-30°C por 10 min. Se leyeron en un espectrofotómetro a 450nm, y una densidad óptica de ≥ 0.190U fue considerada positiva4,8,9,14–19. Los pacientes asintomáticos que resultaron positivos a CAM o que tenían manifestaciones gastrointestinales relacionadas con H. pylori se remitieron a vigilancia en la consulta ambulatoria y en caso de que aparecieran síntomas o tuviesen antecedentes familiares de cáncer gástrico, se valoraban de nuevo.
A los niños sintomáticos y con coproantígeno positivo, se les indicó tratamiento para erradicación con inhibidores de bomba de protones (secnidazol, amoxicilina, claritromicina), y se citaron para una prueba de seguimiento mediante CAM un mes después1,4,9,18–23. Así mismo, se dio seguimiento a los pacientes con sintomatología muy definida para infección por H. pylori que resultaron con coproantígeno negativo; también, a los casos con antecedentes de episodios repetitivos de gastritis o presencia de úlcera gástrica, en familiares directos. De acuerdo al criterio clínico recibieron tratamiento de erradicación19–24. A los pacientes con parásitos se les trató y envió a la consulta ambulatoria del hospital para su control.
Las diferencias de positividad entre los grupos fueron examinadas mediante la prueba de chi cuadrada de Pearson. Para explorar la relación entre la positividad de H. pylori y los antecedentes familiares de gastropatías, por ejemplo: gastritis, úlcera gástrica y cáncer. Se empleó la prueba exacta de Fisher y la de Wald para diferencia de proporciones. Hipótesis de 2 colas fueron empleadas y valores de p<0.05 fueron considerados estadísticamente significativos. Se complementó el análisis calculando la razón de momios (RM), con intervalos de confianza al 95%, para examinar la potencial asociación entre la infección por H. pylori y los signos y síntomas de los sujetos. El análisis de datos se efectuó con el software JMP Pro 11.0 SAS Institute Inc.
ResultadosSe estudió a 110 pacientes, de los cuales 51 (46%) fueron de sexo femenino, y 59 (54%) de sexo masculino; la mayoría de los pacientes se registraron en primavera y verano. Respecto a las etapas pediátricas consideradas, se encontró que: 71 (64%) fueron lactantes mayores y preescolares, 22 (20%) fueron escolares y 17 (15%), adolescentes. Entre los antecedentes heredofamiliares del grupo I, constituido por 29 pacientes, 18 (62%) tenían referencia de gastritis en la madre y 29 (100%) en abuelos maternos; además hubo 6 (20%) con antecedente de cáncer gástrico en abuelos maternos. Por línea paterna se encontraron 19 (65%) casos de gastritris en los padres y 19 (65%) en los abuelos paternos, 14 (48%) en la abuela paterna y de estos, 7 (24%) tenían historia de cáncer gástrico.
De los antecedentes de 81 pacientes del grupo aparentemente sano, 22 (27%) de las madres de los niños refirieron gastritis, así como 41 (51%) de los abuelos maternos. Se identificó cáncer gástrico en 5 (6%) y úlcera gástrica en 2 abuelos maternos. De los 35 padres (44%) y de los 35 abuelos por línea paterna padecieron gastritis; 7 (8%) presentaron cáncer gástrico y uno, úlcera duodenal.
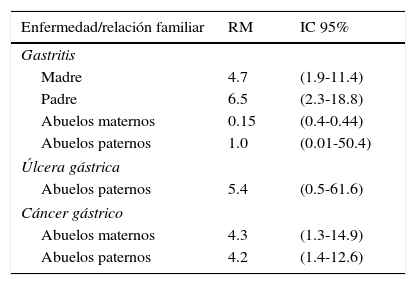
Con relación a los casos positivos-sintomáticos con el antecedente familiar de padecimientos gástricos, se observaron asociaciones significativas para gastritis en madres y en padres, así como para cáncer gástrico en abuelos maternos y paternos (tabla 1).
Relación entre familiares con gastropatías relacionadas con HP y casos positivos
| Enfermedad/relación familiar | RM | IC 95% |
|---|---|---|
| Gastritis | ||
| Madre | 4.7 | (1.9-11.4) |
| Padre | 6.5 | (2.3-18.8) |
| Abuelos maternos | 0.15 | (0.4-0.44) |
| Abuelos paternos | 1.0 | (0.01-50.4) |
| Úlcera gástrica | ||
| Abuelos paternos | 5.4 | (0.5-61.6) |
| Cáncer gástrico | ||
| Abuelos maternos | 4.3 | (1.3-14.9) |
| Abuelos paternos | 4.2 | (1.4-12.6) |
Nivel de significación=0.05.
HP: Helicobacter pylori; IC 95: intervalo de confianza al 95%; RM: razón de momios.
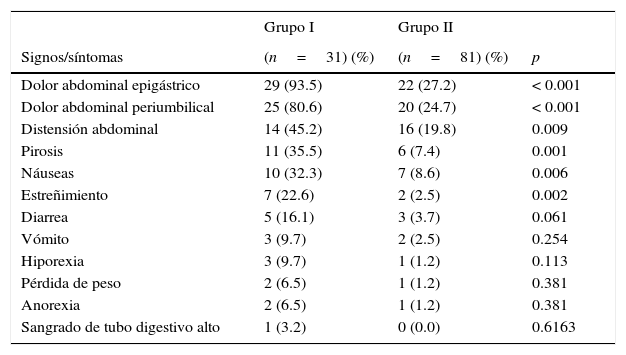
Por otra parte, cuando se comparó a los 2 grupos de estudio se apreciaron diferencias significativas en la distribución de manifestaciones clínicas, como: dolor abdominal epigástrico, periumbilical, distensión abdominal, pirosis, náuseas y estreñimiento; en todos los casos, con mayor frecuencia en el grupo de pacientes sintomáticos. No hubo diferencias significativas en el resto de las manifestaciones examinadas (tabla 2).
Distribución de manifestaciones clínicas en los grupos de estudio
| Grupo I | Grupo II | ||
|---|---|---|---|
| Signos/síntomas | (n=31) (%) | (n=81) (%) | p |
| Dolor abdominal epigástrico | 29 (93.5) | 22 (27.2) | < 0.001 |
| Dolor abdominal periumbilical | 25 (80.6) | 20 (24.7) | < 0.001 |
| Distensión abdominal | 14 (45.2) | 16 (19.8) | 0.009 |
| Pirosis | 11 (35.5) | 6 (7.4) | 0.001 |
| Náuseas | 10 (32.3) | 7 (8.6) | 0.006 |
| Estreñimiento | 7 (22.6) | 2 (2.5) | 0.002 |
| Diarrea | 5 (16.1) | 3 (3.7) | 0.061 |
| Vómito | 3 (9.7) | 2 (2.5) | 0.254 |
| Hiporexia | 3 (9.7) | 1 (1.2) | 0.113 |
| Pérdida de peso | 2 (6.5) | 1 (1.2) | 0.381 |
| Anorexia | 2 (6.5) | 1 (1.2) | 0.381 |
| Sangrado de tubo digestivo alto | 1 (3.2) | 0 (0.0) | 0.6163 |
Basado en una prueba exacta de Fisher o en chi cuadrada de Yates.
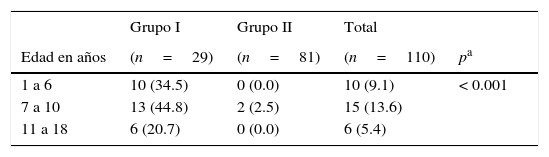
Al realizar la prueba de CAM, se observó que 29 de 31 (93.5%) sujetos del grupo I resultaron positivos y únicamente 2 de 81 (2.5%) en los pacientes del grupo II, que acudían a control del niño sano. No obstante, al aplicarles el cuestionario para explorar manifestaciones clínicas se encontró que también en el 27% de ellos hubo manifestaciones gastrointestinales relacionadas con posible infección por H. pylori. La diferencia en la distribución por grupo de edad fue significativa (tabla 3).
Distribución de la positividad a infección por HP mediante CAM, de acuerdo con grupo de edad de los sujetos de estudio
| Grupo I | Grupo II | Total | ||
|---|---|---|---|---|
| Edad en años | (n=29) | (n=81) | (n=110) | pa |
| 1 a 6 | 10 (34.5) | 0 (0.0) | 10 (9.1) | < 0.001 |
| 7 a 10 | 13 (44.8) | 2 (2.5) | 15 (13.6) | |
| 11 a 18 | 6 (20.7) | 0 (0.0) | 6 (5.4) |
CAM: coproantígeno monoclonal; HP: Helicobacter pylori.
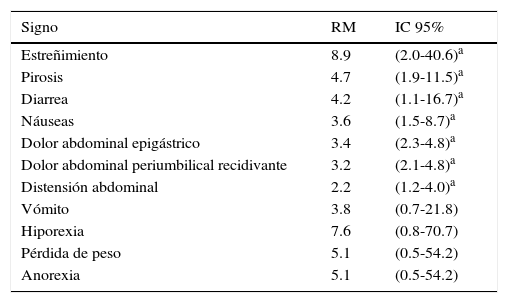
Cuando se examinó la relación entre la positividad de la prueba CAM y las manifestaciones clínicas, se observó que las asociaciones de mayor tamaño ocurrieron con el estreñimiento (RM=8.9, IC 95%: 2.0-40.6), la pirosis (RM=4.7, IC 95%: 1.9-11.5) y la diarrea (RM=4.2, IC 95%: 1.1-16.7), aunque también la presencia de náuseas, dolor abdominal y distensión abdominal mostraron estar asociadas con la positividad a H. pylori (tabla 4).
Asociación entre infección por HP y signos y síntomas de los sujetos de estudio
| Signo | RM | IC 95% |
|---|---|---|
| Estreñimiento | 8.9 | (2.0-40.6)a |
| Pirosis | 4.7 | (1.9-11.5)a |
| Diarrea | 4.2 | (1.1-16.7)a |
| Náuseas | 3.6 | (1.5-8.7)a |
| Dolor abdominal epigástrico | 3.4 | (2.3-4.8)a |
| Dolor abdominal periumbilical recidivante | 3.2 | (2.1-4.8)a |
| Distensión abdominal | 2.2 | (1.2-4.0)a |
| Vómito | 3.8 | (0.7-21.8) |
| Hiporexia | 7.6 | (0.8-70.7) |
| Pérdida de peso | 5.1 | (0.5-54.2) |
| Anorexia | 5.1 | (0.5-54.2) |
HP: Helicobacter pylori; IC 95%: intervalo de confianza al 95%; RM: razón de momios.
Finalmente, en los 31 pacientes que fueron considerados para intervención terapéutica, la respuesta fue adecuada en el 87%. En ellos, la prueba CAM realizada un mes después resultó negativa; por otro lado, se trató a 2 pacientes del grupo II porque tenían antecedentes de cáncer gástrico en familiares directos, a pesar de que estaban aparentemente sanos. A quienes volvieron a resultar positivos, se les ofreció de nuevo el esquema terapéutico.
DiscusiónEl presente estudio muestra que la detección de infección por H. pylori mediante la utilización de CAM es una prueba de valor en niños con manifestaciones clínicas gastrointestinales. La prueba detectó H. pylori en el 94% de los sujetos sintomáticos, pero su capacidad para identificar H. pylori fue bastante menor en los sujetos aparentemente sanos. Los hallazgos del estudio son consistentes y confirman lo registrado en reportes previos, que han mostrado que la técnica es útil5,8–10,13–16.
Con relación a los antecedentes familiares, fueron notablemente más frecuentes las historias de gastritis y cáncer gástrico. Con relación a las razones de momios obtenidas, los resultados se deben tomar con precaución, por la naturaleza de la distribución de la muestra de pacientes estudiada, ya que la prueba que se utiliza (máxima verosimilitud) requiere muestras más grandes.
Los signos y síntomas de H. pylori en la edad pediátrica necesitan de una buena caracterización, particularmente en los niños menores de 3 años, quienes tienen mayor dificultad de expresarse con claridad. Por esta razón es conocido que se obtienen datos más claros en escolares y adolescentes. Por otro lado, los signos y síntomas relacionados con H. pylori, aunque existen aún controversias, se ha señalado que juegan un papel importante en la ocurrencia de dolor abdominal recurrente8,11,16,20–26. En este reporte, al analizar la relación entre H. pylori y sintomatología gastrointestinal, esta variante de dolor abdominal constituyó la segunda manifestación en orden de frecuencia.
Un aspecto controversial es si el H. pylori debe ser investigado y tratado de manera rutinaria, aun en pacientes asintomáticos, debido a su estrecha relación con enfermedades gastrointestinales benignas y malignas, tanto en adultos como en niños. Mientras que en Canadá y Estados Unidos el tamizaje se considera poco beneficioso3–5,9,11–16,19–22, en la población pediátrica latinoamericana, incluyendo la mexicana, la bacteria H. pylori es una importante fuente de morbilidad; su prevalencia se encuentra entre el 30 y el 80% y está relacionada con cuadros de gastritis crónica y úlcera péptica2,7,14–16,18,20,22,25,26. En el Consenso Latinoamericano de la Infección por H. pylori, se concluyó que es recomendable la realización de estudios de prevalencia y factores asociados en cada grupo poblacional y que el H. pylori en Latinoamérica es un problema de salud pública que requiere planes de acción3,14,15.
La prueba serológica para identificar H. pylori es útil, pero previamente a su implementación es necesario establecer los puntos de corte adecuados, para definir los resultados como positivos en cada población. A pesar de que su utilidad en estudios de prevalencia ha sido mostrada, su uso rutinario en el diagnóstico no está definida con claridad, ya que existen controversias; además, esta prueba tiene el inconveniente de la invasividad14,26–29. En niños la utilidad de la prueba serológica no está completamente definida, pues depende de variaciones de la respuesta inmunológica a las distintas edades; por ello, aún es necesario contar con una prueba diagnóstica de bajo costo y fácil realización para la investigación rutinaria de H. pylori5,8,9,19.
El uso de CAM en nuestra institución permitió conocer que al menos el 28% de los pacientes que acuden a la consulta ambulatoria tenían infección por H. pylori. Además de su valor clínico, el procedimiento es de fácil aplicación, no es invasivo y puede ser de utilidad en el diagnóstico y seguimiento, especialmente en los pacientes sintomáticos que muestran positividad. No obstante esto, en la actualidad, para nuestro medio, tiene la desventaja de su costo. Desde luego tiene la ventaja de que también podría aplicarse en estudios de prevalencia, sin dejar de considerar que todo aquel paciente asintomático positivo debe ser estudiado mediante la prueba de urea marcada con carbono 13 en aliento o 13C-UBT.
Por otro lado, consideramos que es prudente continuar estudios en nuestro país que permitan, tanto en sintomáticos como en asintomáticos, conocer la sensibilidad y especificidad de esta prueba, para uso y recomendación más amplia en el diagnóstico como un método simple y no invasivo1,2,5,9,12.
En vista de que en México la infección por H. pylori es un problema de salud pública, relacionado además con el desarrollo ulterior de carcinoma gástrico, es prudente, por un lado, hacer el seguimiento del grupo de niños con antecedentes de cáncer gástrico en sus familiares y tratar en lo posible de conocer el tipo de neoplasia. Por otra parte, también es prudente ofrecer a las autoridades sanitarias evidencias para la implementación de proyectos de estudio y procedimientos auxiliares de diagnóstico accesibles, para la replicación en la población general. Así, se establecerían medidas de control y acciones sanitarias adecuadas1,2,6,30–32.
ConclusionesLa detección de H. pylori, mediante CAM, fue similar a lo que se registra en la literatura con este procedimiento. Hubo una relación estadísticamente significativa para gastropatías en adultos relacionadas con infección por H. pylori y los casos sintomáticos con prueba de CAM positiva. Pacientes aparentemente sanos manifestaron síntomas gastrointestinales y en el 2.5% fueron positivos a CAM. Respecto a las manifestaciones gastrointestinales, se observó que fue el dolor abdominal de localización epigástrica el más frecuente y le siguió el dolor periumbilical. Al comparar individualmente cada signo y síntoma con la prueba de CAM, las variables que resultaron significativas fueron: dolor epigástrico, dolor periumbilical recurrente, distensión abdominal, pirosis, náuseas y estreñimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores agradecemos la asesoría estadística al Dr. Ignacio Fonseca Chon, del Departamento de Ingeniería Industrial de la Universidad de Sonora.