As fístulas aorto-entéricas secundárias são complicações raras, mas potencialmente fatais após cirurgia da aorta abdominal e permanecem umas das mais desafiantes entidades patológicas vasculares a tratar.
Os autores apresentam um caso clínico de uma doente com antecedentes de cirurgia de reconstrução aórtica (bypass aorto-bifemoral realizado há 6 anos) para tratamento de doença arterial periférica, que foi admitida no nosso hospital por hemorragia digestiva tendo-se visualizado em esofagogastroduodenoscopia da 3° porção do lúmem duodenal, prótese de Dacron® de bypass aorto-bifemoral prévio.
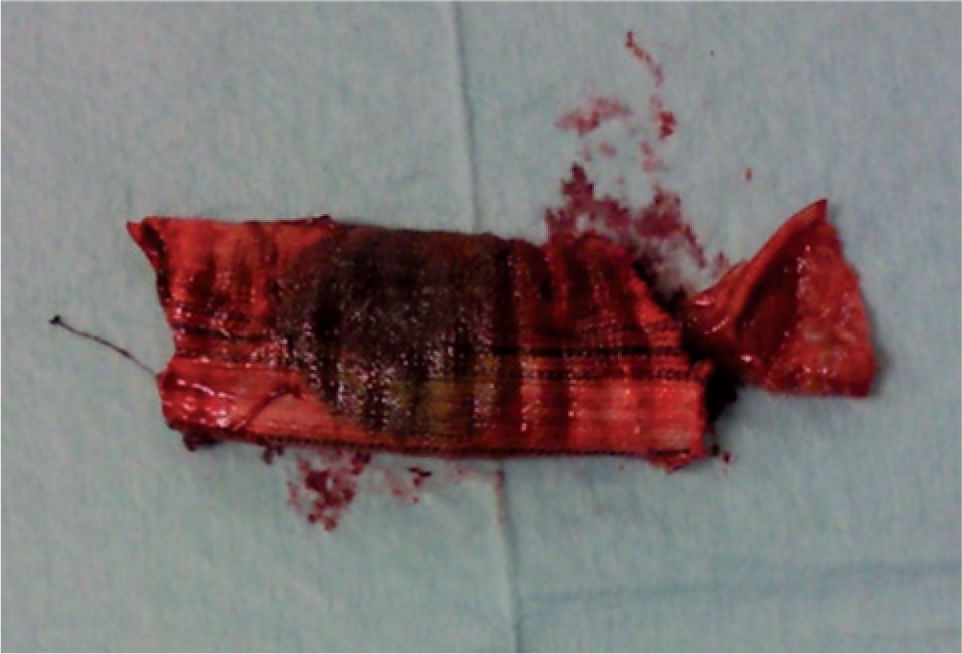
Efetuou-se então, com sucesso, um bypass axilo-bifemoral com duodenectomia segmentar, bypass duodeno-jejunal e remoção parcial do bypass aorto-bifemoral prévio.
A doente teve alta do nosso hospital, após longo internamento, do qual resultou isquemia irreversível do membro inferior direito com consequente necessidade amputação acima do joelho.
Secondary aorto-enteric fistulas are a rare but potentially fatal complication after abdominal aortic surgery and remain one of the most challenging vascular disease.
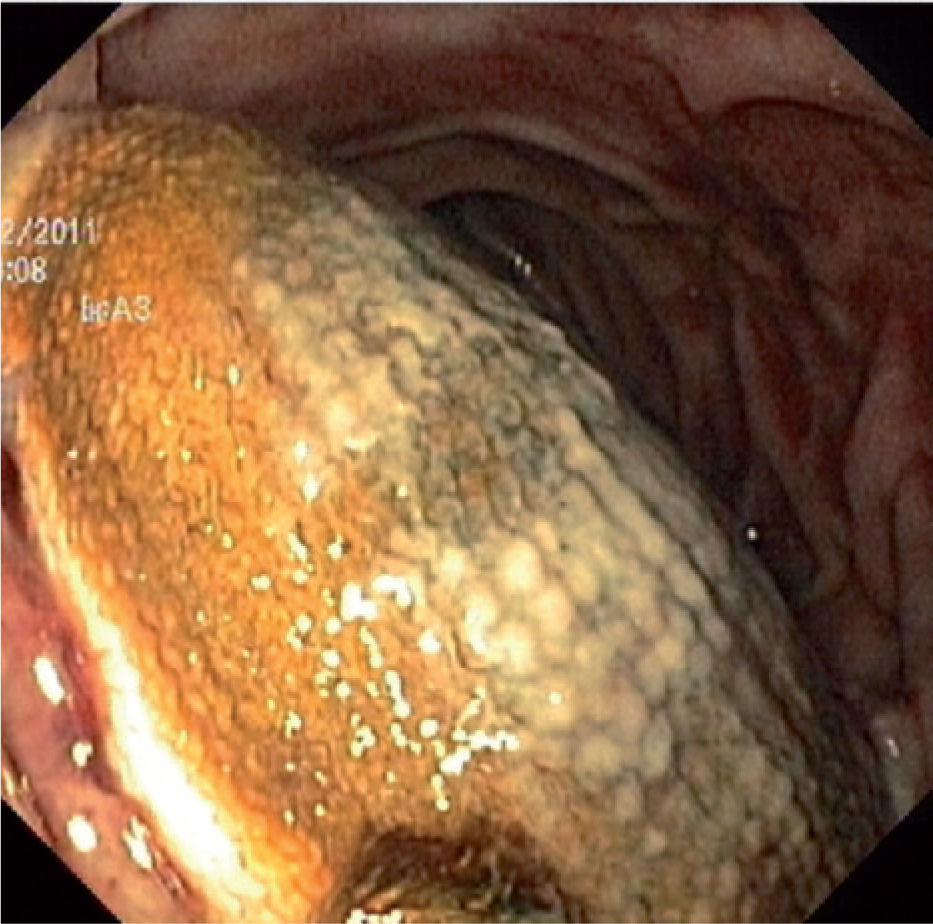
The authors present a case report of a female patient with past history of aortic reconstruction surgery (aortobifemoral bypass, performed 6 years previously) for treatment of peripheral artery disease, that was admitted in our hospital with a gastrointestinal bleeding. The Dacron® graft of the previous aortic procedure was visualized inside the 3rd portion of the duodenum in an esophagogastroduodenoscopy.
A successful axillobifemoral bypass, with segmental duodenectomy, duodenal-jejunal bypass and a partial removal of the aorto-bifemoral was performed.
The complications included irreversible ischemia of the right limb followed by above the knee amputation and the patient was discharged after a long hospital stay.
A comunicação direta entra a aorta e o tracto gastro-intestinal (TGI), permanece uma das mais temidas complicações aórticas que um Cirurgião Vascular pode enfrentar. Se a fístula ocorrer em território de uma aorta abdominal doente intitula-se primária, por sua vez se a fístula ocorrer em território previamente sujeito a reconstrução aórtica, denomina-se secundária.
A primeira descrição de uma fístula aorto-entérica (FAE) primária entre a aorta infra-renal e o duodeno foi publicada em 1829 por Sir Astley Cooper1, o primeiro caso de FAE secundária foi descrito em 1953 por Brock2 e a primeira cirurgia bem sucedida foi realizada em 1958 por MacKenzie3.
Desde a crescente introdução de materiais protésicos para tratamento de patologia aórtica que o número de FAE secundárias em muito ultrapassou o número de FAE primárias. A análise direta de FAE secundárias tem sido dificultada pela sua rara ocorrência (< 1%) depois de cirurgias aórticas reconstrutivas, uma vez que as FAE correspondem a um pequena fração (20–25%) da possível apresentação das infeções aórticas descritas na maioria das sérias4–6.
Infeções do enxerto aórtico tendem a afectar sobretudo materiais protésicos colocados para o tratamento de aneuris mas da aorta abdominal em rotura ou reparações aórticas complicadas por hematoma, trombose ou infeção da ferida cirúrgica7.
Busuttil e colaboradores relataram que correção de aneurismas rotos esteve associada a uma incidência de 1,7% de FAE em vez de 0,7% observada na cirurgia eletiva de correção de aneurismas e de apenas 0,2% após a reconstrução aórtica eletiva para a doença oclusiva aorto-ilíaca oclusiva8.
Neste contexto os autores apresentam um caso clínico raro onde foi efectuado com sucesso o tratamento cirurgico clássico de uma FAE secundária.
Caso clínicoDoente do sexo feminino de 80 anos de idade, com antecedentes hipertensão arterial e de doença arterial periférica, tendo já sido submetida a cirurgia de recons trução aórtica através de bypass aorto-bifemoral (com prótese de Dacron® para tratamento de doença aorto-ilíaca, realizada 6 anos antes), foi transferida de um Hospital secundário para a urgência de Gastroenterologia do Hospital de S. João, por quadro de hemorragia digestiva alta. À sua chegada, a doente apresentava-se sem queixas, apirética, hemodinâmicamente estável e com valor de hemoglobina de 8,5g/dL, leucocitose de 16,39×109/L e neutrofília de 89.8%.
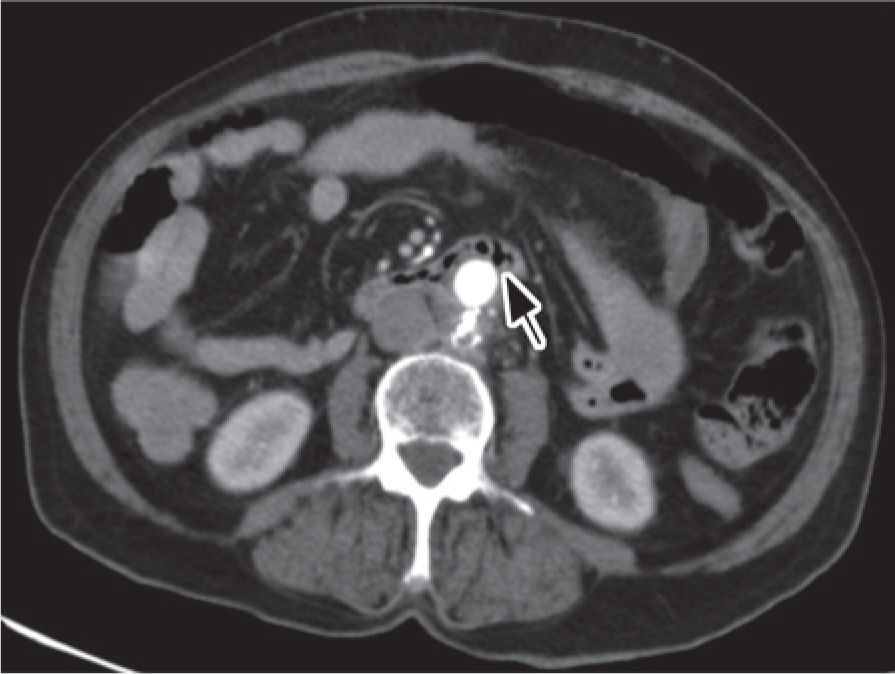
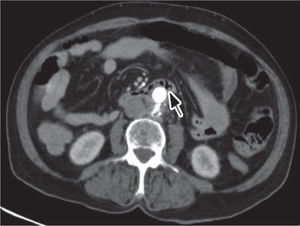
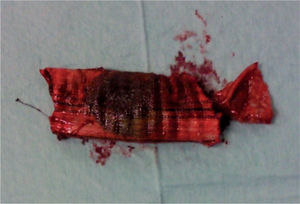
Foi realizada uma esofagogastroduodenoscopia que mostrou abundante conteúdo hemático no estômago e no lúmen intestinal da 3a porção do duodeno (D3), observou-se enxerto protésico de Dacron® de bypass aorto-bifemoral prévio (fig. 1). De seguida dada a estabilidade clínica apresentada e para melhor avaliação do processo patológico efetuou uma angio-TC onde se observou a prótese aórtica em continuidade com bolhas de gás situadas no interior do duodeno (fig. 2). Foi então efetuada cirurgia urgente, com a intervenção conjunta das especialidade de Cirurgia Vascular e de Cirurgia Geral, foi administrada profilaxia antibiótica pré-operatória composta por Teicoplanina 400mg e Cefa zolina 2g EV e realizado um bypass axilo-bifemoral (prótese de 8mm) direito, seguido de laparotomia xifo-púbica com duodenectomia segmentar, bypass duodeno-jejunal, remoção parcial do bypass aorto-bifemoral prévio (fig. 3), desbridamento tecidual e consequente laqueação aórtica com monofila mento. Durante a cirurgia foi feito um uso liberal de solução de Betadine® (B. Braun, Melsungen AG, Germany) na região retroperitoneal. No período intra-operatório a doente man teve-se hemodinâmicamente estável, tendo efectuado apenas 2 U de glóbulos vermelhos.
A doente esteve internada numa Unidade de Cuidados Intensivos durante 5 dias onde iniciou e tolerou alimentação líquida ao 5° dia pós-operatório, no final do qual foi transferida para uma Unidade de Cuidados Intermédios Cirurgicos onde permanceu 32 dias.
Por isolamente de E. coli e fungos leveduriformes nas hemoculturas intra-operatórias a doente efectuou 35 dias de Imipenem, Vancomicina e Fluconazol.
Ao 10° dia de internamento instalou-se quadro sético em consequência de coleções abdominais peri-aórticas, e por períodos transitórios de hipotensão a doente desenvolve isquemia irreversível do membro inferior direito ao 13° dia. Após drenagem percutânea das coleções intra-abdominais e após vários dias de terapêutica antibiótica a doente melhorou dos parâmetros analíticos (já sem leucocitose e diminuição drástica do valor da proteína C reativa), clínicos (com apiréxia sustentada) e imagiológicos (diminuição franca do tamanho das coleções abdominais), tendo sido efectuada amputação acima do joelho do membro inferior direito ao 28° dia e por fim transferida para o internamento.
Ao 40° dia, por queda na enfermaria com traumatismo na região da bacia, a doente foi novamente operada tendo sido realizada um osteossíntese de fratura trocantérica esquerda. Sem mais intercorrências, ao 49° dia de internamento a doente foi então transferida para o hospital de origem.
Um ano após a cirurgia a doente desenvolve flebotrombose poplítea-femoral esquerda, tendo ficado hipocoagulada com varfine®.
A doente apresenta-se atualmente semi-dependente para as atividades de vida diárias, (desloca-se em cadeirade- rodas), com bypass axilo-bifemoral funcionante, sem dor em repouso ou lesão trófica do membro inferior esquerdo (indice tornozelo-braço de 0,55).
DiscussãoAs fístulas aorto-entéricas secundárias são uma complicação rara, mas fatal, após cirurgia da aorta abdominal e permanecem uma das mais desafiantes entidades patoló gicas vasculares a tratar.
Fazer um diagnóstico assertivo é portanto extremamente necessário e muitas vezes difícil.
As manifestações clínicas da FAE, entre as quais a tríade clássica de hemorragia, sepsis e dor abdominal, raramente são encontradas9. O principal sintoma desta complicação cirúrgica da reconstrução aórtica é a hemorragia para o TGI superior10.
O intervalo desde a reconstrução aórtica até ao aparecimento de episódio hemorrágico é em média de 2 a 6 anos11–13.
A hemorragia gastrointestinal é frequentemente encontrada em conjunto com os sinais e sintomas de infeção. Apenas um quarto dos doentes terão evidência de infeção na altura do diagnóstico, sem nenhum episódio hemorrágico concomitante. Febre e mal-estar generalizado são comuns, mas a quantidade de febre e de leucocitose são geralmente baixos. Quadro de sépsis ocorre em apenas 27% dos doentes14.
Se um doente com hemorragia está estável, uma pesquisa mais atempada da fonte hemorrágica poderá ser realizada. No entanto, atrasos prolongados na avaliação pré-operatória podem representar perigos uma vez que até 40% dos doentes terão outro grande episódio hemorrágico dentro de 24 horas15–17.
Tradicionalmente as FAE desenvolvem-se entre a porção proximal do enxerto protésico aórtico e a 3a e 4a porção do duodeno.
O exame auxiliar mais frequentemente utilizado para o diagnóstico de FAE é a endoscopia digestiva alta. A angio-TC pode ajudar, mostrando sinais sugestivos de infeção, tal como a presença de gás ou de líquido peri-protésico18.
A maioria dos achados da angio-TC são consistentes com infeção e raramente mostram fluxo de contraste no percurso do trajeto fístuloso. Apresentam assim uma sensibilidade (94%) e uma especificidade (85%) elevadas19.
Apesar do mecanismo patogénio exato permanecer altamente especulativo, a erosão mecânica do material protésico para o intestino adjacente pode ser facilitado pela falta de tecido retro-peritoneal local, excessiva pulsatilidade de enxerto redundantemente colocado, ou uma infeção subjacente e indolente do enxerto protésico20, o que pode promover resposta inflamatória e erosão do intestino adjacente para a parede abcedada peri-protésica, assim como pode ocorrer processos infeciosos retro-peritoneais (p.e. pseudoquistos pancreáticos e abcessos diveticulares)7.
Enxertos protésicos estéreis aquando da entrada no campo operatório podem ser inoculados durante a cirurgia, quer devido a uma complicação cirúrgica quer devido a uma outra contaminação. Algum tempo depois o crescimento bacteriano pode ocorrer como resultado de uma redução nos mecanismos imunológicos de defesa do doente. O que parece corroborar esta teoria é o fato de que a maioria das bactérias isoladas de infeções de enxertos protésicos da aorta são flora habitual da pele21.
As bactérias mais frequentemente encontradas em culturas intra-operatórias são as gram negativas (52%), Gram positivas (21%) e as duas em 21%. A E. coli é a bactéria Gram negativa mais frequentemente isolada (52%) seguida de espécies da Klebsiella em 17%. Dos 42% dos doentes com isolamento dos gram positiva a bactéria S. epidermidis estava presente em metade dos casos7.
Várias medidas podem ser utilizadas para prevenir a infeção bacteriana inicial, durante a realização de cirurgia aórtica aberta:
- 1.
Proceder a uma adequada desinfeção e isolamento cutâneo no início da cirurgia.
- 2.
Administração de antibióticos de amplo espectro (cefalosporina de segunda ou terceira geração) destinadas a flora da pele a ser instituída 1 hora antes da incisão na pele.
- 3.
Durante a colocação de uma retração fixa, a atenção deve ser dirigida para evitar compressão indevida e isquémica do duodeno, através da colocação de compressas húmidas interpostas entre o intestino e os afastadores de metal.
- 4.
Existe um consenso entre experientes Cirurgiões Vasculares que uma separação adequada entre o intestino e o enxerto protésico colocado, através da colo cação de tecido retroperitoneal após a reconstrução aórtica é uma manobra importante para minimizar o risco de desenvolvimento das FAE. Se o tecido retro-peritoneral for considerado insuficiente poder-se-á utilizar um retalho de omento maior proveniente do mesocólon transverso e colocá-lo cuidadosamente entre o enxerto protésico e o duodeno22.
Factores associados com morte prematura normalmente estão relacionados com chegada do doente em choque, necessidade de suporte transfusional pré-operatório e neces sidade de clampagem aórtica supra-renal durante a cirurgia7.
Os objetivos do tratamento passam em primeiro lugar pela preservação da vida do doente e em seguida, pela salvação dos membros. Idealmente ambos os objetivos devem ser realizados. Os princípios fundamentais do tratamento cirúr gico são o controle de hemorragia, a reparação do TGI, o controle adequado da infeção e a manutenção de perfusão distal22.
Se o doente se apresentar com uma hemorragia ativa, o controle da aorta é imperativo e deve ser efetuado ainda antes da construção do bypass extra-anatómico, mesmo que esta abordagem possa acarretar algum aumento no risco de perda do membro e de um tempo de clampagem aórtico prolongado. O abdómen é normalmente explorado por meio de uma incisão na linha média, mas uma abordagem retroperitoneal esquerda pode ser utilizada alternativamente se for previsível difícil o controlo da aorta proximal, devido a um curto colo infra-renal. A des vantagem da abordagem retroperitoneal esquerda, no entanto, é o pior acesso inferior à artéria ilíaca comum direita e a distal exposição potencialmente menos favorável para a reparação duodenal. Além disso, se a construção de um bypass extra-anatómico for necessário, a abordagem retroperitoneal esquerda pode impedir o uso de um bypass axilo-bifemoral esquerdo22.
Existe controvérsia sobre a melhor abordagem do doente com FAE secundária porque várias opções de tratamento estão disponíveis, mas todas estão associadas com risco substancial a curto ou a longo prazo. As opções disponíveis passam por: (1) reparação local, (2) a remoção do enxerto protésico isolado, ambas com uma elevada taxa de mortalidade associada (3a) substituição protésica in situ, (3b) remoção do enxerto protésico com reconstrução com veia autógena e (4) a revascularização extra-anatómica e remoção do enxerto.
A mortalidade operatória desta patologia varia entre 13–86% com uma taxa de mortalidade média global de 30–40%. As taxas de amputação são habitualmente menores que 10% e a sobrevida a longo prazo aproxima-se de 50% em 3 anos22.
Em 2009 Bergqvist fez uma grande revisão de 332 casos de FAE secundários e concluiu que a melhor proposta terapêutica passava pela revascularização com bypass axilo-bifemoral e consequente remoção do enxerto protésico aórtico infetado, que contudo precisava de um doente hemodinamicamente estável23.
É do consenso geral que se existir clara evidência de contamização do enxerto protésico, que todo o material sintético infetado deva ser ressecado. Esta contaminação que é bastante mais provável quando a FAE envolvendo o TGI distal22.
O tecido aórtico infetado deve ser desbridado e a parede aórtica laqueada usando um fio de sutura (monofilamento) de preferência, em duas camadas22,24.
Se a infeção do enxerto se estender às artérias femorais, como no caso da colocação de um bypass aorto-bifemoral prévio, enxertos axilo-unifemorais bilaterais para a artéria femoral superficial, femoral profunda, ou poplítea pode ser necessária.
Uma variante desta abordagem envolve a utilização de um enxerto composto consistindo na colocação de um enxerto extra-anatômico sintético num plano do tecido não contaminado com o componente de enxerto autógeno estendendo-se para a região contaminada dos vasos femorais. Cuidados devem ser tomados para evitar a contaminação do componente sintético e o cirurgião deve estar familiarizado com técnicas como a rotação de retalho do músculo sartório para fornecer cobertura adequada pelos tecidos musculares aos vasos femorais. A cobertura antibiótica apropriada é importante de modo a minimizar o risco de infetar o enxerto protésico do bypass extra-anatómico, o qual pode ocorrer em cerca de 15–25% dos doentes5,25.
A resseção parcial por nós efectuada foi decidida com base na ausência de sinais infeciosos na região inguinais, imagens da angio-TC sem evidência de infeção na região pélvica e inguinal e por achados intra-operatórios compatíveis com a ausência de infeção dos ramos distais do bypass ABF prévio na região inguinal e tendo em vista minorar também o tempo operatório.
Gábor Bíró e colaboradores referem no estudo publicado em 2011, que não houve uma diferença estatisticamente significativa em termos de mortalidade, perda de membro e de sobrevida livre de infeção aos 3 anos entre a remoção total ou parcial dos enxertos aórticos infetados24.
Já na década de 80, Vollmar, afirmou que a substituição parcial da prótese vascular infetada apresentava melhores resultados quando comparada com outros métodos26.
Técnicas de substituição in situ também foram preconizadas por autores como Kieffer et al. Este grupo utilizou um “allograft” criopreservado para substituição de enxer tos protésicos infetados dos quais quase 1/3 por apresentavam FAE. Contudo 7% destes doentes morreram da infeção residual ou rotura do “allograft” em 1 a 2 meses após os pro cedimentos de substituição6.
A utilização de condutos criopreservados podem ser adequados em doentes cuidadosamente selecionados, se o inócuo bacteriano inicial for residual após o desbridamento do tecido sintético e autógeno infetado e se colonização bacteriana for suprimida. Os condutos criopreservados são essencialmente constituídos de colagénio, estes enxertos podem ser particularmente susceptíveis a bactérias Gramnegativas que produzem enzimas proteolíticas, o que pode resultar em elevada mortalidade24,27.
Substituições protésicas in situ por outros enxertos protésicos têm sido usados esporadicamente28.
Enxertos protésicos impregnados com rifampicina, têm sido usados para a substituição de enxertos aorto-ilíacos29,30, o que parece efetivamente uma ideia atraente, mas a principal desvantagem desta abordagem é a constatação que a actividade antibiótica emitida por este método é atualmente de curta duração31. O desenvolvimento de um melhor sistema de ligação dos antibióticos aos sistemas de distribuição podem tornar esta abordagem num método de escolha preferencial.
Nos últimos anos a correção de aneurisma por via endovascular (EVAR) suplantou em grande proporção as reconstruções aórticas abertas para correção destes aneu ris mas da aorta abdominal. Curiosamente as FAE após correção endovascular de aneurisma de aorta abdominal também tem sido relatados em vários casos clínicos e em pequenas séries32–37.
Isto parece contraditório já que a endoprótese é colocada intraluminalmente e é completamente envolta pela aorta nativa. Dado o pequeno número de casos de FAE secundárias após EVAR, conclusões sobre a sua verdadeira etiologia são difíceis. Ainda assim, teorias sobre uma angulação exuberantemente complicada do colo aneurismático tentam predizer um fator predisponente.
A continuada pressurização do aneurisma quer por endoleak ou endotensão pode resultar em uma pressão pul sá til sustentada do saco aneurismático levando à erosão duode nal. Além disso, a migração e o kinking de uma endoprótese não tão bem acoplada, pode desempenhar um papel na ulceração da aorta adjacente e na formação de FAE eventual. Infeção da endoprótese pode ser também um fator etiológico importante nestes casos22.
A utilização de endopróteses para o tratamento de FAE secundárias tem sido relatada por vários autores38–40.
Esta estratégia de implementar uma endoprótese em um enxerto protésico cirúrgico previamente colocado viola alguns dos princípios do tratamento cirúrgico identificados anteriormente: (1) a fístula entérica não é tratada, o que pode levar a uma infeção persistente e uma eventual contaminação da endoprótese recém-colocada, e o (2) desbridamento retroperitoneal não é possível. Outras limitações incluem a necessidade de vedar a fístula próximo das artérias renais, porque a maioria das FAE ocorre perto ao local da anastomose proximal e da disponibilidade de vários tamanhos de endopróteses adequadas para diferentes situação anatómicas. Apesar destas limitações, o EVAR para tratamento de FAE permite o tratamento da hemorragia massiça e do restabelecimento da perfusão sanguínea às extremidades inferiores com relativamente menor stress fisiológico em doentes muito debilitados38–40.
El Sakka e seus colaboradores utilizaram endopróteses aórticas para tratar 10 doentes com complicações de cirurgia aberta com uma taxa de mortalidade a 30 dias de 10%41, cinco dos quais com FAE. Após estas intervenções, efetivamente verificou-se um elevado número de recorrência de episódios séticos.
Danneels e colaboradores relataram o resultado de 15 doentes submetidos a EVAR para tratamento de FAE. A sua mortalidade aos 30 dias foi zero. No entanto, 9 dos 15 doentes (60%) apresentaram sinais de reinfeção o que obrigou a sete reoperações, a uma média de 9,5 meses. O que ocorreu apesar do tratamento antibiótico em curso. Estes autores concluíram que o EVAR para tratamento de FAE é promissor no curto prazo, mas que as taxas de reinfeção eram altas. Eles defenderam assim que esta técnica poderá quando possível servir como uma «ponte para a cirurgia»40.
Outros grupos também documentaram altas taxas de reinfeções tardias após o EVAR para tratamento das FAE42,43.
George A. Antoniou e colaboradores apresentaram do mesmo modo, um alto índice de reinfeção e de recorrência hemorrágica pós-operatória nos doentes submetidos a EVAR para a correção de FAE secundárias. A evidência de sépsis pré-operatória era indicadora de mau prognóstico44.
ConclusãoDada a elevada taxa de morbi-mortalida associada ao diagnóstico e tratamento desta patologia serve este caso clínico para tentar mostrar que uma história prévia de reconstrução aórtica, a presença de uma longa cicatriz abdominal e uma recente hemorragia gastrointestinal, devem levantar suspeita da existência de um FAE secundária, que poderá e deverá ser tratada da maneira mais diligente possível.
Pelo seu potencial de devastação e de fatalidade, as fístulas aorto-entéricas devem ser abordadas com alto nível de suspeição, tendo sempre em consideração que a sobrevida destes doentes depende grandemente do seu estado clínico na admissão, diagnóstico assertivo e pronta resposta cirúrgica.
Trabalho apresentado na XII Reunião Galaico Duriense, Porto, Portugal.