Determinar a influência da anatomia do aneurisma da aorta abdominal (AAA) nos resultados a curto e médio prazo após Endovascular Aneurysm Repair (EVAR).
MétodosEstudo retrospetivo de todos os doentes com AAA infrarrenal sem menção de rotura submetidos a EVAR aorto‐biilíaco programado na nossa instituição entre 2011‐2013 (n=112). Todos os exames de follow‐up imagiológico foram analisados numa plataforma com Osirix® e foram realizadas medições anatómicas com center lumen line. Apenas foram incluídos os doentes com um follow‐up imagiológico superior a 12 meses, o que resultou na exclusão de 33 (29%) casos. Os doentes foram divididos em 2 grupos: grupo com «anatomia favorável para EVAR» (f‐IFU); grupo com «anatomia desfavorável para EVAR» (df‐IFU).
ResultadosDos 79 doentes elegíveis para o estudo, 35,5% (n=28) foram realizados em doentes do grupo df‐IFU. Estes doentes apresentaram AAA com maiores dimensões (64,4± 10,1mm vs. 60,6±10,8mm, p=0,046) e colos mais curtos (19,8±11,8mm vs. 30,4±14,4mm, p=0,001).
A endoprótese mais utilizada foi a Endurant® (54,5%). Constatou‐se que o grupo df‐IFU é tratado mais frequentemente com endopróteses com sistema de fixação suprarrenal (85,7% df‐IFU vs. 69% f‐IFU, p=0,048).
O tempo médio de follow‐up foi de 21,9±9,8 meses (12‐46 meses).
A taxa de mortalidade perioperatória (0% df‐IFU vs. 2% f‐IFU) e a taxa de mortalidade global por todas as causas (12% df‐IFU vs. 11,9% f‐IFU) foi semelhante nos 2 grupos (p >0,05). Não se verificaram diferenças significativas nas taxas de endoleak (curto prazo 25% df‐IFU vs. 22% f‐IFU; médio prazo 12% df‐IFU vs. 23,8% f‐IFU) nem nas taxas de reintervenção (curto prazo 7,2% df‐IFU vs. 8% f‐IFU; médio prazo 4% df‐IFU vs. 4,8% f‐IFU) (p >0,05).
ConclusãoA realização de EVAR em doentes com anatomia desfavorável produziu resultados que são comparáveis aos dos doentes com anatomia favorável, quer a curto quer a médio prazo. São necessários estudos a longo prazo para confirmar estes achados.
The goal of this study is to determine the influence of abdominal aortic aneurysm (AAA) anatomy in endovascular aneurysm repair (EVAR) short and mid‐term outcomes.
MethodsA total of 112 patients underwent programed aorto‐biiliac EVAR at a single center between January 2011 and December 2013. Pre and postoperative imaging follow‐up were retrospectively reviewed and anatomical measures were calculated on Osirix® with center lumen line. Only patients with a postoperative imaging follow‐up of more than 12 months were included, resulting in the exclusion of thirty three (29%) cases. Patients were divided into 2 groups: the “EVAR suitable anatomy” group (f‐IFU) and the “EVAR challenging anatomy” group (df‐IFU).
ResultsA total of 35.5% (n=28) patients were in the df‐IFU group. These patients had larger AAA diameter (64.4±10.1mm vs 60.6±10.8mm) and shorter proximal neck (19.8±11.8mm vs 30.4±14.4mm) (p<0.05).
The device preferentially used was Endurant® (54,5%). The df‐IFU group was more likely to be treated with suprarenal fixation devices (85.7% df‐IFU vs 69% f‐IFU, p=.048).
Mean follow‐up was 21,9±9,8 months (12‐46).
Perioperative mortality (0% df‐IFU vs 2% f‐IFU) and all‐cause mortality rates (12% df‐IFU vs 11,9% f‐IFU) were similar between the two groups (p>0.05). There was no significant difference in endoleak rate (short‐term 25% df‐IFU vs 22% f‐IFU; mid‐term 12% df‐IFU vs 23.8% f‐IFU) and in re‐intervention rates (short‐term 7.2% df‐IFU vs 8% f‐IFU; mid‐term 4% df‐IFU vs 4.8% f‐IFU)(p>0.05).
ConclusionEndovascular treatment of AAA patients with challenging anatomy for EVAR provided acceptable short and mid‐term results that are comparable to those in patients with suitable anatomy. Long‐term follow‐up is unreliable necessary to confirm these results.
Desde a sua introdução por Parodi em 1991, o Endovascular Aneurysm Repair (EVAR) tem‐se afirmado como o tratamento de eleição dos aneurismas da aorta abdominal (AAA)1–2. Segundo Craig Kent3 estima‐se que, atualmente na Europa, cerca de 80% dos doentes com AAA são tratados por EVAR.
Embora já não seja discutível o seu benefício a curto prazo, demonstrado em vários estudos2,4,5, o seu uso universal ainda é condicionado pelas suas limitações anatómicas (definidas pelas instructions for use – IFU), questões de durabilidade e necessidade de um follow‐up longo e dispendioso.
Com o avanço desta tecnologia, a disponibilização das novas gerações de endopróteses e com o crescimento da experiência institucional, tem‐se tornado cada vez mais comum o tratamento de doentes com anatomia desfavorável para EVAR. Esta extrapolação das IFU fundamenta‐se na grande vantagem de sobrevida a curto prazo que o EVAR pode proporcionar a uma população de doentes com múltiplas comorbilidades e, portanto, de elevado risco.
Estudos prévios que abordaram os resultados do EVAR em doentes com anatomia desfavorável reportaram uma maior taxa de complicações relacionadas com o EVAR nos doentes que apresentavam colo proximal com características adversas6–9. Vários grupos têm desafiado estes estudos com publicações mais recentes que sugerem que o EVAR em doentes com anatomia desfavorável apresenta resultados que são aceitáveis e comparáveis aos dos doentes com anatomia favorável, quer a curto quer a médio prazo2,10–15.
O objetivo deste estudo é examinar os resultados da nossa prática institucional em EVAR e determinar se a anatomia dos AAA influencia os resultados a curto e médio prazo após EVAR. Pretende‐se demonstrar a não inferioridade do EVAR em doentes com anatomia desfavorável.
MétodosTipo de estudo e critérios de seleção dos doentesEstudo retrospetivo de todos os doentes com AAA infrarrenal sem menção de rotura submetidos a EVAR aorto‐biilíaco programado no Serviço de Angiologia e Cirurgia Vascular do Hospital de Santa Marta, no período de 3 anos compreendido entre janeiro 2011 e dezembro 2013.
Do total de 112 doentes elegíveis para o estudo, apenas foram incluídos os doentes com informação clínica completa e exames de imagem do AAA/EVAR acessíveis a consulta. Relativamente aos exames de imagem, apenas foram incluídos os doentes em que foi possível aceder ao exame de imagem pré‐operatório e a pelo menos 2 exames de imagem pós‐operatórios, sendo que o follow‐up imagiológico mínimo para inclusão no estudo eram 12 meses. O incumprimento destes critérios resultou na exclusão de um total de 33 (29%) doentes.
Avaliação anatómicaTodos os exames de follow‐up imagiológico foram analisados numa plataforma informática com Osirix® e foram objeto de revisão para realização das medições das características anatómicas dos AAA com «center lumen line». A realização das medições foi feita por um cirurgião vascular do serviço sem conhecimento dos resultados clínicos nem da endoprótese escolhida.
Os dados anatómicos colhidos foram: diâmetro máximo no AAA antes do EVAR e ao longo do follow‐up imagiológico; comprimento do colo proximal; diâmetro do colo proximal; angulação do colo proximal; presença de trombo no colo proximal; diâmetro máximo da artéria ilíaca comum e diâmetro máximo da artéria ilíaca externa.
Os exames de imagem pré‐operatórios foram analisados para caracterização morfológica dos AAA e classificar anatomicamente os doentes como tendo anatomia favorável ou desfavorável para EVAR.
Os exames de imagem pós‐operatórios foram analisados para avaliar as alterações morfológicas nos AAA pós‐EVAR e a incidência de complicações pós‐operatórias.
DefiniçõesOs doentes foram categorizados em 2 grupos: grupo com «anatomia favorável para EVAR» (f‐IFU) e grupo com «anatomia desfavorável para EVAR» (df‐IFU).
Os doentes foram definidos como df‐IFU quando apresentavam uma ou mais das seguintes características anatómicas: colo proximal curto (<15mm); colo proximal angulado (>60°); presença de trombo no colo proximal (com uma espessura >5mm e uma extensão circunferencial >50%); diâmetro máximo das artérias ilíacas externas <7mm.
Definiram‐se como «outcomes» deste estudo a mortalidade perioperatória (<30 dias), a mortalidade global por todas as causas, a mortalidade relacionada com a endoprótese, o desenvolvimento de endoleaks ou de outros eventos adversos relacionados com a endoprótese (migração, trombose, estenose, rotura secundária do AAA) e a taxa de intervenções secundárias.
EstatísticaA comparação entre os subgrupos foi realizada com o teste de «Mann‐Whitney U» para variáveis contínuas e o teste de Pearson χ2 para variáveis categóricas. Os resultados foram considerados estatisticamente significativos para valores de p<0,05. As variáveis contínuas são apresentadas como média±desvio padrão, seguidas do valor do intervalo quando considerado apropriado. As variáveis categóricas são apresentadas como percentagens. O trabalho estatístico dos dados foi realizado no SPSS®.
ResultadosDados demográficos e características dos gruposNo total foram incluídos 79 doentes no presente estudo, com uma idade média de 72,5 anos (51‐89 anos) e dos quais apenas 7 (9%) do sexo feminino. O tempo médio de follow‐up foi de 21,9±9,8 meses (12‐46 meses).
As características anatómicas dos doentes encontram‐se sumarizadas na tabela 1.
Características anatómicas dos AAA
| Parâmetros (n=79) | n (%) |
|---|---|
| Anatomia favorável (dentro das IFU) | 51 (64,5) |
| Anatomia desfavorável (fora das IFU) | 28 (35,5) |
| Colo proximal curto (<15mm) | 15 (19) |
| Colo proximal angulado (>60°) | 12 (15) |
| Trombo no colo proximal (espessura >5mm e/ou extensão circunferencial >50%) | 11 (14) |
| Diâmetro máximo das artérias ilíacas externas <7mm | 8 (10) |
| Dois ou mais parâmetros anatómicos | 13 (16,5) |
Considerando a população total de doentes incluídos no estudo (n=79), cerca de um terço (n=28/79) dos doentes apresentaram anatomia desfavorável para EVAR, dos quais 19% colos curtos (<15mm), 15% colos angulados (>60°), 14% colos com trombo significativo (>5mm ou >50%), 10% artérias ilíacas com <7mm de diâmetro e 16% apresentaram mais de 2 destas características anatómicas. Desta forma, o grupo f‐IFU consistiu em 51 doentes (64,5%) e o grupo df‐IFU consistiu nos restantes 28 doentes (35,5%).
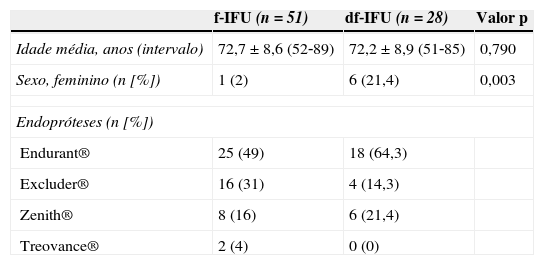
A idade média foi similar em ambos os grupos (tabela 2). Por outro lado, as mulheres apresentaram com maior frequência AAA com anatomia desfavorável para EVAR (p=0,003) (tabela 2).
Características demográficas e endopróteses utilizadas em ambos os grupos
| f‐IFU (n=51) | df‐IFU (n=28) | Valor p | |
|---|---|---|---|
| Idade média, anos (intervalo) | 72,7±8,6 (52‐89) | 72,2±8,9 (51‐85) | 0,790 |
| Sexo, feminino (n [%]) | 1 (2) | 6 (21,4) | 0,003 |
| Endopróteses (n [%]) | |||
| Endurant® | 25 (49) | 18 (64,3) | |
| Excluder® | 16 (31) | 4 (14,3) | |
| Zenith® | 8 (16) | 6 (21,4) | |
| Treovance® | 2 (4) | 0 (0) | |
Todos os doentes foram submetidos a EVAR aorto‐biilíaco tendo‐se utilizado as seguintes endopróteses: Endurant® (54,5%, n=43), Excluder® (25,3%, n=20), Zenith® (17,7%, n=14) e Treovance® (2,5%, n=2). A escolha das endopróteses não foi randomizada ou controlada entre os 2 grupos, tendo‐se baseado na experiência e preferência pessoal do cirurgião. Em ambos os grupos a endoprótese mais utilizada foi a Endurant®. Constatou‐se que o grupo df‐IFU é tratado mais frequentemente com endopróteses com sistema de fixação suprarrenal (85,7% [n=24/28] df‐IFU vs. 69% [n=35/51] f‐IFU, p=0,048).
Morfologia dos aneurismas da aorta abdominalNo geral (n=79), o diâmetro pré‐operatório médio dos AAA foi de 61,9±10,7mm, dos quais 88% com um diâmetro superior a 55mm, 48% com um diâmetro superior a 60mm e 24% com um diâmetro superior a 70mm.
Na tabela 3 estão detalhadas as principais características morfológicas dos AAA de cada um dos grupos.
Características morfológicas dos AAA em ambos os grupos
| Parâmetros | f‐IFU (n=51) | df‐IFU (n=28) | Valor p |
|---|---|---|---|
| Diâmetro colo proximal (mm) | 24,5±3,4 | 25,0±5,0 | 0,955 |
| Comprimento colo proximal (mm) | 30,4±14,4 | 19,8±11,8 | 0,001 |
| Colo proximal 10‐15mm (n [%]) | 0 (0) | 9 (32) | |
| Colo proximal <10mm (n [%]) | 0 (0) | 6 (21) | |
| Angulação colo proximal >60° (n [%]) | 0 (0) | 12 (43) | |
| Trombo colo proximal ≥50% (n [%]) | 0 (0) | 11 (39) | |
| Diâmetro artérias ilíacas <7mm (n [%]) | 0 (0) | 8 (28) | |
| ≥2 parâmetros anatómicos desfavoráveis | 0 (0) | 13 (46) | |
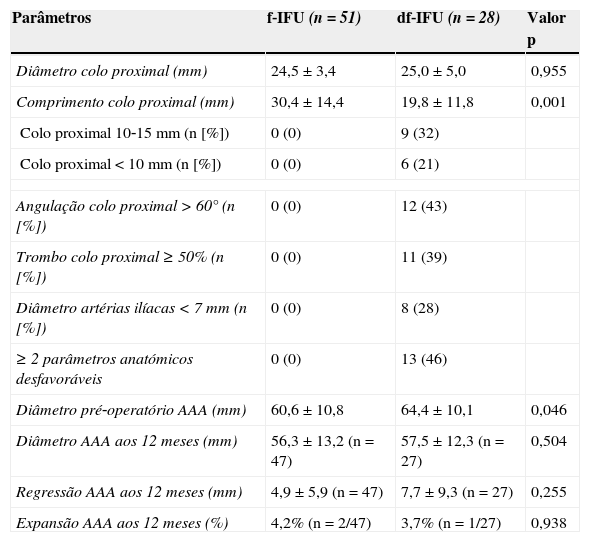
| Diâmetro pré‐operatório AAA (mm) | 60,6±10,8 | 64,4±10,1 | 0,046 |
| Diâmetro AAA aos 12 meses (mm) | 56,3±13,2 (n=47) | 57,5±12,3 (n=27) | 0,504 |
| Regressão AAA aos 12 meses (mm) | 4,9±5,9 (n=47) | 7,7±9,3 (n=27) | 0,255 |
| Expansão AAA aos 12 meses (%) | 4,2% (n=2/47) | 3,7% (n=1/27) | 0,938 |
Constatou‐se que os doentes do grupo df‐IFU apresentaram AAA com maiores dimensões (64,4±10,1mm vs. 60,6±10,8mm, p<0,05). De igual forma, também se verificou que os doentes do grupo df‐IFU apresentaram colos mais curtos (df‐IFU=19,8±11,8mm vs. f‐IFU=30,4±14,4mm, p<0,05), sendo que >50% (n=15) apresentavam colos<15mm, 32% (n=9) colos de 10‐15mm e 21% (n=6) colos muito curtos (<10mm). Quase metade do grupo df‐IFU (46%) apresentou ≥2 parâmetros anatómicos desfavoráveis para EVAR.
Ambos os grupos apresentaram uma regressão similar no diâmetro do saco aneurismático (df‐IFU=7,7±9,3mm vs. f‐IFU=4,9±5,9mm, p >0,05). Por outro lado, verificou‐se que o grupo df‐IFU apresentou uma regressão significativa (>5mm) num maior número de casos (48% [n=13] vs. 37% [n=19] no grupo f‐IFU). A percentagem de casos em que se verificou estabilidade (variação de 0‐4mm) ou expansão (>5mm) do saco aneurismático foi semelhante nos 2 grupos.
Resultados a curto prazoAmbos os grupos não apresentaram diferenças significativas nas taxas de mortalidade e morbilidade precoce (tabela 4).
Morbimortalidade perioperatória (<30 dias)
| Complicação curto prazo (n[%]) | f‐IFU (n=51) | df‐IFU (n=28) | Valor p |
|---|---|---|---|
| Procedimentos intraoperatórios adjuntos (%) | 2 (4) | 6 (21,4) | 0,014 |
| Mortalidade aos 30 dias (%) | 1 (2) | 0 (0) | 0,292 |
| Endoleak (todos) (%) | 11 (22) | 7 (25) | 0,730 |
| Endoleak tipo 1 a (n) | 1 | 1 | |
| Endoleak tipo 1 b (n) | 0 | 1 | |
| Endoleak tipo 2 (n) | 10 | 5 | |
| Endoleak tipo 3 (n) | 0 | 0 | |
| Migração (>10mm) (%) | 0 (0) | 0 (0) | |
| Rotura secundária (%) | 0 (0) | 0 (0) | |
| Trombose/estenose ramo (%) | 3 (6) | 0 (0) | 0,194 |
| Reintervenção (%) | 4 (8) | 2 (7,2) | 0,911 |
| Complicações médicas (%) | 1 (2) | 2 (7,2) | 0,252 |
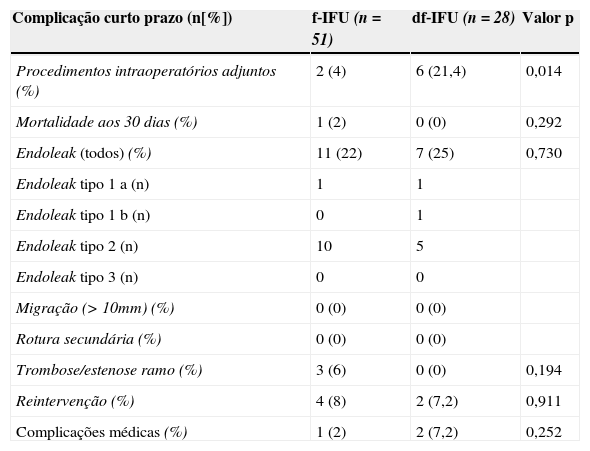
Nenhum doente do grupo df‐IFU morreu até aos 30 dias de pós‐operatório, enquanto um doente (2%) do grupo f‐IFU morreu ao 4.° dia de pós‐operatório por enfarte agudo do miocárdio.
Verificou‐se que no grupo df‐IFU foi necessário, com maior frequência, realizar procedimentos intraoperatórios adjuntos (df‐IFU=21,4% vs. f‐IFU=4%, p<0,05), nomeadamente: 3 casos em que foi realizada angioplastia ilíaca, 2 casos com colocação de um stent para uma das artérias renais e um caso em que foi necessária a realização de uma interposição iliofemoral por rotura da artéria ilíaca externa. Os 4 casos de procedimentos adjuntos nas artérias ilíacas ocorreram todos em doentes que apresentavam pré‐operatoriamente artérias ilíacas <7mm de diâmetro. Tendo em conta que um total de 8 doentes foram classificados como df‐IFU por apresentarem artérias ilíacas <7mm, 50% (n=4/8) dos casos com artérias ilíacas <7mm de diâmetro apresentaram uma complicação intraoperatória que necessitou de um procedimento adjunto ao EVAR para a sua resolução.
As complicações perioperatórias encontram‐se sumarizadas na tabela 4.
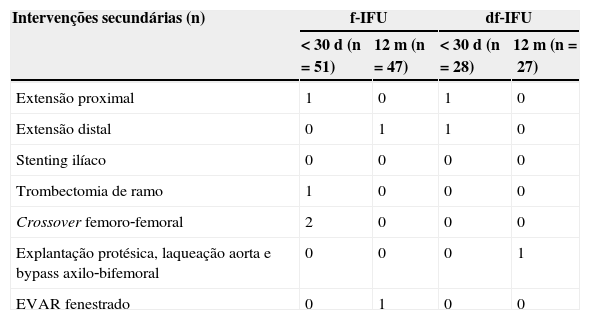
Não se verificaram diferenças significativas nas taxas de endoleak (f‐IFU=22% vs. df‐IFU=25%, p>0,05) nem nas taxas de reintervenção (f‐IFU=8% vs. df‐IFU=7,2%, p>0,05). Todos os doentes com endoleak tipo 1 (um do grupo f‐IFU e 2 do grupo df‐IFU) foram tratados num procedimento secundário com uma extensão proximal (endoleak tipo 1a) ou distal (endoleak tipo 1b); nenhum dos doentes com endoleak tipo 2 (de ambos os grupos) necessitou de reintervenção. De salientar que se verificaram 3 casos de trombose de ramo do EVAR, todos eles do grupo f‐IFU (embora a diferença não seja estatisticamente significativa), com necessidade de reintervenção: trombectomia num caso e realização de crossover femoro‐femoral em 2 casos. Na tabela 5 encontram‐se detalhadas as intervenções secundárias levadas a cabo em cada um dos grupos.
Intervenções secundárias após EVAR
| Intervenções secundárias (n) | f‐IFU | df‐IFU | ||
|---|---|---|---|---|
| <30d (n=51) | 12m (n=47) | <30d (n=28) | 12m (n=27) | |
| Extensão proximal | 1 | 0 | 1 | 0 |
| Extensão distal | 0 | 1 | 1 | 0 |
| Stenting ilíaco | 0 | 0 | 0 | 0 |
| Trombectomia de ramo | 1 | 0 | 0 | 0 |
| Crossover femoro‐femoral | 2 | 0 | 0 | 0 |
| Explantação protésica, laqueação aorta e bypass axilo‐bifemoral | 0 | 0 | 0 | 1 |
| EVAR fenestrado | 0 | 1 | 0 | 0 |
Durante o follow‐up perderam‐se 9 (18%) doentes do grupo f‐IFU e 3 (11%) doentes do grupo df‐IFU, pelo que a informação relativa ao follow‐up total dos doentes foi possível em apenas 42 doentes do grupo f‐IFU e 25 doentes do grupo df‐IFU.
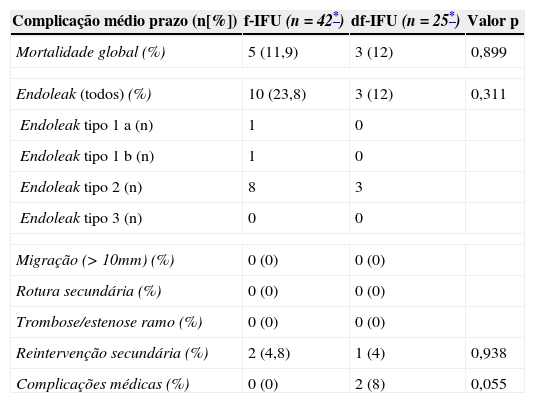
A taxa de mortalidade global (por todas as causas) foi comparável nos 2 grupos (f‐IFU=11,9% vs. df‐IFU=12%, p>0,05) (tabela 5). Por outro lado, a taxa de mortalidade relacionada com a endoprótese foi maior no grupo df‐IFU (66% [n=2/3] vs. 0% [n=0/5], p=0,05). As 2 mortes relacionadas com a endoprótese verificadas no grupo df‐IFU foram: uma por infeção protésica (42 meses após o EVAR) e a outra por fístula aorto‐entérica secundária (32 meses após o EVAR). A terceira morte do grupo df‐IFU foi por pneumonia. Nenhuma das mortes do grupo f‐IFU esteve relacionada com a endoprótese (3 por pneumonia, uma por enfarte agudo do miocárdio e uma por recidiva de neoplasia do cólon).
Curiosamente, o grupo f‐IFU apresentou uma taxa de endoleak ligeiramente superior ao grupo df‐IFU (23,8 vs. 12%, respetivamente), contudo, esta diferença não foi estatisticamente significativa (p>0,05). Constatou‐se que o endoleak tipo 1a ocorreu por dilatação aneurismática da aorta visceral tendo sido corrigido por EVAR fenestrado e o endoleak tipo 1b ocorreu por dilatação aneurismática do sector ilíaco tendo sido corrigido com uma extensão distal.
Não se verificaram diferenças significativas nas taxas de reintervenção (f‐IFU=4,8% vs. df‐IFU=4%, p>0,05) (tabela 6). O único doente do grupo df‐IFU que necessitou de reintervenção foi o caso de infeção protésica.
Morbimortalidade a médio prazo (após 12meses)
| Complicação médio prazo (n[%]) | f‐IFU (n=42*) | df‐IFU (n=25*) | Valor p |
|---|---|---|---|
| Mortalidade global (%) | 5 (11,9) | 3 (12) | 0,899 |
| Endoleak (todos) (%) | 10 (23,8) | 3 (12) | 0,311 |
| Endoleak tipo 1 a (n) | 1 | 0 | |
| Endoleak tipo 1 b (n) | 1 | 0 | |
| Endoleak tipo 2 (n) | 8 | 3 | |
| Endoleak tipo 3 (n) | 0 | 0 | |
| Migração (>10mm) (%) | 0 (0) | 0 (0) | |
| Rotura secundária (%) | 0 (0) | 0 (0) | |
| Trombose/estenose ramo (%) | 0 (0) | 0 (0) | |
| Reintervenção secundária (%) | 2 (4,8) | 1 (4) | 0,938 |
| Complicações médicas (%) | 0 (0) | 2 (8) | 0,055 |
Apesar da evolução que a tecnologia do EVAR tem tido nos últimos anos, a anatomia dos AAA (determinada pelo cumprimento/incumprimento das IFU) continua a ser um fator crítico para a elegibilidade dos doentes para tratamento por EVAR. A solução endovascular para os doentes que são excluídos por estas limitações anatómicas e que apresentam risco elevado para cirurgia convencional é o uso de endopróteses especializadas (fenestradas/ramificadas), mas cuja complexidade técnica é elevada e a disponibilidade é limitada, o que implica a sua realização em centros de referência, impossibilitando o seu uso generalizado.
Desta forma, a estratégia que tem sido adotada por vários centros para tentar expandir a disponibilidade e a aplicabilidade do EVAR tem sido o seu uso em doentes com características anatómicas fora das IFU. De facto, têm sido reportados cada vez mais casos de EVAR em doentes com anatomia desfavorável e, portanto, fora das IFU. Neste estudo, 35,4% dos doentes apresentaram anatomia desfavorável sendo que o sexo feminino parece estar relacionado com uma maior complexidade anatómica dos AAA (p<0,05).
Foram publicados vários estudos que reportaram um maior número de eventos adversos relacionados com a endoprótese em doentes submetidos a EVAR e que apresentavam ≥1 parâmetro anatómico fora das IFU. Leurs et al.6, investigadores do estudo EUROSTAR, documentaram um aumento das taxas precoces e tardias de endoleak tipo 1 nos doentes com colo proximal com um comprimento <15mm. Cerca de um ano mais tarde, Hobo et al. (em colaboração com Leurs et al. também no âmbito do EUROSTAR7) documentaram resultados similares nos doentes com uma angulação do colo proximal >60°. O estudo publicado por Abbruzzese et al.8 revelou que o uso do EVAR em doentes com critérios anatómicos fora das IFU está associado a um efeito negativo nos resultados a longo prazo (aos 5 anos), nomeadamente na taxa de eventos adversos relacionados com a endoprótese e na taxa de trombose. Schanzer et al.9 constataram que, ao fim de 5 anos de follow‐up, 41% dos doentes com anatomia fora das IFU que foram submetidos a EVAR apresentaram expansão do saco aneurismático. Este autor concluiu que a presença de características anatómicas desfavoráveis para EVAR constitui um fator de risco independente para a expansão do saco aneurismático.
Contrariando os resultados destes estudos, os nossos resultados a curto e médio prazo não revelam diferenças estatisticamente significativas na taxa de mortalidade perioperatória, na taxa de mortalidade global por todas as causas, na regressão do saco aneurismático, na taxa de endoleak, na taxa de migração protésica, na taxa de trombose/estenose de ramo, na taxa de intervenções secundárias nem na taxa de complicações médicas. Constatou‐se que poderá haver maior número de mortes relacionadas com a endoprótese no grupo df‐IFU (66% [n=2/3] no grupo df‐IFU vs. 0% [n=0/5] no grupo f‐IFU, p=0,05, mas a diferença não é estatisticamente significativa (provavelmente por a amostra ser pequena). Verificou‐se também que a presença de artérias ilíacas com um diâmetro <7mm poderá estar associada a uma maior incidência de complicações intraoperatórias relacionadas com o acesso (já que 50% dos doentes com artérias ilíacas com <7mm foram submetidos a algum tipo de procedimento intraoperatório adjunto a este nível).
Os nossos resultados, quer a curto quer a médio prazo, são comparáveis aos reportados por outros centros. Os resultados institucionais a curto e médio prazo publicados por Lee et al.10, de um estudo retrospetivo de 218 doentes submetidos a EVAR durante um período de 4 anos, revelaram taxas de migração, endoleak, intervenção secundária, regressão do saco e de morte relacionada com a endoprótese similares entre os 2 grupos (doentes com colos proximais com anatomia favorável vs. doentes com colos proximais com anatomia de elevado risco). Estes autores concluíram que o EVAR pode ser realizado com segurança em doentes com colos proximais que apresentem anatomia desfavorável para EVAR. Katsuyuki Hoshina et al.11 também reportaram uma série de 275 doentes submetidos a EVAR durante um período de 34 meses, tendo documentado taxas de sobrevida e de reintervenção semelhantes entre os doentes classificados como «dentro das IFU» e os doentes «fora das IFU», tendo concluído que os resultados do EVAR no grupo «fora das IFU» é considerado aceitável. Bastos Gonçalves et al.14,15 investigaram a influência da angulação severa do colo proximal nos resultados a curto e médio prazo após EVAR e concluíram que: 1) a curto prazo os resultados são comparáveis em termos de endoleak tipo 1, complicações major e taxa de sobrevida14; 2) a angulação severa do colo proximal não apresenta influência nos resultados a médio prazo15.
Torselo et al.12 e Georgiadis et al.13 publicaram recentemente resultados que confirmam e são comparáveis aos do nosso estudo, tendo também concluído que o uso de endopróteses com fixação suprarrenal nos doentes df‐IFU, nomeadamente a Endurant®, parece ser vantajoso na obtenção de resultados similares aos do grupo f‐IFU. De igual forma, na sua série de doentes Lee et al.10 documentaram o uso preferencial da endoprótese Zenith® no grupo df‐IFU e concluíram que o sistema de fixação suprarrenal é o principal motivo da preferência por esta endoprótese, parecendo ser vantajosa particularmente nos doentes com colos proximais muito curtos e muito angulados. À semelhança destes estudos, na nossa série de doentes também se constatou que o grupo df‐IFU é tratado mais frequentemente com endopróteses com sistema de fixação suprarrenal (85,7% [n=24/28] df‐IFU vs. 69% [n=35/51] f‐IFU, p<0,05), sendo que a Endurant® foi a endoprótese mais utilizada. Estes resultados poderão ser apenas o reflexo da preferência pessoal dos cirurgiões do nosso centro, mas também poderão ser indicativos de que o uso preferencial de endopróteses com sistema de fixação suprarrenal é vantajoso, em termos de eventos adversos relacionados com a endoprótese, nos doentes com colos proximais com anatomia desfavorável.
Este estudo apresenta várias limitações importantes, que deverão ser tidas em conta aquando da interpretação dos resultados.
A sua maior limitação é tratar‐se de um estudo retrospetivo, não randomizado, não controlado. Reflete a prática e os resultados de um único centro, não podendo ser extrapolados em maior escala.
Devemos também ter em conta que quase um terço dos doentes foi excluído por dados de follow‐up insuficientes. Uma grande percentagem destes doentes foi referenciada de outras instituições de saúde, tendo sido excluídos por impossibilidade de acesso ao(s) seu(s) exame(s) de imagem pré‐operatório(s), realizados nesses mesmos centros. De igual forma, vários doentes perderam‐se durante o follow‐up (n=9 [17,6%] no grupo f‐IFU e n=3 [10,7%] no grupo df‐IFU). Por isso, os doentes que mantêm o follow‐up imagiológico e que foram incluídos neste estudo, poderão ser os doentes com mais eventos adversos relacionados com o EVAR e que necessitam de maior vigilância imagiológica, ou vice‐versa, tornando os resultados não generalizáveis.
Outra das limitações do nosso estudo será o uso da endoprótese Endurant® em doentes com colo 10‐15mm, que no nosso estudo foram classificados como df‐IFU, mas que, de acordo com as IFU desta endoprótese em específico, poderiam ter sido classificados como f‐IFU, conduzindo invariavelmente a um viés de seleção. Contudo, inicialmente constituía nossa intenção fazer uma análise de subgrupos para cada uma das endopróteses (incluindo as endopróteses cujas IFU definem como critério anatómico um colo com comprimento >15mm), o que em última instância não se revelou possível por a amostra ser demasiado pequena. Desta forma, o desconhecimento da endoprótese utilizada foi considerado fator indispensável para evitar um viés na categorização dos doentes e assim todos os doentes com colos <15mm foram considerados df‐IFU.
Analisando os 9 doentes que apresentaram colos proximais 10‐15mm e que foram classificados como df‐IFU, verificou‐se que foi utilizada a endoprótese Endurant® em 5 casos e a endoprótese Excluder® em 4 casos. Desta forma, 5 doentes poderiam ter sido classificados como f‐IFU. A análise do follow‐up a curto e médio prazo destes 5 doentes revelou que 2 deles apresentaram endoleaks tipo 2, sem outros eventos adversos relacionados com a endoprótese associados. Fazendo uma nova análise estatística considerando o crossover destes 5 doentes (ficando o grupo f‐IFU com 56 doentes e o grupo df‐IFU com 23 doentes), não se verificou uma diferença estatisticamente significativa na taxa de endoleaks a curto prazo (23% f‐IFU vs. 22% df‐IFU, p>0,05), mas constatou‐se uma diferença estatisticamente significativa na taxa de endoleaks a médio prazo (25% f‐IFU vs. 5% df‐IFU, p=0,013). Esta superioridade na taxa de endoleaks a médio prazo do grupo f‐IFU deve ser interpretada com caução pois deve‐se à presença de um maior número de endoleaks tipo 2 (n=8/10 f‐IFU vs. n=3/3 df‐IFU), nenhum dos quais associado a complicações e/ou reintervenção durante o follow‐up. Analisando os restantes outcomes definidos para este estudo, também não se constataram diferenças estatisticamente significativas entre os 2 grupos. Assim sendo e tendo em conta que se pretende demostrar a não inferioridade do EVAR em doentes df‐IFU, a inclusão destes 5 doentes com colos 10‐15mm tratados com a endoprótese Endurant® no grupo f‐IFU não influencia os nossos resultados.
Este estudo pode simplesmente representar a nossa experiência institucional crescente de EVAR em doentes com anatomia menos favorável. Para além de poder ser o reflexo da prática e preferência pessoal dos cirurgiões do nosso centro, poderá existir também um desvio anatómico na seleção dos doentes (sendo selecionados os doentes com «anatomia desfavorável permissível»), pelo que o grupo df‐IFU do presente estudo pode não ser representativo da globalidade de doentes com anatomia desfavorável para EVAR.
ConclusãoNa série apresentada, a realização de EVAR em doentes com anatomia desfavorável (grupo df‐IFU) não só não apresentou um efeito negativo como parece ter produzido resultados que são aceitáveis e comparáveis aos dos doentes com anatomia favorável (grupo f‐IFU), quer a curto quer a médio prazo. É mandatória a realização um follow‐up a longo prazo para determinar se esta aparente não inferioridade se manterá ou se se perderá ao longo do tempo.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
FinanciamentoNenhum.
Conflito de interessesOs autores declaram não haver conflito de interesses.