En la actualidad continúa siendo objeto de controversia el papel de las infecciones víricas respiratorias en el lactante y en niño. La discusión tiene su base en la diferencia, al menos aparente, de la historia natural de las sibilancias.
Las infecciones víricas provocan con frecuencia episodios de sibilancias en niños pequeños no asmáticos, pero en la mayoría de ellos las sibilancias desaparecen no desarrollando posteriormente asma. En algunos casos, sin embargo, las sibilancias persisten y, en otros padecen asma.
Se desconoce no sólo el papel de la infección vírica, sino los mecanismos por los que pueden producir sibilancias en un niño previamente sano o exacerbar aquéllas en un niño con asma. En este sentido se han propuesto diferentes hipótesis: alteración de la respuesta inmune a los diferentes alergenos; inflamación de las vías aéreas, directamente en el niño sano o tras acentuar la respuesta alérgica del niño previamente sensibilizado; modificación de la inflamación alérgica en el niño atópico, etc. En cualquier caso la aparición de asma y la persistencia o no de las sibilancias tras la infección vírica posiblemente esté relacionada con las características de la infección, las modificaciones inmunológicas que ésta provoque y la susceptibilidad genética del niño.
DINAMICA DE LA INFLAMACION ALÉRGICA EN EL ASMA
El asma es un síndrome complejo, con diferentes fenotipos, que se caracteriza por broncospasmo, hiperreactividad bronquial e inflamación de las vías aéreas. La mayoría de los pacientes inician su enfermedad en la edad pediátrica, interviniendo tanto en su inicio como en la evolución factores genéticos (atopia), y factores ambientales (infecciones, alergenos, contaminación, etc.). La comprensión de los mecanismos etiopatogénicos de los diferentes tipos de asma requiere la identificación de los factores que inician, intensifican y modulan la respuesta inflamatoria de las vías aéreas (1).
La respuesta inmunológica inmediata, mediada por IgE, se considera el mecanismo principal en la respuesta inflamatoria alérgica, si bien hasta muy recientemente no han sido conocidos en su integridad sus componentes.
La síntesis de la IgE frente a los alergenos inhalados se inicia con el procesamiento de éstos por las células dendríticas, encargadas de presentar el alergeno procesado a los linfocitos T y B. Las interacciones entre células presentadoras y linfocitos provocan respuestas que se ven influenciadas por citocinas y por la presencia o ausencia de moléculas coestimuladoras.
La activación de los linfocitos Th2, considerada como la célula clave en la respuesta inflamatoria alérgica, conduce a la producción de IgE específica, y posterior activación de los mastocitos y basófilos y es responsable de otros hechos, incluso ajenos a la síntesis de IgE.
La síntesis de la IgE por los linfocitos B, precisa dos señales: la primera a cargo de la IL-4 o la IL-13 que comparten un único receptor en los linfocitos B (cadena a) y utilizan la misma señal de transducción (STAT-6). La segunda deviene cuando la molécula CD40 se une a su ligando en los linfocitos T. La interacción adicional entre otros pares de ligandos (CD28 y B7; a1, B2 integrinas y moléculas de adhesión) pueden complementar o potenciar la respuesta de linfocitos T.
La activación de los mastocitos y basófilos, tras nueva exposición a los alergenos, hace que estas células liberen mediadores (histamina, leucotrienos, factores activadores de plaquetas, etc.) responsables de la reacción alérgica aguda.
Los linfocitos Th2, a través de diversas interleucinas, intervienen igualmente en la maduración, desplazamiento y activación de otras células y sobre funciones responsables de la respuesta alérgica tardía y de la inflamación:
Las interleucinas IL-4 e IL-9 participan en la maduración y activación de mastocitos (independiente de la síntesis de IgE) que igualmente liberan mediadores. A su vez los propios mastocitos participan en la regulación de la síntesis de IgE.
Las IL-3, IL-5 e IL-9 intervienen en la maduración, desplazamiento y activación de los eosinófilos, que una vez activados liberarán nuevos mediadores (leucotrienos, PAF, etc.) así como las proteínas contenidas en sus gránulos intracitoplasmáticos. Además dañan los receptores muscarínicos. Por el contrario producen factor de crecimiento de fibrinógeno y proteínas que intervienen en el remodelado de las vías aéreas.
La IL-5 estimula la salida de eosinófilos, maduros e inmaduros, desde la medula ósea, regula la expresión de sus receptores de membrana y es esencial para la diferenciación terminal de los mismos.
Las IL-3 e IL-5 y el factor estimulador de colonias de granulocitos y monocitos, favorecen la acumulación de eosinófilos mediante la interacción entre las moléculas de adhesión (a1, b2 integrinas y moléculas de adhesión vascular); la migración de eosinófilos a través de receptores, para quimiocinas (eotaxín-1; eotaxín-2, eotaxín-3, RANTES, proteínas quimiotácticas de monocitos [MCP 3 y 4]) y prolongan la supervivencia de estas células.
La IL-4 e IL-13 estimulan la expresión de moléculas de adhesión.
Las IL-9 e IL-13 favorecen la hiperreactividad bronquial y por tanto contribuyen a la inflamación bronquial y a las crisis de asma.
Las IL-4, IL-9 e IL-3 favorecen la producción de mucosidad a través de la activación de los neutrófilos y de la estimulación de los receptores de factor de crecimiento epidérmicos.
Durante la inflamación alérgica pueden liberarse neuropéptidos (principalmente sustancia P, neurocinina A), por acción de neurotrofinas secretadas por linfocitos T, macrófagos, eosinófilos y mastocitos, que favorecen el aumento de la permeabilidad vascular, la contracción de músculo liso y la hipersecreción de moco. Además pueden provocar la liberación de histamina de los mastocitos del pulmón.
La mejor evidencia de la respuesta inflamatoria en el asma es la presencia en el lavado del árbol bronquial de citocinas que intervienen en la inflamación y de quimiocinas quimiotácticas. Algunas de las citocinas que intervienen inician la respuesta inflamatoria activando factores de transcripción genética como el factor nuclear kB, el activador de proteínas-1; el factor nuclear de linfocitos T, u otros factores miembros de la familia de transcripción de señal (STAT). Tales factores de transcripción actúan sobre los genes que codifican las citocinas proinflamatorias, quimiocinas, moléculas de adhesión y otras proteínas que inducen y perpetúan la inflamación.
Citocinas proinflamatorias como la IL-1b, IL-6, IL-11, TNF-a y GM-CSF son liberadas por una gran variedad de células incluidas macrófagos y células epiteliales y están implicadas en la amplificación de la respuesta inflamatoria. La TNF-a está especialmente implicada en las reacciones asmáticas.
Citocinas reguladoras, IL-12; IFN-g; IL-4; IL-6, IL-13, se comportan como moléculas reguladoras de la respuesta inflamatoria alérgica, participando en el paso de linfocitos T0 a Th2, o en la diferenciación de linfocitos B hacia células productoras de IgE.
La presencia en los diferentes órganos de choque, piel, bronquios, etc., de los linfocitos Th2 se considera el hecho determinante en la diferenciación del paciente atópico con respecto al no atópico. En el feto y recién nacido predominan los linfocitos Th2, por lo que en el niño normal (no atópico) se produce un cambio de respuesta inmune en favor de los linfocitos Th1; mientras que en los niños potencialmente alérgicos aumentan las células Th2, primados en el útero por los alergenos que traspasaron la barrera placentaria. Los microorganismos posiblemente son los principales responsables del efecto protector inmune de los linfocitos Th1. Los macrófagos, una vez ingeridos los microorganismos, producen IL-12 que induce a los Th1 a producir IFN-g. Otros factores que intervienen son la cantidad y tiempo de exposición a los alergenos y la avidez de la interacción específica entre células presentadoras de antígenos y los linfocitos T.
La IL-12 producida por macrófagos tiene un papel importante en el paso hacia Th1, acción que produce mediante la liberación de IFN-g, cuyo efecto es contrario al de los Th2. En animales de experimentación la IL-12 inhibe la respuesta inflamatoria inducida por alergenos. La IL-10 inhibe las células Th1, pero igualmente inhibe el efecto de otras muchas citocinas por lo que se le atribuye cierto mecanismo antiinflamatorio. Según algunos estudios la producción de IL-10 está disminuida en algunos asmáticos.
EFECTOS DE LA INFECCION VIRICA
El hecho de que la mayoría de los niños padezcan infecciones respiratorias de origen vírico y pocos desarrollen sibilancias persistentes y/o asma hace pensar que no es la infección en sí, sino las circunstancias que la rodean (gravedad de la infección, momento de aparición, localización, edad del niño, etc.) las responsables del riesgo de asma.
Existen diferentes hipótesis mediante las cuales la infección vírica puede inducir sibilancias persistentes y asma crónica.
Alteración de la respuesta inmune frente a los diferentes alergenos
Las infecciones víricas respiratorias pueden favorecer la sensibilización a diferentes alergenos sin que esté totalmente aclarado su mecanismo. Sigurs et al (2) han hallado un número significativamente elevado de niños con pruebas cutáneas positivas, elevación de anticuerpos IgE específicos y asma entre los que habían padecido bronquiolitis, frente a los que no habían padecido esta enfermedad.
Rabatic S et al y Renzi P et al y Smyth et al (3-5) por su parte, observan un incremento en la expresión en linfocitos de CD21, CD23 y sCD25 respectivamente, tras el padecimiento de bronquiolitis. Estos marcadores favorecen la síntesis de IgE. Por otra parte, el recuento de eosinófilos y de receptores de baja afinidad para IgE es superior a los cinco meses de haber padecido una bronquiolitis que en la fase aguda de esta enfermedad, lo que podría interpretarse como una activación prolongada Th2.
Las infecciones víricas promueven la infiltración de linfocitos en las vías aéreas, habiéndose sugerido que éstos podrían provocar una respuesta Th2 preexistente favoreciendo la producción de IL-4 e IL5. De ser ello cierto la sensibilización alérgica a los diferentes alergenos ambientales se vería facilitada tras la infección vírica.
Norman et al (6) demuestran una supresión total de la síntesis de IFN-g por parte de linfocitos de sangre periférica de pacientes con bronquiolitis, junto a una menor supresión de la síntesis de IL-4, por lo que los autores deducen que la infección por VSR desencadena una respuesta característica de linfocitos Th2. El hecho de que los niveles más altos de IL-4 se observaran en niños de familias atópicas, hace pensar que la alteración es previa a la infección por VSR. Matsuzaki et al (7) han observado que linfocitos B de amígdalas activados por células epiteliales infectadas por VSR producen IL-4 e IL-5 pero no IFN-g.
Por el contrario Welliver R et al (8) observan que el IFN-g es la interleucina predominantemente producida en secreción de vías respiratorias durante la bronquiolitis aguda, mientras que la IL-4 se encuentra en secreciones de vías respiratorias de individuos sanos y en infecciones de vías respiratorias altas. Por lo que para estos autores es difícil que la infección por virus al menos VSR ofrezca las condiciones oportunas para la sensibilización alérgica.
Un mecanismo alternativo, que favorecería la sensibilización a aeroalergenos, tras la infección respiratoria por virus sería el apuntado por Tsitoura et al (9). Según estos autores la infección vírica respiratoria, al menos por virus influenza, interfiere, en animales de experimentación, con el desarrollo de la tolerancia inducida por alergenos. Afirmando además que el intervalo entre la infección vírica y la exposición al alergeno es fundamental para que tanto la sensibilización a aeroalergenos como la hiperreactividad bronquial se vea dificultada o favorecida.
Inducción de inflamación típica del asma alérgica en la infección vírica respiratoria
Las infecciones víricas podrían provocar episodios agudos de sibilancias o poner en marcha ataques de sibilancias recurrentes en individuos predispuestos mediante una respuesta similar a la que se observa inducida por alergenos en el asma.
Muchas de las citocinas, quimiocinas, células respondedoras y mediadores solubles que intervienen en la obstrucción causada por infecciones víricas se encuentran también presentes en el asma alérgico. Existen múltiples trabajos al respecto sobre todo en infección por rinovirus en adultos y VSR en niños.
Interacción virus-linfocitos T
Las infecciones víricas se asocian clásicamente a una respuesta inmune celular con producción de citocinas asociadas a las células Th1 (IL-2 e IFN-g).
El IFN-g posee una actividad antivírica y sobre todo una importante función inmunomoduladora contribuyendo así a regular el equilibrio Th1/Th2 a favor de la proliferación de linfocitos Th1, induciendo la proliferación de IL-12 e inhibiendo la proliferación de las células Th2. Además el IFN-g activa a los macrófagos y monocitos aumentando así su capacidad de presentar el antígeno vírico. Las células citotóxicas (NK), son igualmente estimuladas interviniendo en la destrucción de células infectadas por virus (10, 11).
Por el contrario las células T CD4 activadas en presencia de IL-4 y especialmente IL-6 tienden a diferenciarse a células Th2 (la IL-4 e IL-6 promueven la diferenciación de células Th2 y las interleucinas IL-4 e IL-10 inhiben la generación de células Th1). Una fuente principal de la IL-4 necesaria para general células Th2 es un subtipo especializado de células T CD4 que expresan el marcador NK1.1 normalmente asociado a células NK denominado T CD4 NK.1. Estas células posen un receptor a:b prácticamente invariable. Tras la activación las células T CD4 NK.1 secretan grandes cantidades de IL-4 y pueden así amplificar el desarrollo de células Th2 que promueve la producción de IgE en respuestas humorales subsiguientes.
La capacidad diferencial de los agentes patógenos para interactuar con células dendríticas, macrófagos, células NK y células T CD4 NK1.1 puede por tanto influir en el balance global de las citocinas presentes en la respuesta inmunitaria temprana y determinar si desarrollan preferentemente células Th1 o Th2.
Un factor que influye en la diferenciación de células T CD4 es la cantidad y secuencia de pépticos antigénicos que inicia la respuesta. Grandes cantidades de péptidos que alcanzan una densidad elevada en la superficie de las células presentadoras de antígeno tienden a estimular la respuesta Th1, mientras que una presentación de menor densidad tiende a permitir respuestas de células Th2; además los péptidos que interactúan intensamente con el receptor de células T tienden a estimular respuestas similares a Th1 mientras que los que se unen débilmente suelen inducir respuestas similares a Th2.
Uno de los hechos en los que la infección vírica recuerda al asma alérgica es la infiltración de linfocitos T en vías respiratorias, que desempeñan un papel fundamental en la terminación de la replicación vírica. Los linfocitos CD4 predominan en las biopsias de pacientes con asma alérgica, y en las infecciones por VSR y rinovirus de niños con sibilancias.
Aunque la respuesta inflamatoria tiene un papel importante en la erradicación de la infección vírica, respuestas exageradas de linfocitos pueden desempeñar un papel en la patogénesis de las sibilancias inducidas por virus. Una vez presente en las vías aéreas los linfocitos pueden amplificar o prolongar la inflamación por la liberación de citocinas que atraen y estimulan otras células inflamatorias. Mediadores proinflamatorios producidos por linfocitos T incluyen IFN-g, RANTES y MIP-1, los cuales pueden atraer o activar mastocitos, basófilos y eosinófilos.
La respuesta inmunología en la infección por VSR del lactante parece peculiar. Los lactantes infectados por VSR tienen una respuesta predominantemente Th2, lo que evoca la intervención de agentes víricos en la respuesta de IgE total y específica probablemente por elevación de la proporción IL-4/IFN-g.
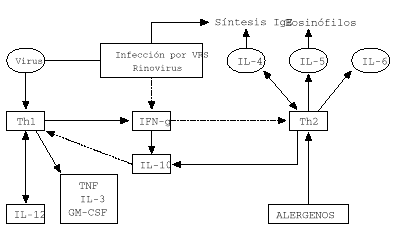
Este cambio de respuesta inmune frente al VSR tiene ventajas para el propio virus porque las células Th2 producen IL-10 que inhibe la proliferación y la función de los linfocitos Th1 (12). Por otra parte, los linfocitos Th2 producen IL-4 que actúa como un factor de crecimiento autocrino y conduce a la activación de mastocitos, aflujo de eosinófilos (vía IL-5) y a la producción de IgE. La citocina predominante en niños sanos y niños con diferentes formas de infección por VSR es la IL-4 (4, 8, 12). En contraste el IFN-g predominan en niños con bronquiolitis y niños con sibilancias de repetición (fig. 1).
Figura 1.--Respuesta inmune en infección vírica del lactante e infección por virus RVS y rinovirus.
Interacción virus-células epiteliales
La respuesta inflamatoria puede ser iniciada por las células epiteliales. La infección de las células epiteliales por virus (VSR, rinovirus y otros virus) activa en ellas factores de transcripción nuclear Kb y factor nuclear IL-6 produciéndose la liberación de numerosas citocinas y quimiocinas proinflamatorias (IL-1b, IL-6; IL-8 IL-11, GMCSF; TNF-a y RANTES (13-16).
Además las infecciones víricas inducen en las células epiteliales la expresión de las moléculas de adhesión ICAM-1 y aumentan la expresión del complejo HMC-clase I (5, 7, 17).
Moléculas específicas para linfocitos T, eosinófilos, basófilos y mastocitos, liberadas por las células epiteliales infectadas, son la eotaxin, MIP-Ia y MCOs por lo que parecen tener una mayor importancia en la inflamación.
Varios de los mediadores anteriormente mencionados se observan en secreciones de niños con infecciones de tracto respiratorio alto y bajo (16). Sin embargo, las moléculas MCOsa y MIP-1a son segregadas presentemente por células de tracto respiratorio bajo lo que sugiere un papel específico de estas quimiotoxinas en la iniciación de enfermedad de tracto respiratorio bajo.
Eosinófilos en la infección vírica
Los eosinófilos son importantes en la inflamación alérgica. Liberan proteínas tóxicas para las células epiteliales y son fuente de leucotrienos que promueven obstrucción de vías aéreas por diversos mecanismos. No es muy claro, sin embargo, el papel que desempeñan en las infecciones víricas respiratorias.
No se han identificado eosinófilos en biopsias de niños fallecidos de bronquiolitis por VSR pero sí se ha observado la presencia de proteína catiónica de eosinófilos en secreciones respiratorias durante la enfermedad y sobre todo, en el período de convalecencia, poniendo en evidencia su desgranulación (5, 18). Además se ha apreciado una eosinofilia pulmonar marcada en pulmón de niños que tuvieron un episodio fatal de broncospasmo inducido por rinovirus, y en muestras de biopsias de mucosa en pacientes asmáticos con infecciones víricas.
En cierto modo el grado de eosinofilia durante la bronquiolitis predice la persistencia de sibilancias posteriormente en el niño. Presuntamente los mecanismos inmunológicos que llevan a la eosinofilia durante la bronquiolitis estén presentes antes de la infección y no sea la infección por VSR la responsable directa de ella. Así pues puede decirse que posiblemente la bronquiolitis no es responsable del asma pero puede servir de marcador de posibles alteraciones inmunológicas comunes a ella (14).
Infección vírica con otras células inflamatorias
Los neutrófilos son las células prominentes en el lumen de las vías aéreas durante la inflamación; sin embargo, los neutrófilos predominan particularmente en las infecciones bacterianas y éstas no suelen cursar con sibilancias. El papel de los neutrófilos induciendo sibilancias en las infecciones víricas es, pues, realmente incierto. Los niveles de MPO derivada de neutrófilos son similares en niños con bronquiolitis que en controles (18).
Los macrófagos alveolares se ven también envueltos en la respuesta inicial inflamatoria de las vías aéreas tras estímulos infecciosos y no infecciosos. Una vez activados los macrófagos liberan mediadores como IL-1, IL-6, IL-8, IL-10, TNF-a y prostaglandinas. Al igual que los neutrófilos, los macrófagos son activados no provocan obstrucción bronquial y por tanto su papel en la aparición de sibilancias es dudoso.
Papel de los mediadores químicos en la inflamación vírica
Se ha observado respuesta de anticuerpos IgE específicos frente a virus en secreciones de niños con sibilancias causadas por infección por VSR y virus parainfluenza. El virus del sarampión, por su parte, induce la síntesis de IgE, de manera similar a como los hace la IL-4 (19).
Igualmente, durante la infección respiratoria de origen vírico se observa la presencia en secreciones respiratorias de mediadores (leucotrienos, especialmente LTC4, histamina, prostaglandinas y triptasa) (20). El hecho de que exista correlación entre niveles de mediadores y de IgE específica frente a los virus hace pensar que la IgE específica para virus interactúa, durante la infección vírica aguda, con mastocitos, basófilos y eosinófilos y que los mediadores liberados pueden contribuir a la obstrucción de vías aéreas.
Las infecciones por rinovirus parece que no inducen liberación de cantidades detestables de histamina en vías aéreas, sin embargo Calhoun et al (21) observaron que pacientes infectados por rinovirus liberaran mayor cantidad de histamina que los no infectados cuando se les realiza provocación con alergenos. Hay que tener en cuenta, sin embargo, que bacterias presentes de manera ordinaria en tracto respiratorio pueden liberar también histamina.
Los leucotrienos están aumentados en las secreciones nasales y bronquiales durante la infección vírica. Concretamente estudios realizados por Welliver (8) han demostrado la presencia de LTC4 en secreciones respiratorias de niños con bronquiolitis aunque estos autores no observan correlación entre la cantidad de LCT4 y la gravedad de la infección. Van Schaik et al, observan un aumento de IFN-g y leucotrienos superior en niños con infecciones víricas respiratorias y sibilancias que en aquellos que solamente presentan infección de vías respiratorias (22).
Diferentes tipo de infecciones víricas, incluyendo infecciones víricas experimentales con diversas cepas de rinovirus (RV 16), influenza, y VRS pueden causar cambios en la respuesta de la vía aérea frente a histamina, metacolina o alergenos (23). La infección experimental con rinovirus incrementa la respuesta a histamina, metacolina y alergenos e incrementa la posibilidad de desarrollar una respuesta inflamatoria alérgica retardada después de la inhalación de antígeno.
Potenciación de inflamación alérgica durante las infecciones víricas
El virus respiratorio sincitial y virus influenza inducen la aparición de sibilancias e hiperreactividad bronquial en sujetos normales y en pacientes con asma. Infecciones, incluso leves, producidas por estos virus, se asocian con una disminución significativa del FEV1 tras provocación inhalatoria con alergenos específicos y/o sustancias inespecíficas (24-26).
Los niños tienen mayor reactividad bronquial que los adultos, disminuyendo, con el tiempo, la hiperreactividad. La disminución de la hiperreactividad puede quedar detenida tras una infección por VSR, e incluso puede favorecer hiperreactividad bronquial provocada por la inhalación de alergenos.
La infección por rinovirus, sin embargo, provoca hiperreactividad bronquial solamente en pacientes asmáticos o atópicos (27, 28). Es posible que los virus VRS y el virus influenza, al provocar mayor daño epitelial, sean más lesivos que el rinovirus e induzcan por tanto hiperreactividad incluso en sujetos no atópicos ni previamente asmáticos.
Calhoun et al (21, 27) han observado una mayor liberación de histamina y TNF-a, así como un aumento en la infiltración de eosinófilos en vías aéreas en pacientes con rinitis alérgica cuando, previamente infectados por rinovirus, fueron provocados con alergenos específicos inhalados, observando además una respuesta asmática tardía. Estos hallazgos fueron observados solamente en paciente atópicos, demuestran que los rinovirus pueden aumentar la inflamación alérgica pero solamente en sujetos alérgicos.
Tanto en humanos como en animales de experimentación la hiperreactividad bronquial observada durante las infecciones víricas es el resultado de una broncoconstricción. En este sentido se ha observado una alteración en los receptores muscarínicos M2, ello podría ser debido a una deglucosilación del mismo por parte de la neuraminidasa vírica (29).
Las infecciones víricas pueden potencialmente causar broncoconstricción y aumento de la hiperreactividad bronquial estimulando el broncospasmo reflejo o liberando neuropéptidos a partir de fibras C sensibles, e incluso interfiriendo con el broncoditalador óxido nítrico (30).
A pesar de todo lo expuesto anteriormente parece que las sibilancias recurrentes tras la bronquiolitis en el niño no son el resultado de la infección vírica, sino que otros factores pueden intervenir en la misma. Las alteraciones producidas por los virus en la reactividad bronquial permanecen solamente por unas cuantas semanas. Por tanto, el aumento de la hiperreactividad bronquial, resultado de la infección vírica, podría contribuir a la obstrucción bronquial durante la primera fase de la enfermedad y no ser responsable de la aparición del asma crónica.