INTRODUCCION
En la actualidad la causa más frecuente de patología respiratoria en pacientes alérgicos es la sensibilización a ácaros domésticos 1. En un principio se identificaron a los ácaros de la familia Pyroglyphidae como los principales y únicos responsables de patología alérgica dentro de las viviendas en pacientes previamente sensibilizados 1,2. Sin embargo, durante los últimos años se ha observado la existencia de otras especies de ácaros de las familias Acaridae (Acarus y Tyrophagus) y Glycyphagidae (Glycyphagus, Lepidoglyphus y Blomia) en viviendas húmedas, tanto urbanas como rurales. Estos hallazgos confirman que los ácaros, denominados de almacenamiento, no limitan su presencia a determinados medios rurales y ámbitos profesionales donde predomina el grano, y, por tanto, su sensibilización y efecto clínico parecen estar más extendidos de lo que se pensaba en un principio 3,4.
Diversos estudios 5,6 realizados en nuestro país confirman la presencia de estos ácaros en un alto porcentaje de las muestras de polvo doméstico analizadas, siendo los índices de sensibilización mucho más elevados en lugares de Galicia y Canarias 5,7 donde se alcanzan valores superiores al 85 %.
En la provincia de Huelva, las condiciones climáticas reinantes como la presencia de inviernos suaves, precipitaciones medias anuales de 516 litros/m 2 y una elevada humedad por su proximidad al mar (8), favorecen la supervivencia y reproducción de los ácaros en las viviendas.
Así, un trabajo realizado en nuestra provincia 9 mostraba la presencia de ácaros de almacén en el 51,2 % de las muestras de polvo doméstico analizadas. Tyrophagus putrescentiae (Tp) fue el segundo más frecuente, después del Glycyphagus domesticus (Gd), identificándose en el 24,4 % de las muestras y, además, el ácaro de almacén con mayor número de sensibilizaciones cutáneas.
En este trabajo se analiza la importancia alergológica del Tp, determinando, tanto el nivel de exposición como el grado de sensibilización a dicho ácaro en una población de pacientes diagnosticados de alergia a Dermatophagoides pteronyssinus (Dpt) en la provincia de Huelva. Así mismo también se estudió la reactividad cruzada existente entre Dpt y Tp mediante RAST inhibición.
MATERIAL Y MÉTODOS
Pacientes
Se seleccionaron pacientes de la provincia de Huelva diagnosticados de rinoconjuntivitis y/o asma por hipersensibilización a Dpt y donde se identificó Tp en la muestra de polvo de su vivienda.
Recogida de muestras de polvo doméstico
Para la recogida de las muestras de polvo se utilizó la técnica del aspirado con un aspirador convencional, utilizando una bolsa nueva. En aquellos casos en los que el paciente no disponía de un aspirador se utilizó la técnica del cepillado.
Las muestras se recogieron del dormitorio del paciente y sala de estar principalmente, además del resto de la casa, incluidos baños y cocina. Los hogares no debían limpiarse al menos los 4 días previos a la recogida de la muestra. Las muestras se obtuvieron durante los meses de primavera y otoño, época en la que la reproducción de los ácaros es más rápida, y siguiendo las recomendaciones de la literatura 10.
Se aspiró la superficie del colchón y los sofás, debajo y alrededores de la cama, cada esquina de las habitaciones y las alfombras, si existieran, durante 2 minutos cada metro cuadrado. Con las alfombras y colchones, además de aspirarse o cepillarse, también se golpearon poniendo un plástico en la base para la recogida de polvo.
Las muestras de polvo se recogieron sobre etanol de 70° para su conservación y posterior procesamiento.
Procesamiento de las muestras
Extracción de ácaros: Se basa en el método de flotación descrito por Hart y Fain 11 que utiliza la diferencia de densidad entre los ácaros y un medio acuoso utilizado (etanol y solución salina saturada). Después de lavar y filtrar la muestra repetidas veces, se decanta el etanol de 70°, evitando remover mucho el sedimento. Se añade la solución salina y se deja reposar unos 10 minutos. Posteriormente se decanta la solución en varias placas de Petri y se extraen los ácaros, que flotan en la superficie de la solución, con ayuda de una aguja enmangada y bajo una lupa binocular con luz episódica.
Montaje y determinación de los ejemplares: Los ácaros se montaron en polivinil lactofenol (PVA lactofenol) entre el porta y cubre objetos. Después de al menos 24 horas (tiempo necesario para el aclaramiento de las estructuras del ácaro) se procedió a la identificación específica de los ejemplares por microscopia. Se identificaron todos los ácaros presentes en la muestra procesada o aproximadamente 100 ácaros individuales.
Pruebas cutáneas
Se realizaron pruebas cutáneas (PC) en prick test (ALK-Lancet, Horsholm, Denmark) por duplicado con extractos de Dpt y Tp estandarizados biológicamente o en unidades de masa (ALK-Abelló, S.A. Madrid). Se utilizó histamina a 10 mg/ml como control positivo y solución salina como control negativo. El tamaño de la pápula se midió a los 15 minutos y se consideró una prueba positiva cuando el diámetro de la pápula era igual o superior a 3 mm.
Test de provocación conjuntival (TPC)
Esta prueba se realizó aplicando una gota de extracto de Tp (ALK-Abelló, S.A. Madrid) a 10 BU/ml en el saco conjuntival. Si no se observaba reacción en 30 minutos se administraba una gota del extracto 100 BU/ml en el mismo ojo. El control negativo se llevó a cabo aplicando una gota de suero fisiológico en el saco conjuntival del otro ojo. Se consideró un resultado positivo cuando el paciente presentaba síntomas de hiperemia conjuntival, lagrimeo, prurito oculonasal, hidrorrea o estornudos en el lado donde se había administrado el extracto.
Esta prueba no se realizó en aquellos pacientes que presentaban en ese momento síntomas oculares alérgicos, ni en aquéllos con patología ocular distinta a su proceso alérgico.
Valoración IgE específica
Para la determinación de IgE específica se utilizó la técnica RAST. Para ello se sensibilizaron discos de papel, previamente activados con BrCN, con los extractos de ácaros según describen Ceska et al 12. Los discos se incubaron con 50 mL del suero de los pacientes y, posteriormente, con *100.000 cpm de 125I-anti-IgE mAb HE-2. Como Referencia se utilizaron discos sensibilizados con Lolium perenne y 4 diluciones de un "pool" de sueros de pacientes alérgicos a gramíneas que se había calibrado previamente con el sistema Pharmacia Phadebas® RAST. En aquellos pacientes donde el RAST fue negativo pero presentaron una prueba in vivo (PC y/o TPC) positiva se les repitió la determinación utilizando CAP System. Los valores inferiores a 0,35 kU/L se consideraron negativos.
RAST de inhibición
Discos sensibilizados con extracto de los ácaros Dpt o Tp se incubaron con 50 mL de suero del paciente (una selección de 7 sueros) y 50 mL de extracto inhibidor a diferentes concentraciones proteicas (rango 1000-1 mg proteína/ml). Posteriormente, se lavaron los discos y se incubaron con *100.000 cpm de 125I-anti-IgE mAb HE-2. Finalmente, después de lavar los discos, se determinó su radiactividad.
El % de inhibición de la unión de IgE se calculó utilizando la fórmula:
100 * (1 [(cpmx cpm100 %)/(cpm0 % cpm100 %)])
Donde cpmx es la radiactividad media de discos con inhibidor a la concentración x, cpm0 % es la de los discos en ausencia de inhibidor, y cpm100 % la correspondiente al blanco.
RESULTADOS
Se analizaron un total de 167 muestras de polvo doméstico, de las cuales 12 (7,2 %) fueron negativas y 19 (11,4 %) no se pudieron analizar por encontrarse defectuosas. En las 136 (81,4 %) restantes se identificaron, al menos, un tipo de ácaro que se distribuyeron de la siguiente manera: Dpt apareció en 129 muestras (94,8 %), Gd en 74 (54,4 %), Tp en 56 (41,1 %), Lepidoglyphus destructor (Ld) en 23 (16,9 %), Acarus sirus en 15 (11 %) y Blomia en 9 (4,4 %).
Mientras que el ácaro mas abundante fue Dpt, presente en las muestras con una media del 42,8 % del total de ácaros (rango 17,9 %-95,2 %), Tp apareció en tercer lugar, con una media del 15,8 % y un rango de 0,9 % a 55,5 %.
De los 56 pacientes en los que se había detectado Tp en su domicilio, se estudiaron 45 (80,3 %), a todos los cuales se les realizaron PC y TPC y en 25 (55,5 %) se completó el estudio con la determinación de IgE específica.
Sólo en 12 pacientes (26,7 %) las tres pruebas fueron positivas, 11 (24,4 %) presentaron PC y TPC positivos con RAST negativo (7 pacientes) o no realizado (4 pacientes), 1 paciente mostró TPC positiva con PC y RAST negativas, tres pacientes presentaron PC positiva con TPC negativa y RAST negativa (1 paciente) o no realizada (2 pacientes), en 4 pacientes (8,9 %) las tres pruebas fueron negativas y en 14 (31,1 %) la PC y TPC fueron negativas y la IgE específica no se realizó.
De los 7 pacientes con PC y TPC positivos y RAST negativo, se determinó la IgE específica por CAP System en 4 de ellos, siendo positiva en todos los casos. Por su parte, la única paciente que presentaba PC y RAST negativas y TPC positiva, el valor de IgE específica por CAP System fue positivo pero con un valor muy bajo (0,45 kU/L).
En resumen, de los 45 pacientes estudiados con exposición a Tp, 23 (51,1 %) presentaron, al menos dos pruebas diagnósticas positivas lo que demuestra una sensibilización a este ácaro, 18 pacientes (40 %) no mostraron sensibilización y en 4 pacientes (8,9 %) los datos no fueron concluyentes.
Con respecto al hábitat domiciliario, 26 pacientes (57,8 %) vivían en ambiente urbano (ciudad mayor de 100.000 habitantes) y 19 (42,2 %) en vivienda rural (pueblos inferiores a 20.000 habitantes). Sin embargo, dentro de los pacientes sensibilizados a Tp, 16 (69,5 %) habitaban en zona urbana y sólo 7 (30,5 %) en ambiente rural.
La distribución por sexos fue de 27 (60 %) hombres y 18 mujeres (40 %), siendo la edad media de 21,4 años con un rango de 4-37 años.
La mayoría de los pacientes presentaban clínica de rinoconjuntivitis (RC) (66,7 %), seguido de RC con asma (31,1 %) y sólo un paciente (2,2 %) presentaba asma sin RC.
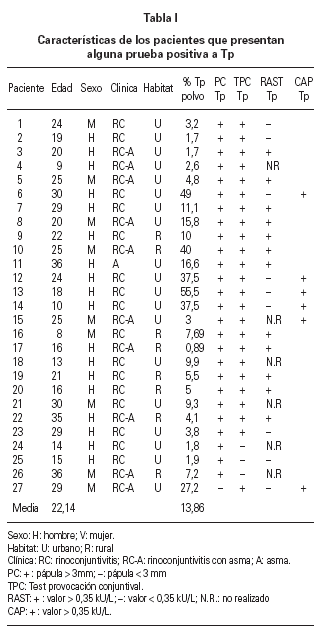
En la tabla I se reflejan las características de los pacientes que presentaban alguna prueba positiva a Tp. En este grupo el Tp representa una media del 13,9 % del total de ácaros identificados en cada muestra de polvo con un rango de 0,9 % a 55,5 %.
La tabla II muestra los resultados de la IgE específica sérica a Dpt y Tp de los 25 pacientes a los que se realizó el estudio completo. Todos los pacientes menos uno presentaron IgE específica a Dpt y 12 a Tp, de los cuales 7 presentaron valores superiores a 2 kU/L. El coeficiente de correlación entre los títulos de IgE de la tabla II (prueba no paramétrica de Spearman), fue no significativo (r = 0,016; p = 0,938).
Estos resultados sugieren la ausencia de reactividad cruzada entre Dpt y Tp, pero para confirmarlo, se realizó un experimento de RAST de inhibición con una selección de sueros de los pacientes. Los resultados se indican en la tabla III. Se utilizaron varias concentraciones de inhibidor (rango 1000-1 mg/ml), y se indican en las tablas los porcentajes de inhibición máximos (zona de plateau) de la unión de IgE al extracto en la fase sólida. El extracto de Tp no fue capaz de inhibir significativamente la unión de IgE a Dpt (tabla III) en ninguno de los 7 sueros individuales ensayados. En los experimentos de RAST de inhibición los porcentajes de inhibición inferiores al 15 % no se consideran significativos. Por otro lado, en el experimento reverso, Dpt sólo inhibió parcialmente la unión de IgE a Tp en uno de los 6 sueros analizados, indicando una baja reactividad cruzada entre estos ácaros (tabla III).
DISCUSION
Tp es un ácaro de la familia Acaridae cuyas condiciones climáticas óptimas para su desarrollo son una temperatura de 25 °C y una humedad relativa del 75 %. Suele frecuentar lugares donde existen productos almacenados (cereales, legumbres, semillas...) con alto contenido de grasas y proteínas, aunque también se ha identificado en las viviendas, especialmente en baño y cocina. Así, Warner et al 13, identificó Tp en el 62 % de las viviendas estudiadas, sobretodo en cocina y baño, mientras que Gd y Ld se localizaron en menor proporción en el dormitorio.
Múltiples estudios 1,14-16 han evidenciado que Dpt es el ácaro más extendido a nivel mundial y, sin embargo, la presencia de Tp varía mucho según la zona estudiada. Así, mientras que en Suecia 13 se ha identificado en el 62 % de las viviendas, en Oporto 16 sólo apareció en el 15 %. Dentro de nuestra geografía, en Zamora y Salamanca 6, Tp se encontró en el 21 % y 30 % de las muestras, respectivamente, en Valladolid 17 fue el segundo ácaro de almacén más frecuente tras Ld y en Galicia 5 sólo estaba presente en el 19,3 % de las muestras.
En nuestro estudio, Dpt es el ácaro más frecuente apareciendo en el 94,8 % de las muestras analizadas, mientras que Tp fue el segundo ácaro de almacén más identificado, tras Gd, apareciendo en el 41,1 % de las muestras. Sin embargo, su presencia no parece ser muy significativa ya que supone como media el 15,8 % de los ácaros identificados, frente al 42,8 % del Dpt.
Respecto a la prevalencia de sensibilización acarina en nuestro país, Ld y Tp son los ácaros de almacén con mayor número de sensibilizaciones 5,17,18. Así, en Santiago de Compostela 5 y Vigo 19 Tp presenta unos porcentajes de sensibilización del 84,3 y 64,6, respectivamente, en Orense 20 desciende a un 47 %, y en otras zonas como en Salamanca 18 o Valencia 21 alcanza valores del 64,8 % y 34 %, respectivamente. Sin embargo, se ha observado que la sensibilización a este ácaro no siempre es un indicador de la presencia de éste en las viviendas. Así, Warner et al 13 obtuvieron una relación significativa entre la sensibilización y la presencia y densidad del Tp en las muestras de polvo del dormitorio pero no en las del baño ni cocina donde existía una mayor concentración de este ácaro. Por su parte, Vidal et al 5 encontraron una correlación significativa entre la sensibilización y su presencia en las muestras de polvo con Ld pero no con Tp y Arias 9 observó que sólo en el 27 % de los pacientes sensibilizados a Tp se identificó este ácaro en sus viviendas.
Por tanto, la sensibilización a los ácaros de almacén se puede deber, tanto a la presencia de éstos en las viviendas o ambiente laboral, como a la existencia de una reactividad cruzada entre las especies de una misma familia o entre distintas familias de ácaros.
La mayoría de los trabajos epidemiológicos que analizan la sensibilización a los ácaros de almacenamiento en una población de alérgicos utilizan la PC y/o la determinación de IgE específica como métodos diagnósticos. En nuestro estudio, no sólo se ha estudiado la sensibilización a Tp utilizando tres pruebas diagnósticas diferentes, dos in vivo (PC y TPC) y otra in vitro (RAST), sino que también se ha comprobado la existencia de dicho ácaro en las viviendas de los pacientes. Se ha observado que aproximadamente la mitad de los pacientes (51,1 %) expuestos al ácaro eran sensibles a éste. De los 7 pacientes que presentaron PC y TPC positivas con RAST negativo, se repitió la determinación de IgE específica utilizando CAP en 4 de ellos obteniendo un valor positivo en todos los casos. Estos datos nos muestran la existencia de una mejor capacidad diagnóstica del CAP frente al RAST, ya descrita en varios estudios 22. Dentro del grupo de pacientes con datos no concluyentes, 3 presentaron TPC negativa y PC positiva pero con una pápula de 4 mm o menor. Sin embargo, si se sigue el criterio de positividad para la PC al Tp recomendado por Kanceljak-Macan et al 23 y establecido en la presencia de una pápula > 4,5 mm, nuestros pacientes obtendrían unas PC negativas y, por tanto, se incluirían en el grupo de no sensibles.
Desde hace años se ha observado que existía un mayor porcentaje de sensibilización a los ácaros de almacenamiento en poblaciones de granjeros y personas de ambiente rural que en poblaciones urbanas 4,24. Sin embargo, existen trabajos recientes 17,25 que no han observado relación entre la sensibilización a estos ácaros y otras variables como el hábitat rural, profesiones relacionadas con el grano o la humedad en el interior de los hogares. En nuestro estudio el 57,7 % de las muestras con Tp corresponden a ambiente urbano y en el grupo de pacientes sensibilizados el valor sube hasta el 69,5 %, por lo que se puede decir que este ácaro, en nuestra provincia, es más frecuente en ambientes urbanos.
Ciertos trabajos 26-28 que analizan la relación existente entre Dpt y Tp confirman la existencia de una fuerte reactividad cruzada entre ambos ácaros. Sin embargo, mientras algunos autores 26,27 observan que los alérgenos de Tp tienen una estrecha reactividad cruzada con extractos de Dpt y los alérgenos de Dpt sólo muestran una reactividad cruzada parcial con extractos de Tp, otros estudios 28 reflejan lo contrario. Los resultados obtenidos en nuestro estudio, al igual que los descritos por otros autores 29,30, no muestran la existencia de una reactividad cruzada importante entre ambos ácaros. Sólo en un paciente se evidenció una inhibición parcial de Dpt sobre el extracto de Tp, mientras que, en el experimento contrario, Tp no inhibió al extracto de Dpt en ningún caso. También hay que señalar que el número de sueros seleccionados para la realización del RAST inhibición fue de sólo 7, ya que son los únicos que lograron superar el valor de 2 kU/L entre los 12 sueros positivos a Tp. A favor de la baja reactividad cruzada entre Tp y Dpt está el hecho de que el alérgeno mayoritario de Tp, Tyr p2, tiene una baja identidad de secuencia, menor del 40 %, respecto al alérgeno homólogo de Dpt, Der p2 30. Los casos de reactividad cruzada entre Tp y Dpt deben circunscribirse a alérgenos menores como, por ejemplo la tropomiosina (grupo 10), que tienen una baja prevalencia.
Los motivos de la disparidad de los resultados en los diferentes estudios realizados puede deberse, por un lado, a la utilización de sueros de pacientes de diferentes orígenes, sin un conocimiento sobre la sensibilización clínica del paciente así como de su exposición a los diferentes ácaros, y por otro lado, a la frecuente utilización de extractos de ácaros no estandarizados.
En resumen, Tp es el segundo ácaro de almacén más identificado en las viviendas de los pacientes alérgicos a Dpt en la provincia de Huelva. Sin embargo, sólo la mitad de los pacientes expuestos son sensibles a dicho ácaro y viven en su mayoría en un ambiente urbano. No se ha encontrado una correlación significativa entre los títulos de IgE a Dpt y Tp y mediante el experimento de RAST inhibición se confirma la baja reactividad cruzada entre ambos ácaros.