INTRODUCCION
Las inmunoglobulinas endovenosas son preparaciones terapéuticas de inmunoglobulina G (IgG) concentrada, polivalente y policlonal o anticuerpos normales de la población. El efecto beneficioso del tratamiento con IgG endovenosa (IGEV) se observa en diversas enfermedades, mediante distintos mecanismos de acción.
En el caso de las inmunodeficiencias primarias (congénitas), donde un desorden genético reduce la respuesta humoral y/o celular del organismo, los preparados farmacéuticos de inmunoglobulinas humanas son utilizados como terapia de sustitución1-2.
Con respecto a las hipogammaglobulinemias secundarias que se generan como consecuencia de enfermedades oncohematológicas o por causas iatrogénicas, la aplicación de inmunoglobulinas sirve para modular y cooperar con el sistema de defensa.
Se ha comprobado, además, que la IGEV posee un efecto inmunomodulador en una gran variedad de enfermedades autoinmunes y por inmunocomplejos3 que depende de las interacciones entre la porción Fc de la IgG infundida con los receptores Fc de las células inflamatorias y linfocitos, y/o de la modulación del repertorio de anticuerpos, por la interacción de las regiones variables de la IgG con las inmunoglobulinas circulantes y los receptores antigénicos de las células inmunocompetentes4.
Varios estudios muestran que la IGEV es utilizada con éxito en enfermedades autoinmunes tales como la Púrpura Trombocitopénica Inmune5-6, y en procesos inflamatorios sistémicos, como la enfermedad de Kawasaki7-8.
En el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba, Argentina, una industria farmacéutica sin fines de lucro, se elabora IGEV (Inmunoglobulina G Endovenosa UNC) a partir de plasma de donantes voluntarios no remunerados de Argentina, Uruguay y Chile.
A partir de la comercialización de la Inmunoglobulina G Endovenosa UNC, se inició un estudio de farmacovigilancia de este producto, con el objetivo de evaluar la tolerancia clínica, eficacia terapéutica y seguridad viral de esta IGEV regional, considerando que es la única obtenida a partir de plasma proveniente de donantes de América del Sur, ya que otras IGEV disponibles en el mercado son elaboradas con plasma de origen europeo o norteamericano.
Para tal efecto, se diseñó un Registro de Farmacovigilancia, según las regulaciones de la European Agency for the Evaluation of Medicinal Products (EMEA)9, y del Grupo Latinoamericano de Inmunodeficiencias Primarias (LAGID)10.
Es un estudio retrospectivo que está basado en el análisis de los datos reportados en dichos registros.
El número de informes recolectados y analizados, no refleja de manera cabal la cantidad utilizada de Inmunoglobulina G Endovenosa UNC, ya que en la rutina terapéutica de nuestra región, aún no existe el hábito de registrar los parámetros clínicos y bioquímicos relacionados con la farmacovigilancia de medicamentos, de manera especial los de origen biológico.
PACIENTES Y MÉTODOS
Pacientes
Se realizó un estudio retrospectivo de los Registros de Farmacovigilancia de 448 infusiones administradas a 111 pacientes, con un rango de edad entre 1 día a 80 años, tratados en 42 centros de salud de la República Argentina.
Se realizó un análisis de subgrupos (edad, sexo, patología), con el objetivo de determinar una posible predisposición a efectos colaterales seguidos de la administración del producto.
Medicación
Se infundió Inmunoglobulina G Endovenosa UNC liofilizada, elaborada por el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba, a partir de una mezcla de plasma humano normal (proveniente de donantes sanos, voluntarios, no remunerados, de Argentina, Uruguay y Chile), constituída por unidades individuales serológicamente no reactivas para: HIV, HBV y HCV, analizadas en el Banco de Sangre de origen y re-evaluadas en el Laboratorio de Hemoderivados. Esta mezcla de plasma es sometida a la técnica de PCR para el virus de la hepatitis C, según los requerimientos de la Unión Europea11. La procedencia del plasma asegura que este medicamento de origen biológico, además de ser único con carácter regional, contenga anticuerpos dirigidos hacia agentes infecciosos característicos de esta zona de América del Sur.
Inmunoglobulina G Endovenosa UNC12, es elaborada a partir de la Fracción II (FII) de Cohn mediante tratamiento a pH ácido con trazas de pepsina13, obteniéndose un preparado donde la molécula de IgG mantiene tanto su estructura como su actividad biológica intactas. El procedimiento de manufactura incluye tres pasos de inactivación viral: fraccionamiento etanólico, pasteurización y tratamiento enzimático a pH ácido, que le confieren a este medicamento un alto grado de seguridad14.
Recolección de los datos
Los datos fueron asentados por el médico en un Registro de Farmacovigilancia diseñado según las regulaciones de EMEA9 y LAGID10.
Dicho formulario recomienda el registro de los siguientes datos: de la Institución donde se realizó la infusión y el médico prescriptor; del paciente (sexo, edad, peso, diagnóstico clínico, antecedentes alérgicos, y, si recibió un producto similar con anterioridad, dosis aplicada y efectos adversos observados); del medicamento (lote, fecha de vencimiento, esquema de administración: número de infusión, fecha, dosis, cantidad absoluta y velocidad de infusión); el resultado del análisis serológico de los marcadores virales: anticuerpos anti HIV (Ac anti-HIV), antígeno de superficie del virus de la hepatitis B (HBsAg) y anticuerpos anti virus de la hepatitis C (Ac anti-HCV), pre-infusión y a los 2, 4 y 6 meses posterior a la infusión; reacciones adversas inmediatas (durante las primeras 4 h de infusión) y mediatas (después de las 24 h): alteración de presión sanguínea, pulso cardíaco, temperatura corporal y ritmo respiratorio; manifestación de cefalea, urticaria, náuseas, vómitos, escalofríos, artralgias, eritema, disfunción renal, fiebre, dolor corporal, otros; la evolución clínica y los parámetros bioquímicos relevantes para evaluar la eficacia farmacológica del producto; los datos sobre parámetros específicos o generales relativos a la enfermedad de base, como así también observaciones de relevancia no descriptas en ítems anteriores; y la firma y sello del profesional.
Tanto en el Registro de Farmacovigilancia como en este trabajo se ha resguardado la confidencialidad respecto a la identidad de los pacientes.
Procesamiento de los datos
Los datos documentados por los profesionales en los Registros de Farmacovigilancia se ingresaron a una base de datos.
Las enfermedades en las cuales se utilizó la Inmunoglobulina G Endovenosa UNC se clasificaron en: Inmunodeficiencias Primarias (IDP), Inmunodeficiencias Secundarias (IDS), Enfermedades Autoinmunes (AI), Enfermedades Inflamatorias Sistémicas (INFSIS) y otras enfermedades que no pueden ser claramente asignadas dentro de los grupos de patologías anteriores (OTRAS).
El contenido de la base fue revisado al azar a intervalos regulares para comprobar la exactitud y comprensión de los datos.
Tolerancia clínica
Las reacciones adversas fueron clasificadas siguiendo la descripción de otros autores10,15,16 en:
Leves. Usualmente comienzan dentro de los 30 minutos de iniciada la infusión, y se caracterizan por dolor de espalda, rubor, fiebre, prurito, eritema, escalofrío, cefalea, náusea, mialgia, ansiedad, irritabilidad. Este tipo de reacciones están generalmente asociadas a la velocidad de infusión, los síntomas desaparecen ante la disminución de la misma, y rara vez requieren de la interrupción de la administración.
Moderadas. Reacciones tales como broncoespasmo, jadeo, vómitos, dolor de pecho, urticaria, taquicardia, o síntomas leves progresivos que no responden a la disminución de la velocidad de infusión. Requieren de la interrupción de la infusión y de la instauración de un tratamiento de emergencia.
Graves. Los síntomas y signos comienzan segundos o minutos después de comenzada la infusión y consisten en opresión de garganta, dolor de cabeza intenso, temblores, hinchazón facial, disnea, desmayo, hipotensión y colapso. Tales reacciones son principalmente debidas a anticuerpos anti IgA en pacientes con deficiencia selectiva y absoluta de IgA. Otras reacciones graves, generalmente asociadas a la administración de altas dosis con fines de inmunomodulación, son meningitis aséptica, accidentes tromboembólicos, insuficiencia renal y eritema multiforme.
Para determinar la tolerancia general de Inmunoglobulina G Endovenosa UNC, se establecieron los siguientes parámetros:
Excelente tolerancia. Incluye aquellas infusiones en las cuales los pacientes no presentaron reacción adversa alguna.
Muy Buena tolerancia. Aquellas infusiones en las cuales los pacientes presentaron reacciones adversas comunes o leves.
Regular tolerancia. Aquellas infusiones en las cuales los pacientes presentaron reacciones adversas de moderada intensidad.
Intolerancia. Aquellas infusiones en las cuales los pacientes presentaron reacciones adversas graves.
Análisis estadístico
Se utilizó el análisis estadístico de los programas Epi Info versión 6 y Statistix 7.
Los datos son informados por la media, desviación estándar (DE), mediana y rangos.
La frecuencia de reacciones adversas fue analizada mediante la prueba de Fisher.
RESULTADOS
Descripción de los pacientes
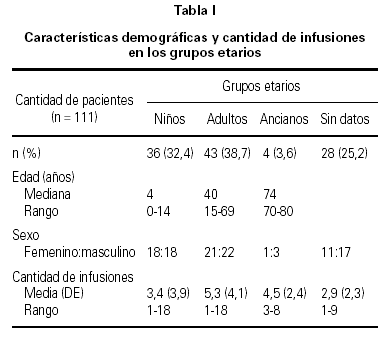
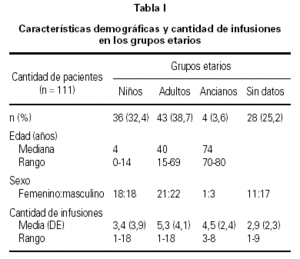
De los 111 pacientes incluídos en el estudio, 51 (45,9 %) fueron de sexo femenino y 60 (54,1 %) de sexo masculino. La tabla I muestra los datos demográficos de los pacientes y la media de la cantidad de infusiones del medicamento, según el grupo etario.
Las enfermedades y el número de pacientes afectados por cada una de ellas fueron: IDP (n = 34), IDS (n = 11), AI (n = 51), INFSIS (n = 4) y OTRAS (n = 11).
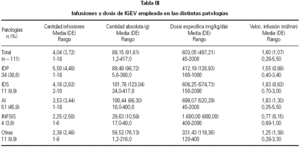
La tabla II muestra las enfermedades registradas, su frecuencia y las infusiones administradas durante el curso de este estudio.
En las distintas enfermedades AI, IDP e IDS, en algunos casos los médicos documentaron cuadros clínicos agudos, crónicos, o infecciones recurrentes con relación a la enfermedad básica.
Dosificación
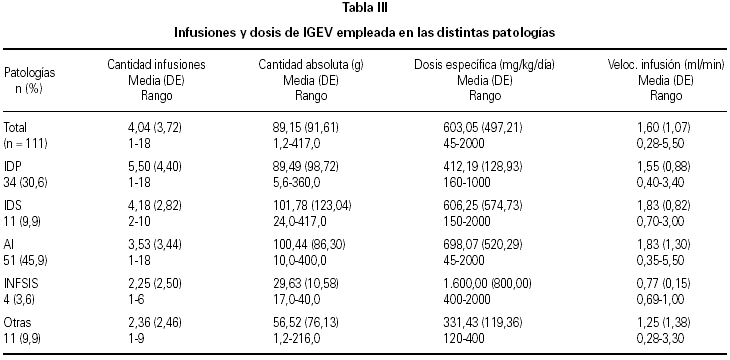
Durante el periodo de observación fueron administradas 448 infusiones. La tabla III provee un resumen de los hábitos de tratamiento en cada grupo de patología. En el tratamiento de las IDS y AI, las medias de las cantidades absolutas administradas son más altas que aquellas utilizadas en las restantes enfermedades. Con respecto a las dosis específicas, se observó un promedio mayor en la enfermedad de Kawasaki (inflamatoria sistémica). Las velocidades de infusión promedio no superaron, en ningún caso, el valor recomendado por el laboratorio productor (2 ml/min).
Tolerancia clínica
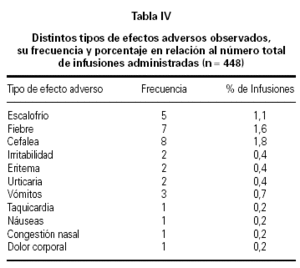
Reacciones adversas leves tales como escalofrío, fiebre, cefaleas, irritabilidad, dolor de espalda, eritema, se registraron en 14 (3,1 %) de las 448 infusiones totales, valor inferior estadísticamente significativo (p < 0,05) del informado en la literatura16. Reacciones adversas de intensidad moderada, tales como vómitos, urticaria y taquicardia se informó en 6 (1,3 %) del total de las infusiones.
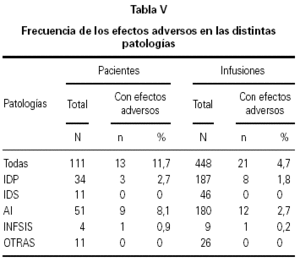
De los 111 pacientes, en 13 (11,7 %) se informaron reacciones adversas, de los cuales 7 (6,3 %) presentaron reacciones leves y 5 (4,5 %) moderadas. Estos resultados concuerdan con los informados en la literatura relacionada (p > 0,05)17-19.
Un solo paciente (0,9 %) diagnosticado con una PTI sangrante presentó un cuadro clínico de tipo meningeo leve, luego de 4 días de la infusión del producto, que evolucionó favorablemente sin dejar secuelas. Reportes similares fueron informados por otros autores20-22, utilizando otras marcas comerciales.
En el 98 % de los casos, estos efectos adversos se presentaron durante la administración de las primeras infusiones, desapareciendo ante una disminución de la velocidad de administración o en posteriores infusiones, permitiendo la prosecución de los tratamientos.
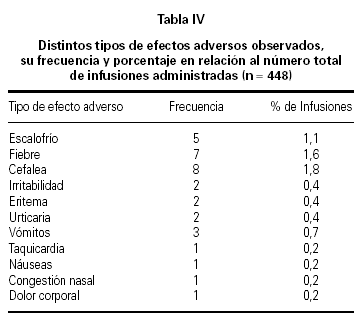
De los efectos colaterales registrados, fiebre y cefalea fueron los mencionados con mayor frecuencia (1,6 % y 1,8 %, respectivamente, del total de infusiones administradas) (tabla IV).
Con relación al análisis de la prevalencia de efectos adversos según el sexo, no se observó diferencia estadísticamente significativa (p > 0,05); con respecto a los grupos etarios, la prevalencia de reacciones colaterales fue significativamente mayor (p < 0,05) en niños.
La frecuencia de reacciones adversas en los distintos grupos de enfermedades no fue estadísticamente significativa cuando se las analizó con respecto a la cantidad total de pacientes e infusiones (tabla V).
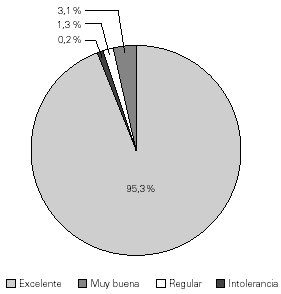
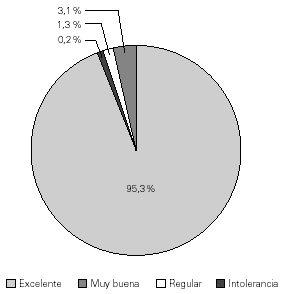
Con los parámetros antes definidos y, mediante el análisis estadístico de la información obtenida de los registros relativa al total de infusiones de Inmunoglobulina G Endovenosa UNC, se observaron los siguientes resultados: 427 infusiones (95,3 %; IC95 % 93,3-97,3 %) con excelente tolerancia, 14 (3,1 %; IC95 % 1,5-4,7 %) con muy buena tolerancia, 6 (1,3 %; IC95 % 0,3-2,3 %) con regular tolerancia y 1 infusión (0,2 %; IC95 % 0,0-0,6 %) con intolerancia al producto (fig. 1).
Figura 1.--Distribución porcentual de infusiones en relación a la tolerancia de la inmunoglobulina G endovenosa UNC.
Eficacia farmacológica
De los datos obtenidos a partir de los registros analizados, se observó que la mayor atención de los profesionales médicos estuvo dirigida a comunicar la ocurrencia de efectos adversos. De todos modos, en los casos de PTI se informó que la Inmunoglobulina G Endovenosa UNC resultó eficaz, ya que luego de la infusión aumentaron los niveles de plaquetas, provocando una mejoría en la sintomatología clínica.
En lo que respecta a los casos de IDP se reportaron aumentos en los niveles de IgG, en comparación con los basales, generando una menor incidencia de cuadros infecciosos.
Con relación a la eficacia de este producto en otros cuadros patológicos, como por ejemplo síndrome de Kawasaki y de Guillain Barré, se reportaron mejoras en la imagen ecocardiográfica, normalización de los índices de inflamación y estado febril, y abandono de la asistencia respiratoria mecánica y recuperación de la motilidad de las zonas afectadas, respectivamente. En los pacientes con AHA se informaron aumentos en la concentración de hemoglobina y el hematocrito; en las mujeres embarazas Rh sensibilizadas (Incompatibilidad Rh) se reportó descenso en el título de los anticuerpos anti-D, y, se notificaron también, otros datos generales sobre la evolución favorable de los pacientes post administración de Inmunoglobulina G Endovenosa UNC.
Los datos sobre la eficacia farmacológica del medicamento, concordaron con los obtenidos en otros trabajos clínicos en donde se infundió la Inmunoglobulina G Endovenosa UNC23-26.
Seguridad viral
No se notificaron seroconversiones generadas por la administración de Inmunoglobulina G Endovenosa UNC, ni manifestaciones clínicas asociables a hepatitis postransfusionales.
DISCUSION
El uso de preparaciones de IGEV está ampliamente difundido y aceptado en varias enfermedades, en donde ejerce su acción terapéutica a través de diversos mecanismos de acción. En algunos pacientes, la infusión de IGEV puede provocar la aparición de reacciones adversas27-28, las que pueden ser prevenidas o modificadas por la administración de aspirina, difenhidramina o hidrocortisona una hora antes de la infusión. Muchos efectos adversos están asociados a una alta velocidad de infusión de grandes cantidades de IGEV, particularmente en aquellos pacientes que padecen enfermedades autoinmunes o inflamatorias sistémicas16.
Los estudios clínicos de Fase IV o Farmacovigilancia tienen como objetivos principales: detectar las reacciones adversas a medicamentos (RAM), identificar problemas de efectividad de los medicamentos, obtener información sobre el uso del medicamento en nuevas indicaciones, nuevas pautas posológicas y/o terapéuticas, cuantificar la presentación y el riesgo de ocurrencia de reacciones adversas a medicamentos, difundir oportuna y eficazmente la información obtenida, previamente procesada, proponer las medidas correctivas convenientes y hacer el seguimiento de su cumplimiento29.
Este estudio de farmacovigilancia de Inmunoglobulina G Endovenosa UNC, de tipo observacional abierto, se realizó sin selección de centros específicos, sin limitaciones en términos de indicaciones del producto y sin prescripción de dosis; por lo tanto, es representativo de la aplicación práctica de este producto en términos de indicación y modo de tratamiento.
Luego de dos años de uso (posteriores a la aprobación del producto), se recolectaron y evaluaron datos de 448 infusiones administradas a 111 pacientes, para analizar la tolerancia clínica, eficacia terapéutica y seguridad viral de una IGEV regional, elaborada en Argentina, por el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba, ya que es la única disponible en el mercado obtenida a partir de plasma proveniente de donantes de América del Sur.
La frecuencia de los efectos colaterales totales fue de 4,6 %, en relación a las 448 infusiones registradas, y de 11,7 %, relativo al número total de pacientes tratados. La mayoría de los síntomas asociados a estas reacciones adversas fueron leves (3,1 % del total de infusiones); en sólo una infusión el paciente presentó un efecto calificado como grave en cuanto a la sintomatología clínica, pero el evento fue superado sin inconvenientes.
Con respecto a la eficacia terapéutica del medicamento se informó aumento de plaquetas en pacientes con PTI, aumento de hemoglobina en pacientes con AHA, descenso del título de anticuerpos anti-D en pacientes Rh sensibilizadas, recuperación del compromiso neurológico en pacientes con Guillain-Barré, buena evolución clínica en pacientes con Miastenia Gravis o con Enfermedad de Kawasaki, como así también aumento del nivel de anticuerpos en los inmunodeficientes.
En relación a la seguridad viral del producto, no se reportó la presencia de marcadores virales de la hepatitis B, HIV, o hepatitis C, en ninguno de los pacientes participantes de este estudio.
La Inmunoglobulina G Endovenosa UNC, es elaborada a partir del plasma proveniente de donantes voluntarios no remunerados de Argentina, Uruguay y Chile, lo que asegura la presencia de un amplio espectro de anticuerpos, tanto en especificidad como en concentración, dirigidos hacia agentes infecciosos típicos de esta región de América del Sur. Esta característica determina su eficacia terapéutica en enfermedades en las que la especificidad de los anticuerpos es trascendente, como por ejemplo en la Deficiencia de anticuerpos específicos con inmunoglobulinas normales.