INTRODUCCION
La dermatitis atópica es una enfermedad de la piel que se manifiesta como una inflamación y representa una causa de consulta muy frecuente en la edad pediátrica. Estudios realizados durante décadas han determinado la prevalencia de la dermatitis atópica (basándose en criterios clínicos y cuestionarios) y se ha establecido alrededor del 1,1 % al 3,1 %1. Estudios más recientes la elevan al 10-12 % en los países desarrollados2. La dermatitis atópica se manifiesta antes de los 6 meses de edad en un 50-75 % de los niños y antes de los 5 años en el 80-90 %1.
A pesar de ser una enfermedad tan frecuente no disponemos de pruebas de laboratorio simples para establecer el diagnóstico. En niños con dermatitis atópica se hallan niveles elevados de inmunoglobulina E (IgE) y eosinofilia periférica. Las pruebas cutáneas y la determinación de IgE específica, no son lo suficientemente sensibles o específicas para establecer un diagnóstico exacto, aunque nos pueden ayudar a identificar alergenos desencadenantes de la dermatitis atópica o sus exacerbaciones. Históricamente, se han empleado los criterios clínicos de Hanifin y Rajka3, compuestos por un listado de características mayores y menores (cronicidad y localización de las lesiones, prurito, historia familiar...), para establecer el diagnóstico de dermatitis atópica, complementados con estudios inmunoalergológicos.
La causa exacta de la dermatitis atópica es desconocida, pero se considera que factores genéticos desempeñan un papel importante en el desarrollo de esta enfermedad. La dermatitis atópica se ve frecuentemente en niños con historia familiar de atopia (dermatitis atópica, asma, rinitis...). En niños con historia familiar positiva, la dermatitis atópica es la más prevalente de las enfermedades alérgicas, seguida del asma y en tercer lugar de la rinitis1.
Con el propósito de evaluar la asociación de la dermatitis atópica al desarrollo de enfermedades alérgicas respiratorias, en este trabajo se han analizado, en un grupo de pacientes afectos de dermatitis atópica, una serie de características tales como la historia familiar de atopia, la sensibilización a alimentos e inhalantes, y el tipo de lactancia realizada.
MATERIAL Y MÉTODOS
Se trata de un estudio retrospectivo realizado en el departamento de Alergia Infantil del Hospital Universitario Vall d'Hebron de Barcelona, que atiende población pediátrica de la comunidad autónoma de Cataluña.
Pacientes
Se incluyeron 100 niños, con edades comprendidas entre los 4 meses y los 12 años que consultaban en primera visita o en visitas sucesivas por síntomas compatibles con DA.
Material y métodos
El diagnóstico de DA se estableció mediante una historia clínica sugestiva, basándonos en los criterios determinados por Hanifin y Rajka3 y las sensibilizaciones se confirmaron a partir de pruebas cutáneas (prick test y parches) e IgE específica. Para valorar la intensidad de la dermatitis atópica empleamos el SCORAD4, un índice que abarca una puntuación de 0 a 103 puntos y engloba aspectos como la extensión (0-100), la intensidad del brote (0-18) y síntomas subjetivos como el prurito o el insomnio (0-10 cada uno). Se utiliza la siguiente fórmula: (extensión/5) + (intensidad x 3,5) + suma de los síntomas subjetivos. Se considera leve una puntuación < 15, moderada de 15 a 40 y grave > 40.
A las madres se les pasó un cuestionario sobre la carga antigénica (consumo de leche y huevos) durante el tercer trimestre del embarazo y el periodo de lactancia.
Las pruebas diagnósticas realizadas fueron las siguientes:
Prick tests
Se emplearon extractos estandarizados de los laboratorios Bial-Aristegui® y CBF-Leti®, así como en determinados casos, extractos frescos. Se colocó una gota del extracto sobre la piel, a nivel de la cara interna del antebrazo y se realizó una punción cutánea con lancetas de 1 mm de profundidad (Dome Hollister®). Se probaron los siguientes alergenos alimentarios a cada uno de los niños: alfa lacto albúmina, beta lacto globulina, caseína, huevo entero, yema, clara, arroz, avena, cebada, centeno, trigo, maíz, gluten, cerdo, cordero, pollo, ternera, vaca, buey, garbanzos, alubias, lentejas, habas, guisantes, soja, harina de soja, patata, zanahoria, espinaca, tomate, gamba, almeja, mejillón, ostra, caracol, calamar, bacalao, merluza, rape, lenguado, gallo, atún, sardina, trucha, salmón, salmonete, albaricoque, melocotón, manzana, pera, plátano, melón, piña, cereza, ciruela, higo, níspero, sandía, uva blanca, aguacate, fresa, naranja, mandarina, limón, kiwi, almendra, avellana, cacahuete, castaña, nuez, piñón, pipas de girasol, levadura y cacao. Los inhalantes probados fueron: Dermatophagoides pteronyssinus, Dermatophagoides farinae, Acarus siro, Lepidoglyphus destructor, Tyrophagus putrescentiae, Blomia tropicalis, epitelio de gato, perro, caballo, conejo, y hámster, plumas de canario, paloma, ganso y periquito, Alternaria alternata, Cladosporium herbarum, Dactylis glomerata, Phleum pratense, Poa pratensis, Cynodon dactylon, Lolium perenne, Triticum sativum, Secale cereale, Parietaria judaica, Urtica dioica, Artemisia vulgaris, Chenopodium album, Plantago lanceolata, Chrysanthemum leucanthemum, Taraxacum vulgare, Rumex acetosella, Ligustrum vulgare, Olea europaea, Corylus avellana, Pinus strobus, Cupressus sempervivens, Quercus alba, Platanus acerifolia, Tillia cordata y látex.
El tamaño del habón producido se comparaba con el inducido por la histamina (10 mg/ml). Solamente los habones de diámetro igual o mayor a la mitad del control se consideraban positivos, con el control con suero fisiológico negativo.
IgE sérica
Se tomaron muestras de sangre para la determinación de la IgE total y específica a los diferentes alergenos que habían salido positivos en los prick tests. El método utilizado fue el inmunoenzimático (CAP-system Pharmacia®), considerándose positivos los valores de IgE específica superiores a 0,35 U/ml. El valor de IgE total depende de la edad, así pues, en niños menores de 1 año se considera normal un valor inferior a 20 U/ml, entre 1 y 13 años un nivel inferior a 50 U/ml y en adultos una cifra igual a 80-100 U/ml.
Pruebas epicutáneas
Se colocaba una gota de cada uno de los alergenos a probar en la espalda del paciente y se cubría mediante un apósito adhesivo (Leucotest®). Dicho apósito se retiraba a las 48 horas de su aplicación y se hacía una primera lectura que se repetía a las 96 horas. Se consideraba que la prueba era positiva si aparecía eritema, habón o vesículas en la zona de aplicación del extracto.
Provocación oral
Se iniciaba mediante una provocación labial, que consistía en rozar con el alergeno el labio inferior y lectura a los 10 minutos. Se consideraba positiva la aparición de prurito, eritema o edema en el labio o región perioral. Si la provocación labial era negativa se continuaba con la administración oral del alimento sospechoso. Éste había sido eliminado de la dieta por lo menos 2 semanas antes. La metodología empleada fue la administración de 1 gramo del alergeno. Al cabo de 30 minutos, si no aparecía reacción adversa se seguía con 2 y 4 gramos, siempre a intervalos de 30 minutos. Se consideraba positiva si aparecían síntomas cutáneos (urticaria, edema), gastrointestinales (náuseas, vómitos, diarrea, dolor abdominal), o respiratorios (rinitis, conjuntivitis, asma). La reacción podía ser inmediata: hasta 2 horas desde el inicio de la administración, o retardada: hasta 72 horas después.
Cuestionario a las madres
Para averiguar la cantidad de alimentos altamente alergénicos (huevos, leche de vaca) consumidos por las madres durante el tercer trimestre del embarazo y el periodo de lactancia se les pasaba un cuestionario en el momento de la primera visita del niño.
Análisis estadístico
Mediante el uso del programa informático SPSS para Windows®, versión 9.0, se emplearon la prueba de Chi-cuadrado para variables cualitativas y la prueba de t de Student para variables cuantitativas, con distribución normal. Se consideraron significativos valores de p < 0.05. El riesgo estimado se determinó mediante el cálculo de la Odds ratio (OR).
RESULTADOS
Pacientes
La distribución por sexos correspondía a 57 niños y 43 niñas.
La edad de inicio de la DA fue de 1,09 ± 1,69 años, pero al igual que ocurre con otros tipos de patología atópica, apreciamos una demora en el momento del diagnóstico, siendo la media de edad en el momento de la consulta los 3,77 ± 2,81 años.
Intensidad de la dermatitis atópica
La intensidad de la DA se clasificó según la gravedad de los brotes en leve (52 %), moderada (36 %) y grave (12 %).
Historia familiar de atopia
La presencia de antecedentes familiares de atopia fue del 72 %, que desglosado en relación a la gravedad de los brotes correspondía a un 73 % de las leves, un 75 % de las moderadas y un 58 % de las graves.
En el grupo con historia familiar de atopia positiva encontramos un 44,44 % de sensibilización positiva a los ácaros del polvo, el neumoalergeno más importante en nuestro medio (DPT), frente al grupo sin historia familiar de atopia donde la sensibilización a DPT fue del 21,42 % (p < 0,04). A pesar de ello, tan solo el 10 % de toda la serie de pacientes presentó pruebas epicutáneas positivas a ácaros.
Tipo de alimentación en la primera infancia
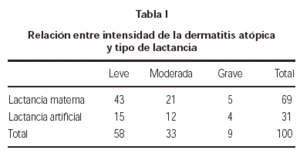
La proporción de niños que siguió lactancia materna fue del 69 %, con un tiempo medio de duración de 3,54 ± 2,05 meses. En cuanto a la carga antigénica materna durante el tercer trimestre del embarazo y el periodo de lactancia fue de un consumo medio de 725 cc de leche al día y unos 2-3 huevos a la semana.
Estudiamos la relación entre el momento de aparición de la dermatitis atópica y su grado de intensidad, comparando el grupo de niños que recibió lactancia materna y el que no la recibió y no encontramos diferencias significativas (p = 0,38) (tabla I).
Sensibilizaciones
En cuanto a los resultados de los estudios inmunoalérgicos realizados encontramos un 30 % de dermatitis atópicas con sensibilización negativa, un 28 % con sensibilización exclusiva a alimentos, un 20 % con sensibilización exclusiva a inhalantes y un 22 % sensibilizado tanto a alimentos como a inhalantes (DPT).
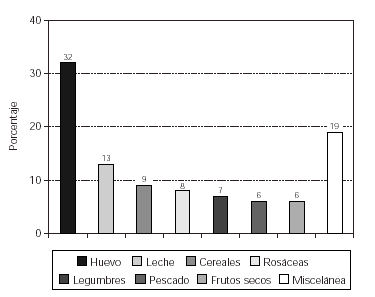
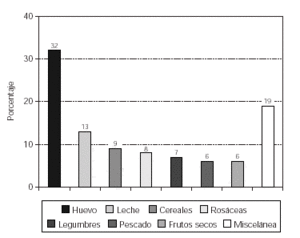
Cuando analizamos los resultados obtenidos en relación a la sensibilización a alimentos se observó un predominio de positividad al huevo (32 %) y la leche de vaca (13 %), seguido de los cereales (9 %), las frutas de la familia de las rosáceas (8 %), las legumbres (7 %), el pescado (6 %) y los frutos secos (6 %), tal como se expone en la figura 1.
Figura 1.--Sensibilización a alimentos en los pacientes con dermatitis atópica.
Esta sensibilización alimentaria tuvo repercusión clínica en el 14 % de los niños con dermatitis atópica, siendo la introducción de la leche de fórmula el alimento implicado con más frecuencia. El 86 % de los niños presenta una sensibilización alimentaria positiva sin ningún tipo de expresión sintomática.
El 42 % de los pacientes estaba sensibilizado a neumoalergenos, predominantemente ácaros del polvo (90 %). Otras sensibilizaciones a inhalantes fueron: gramíneas (5 %), Parietaria judaica (2 %), epitelio de perro y gato (1 %), hongos (0,2 %)...
IgE sérica
La cifra media de IgE total del conjunto de todos los pacientes fue de 180,32 ± 311,93 U/ml. Los niños sensibilizados a DPT presentaron un valor medio de IgE total significativamente mayor que los niños no sensibilizados (346,86 ± 430,43 vs 78,24 ± 132,93 U/ml, p < 0,001).
Asociación a enfermedad respiratoria
En el grupo completo de pacientes, hallamos que un 52 % de los niños presentaba dermatitis atópica exclusivamente, en un 27 % ésta se asociaba a asma, en un 13 % a rinoconjuntivitis y en un 8 % a urticaria-angioedema.
De los 52 pacientes que iniciaron su enfermedad alérgica exclusivamente en forma de dermatitis atópica el 35 % desarrollaron algún tipo de patología respiratoria (asma y/o rinoconjuntivitis), mientras que el 20 % evolucionó hacia otros tipos de enfermedades alérgicas (urticaria-angioedema, síndrome de alergia oral) bien de manera aislada, o asociada a la patología respiratoria. El tiempo medio transcurrido entre el inicio de la dermatitis atópica y la aparición del asma fue de 2,55 años y de 7,50 para la rinoconjuntivitis.
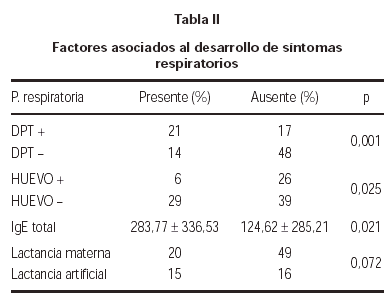
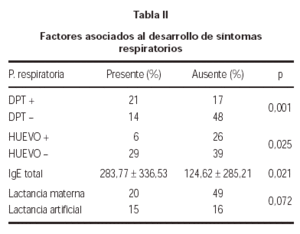
La sensibilización a DPT, se asoció al desarrollo de patología respiratoria (p = 0,001). En cambio, la alergia al huevo, se asoció inversamente a la aparición de síntomas respiratorios (p = 0,025). Así mismo, se comprobó que los pacientes con síntomas respiratorios presentaban una IgE sérica total más elevada que aquellos niños sin síntomas de asma o rinoconjuntivitis (tabla II).
La aparición de síntomas respiratorios fue menos frecuente en los niños que habían recibido lactancia materna, aunque no alcanzó significación estadística (p = 0,072) (tabla II).
DISCUSION
La dermatitis atópica es una enfermedad cutánea crónica que en la mayoría de casos se presenta durante el primer año de vida5,6. En general existe una producción anormal de inmunoglobulina E (IgE) frente a diferentes alergenos comunes en nuestro medio7. Si bien este aumento de los niveles de IgE se observa en la mayoría de dermatitis atópicas, es mucho mayor en el grupo de niños que acabarán siendo asmáticos. Esta afirmación, concuerda con nuestros resultados, los pacientes que desarrollaron enfermedades respiratorias presentaban valores de IgE superiores a los de los niños con DA que no evolucionaron a patología respiratoria. La hipótesis de nuestro estudio fue que los niños con DA asociada a niveles altos de IgE y sensibilización precoz a los diferentes alergenos, necesitan un seguimiento cercano por lo menos, hasta la adolescencia, porque tienen un riesgo más elevado de desarrollar enfermedades respiratorias. No está establecido un valor de IgE que nos discrimine de forma precisa la enfermedad atópica8, pero una cifra elevada de IgE nos puede ser útil para reconocer posibles nuevos casos de patología respiratoria.
Clásicamente las dermatitis atópicas se han dividido en tres grupos. La dermatitis atópica precoz, que correponde a niños que presentan pruebas cutáneas positivas a los 2 años de edad. La dermatitis atópica retardada, que se caracteriza por tener pruebas negativas a los 2 años pero que se positivizan a los 11. El tercer grupo corresponde a la dermatitis atópica no alérgica, en la que los pacientes presentan las pruebas negativas tanto a los 2 como a los 11 años9. Esto permite hablar de dermatitis atópica extrínseca, que englobaría a los dos primeros grupos y dermatitis atópica intrínseca, como sinónimo del tercer grupo. El curso que van a seguir ambos tipos de entidades va a ser completamente distinto. Según un estudio realizado por Novembre y colaboradores9 ninguno de los pacientes con dermatitis atópica intrínseca desarrolló asma a los 11 años, después de un seguimiento de 9 años, en comparación con el 25 % y el 59 % de los niños con dermatitis atópica retardada y precoz. Estos resultados son parecidos a los encontrados en nuestra serie de pacientes (22,58 % de las intrínsecas vs 55,26 % de las extrínsecas), lo que nos llevaría a afirmar que la dermatitis atópica intrínseca podría ser un estado cutáneo transitorio ya que se suele resolver en la adolescencia y no se suele asociar a patología respiratoria.
Recientemente la EAACI10 ha propuesto el término síndrome eczema/dermatitis atópica (AEDS) para referirse a que la DA no es una entidad aislada, sino que suele asociarse a varias enfermedades con características clínicas comunes. El AEDS alérgico incluiría el subgrupo de los casos de DA asociados a IgE (seleccionados según los criterios de Hanifin y Rajka). Otro subgrupo, sería el asociado a las células T (niños con pruebas epicutánas positivas a inhalantes o alimentos, con presencia de células T en sangre periférica o en las biopsias cutáneas, pero no asociadas a IgE). Por último, el término AEDS no alérgico sustituiría a la variante intrínseca descrita anteriormente.
Del 50 al 80 % de los pacientes con dermatitis atópica acaba desarrollando asma y/o rinoconjuntivitis alérgica11. En nuestro estudio corresponde a un 55,26 %. En un estudio prospectivo, Diepgen y Fartasch12 objetivaron que el 33 % de pacientes con dermatitis atópica desarrollaba asma alérgico y el 16 % rinitis alérgica durante sus primeros 5 años de vida. En cuanto a los hallazgos en los prick tests a alimentos encontró que el huevo era el alimento que en mayor parte se positivizaba (21 %), seguido del cacahuete (15 %). Esta alta prevalencia de sensibilización al cacahuete es similar a la encontrada en otros estudios como el de Eigenmann13, pero difiere de la que hemos objetivado en nuestra serie de niños, puesto que los frutos secos ocupan la sexta posición en orden de frecuencia. Esto puede ser debido a los hábitos alimentarios propios de nuestra región. En la dieta mediterránea el consumo de frutos secos es bastante frecuente, pero el cacahuete en concreto no es el más consumido, a diferencia de lo que ocurre en otras poblaciones como la estadounidense.
En nuestro estudio la aparición del asma desde el momento de la presentación de la dermatitis atópica fue bastante precoz, a los 2,55 años, a diferencia de lo que ocurre en otras series como la que presenta Wüthrich14. Éste, hizo un seguimiento de 121 pacientes afectos de dermatitis atópica durante su infancia hasta los 23,5 años de edad y observó que a los 15 y 23 años, alrededor del 55 y 60 % respectivamente ya presentaban enfermedades respiratorias concurrentes. La edad de manifestación fue de 6,3 años para el asma, 8,1 para la rinitis perenne y 9,7 para la rinitis estacional.
La sensibilización atópica es un factor predisponente muy importante para el desarrollo de asma. Aproximadamente dos tercios de los sujetos asmáticos están sensibilizados al menos a un neumoalergeno. Sin embargo, a pesar de que más del 40 % de los niños en edad escolar están sensibilizados a inhalantes, tan solo el 25-30 % de éstos acabará desarrollando asma15,22. La sensibilización a alergenos alimentarios, particularmente huevo y leche de vaca, se observa como primer paso en el curso de la marcha atópica16, con anticuerpos IgE específicos que se detectan en más del 10 % de los niños de 1 año de edad17. Esta sensibilización al huevo a la edad de 1 año se ha asociado a una posterior sensibilización a inhalantes18,19 y al desarrollo de asma en la edad escolar19,20,21.
Según el estudio de Illi S. y colaboradores22 cuando se analiza el tipo de sensibilización asociado con el desarrollo de asma hay que separar a los niños por grupos de edad, antes de los 2 años y después de los 7. Se ha observado que a los 7 años de edad la sensibilización alimentaria sin sensibilización a inhalantes no comporta un mayor riesgo de asma en la edad escolar. Un niño sólo tiene un mayor riesgo de desarrollar asma si está sensibilizado a neumoalergenos, con o sin sensibilización alimentaria. Estas observaciones podrían indicar, según varios estudios realizados a escolares la importancia de una reacción inmune local a nivel de la mucosa aérea23-25. En cambio, la sensibilización alimentaria antes de los dos años de edad, con o sin concurrencia de sensibilización a inhalantes, fue un factor predictivo para el posterior desarrollo de asma hasta la edad escolar. En contraste, la sensibilización a neumoalergenos presente antes de los dos años sin sensibilización alimentaria, no aumentaba el riesgo de asma. Estudios prospectivos que se han iniciado a la edad de 1 año o más temprano han observado que la sensibilización alimentaria que tiene lugar muy pronto en la vida se asocia a una mayor prevalencia de asma en la edad escolar19,20. Estos hallazgos indican que la sensibilización atópica puede ser un paso intermedio en el desarrollo de asma y no un factor de riesgo causal necesariamente resultante en asma. De acuerdo con esta hipótesis, el grupo de Illi22 postula que la atopia en sí misma no desencadena asma a menos que se sumen los efectos de la influencia familiar junto al sustrato alérgico. Por eso, se explicaría el motivo por el cual las estrategias de evicción de alergenos fallan en la prevención del asma infantil, ya que juegan un paper muy importante tanto la base genética, como las influencias medioambientales en el útero materno.
En niños de riesgo que ya han empezado a desarrollar los primeros síntomas de atopia deberíamos considerar la aplicación de medidas de prevención26. La sensibilización frente a la proteína de la leche de vaca, por ejemplo, sabemos que es un factor predictivo de posterior sensibilización alérgica18, igual que ocurre con el huevo16. Ahora bien, en el caso que tengamos pacientes con sensibilización alimentaria sin expresión clínica, no queda claro si la evicción del alimento implicado condiciona o no la aparición de otras alergias. Serían necesarios más estudios para concretar el papel de las medidas de evicción alimentaria. Del mismo modo, hemos visto que la sensibilización a aeroalergenos es más prevalente en escolares que han padecido dermatitis atópica en sus dos primeros años de vida27. Esto sugiere, que la dermatitis atópica precoz en combinación con una historia familiar de atopia positiva, debería iniciar medidas preventivas frente a la sensibilización a los diferentes aeroalergenos28. En los últimos años se han introducido medidas de control frente a los ácaros del polvo en el tratamiento de la dermatitis atópica. Se supone que una vez se inicia el eczema atópico, se altera la permeabilidad de la barrera cutánea y los antígenos de los ácaros pueden penetrar en la epidermis y desencadenar una respuesta inmune en la piel de los pacientes afectos29, aunque existen autores como Tupker30 que consideran la vía inhalativa como la más probable ruta de sensibilización frente a los ácaros. También, encontramos estudios en los que se ha demostrado que los pacientes con dermatitis atópica presentan precozmente niveles elevados de IgE frente a los ácaros del polvo y dicha presencia se asocia a un aumento de la prevalencia de asma bronquial31,32. Tan solo hay una evidencia limitada de que la eliminación de los ácaros del polvo reduzca la severidad de los síntomas cutáneos. Así pues, existen grupos de trabajo que postulan un beneficio tras la aplicación de medidas ambientales frente a los ácaros del polvo31-34. Sin embargo, también encontramos estudios que a pesar del uso de acaricidas, aspiradores o fundas para el colchón, no objetivan ninguna mejoría en el SCORAD de los pacientes estudiados35,36. Ya por último, considerando la dermatitis atópica como un precusor del desarrollo de asma, se han llevado a cabo dos estudios en los que se evalúa el uso de antihistamínicos para frenar la evolución de la enfermedad atópica. El primero de ellos fue el llevado a cabo por Likura y colaboradores37, en el cual se comparaba el uso de ketotifeno versus placebo en niños afectos de eczema atópico y se observó una reducción en la evolución posterior a asma, pero sólo en aquellos niños que tenían niveles muy elevados de IgE y no en los que tenían niveles normales de anticuerpos. El segundo estudio fue el ETAC38 (Early Treatment of the Atopic Child) que comparaba la Cetirizina con el placebo. Este trabajo puso de manifiesto que la Cetirizina retrasa e incluso previene el desarrollo de asma en un subgrupo de niños con dermatitis atópica sensibilizados a polen o a ácaros del polvo. Así pues, los grupos de pacientes que parecen responder a las medidas preventivas son aquellos en los que se cumplen estas tres premisas: una historia familiar de atopia positiva, una historia personal de dermatitis atópica y niveles elevados de IgE (total o específica frente a polen o a ácaros del polvo)39.
En conclusión, nuestro estudio pone de manifiesto que los niños con dermatitis atópica de aparición durante el primer año de vida, asociada a la existencia de niveles elevados de IgE y la presencia de sensibilización precoz a alimentos o inhalantes, independientemente del tipo de lactancia recibida, tienen más riesgo de acabar desarrollando patología respiratoria alérgica que los niños con dermatitis atópica sin la asociación de todos estos factores.