A categoria atipia de significado indeterminado/lesão folicular de significado indeterminado (ASI/LFSI) da classificação de Bethesda para as citologias aspirativas de nódulos da tiroideia (CAAF) é reservada para as lesões que contenham células cuja arquitetura e/ou atipia nuclear não seja suficiente para serem classificadas como suspeitas ou malignas. O objetivo deste trabalho é transmitir a experiência do nosso centro sobre o seguimento dos doentes cuja CAAF foi de ASI/LFSI.
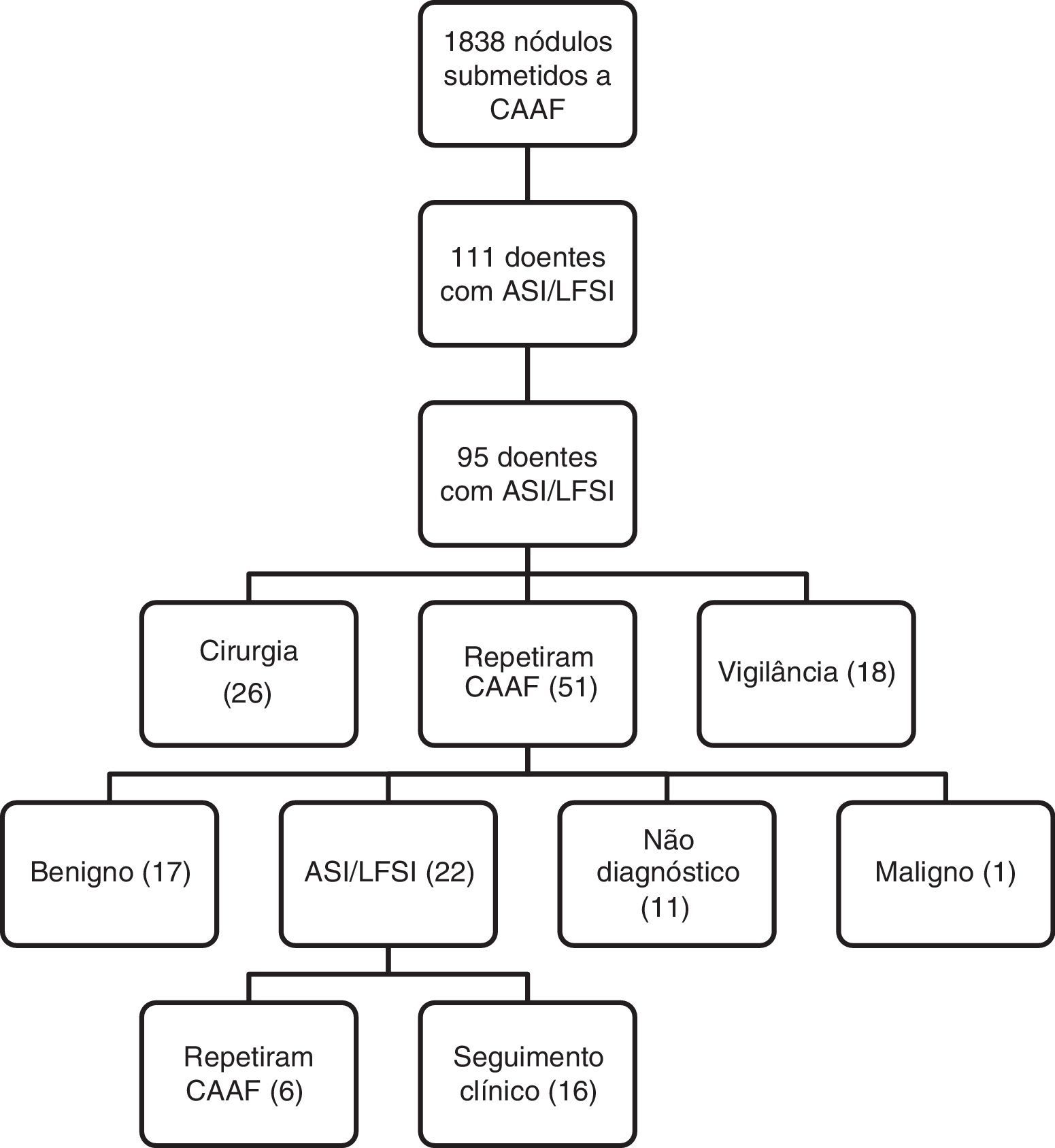
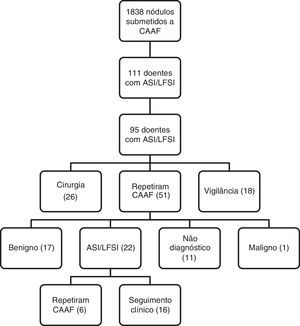
De 1.529 doentes com 1.838 nódulos submetidos a CAAF, 11,4% dos nódulos teve diagnóstico de LFSI. De um total de 111 doentes com diagnóstico de ASI/LFSI, avaliámos 95, 88 do sexo feminino e 7 do sexo masculino.
Vinte e seis doentes (27,4%) foram submetidos diretamente a cirurgia, 5 (19,2%) com diagnóstico histológico de malignidade. Cinquenta e um doentes (53,7%) repetiram a CAAF. Destes, 17 (33,3%) tiveram diagnóstico de benignidade, 22 (43,1%) de ASI/LFSI, 11 (21,6%) de citologia não diagnóstica e um (1,9%) de malignidade. Dos doentes com uma segunda CAAF, 12 (23,5%) foram submetidos a cirurgia: 8 com resultado citológico de ASI/LFSI, 2 citologias não diagnósticas, uma benigna e uma maligna. O resultado histológico foi maligno em 2 doentes. Dezoito doentes (18,9%) mantiveram seguimento clínico, sem repetição de CAAF ou cirurgia. Seis doentes (6,3%) realizaram uma terceira CAAF – 4 foram benignas e 2 não diagnósticas. Dos 95 doentes com diagnóstico de ASI/LFSI, 38 (40%) foram submetidos a cirurgia e 7 (18,4%) tiveram diagnóstico histológico maligno. A taxa de malignidade nos 95 doentes com resultado citológico de LFSI foi de 7,4%, mas de 18,4% nos operados.
Apesar de nesta categoria a recomendação ser a repetição da CAAF, sugerimos que o seguimento destes doentes seja individualizado e discutido em equipa multidisciplinar. A combinação da suspeita clínica, as características ecográficas e os testes moleculares podem auxiliar esta decisão.
The «Atypia of Undetermined Significance/Follicular lesion of Undetermined Significance» (AUS/FLUS) category of the Bethesda Classification for thyroid nodules fine needle aspiration cytology (FNAC) is reserved for specimens that contain cells with architectural and/or nuclear atypia that is not sufficient to be classified as suspicious or malignant. Our objective is to report our experience in the follow‐up and outcome of patients with AUS/FLUS in thyroid nodules FNAC.
From 1529 patients with 1838 thyroid nodules, 11,4% of the nodules were diagnosed as AUS/FLUS. From 111 patients with AUS/FLUS, we analyzed 95, 88 females and 7 males.
Twenty‐six patients (27.4%) had directly neck surgery and five (19.2%) had malignant nodules. Fifty‐one patients (53.7%) repeated FNAC. On the second FNAC, 17 (33.3%) nodules were benign, 22 (43.1%) were AUS/FLUS, 11 (21.6%) were non‐diagnostic and 1 (1.9%) was malignant. From the patients submitted to a second FNAC, 12 undergone to surgery: eight with AUS/FLUS, two non‐diagnostic, one benign and one malignant. The histology revealed that two nodules were malignant. Eighteen patients (18.9%) did only clinical follow up without repeating FNAC or surgery. Six patients (6.3%) repeated FNAC a third time: four nodules were benign and two non‐diagnostic.
Among the 95 patients with AUS/FLUS, 38 (40%) were submitted to neck surgery and seven (18.4%) had a malignant diagnosis. The malignancy rate in the 95 patients with AUS/FLUS was 7.4%, but 18.4% in the patients who did surgery.
In this category the recommendation is to repeat the FNAC rather than excision. We suggest the follow up of these patients should be individualized and discussed in multidisciplinary teams. The combination of clinical suspicion, ultrasound characteristics and molecular tests could help in this decision.
Os nódulos tiroideus são um achado clínico comum, com uma prevalência estimada à palpação de 3‐7%1. O risco de malignidade num doente eutiroideu com um nódulo único estima‐se que seja entre 5‐10%, com uma variação de 3,9‐29%2. A citologia aspirativa por agulha fina (CAAF) dos nódulos tiroideus é o procedimento de eleição na abordagem diagnóstica desta patologia3 e na estratificação do risco de malignidade4. O objetivo da CAAF é identificar quer a patologia benigna, que deve manter vigilância, quer a patologia suspeita ou maligna5. A CAAF, realizada por um técnico experiente, tem uma sensibilidade de 83% (65‐98) e uma especificidade de 92% (72‐100)1.
A classificação de Bethesda para a citologia dos nódulos da tiroideia uniformizou os resultados da CAAF em 6 categorias diagnósticas e tornou‐se no modo de comunicação aceite entre as várias especialidades em contacto com a patologia nodular da tiroideia6. A terceira categoria desta classificação, denominada de atipia de significado indeterminado ou lesão folicular de significado indeterminado (ASI/LFSI), está reservada para as amostras que contenham células (foliculares, linfoides ou outras) com atipia nuclear ou de arquitetura que não é suficiente para serem classificadas como suspeita para neoplasia folicular, suspeito para malignidade ou maligno7. De acordo com Bethesda, o risco de malignidade desta categoria é entre 5‐15%7. Tem‐se demonstrado a categoria mais controversa da classificação de Bethesda8. Segundo a referida classificação, esta categoria deve ser de último recurso e não usada indiscriminadamente. É aconselhado que o número de resultados citológicos classificados como ASI/LFSI não ultrapasse os 7%. A atuação proposta aquando deste diagnóstico é a repetição da CAAF passados 3‐6 meses, com posterior cirurgia caso o resultado seja novamente de ASI/LFSI7. Repetir a CAAF antes de 3 meses pode aumentar a probabilidade de haver atipia reparadora das células foliculares aumentando o número resultados malignos falsos positivos9. Na literatura, a taxa de malignidade das ASI/LFSI após excisão cirúrgica varia entre 6‐48%4.
O nosso objetivo é transmitir a experiência do nosso centro sobre o seguimento dos doentes cujo diagnóstico citológico foi de ASI/LFSI.
MétodosEfetuámos uma análise retrospetiva das CAAF realizadas no nosso centro de janeiro a dezembro de 2012. As CAAF foram realizadas com uma agulha de 25‐gauge, por um endocrinologista ou radiologista, com orientação ecográfica.
Dos 1.529 doentes, com 1.838 nódulos, que realizaram CAAF ecoguiada, selecionámos os que obtiveram resultado citológico de ASI/LFSI de acordo com a classificação de Bethesda. Obtivemos um total de 111 doentes. Destes, excluímos 3 doentes que abandonaram seguimento e não foi possível contactar, 4 que aguardavam repetição de CAAF e 9 que aguardavam cirurgia. Assim, analisámos um total de 95 doentes.
Na análise estatística dos dados usámos o SPSS versão 20. As variáveis categóricas foram comparadas usando o teste do qui‐quadrado. A significância estatística foi aceite para um p<0,05.
ResultadosNo total, 11,4% de todas as CAAF tiveram diagnóstico de ASI/LFSI. Dos 95 doentes, 88 (92,6%) eram do sexo feminino e 7 (7,4%) eram do sexo masculino. A idade média foi 63,6±13,3 anos. Setenta e sete doentes (81%) tinham bócio multinodular e 18 (19%) um nódulo único. A dimensão média dos nódulos foi 22,95±9,7mm. O diâmetro mínimo foi 10mm e o máximo 51mm. Desta amostra, 27,4% (26/95) dos doentes foram encaminhados para cirurgia, 53,5% (51/95) repetiram a CAAF e 18,9% (18/95) mantiveram‐se em vigilância (fig. 1). As dimensões médias dos nódulos nestes subgrupos foram 25,1, 23,9 e 20,6mm, respetivamente.
Vinte e seis doentes (27,4%) foram encaminhados diretamente para cirurgia. Os motivos da decisão cirúrgica foram: nódulo com dimensões superiores a 40mm em 5 doentes; nódulo com crescimento rápido em 3 doentes; bócio com sintomas compressivos em 2 doentes; sugestão do citologista para caracterização histológica do nódulo em 6 doentes; características ecográficas suspeitas em 3 situações; e preferência do doente em 3 casos. O resultado histológico foi maligno em 5 (19,2%): 3 com carcinoma papilar e 2 com carcinoma papilar variante folicular. Em 21 (80,8%) doentes a histologia do nódulo puncionado foi benigna: 17 com hiperplasia nodular, 2 com adenoma folicular e 2 com tiroidite linfocítica. O carcinoma papilar incidental foi um achado em 3 (11,5%) casos.
Cinquenta e um (53,5%) doentes repetiram a CAAF (fig. 1). Na segunda citologia, 43,1% (22) dos resultados foram de ASI/LFSI, 33,3% (17) foram benignos, 21,6% (11) foram não diagnósticos e 1,9% (1) foram malignos. Dos doentes que repetiram a citologia, 12 foram encaminhados para cirurgia: 8 com diagnóstico de LFSI, 2 com citologias não diagnósticas, um com carcinoma papilar e um com um nódulo benigno com 51mm de diâmetro. A histologia do nódulo foi benigna em 10 doentes e maligna (carcinoma papilar) em 2. Foram registados 3 carcinomas papilares incidentais.
Seis doentes repetiram pela terceira vez a CAAF, 4 foram benignas e 2 não diagnósticas (fig. 1).
Dezoito doentes (18,9%) mantiveram seguimento clínico e imagiológico: 11 por rejeitarem a repetição da citologia, 3 por não terem condições cirúrgicas e 4 por não lhes ter sido proposta repetição da citologia ou cirurgia.
No total, dos 95 doentes com diagnóstico de LFSI, 38 (40%) foram submetidos a cirurgia. Destes, 7 (18,4%) tiveram diagnóstico histológico de malignidade (tabela 1). Os nódulos malignos tinham em média 26,9±14,8mm de diâmetro, tendo 48mm o maior nódulo e 14mm o menor. Ecograficamente eram todos hipoecogénicos e 2 eram heterogéneos.
Resultados histológicos de todos os doentes submetidos a cirurgia na nossa série
| Histologia | |
|---|---|
| Maligno | 7 |
| Carcinoma papilar | 5 |
| Carcinoma papilar variante folicular | 2 |
| Benigno | 31 |
| Hiperplasia nodular | 21 |
| Hiperplasia folicular | 1 |
| Adenoma de células de Hurthle | 2 |
| Adenoma folicular | 4 |
| Tiroidite linfocítica crónica | 3 |
| Carcinoma papilar incidental | 6 |
A taxa de malignidade, até à data da recolha dos dados, nos 95 doentes com resultado citológico de LFSI foi de 7,4%, mas de 18,4% nos 38 doentes operados.
A taxa de malignidade nos doentes operados foi de 16,7% nos que repetiram a CAAF e de 19,2% nos que não repetiram a CAAF.
No total registaram‐se 6 carcinomas incidentais.
DiscussãoA classificação de Bethesda para as citologias dos nódulos tiroideus veio facilitar a uniformização dos relatórios das mesmas, bem como estratificar o risco de cada lesão de forma mais clara10. Contudo, na Categoria III desta classificação, nem a percentagem das lesões assim classificadas nem o risco associado se encontram totalmente clarificados. Apesar da classificação de Bethesda propor que o uso da Categoria III não deva exceder 7% do total de citologias observadas e que o risco de malignidade seja entre 5‐15%, séries recentes não o têm demonstrado. Assim, a percentagem de citologias classificadas de ASI/FLSI na nossa série, 11,4%, é concordante com outras séries publicadas, com taxas entre 3‐18%4. Esta variabilidade entre centros pode justificar‐se quer pela variabilidade entre os diferentes observadores quer por diferenças técnicas8. Na realidade, a subjetividade desta categoria diagnóstica é provavelmente o fator principal para estas diferenças. Outra razão possível é a aplicação de diferentes métodos de preparação das amostras11. Fatores de confundimento podem advir da realização do esfregaço, incluindo formação de coágulos e de artefactos na secagem ou fixação. Uma vez que os artefactos são removidos nas preparações em meio líquido, a utilização deste meio poderá resultar numa menor taxa de ASI/LFSI4.
No algoritmo proposto pela classificação de Bethesda o seguimento dos doentes com LFSI/ASI é a repetição da CAAF 3‐6 meses após a primeira CAAF, com indicação para resseção cirúrgica no caso de o resultado ser sobreponível7,12. Na nossa série, a maioria dos doentes, 53,5%, repetiu a CAAF, sendo a maioria dos resultados da repetição, 43,1% (22 doentes), concordante com a citologia anterior. O risco de malignidade para um nódulo com diagnóstico de ASI/LFSI foi de 18,4% (7/38) nos doentes submetidos a cirurgia e de 7,4% (7/95) quando incluídos todos os doentes. Estes resultados são semelhantes aos de outras séries, em que a taxa de malignidade registada foi entre 5‐27% na totalidade dos doentes e entre 17‐48% nos doentes operados4.
Nos doentes que foram diretamente submetidos a cirurgia sem repetição de CAAF, a taxa de malignidade (19,2%) foi superior à dos doentes operados após repetição da CAAF (16,7%). Este facto justifica‐se por um viés de seleção para um maior risco de malignidade decorrente dos fatores clínicos, citológicos e imagiológicos, que conduziram os doentes prontamente para a cirurgia.
Um dos benefícios da repetição da CAAF após um diagnóstico inicial de ASI/LFSI é evitar uma cirurgia desnecessária nos doentes cujo segundo resultado de CAAF seja benigno. A repetição foi a escolha preferencial nesta série, com diagnóstico de benignidade na segunda CAAF em 33,3% dos doentes. Contudo, foi demonstrado por Renshaw que nódulos com resultados citológicos de atipia e posteriormente de benignidade têm um risco de malignidade de 16%, o que é significativamente superior aos nódulos apenas com diagnóstico de benignidade, cujo risco é de 1,7%, e inferior aos nódulos classificados como LFSI/ASI, com risco de 24,5%13. Estes resultados levam‐nos a questionar se doentes com um primeiro diagnóstico de ASI/LFSI devam ser seguidos da mesma forma que os doentes com um primeiro diagnóstico de benignidade.
Vários grupos têm defendido a divisão da Categoria III em 2 subcategorias: ASI e LFSI14–16. A subcategoria ASI incluindo os casos de atipia nuclear, mas com alterações insuficientes para serem consideradas suspeitas para malignidade. Por outro lado, na categoria LFSI os casos com atipia da arquitetura celular, contudo, insuficiente para ser classificada como suspeita para neoplasia folicular14. Estes grupos têm demonstrado que o risco de malignidade é superior para os casos classificados como ASI. Nas séries referidas, a taxa de malignidade variou entre 42‐52,7% nos casos de ASI e entre 6,8‐27% nos casos de LFSI14–16. Dado estes resultados, a subdivisão desta categoria poderá ser uma mais‐valia na decisão clínica e no seguimento destes doentes.
Os testes moleculares têm surgido como um complemento diagnóstico nos nódulos com dimensões superiores a um centímetro e com diagnóstico de ASI/LFSI. Estes testes apenas estão recomendados caso o seu resultado altere a decisão de realizar uma cirurgia ou a extensão da mesma17. Estão disponíveis 2 tipos de testes: os de inclusão e os de exclusão. Os testes de inclusão detetam a presença de mutações pontuais (BRAFV600E ou RAS) ou rearranjos de genes (RET/PTC, PAX8/PPARγ) que demonstraram capacidade na previsão de malignidade. Os testes de exclusão recorrem a propriedades de expressão genética (expressão de RNA) que têm a capacidade de definir um processo como benigno17. Os estudos realizados têm demonstrado que os testes moleculares de inclusão têm elevada especificidade, muito perto de 100%, contudo, com uma sensibilidade mais limitada, entre 59,3‐71%14,18,19. Neste sentido, a presença de um teste de inclusão positivo permite‐nos, com segurança, encaminhar um doente para a cirurgia, contudo, um teste negativo não nos permite excluir a presença de lesão neoplásica. Nestas situações é necessário conjugar o juízo clínico, bem como as características ecográficas e citológicas para tomar a decisão mais apropriada a cada caso.
A Categoria de ASI/LFSI tem demonstrado heterogeneidade entre os diferentes centros tanto na sua prevalência como na taxa de malignidade. A maioria dos centros reporta um número de citologias classificadas como ASI/LFSI superior ao recomendado pela classificação de Bethesda, bem como uma taxa de malignidade mais elevada. Assim, são necessários mais estudos com o intuito de clarificar a real taxa de malignidade destas lesões, nomeadamente com a caracterização histológica de todos os nódulos. Por outro lado, a subdivisão desta categoria parece ser uma das formas de atenuar esta heterogeneidade. É igualmente importante esclarecer se doentes com um resultado citológico de benignidade após um primeiro diagnóstico de ASI/LFSI têm o mesmo risco que doentes apenas com um diagnóstico benigno.
Apesar de nesta categoria a recomendação ser a repetição da CAAF, sugerimos que o seguimento destes doentes seja individualizado e discutido em equipa multidisciplinar. O facto de termos verificado uma percentagem de malignidade de 19,2% nos doentes operados logo após uma primeira CAAF com diagnóstico de ASI/LFSI e sabendo que estes doentes foram encaminhados para a cirurgia por fatores de risco clínico e imagiológicos, suporta esta necessidade de individualizar a decisão. A combinação da suspeita clínica, as características ecográficas e os testes moleculares devem ser tidos em conta aquando da decisão.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.