INTRODUCCIÓN
Si nos aferramos a la tesis que contempla la patogenia de la osteoporosis posmenopáusica (OP) como un proceso multifactorial con señalada participación de los factores ambientales, probablemente no encontraremos demasiado sentido clínico a cuestiones como: ¿es la OP una enfermedad genética?, o ¿existen variantes genéticas que identifiquen pacientes con riesgo de padecer OP o de responder adecuadamente a las opciones terapéuticas?
En efecto, la primera lección que se asimila al relacionarnos con la OP es no perder la referencia del ambioma como componente elemental o dispositivo básico en el principio de la fragilidad ósea. Mas para comprender la singularidad de este proceso, en tanto distintivo y distinto para cada paciente, es igualmente valiosa la exploración de su genoma.
De momento, la genética clínica nos permite el diagnóstico prenatal de enfermedades genéticas y la identificación de sujetos con susceptibilidad de padecer enfermedades frecuentes. En los últimos años su dominio se ha extendido al terreno de la semiología y al de la respuesta a los tratamientos, otorgando un evidente sentido al principio que dice que no hay dos pacientes iguales, y ha dejado la puerta abierta a la nueva dimensión de la medicina predictiva y personalizada.
Una de sus herramientas más recurridas recientemente es el uso de los polimorfismos de un gen determinado, entendidos como las variaciones en la secuencia de ADN de este gen. En la mayoría de los casos no tienen repercusión fenotípica porque no afectan a la región codificante del gen, y pueden consistir en cambios de un único nucleótido (SNP, single nucleotide polymorphism) o en repeticiones de una secuencia determinada de ADN (VNTR, variable number of tandem repeats). Cuando aparecen secuencias de ADN cortadas por nucleasas, se provoca un error en la transcripción y pasan a llamarse polimorfismos en la longitud de los fragmentos de restricción (RFLP, restriction fragment length polymor-phism). Conceptualmente, la diferencia entre un polimorfismo y una mutación está en que el primero afecta al menos al 1% de la población; especialmente los SNP se consideran una forma de mutación puntual lo suficientemente exitosa evolutivamente como para fijarse en una parte significativa de la población.
LA CONTRIBUCIÓN DE LOS FACTORES GENÉTICOS A LA OSTEOPOROSIS POSMENOPÁUSICA
Podemos convenir que cualquier enfermedad es el resultado de la interacción entre su genoma y los factores ambientales a los que está sometido, si bien para la OP en particular aún nos hallamos en el camino que nos aclare o cuantifique la trascendencia del primer componente. A la vista de la distribución de la osteoporosis en general, es lícito afirmar que se trata de un proceso característico del sexo femenino, en tanto sólo uno de cada 4 afectados es un varón. La protección del hombre se explica por varias razones que no esconden que la genética ha dejado de cumplir un mero papel secundario: adquiere mayor masa ósea a lo largo de toda su vida, carece del hito de la menopausia, tiene menor tendencia a caerse y su esperanza de vida es más corta.
Partimos, pues, de diferencias de sexo (en parte connatales) en la adquisición de masa ósea, tal es así que probablemente hasta el 80% de la cantidad de hueso que adquiere un individuo esté determinada genéticamente, circunstancia que por sí sola condiciona incluso cómo será su resistencia a la fractura en la vejez. Desde esta perspectiva, la osteoporosis se constituye pues en una enfermedad compleja, con una predisposición adquirida y sujeta a fuertes influencias ambientales perfectamente descritas en los estudios epidemiológicos. En otras palabras, que como otros procesos ligados al envejecimiento, con una poderosa interrelación entre genoma y ambioma. Además, la OP es una enfermedad cuya patogénesis se caracteriza en esencia por un alto remodelado óseo, y los factores que lo regulan tienen también una heredabilidad variable, cercana al 85%, y que incluye la propia genética de la función ovárica1.
La importancia y actualidad de la investigación genética en la OP queda reflejada en las más de mil publicaciones aparecidas desde que se descifró el códi go genético humano. La identificación del gen o los genes implicados en su desarrollo se ve dificultada, sin embargo, por el carácter multifactorial de la propia enfermedad, así como por la heterogeneidad de las distintas poblaciones. La carrera por descubrir una alteración genética que desarrollase la OP se inició con el del colágeno tipo 1 (COL1A1), la principal proteína de la matriz ósea y cuya mutación determina la aparición de la osteogénesis imperfecta. Por técnicas como el análisis de asociación se han identificado después otros genes candidatos a la OP, como el del receptor de la vitamina D (VDR), el de los receptores estrogénicos o el de la interleucina 6. Aunque los resultados han sido, desde su inicio, prometedores, las publicaciones posteriores no han mostrado toda la consistencia esperada y rebaten la hipótesis que conjetura que un solo marcador genético puede servirnos en la detección de pacientes de riesgo.
FORMAS DE INVESTIGACIÓN EN GENÉTICA Y OSTEOPOROSIS POSMENOPÁUSICA
Las estrategias de conocimiento sobre genética y OP utilizadas hasta el momento se han basado en estudios de asociación, análisis del ligamiento y estudios de funcionalidad.
Los estudios de asociación genética buscan polimorfismos de un gen candidato con el propósito de identificar asociaciones estadísticamente significativas entre el rasgo estudiado y la variante del genoma estudiado. En la actualidad, la mayoría de los estudios de asociación son univariantes, y con ellos se persigue el aislamiento de genes que den lugar a enfermedades, síndromes, rasgos clínicos o efectos adversos a la medicación usada.
Se consigue lograr un gen candidato tras un meticuloso proceso donde se mezclan experimentos biológicos o moleculares que revelen su expresión en el hueso, junto con modelos animales donde una mutación vaya asociada a un fenotipo óseo característico. Entre estos últimos se incluyen las mutaciones naturales que en humanos causan enfermedades óseas con herencia mendeliana, los experimentos de sobreexpresión (experiencias transgénicas) y los de bloqueo de la expresión génica (knock-out).
Una vez identificado el gen candidato, se localizan las variantes alélicas comunes (polimorfismos genéticos) asociadas con alguna modificación en la función de las proteínas codificadas por dicho gen. Si el polimorfismo no determina variación en la función del gen se llama polimorfismo anónimo, mientras que aquellos casos donde se altera su función se denominan polimorfismos funcionales, y pueden afectar a la región codificante, provocando un cambio en la secuencia de aminoácidos, a la región promotora 5' asociándose a diferencias en la transcripción del ARN, o a la región 3' determinando diferencias en la degradación del ARN mensajero.
Hasta la fecha se han descrito 62 genes candidatos relacionados con la OP, aunque casi la mitad sólo se ha estudiado en una cohorte, quedando sin verificar su importancia en otras poblaciones de estudio, lo que limita su papel determinante en esta enfermedad. Los más estudiados son, por este orden: los del receptor de la vitamina D, los de los receptores para estrógenos y el del colágeno de tipo 12.
Pero a medida que se van descubriendo genes implicados, se empieza a considerar la OP como una enfermedad poligénica modulada por factores ambientales donde la predisposición, la patogenia o la respuesta a los tratamientos dependen de la interacción entre diferentes genes o de ellos con factores ambientales.
LOS POLIMORFISMOS GENÉTICOS EN LA RUTA ESTROGÉNICA Y SU RELACIÓN CON LA OSPEOPOROSIS POSMENOPÁUSICA
Que el estradiol desempeñe un papel importante para la adquisición y mantenimiento de la masa ósea en hombres y en mujeres es una tesis íntegramente aceptada, así como su extensión a múltiples dianas y, por consiguiente, su implicación fisiopatológica en otras enfermedades. Esta singularidad de los estrógenos ha sido analizada en un reciente estudio en el que se han aislado más de 3.600 sitios de unión de los receptores de estrógenos o, lo que es lo mismo, que aparecen dianas de receptores de estrógenos cada 839 kilobases del genoma3.
Existen dos tipos de receptores para los estrógenos, el alfa o tipo 1 (ESR1) y el beta o tipo 2 (ESR2). Ambos pertenecen a la superfamilia de los receptores nucleares y están distribuidos de forma distinta en casi todos los tejidos del organismo, coincidiendo en algunos de ellos. ESR1 y ESR2 se comportan como reguladores de la transcripción del ADN; así, la asociación del ligando a su receptor promueve su unión a una secuencia específica del ADN denominada elemento de respuesta a estrógeno (ERE), que se localiza en las regiones promotoras de los genes diana. Dicha regulación también puede estar mediada por una interacción proteína-proteína con otros factores de transcripción como la proteína activadora 1 (AP-1), el factor nuclear kappa B (NFkB), el factor específico de promotor tipo 1 (Sp1) y otras proteínas correguladoras llamadas proteínas de interacción con receptores nucleares (NRIP1), capaces de activar o reprimir la transcripción.
Los trabajos que en la actualidad relacionan de una manera independiente las variantes genéticas de ESR1, ESR2 y otros factores relacionados con el metabolismo estrogénico confirman el relevante papel que desempeñan en la patogénesis y clínica de las enfermedades relacionadas con los estrógenos, lo cual es lógico si pensamos que los niveles estrogénicos siguen un proceso de regulación muy fino, de manera que una pequeña alteración en cualquiera de sus receptores podría modificar el proceso de señalización y dar lugar a un fallo en su función metabólica4.
POLIMORFISMOS DE LOS GENES DEL ESR1 Y DEL ESR2
Los genes para los ESR1 y ESR2 se expresan en los osteoblastos, los osteoclastos y las células estromales. Parece que el ESR1 es el principal receptor que media la acción estrogénica en el hueso y tiene una importancia primordial en la regulación de su remodelado, mientras que la acción del ESR2, si bien menos conocida, se ha identificado sobre todo en el hueso trabecular.
Polimorfismos del ESR1
El gen del ESR1 se localiza en el brazo corto del cromosoma 6, en la región 6q25, está formado por 8 exones y 7 intrones, y en su estructura se han descrito varios lugares sobre los que asientan distintos polimorfismos, los más importantes en las regiones promotoras, las que determinan el inicio de su transcripción. La mayoría de los estudios se han dirigido a tres polimorfismos, dos de ellos de tipo RFLP: el PvuII (T397C) y el XbaI (C351G) del intrón 1, y otro de tipo VNTR: (TA)n5.
En relación con la osteoporosis, en una población de 2.230 pacientes japonesas se observó que en las mayores de 60 años, el marcador XbaI por sí solo o en combinación con PvuII estaba significativamente asociado con la DMO de cuello femoral6. También en un estudio de 8 marcadores dentro del gen ESR1 en 405 núcleos familiares (1.873 sujetos) se encontraron efectos marginales en la DMO femoral con los marcadores rs932477 y rs2228480. Estos mismos autores observaron una asociación entre un haplotipo formado por 7 marcadores y la DMO lumbar7.
La asociación de PvuII, XbaII y las repeticiones (TA)n fueron estudiadas en 2.042 mujeres alemanas ancianas, observándose que las homocigotas para el haplotipo px junto con un bajo número de repeticiones (TA)n tuvieron una menor DMO lumbar, junto con un incremento del riesgo de fractura vertebral8.
Por otro lado, en algunos metaanálisis se ha observado que el homocigoto XX del marcador XbaII presentaba una mayor DMO y un menor riesgo de fractura que las portadoras del alelo x, mientras que el polimorfismo PvuII no estaba asociado en estas pacientes9.
La importancia que tiene el gen ESR1 en relación con la osteoporosis también ha quedado de manifiesto en el estudio Framin gham realizado con la tecnología Affrimetrix 100K en 1.141 individuos, donde observaron dos marcadores (rs1884052 y rs3778099) de dicho gen como candidatos para la susceptibilidad a osteoporosis10.
Polimorfismos del gen del ESR2
El gen que codifica el ESR2 en humanos se localiza en el cromosoma 14, en la región 14q23.2. Tiene 9 exones y su secuencia genómica comprende alrededor de 61,2 Kb. El primer polimorfismo en ESR2 no fue caracterizado hasta 1998 en población japonesa y consistía en una repetición dinucleó tida (CA)n altamente polimórfica en el intrón 511. Es por ello que en la actualidad no existen muchos trabajos que relacionen el gen ESR2 con enfermedades ginecológicas, o sus resultados son contradictorios.
Los principales estudios realizados en el gen ESR2 han sido efectuados precisamente en OP, observándose una asociación entre el polimorfismo de repetición (CA)n y la DMO12.
POLIMORFISMOS DEL GEN DEL RECEPTOR DE LA HORMONA ESTIMULANTE DEL FOLÍCULO
El receptor para la hormona estimulante del folículo (FSHR) pertenece a la familia de receptores acoplados a proteína G y se encuentra localizado en el cromosoma 2, en la región 2p16.3.
La primera mutación encontrada en el gen FSHR en humanos fue descrita en 1995 en población finlandesa y consistía en un cambio de aminoácido (A189V) asociado a amenorrea primaria, si bien con posterioridad se encontraron otras mutaciones (I160T, R573C, D224V, L601V, I191L, A189V y A419T) en casos esporádicos de amenorrea13.
Los polimorfismos del gen del FSHR que determinan una hipofunción de este receptor se acompañan de una menor pérdida de masa ósea en ratonas castradas, lo que sugiere que el exceso de expresión de este gen pueda estar detrás del remodelado óseo aumentado tras la menopausia14.
POLIMORFISMOS DEL GEN DE LA AROMATASA
El gen de la aromatasa (CYP19A1) se encuentra localizado en el cromosoma 15, en la región 15q21, y codifica una enzima de la familia del citocromo P450, encargada de catalizar la transformación (aromatización) de los andrógenos en estrógenos. Aparte de expresarse en órganos sexuales como el ovario, el testículo o la placenta, se produce también en otros tejidos, fundamentalmente el adiposo, fuente principal de los estrógenos tras la menopausia.
Masi et al fueron los primeros que encontraron una asociación entre el polimorfismo (TTTA)n y la DMO o la fractura, pero sus resultados, sin embargo, no han sido confirmados en estudios posteriores, y se han identificado otros marcadores diferentes con asociación variable a la OP15.
OTROS GENES CANDIDATOS NO ESTUDIADOS EN OSTEOPOROSIS POSMENOPÁUSICA
Polimorfismos del gen de la NRIP1
La NRIP1 es una proteína que, como hemos apuntado, modula la actividad transcripcional de los receptores de estrógenos. Sus alteraciones se han relacionado con otras enfermedades dependientes de los estrógenos, pero su papel en el desarrollo de la OP es en la actualidad desconocido. Sin embargo, como veremos en el próximo apartado, sí se ha encontrado relación de este gen con la OP mediante estudios de interacción genética.
POLIMORFISMOS DEL GEN DE LA PROTEÍNA MORFOGENÉTICA DE HUESO 15
El gen de la proteína morfogenética de hueso 15 (BMP15) está localizado en el cromosoma X, en la región Xp11.2. Se sintetiza en el ovocito en forma de pre-pro-hormona y se procesa por una endopeptidasa a pro-hormona para más tarde adquirir su configuración tridimensional con la que se une al receptor. Pertenece a la superfamilia de los factores de crecimiento transformantes Beta (TGF-B), junto con el GDF9 (growth differentation factor 9). Tanto la BMP15 como el GDF9 se unen a dos tipos de receptores transmembrana localizados en las células de la granulosa: el receptor de BMP de tipo II (BMPRII) y el receptor de BMP de tipo IB (BMPRIB). Interviene en la producción es trogénica mediante varios mecanismos: estimulando la proliferación de las células de la granulosa, inhibiendo la expresión del FSHR y estimulando al factor de desarrollo folicular KL (KIT ligand).
La primera mutación del gen de la BMP15 fue descrita en ovejas, una de las pocas especies que, como el ser humano, presentan ovulaciones únicas. En las heterocigotas se observaron poliovulaciones y embarazos múltiples, mientras en las homocigotas se producía un bloqueo temprano de la foliculogénesis y eran, por tanto, infértiles. En la actualidad se han identificado otras mutaciones de este gen que producen infertilidad en ovejas y ratonas, pero lo más interesante de estos trabajos consiste en haber estimulado la investigación de los polimorfismos de este y otros genes de la foliculogénesis humana, y se han asociado a procesos ginecológicos como la hiperestimulación ovárica, el fallo ovárico precoz y el síndrome de ovarios poliquísticos16.
Aun cuando no se han estudiado los vínculos de los polimorfismos del gen de BMP15 con la masa ósea, sí es importante su asociación con la reducción del periodo de vida fértil y, en consecuencia, con el tiempo de exposición a los estrógenos. En 2004 Di Pascuale describe en dos hermanas afectas de fallo ovárico prematuro la presencia de un polimorfismo del gen BMP15 (Y235C). Más adelante, estos mismos autores confirmaron sus hallazgos en una cohorte de 166 pacientes con menopausia precoz, en las que hallaron 7 casos de mutaciones en el gen BMP15 y ninguna en el grupo control (p = 0,03). De las 7 mutaciones encontradas, una era la ya conocida (Y235C) y las 6 restantes no estaban hasta entonces descritas. Todos estos polimorfismos determinaban una alteración en la región pro-proteína provocando también una alteración en la configuración espacial de BMP15 y, en consecuencia, una alteración en su función17.
A pesar de que estos hallazgos se han verificado por otros autores, la evidencia acerca del papel de los polimorfismos de la BMP15 como causa de menopausia precoz empieza a debilitarse con la publicación de estos polimorfismos en otras poblaciones18.
Sobre la variante más estudiada de la BMP15, la A180T, podemos decir que no es ni suficiente ni necesaria para generar una menopausia prematura, al menos en población española, pues, al contrario de lo que sucedió en las otras tres poblaciones, se aísla en mujeres sin menopausia precoz. Sin embargo, sí encontramos que cuando aparece el marcador IVS1+905A>G la menopausia se adelanta un promedio de 1,29 y el período fértil se acorta 1,9 años19. Acaso las pacientes de otros trabajos anteriores al nuestro constituyan un conjunto heterogéneo, y queda claro a qué grupo étnico pertenecen las que se incluyeron como controles, por lo que las diferentes variantes descritas en ellas podrían simplemente ser artefactos derivados de la estratificación de la población; en otras palabras, serían variantes comunes en ciertos grupos étnicos más que variantes causantes de la menopausia precoz.
En consecuencia, no disponemos de suficientes evidencias para relacionar una sola variante funcional de la BMP15 con la OP, pero los resultados obtenidos en nuestras mujeres, con adelanto de la edad de la menopausia y disminución de la ventana reproductiva, puede abrirnos posibilidades diagnósticas y terapéuticas en sus afectadas.
ESTUDIOS DE INTERACCIÓN GÉNICA
De una manera individual, las diferentes variantes genéticas de los loci que hemos analizado han sido estudiadas en gran cantidad de enfermedades relacionadas con los estrógenos, incluida la OP. No obstante, los resultados son muy variados y controvertidos, debido acaso a la falta de poder estadístico en el análisis genético, al empleo de diferentes valoraciones clínicas o a la presencia de estratificación genética, aunque pensamos que la principal razón asienta en que los estudios univariantes ignoran por completo la naturaleza compleja de esta enfermedad y la interacción de esas variaciones genéticas entre sí y con los factores ambientales.
Siguiendo esta dirección, hemos observado interacciones génicas entre los loci de FSHR, ESR1 y ESR2 en otros procesos ginecológicos20, trabajo pionero en mencionar los polimorfismos del ESR2 y en describir la asociación de estos dos genes o en las enfermedades relacionadas con los estrógenos.
Otros grupos también han descrito una interacción génica entre los genes del VDR, del CYP19A1 o del ESR1 para explicar la baja DMO o la baja edad de la menarquia21-23.
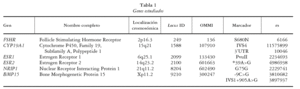
Hemos realizado un estudio de interacción génica entre varios genes de la ruta estrogénica (tabla 1) y la OP, detectando una fuerte asociación entre esta enfermedad y dos patrones digénicos: ESR1-ESR2 y ESR2-NRIP124, como ya ocurría en otros procesos ginecológicos23, por lo que es posible que otras asociaciones de estos y otros loci implicados en la ruta estrogénica puedan tener un efecto relevante sobre la OP.
Precisamente, la interacción ESR1-ESR2 ha sido descrita en otros tres estudios recientes. En el primero, en una población de mujeres holandesas con riesgo de fractura, se observó una interacción del gen ESR2 con el gen ESR1 o con el gen del factor de crecimiento insulínico de tipo 1 (IGF-1)25. El segundo trabajo relaciona la interacción ESR1-ESR2 con el retraso de la edad de la menarquia en un grupo de adolescentes griegas26. Este último ha sido confirmado con resultados nuestros, que refuerzan la importancia de la interacción ESR1-ESR2 en un fenotipo relacionado con los estrógenos27.
Con respecto al gen de la BMP15, además de una mejor comprensión de su papel en poblaciones mayores, será necesario recurrir al estudio de interacción con otros genes relacionados como el GDF9, BMPRIB, BMPRII, KL o C-KIT, o con los genes ya estudiados de la ruta estrogénica (FSHR, ESR1 y ESR2).
Aparte de la interacción entre genes, nos interesa la posible interacción entre factores genéticos y ambientales. De esta manera, profundizamos en la relación ya descrita entre los polimorfismos del gen CYP19 y la OP, descrita sobre todo por el grupo español de Riancho et al23. Para ello, realizamos un análisis de los marcadores localizados en la región no traducida 3'UTR (rs10046) y en la región intrónica IVS4 (rs11575899) del gen CYP19A1. Aparte de confirmar los resultados observados en estudios previos, comprobamos que el efecto de los alelos de CYP19A1 con respecto a la DMO y a la OP en población española podría depender del índice de masa corporal de las mujeres posmenopáusicas28.
Otra faceta de estos estudios se refiere a la búsqueda de variantes génicas que identifiquen pacientes en donde se altere la efectividad y la eficiencia en la actitud terapéutica. Existe aún poca literatura de esta índole, pero empiezan a describirse asociaciones entre determinados polimorfismos del gen del VDR y la absorción de calcio29, o de los ESR con la respuesta a la terapia hormonal sustitutiva en mujeres posmenopáusicas30. Previendo cómo puede ser la respuesta a un tratamiento determinado (no olvidemos que el polimorfismo de una enzima encargada de la metabolización de un fármaco puede alterar la respuesta normal a éste), los análisis genotípicos pueden identificar a las pacientes proclives a responder mal o a sufrir efectos no deseados. Es el argumento en el que se fundamenta la medicina individualizada.
CONCLUSIÓN
La investigación genética representa ahora una de las más activas áreas dentro de la Osteología. Aun cuando nos hallamos en fases preliminares, esperamos que entre de lleno en la práctica clínica de la OP. Detallar el mapa genético y los polimorfismos o mutaciones que influyen sobre la DMO o el riesgo de padecer OP permitirá en un futuro conocer mejor su patogenia e identificar a individuos con alto riesgo de sufrir fracturas por fragilidad, para así desarrollar programas de prevención individualizados y habilitar la medicina predictiva; también permitirá anticipar respuestas o resistencias a los tratamientos convencionales y desarrollar nuevas alternativas terapéuticas (medicina personalizada). Es pues una carrera por etapas, en la que dejamos atrás aquella en la que se pensaba que todo podría resultar fácil con la determinación de un solo loci. Nos adentramos en la siguiente fase, donde impera conocer qué interacciones génicas existen, cuáles son sus relaciones con los factores ambientales y cómo explican la patogenia de la OP.