Las infecciones del tracto genitourinario están relacionadas con un alto porcentaje de casos de infertilidad masculina, sin embargo, en la gran mayoría estas infecciones suelen ser asintomáticas y los microorganismos responsables no siempre son identificados. El objetivo de este trabajo fue detectar la presencia de las bacterias Chlamydia trachomatis (C. trachomatis), Neisseria gonorrhoeae (N. gonorrhoeae) y Ureaplasma urealyticum (U. urealyticum) en el semen de voluntarios aparentemente sanos.
Materiales y métodosMuestras de semen de 84 voluntarios aparentemente sanos fueron colectadas y analizadas siguiendo los lineamientos de la Organización Mundial de la Salud. Además, se realizó la extracción de ADN empleando la técnica de fenol-cloroformo y se detectó el ADN de los microorganismos usando la técnica de reacción en cadena de la polimerasa.
ResultadosEn las 84 muestras evaluadas se detectó ADN de alguno de los microorganismos en 8 muestras (9,5%), 6 de ellas positivas para U. urealyticum (7,1%) y 3 muestras fueron positivas para la detección N. gonorrhoeae (3,6%). Una muestra (1,0%) presentó coinfección por U. urealyticum y N. gonorrhoeae. No se detectó ADN de C. trachomatis en ninguna muestra evaluada. No se observó relación entre la presencia del ADN de alguno de los microorganismos con la calidad seminal.
ConclusiónEl semen de los individuos de población general asintomática puede albergar microorganismos como N. gonorrhoeae y U. urealyticum sin que su presencia afecte la calidad seminal.
Genitourinary tract infections are associated with a high percentage of cases of male infertility, but these infections are usually asymptomatic and microorganisms responsible are not always identified. The objective of this study was to detect the presence of C. trachomatis, N. gonorrhoeae, and U. urealyticum in the semen of healthy volunteers.
Materials and methodsSemen samples from 84 healthy volunteers were collected. Seminal analysis was performed according to the WHO guidelines, and DNA was extracted using the phenol/chloroform technique. The polymerase chain reaction was employed to detect bacterial DNA.
ResultsBacterial DNA was detected in 8 (9.5%) of the 84 samples, six of them positive for U. urealyticum (7.1%), and 3 samples were positive for N. gonorrhoeae (3.6%). Only one sample (1.0%) had a co-infection with U. urealyticum and N. gonorrhoeae. None of the samples was positive for C. trachomatis. The presence of bacterial DNA was not related to semen quality.
ConclusionThe semen of asymptomatic individuals from the general population may harbour microorganisms such as N. gonorrhoeae and U. urealyticum, without affecting semen quality.
Los procesos inflamatorios e infecciosos del tracto urogenital masculino se han asociado con el 8 al 35% de los casos de infertilidad1. Dentro de este grupo se encuentran las infecciones de transmisión sexual (ITS), con una estimación de 19 millones de nuevos casos cada año y casi la mitad de ellos en jóvenes de 15 a 24 años2.
Tanto las ITS como las demás infecciones del tracto urogenital masculino continúan presentando una alta prevalencia en la población mundial a pesar de ser fácilmente tratables y prevenibles3; de estas infecciones, la prostatitis crónica es el problema urológico más común4 y responsable de un gran número de casos de infertilidad, aún mayores que los reportados por la bacteriospermia asintomática, las infecciones de las glándulas sexuales o del epidídimo1.
Se estima que entre el 9 y el 11% de los hombres en edad reproductiva han tenido síntomas de prostatitis en algún momento de su vida y la mayoría son medicados con antimicrobianos5,6. El panorama de diagnóstico clínico de estas infecciones se complica aún más debido a que en muchos casos las infecciones prostáticas son raramente documentadas, aun cuando cerca del 7% de los pacientes con prostatitis tienen infecciones bacterianas crónicas5. Por este motivo, metodologías como la reacción en cadena de la polimerasa (PCR) se convierten en un método altamente sensible y versátil para detectar bacterias en el tracto urogenital masculino no diagnosticadas por los métodos de cultivo tradicionales7.
La infección de los órganos que contribuyen al eyaculado (testículo, epidídimo, vasos deferentes, vesículas seminales, próstata y uretra) aportan un alto número de enfermedades masculinas entre las que se encuentra la infertilidad8. Los microorganismos más prevalentes son Chlamydia trachomatis (C. trachomatis), Ureaplasma urealyticum (U. urealyticum), Neisseria gonorrhoeae (N. gonorrhoeae) y otros micoplasmas, pero su efecto sobre la calidad seminal aún no es claro6,7.
El papel de U. urealyticum en la infertilidad femenina está bien documentado en los casos de complicaciones y secuelas durante el embarazo9, pero el efecto de la infección masculina aún es controversial; su presencia en el semen se ha asociado con una disminución de la concentración espermática, la movilidad y la morfología10. En 2003, Knox et al.9 reportaron una prevalencia de U. urealyticum del 22 y el 8,5% en muestras antes y después de realizar lavados de semen, como los usados en las técnicas de reproducción asistida. De otro lado, C. trachomatis es una de las bacterias de transmisión sexual más prevalente en el mundo1 y causa serias secuelas en las mujeres, como la enfermedad pélvica inflamatoria, el embarazo ectópico y la infertilidad11. En hombres se describe como un agente causal de uretritis, epididimitis y epidídimo-orquitis, y desde hace algunos años es reconocida como un agente etiológico de prostatitis12,13, sin tener un papel claro en la infertilidad masculina. Por su parte, N. gonorrhoeae está catalogada como la responsable de la gran mayoría de casos de uretritis14 y, aunque la incidencia de gonorrea está disminuyendo en los países industrializados, esta infección sigue siendo la ITS más importante en las ciudades en vía de desarrollo15.
El objetivo de este trabajo fue detectar la presencia de las bacterias U. urealyticum, C. trachomatis y N. gonorrhoeae en el semen de voluntarios aparentemente sanos y correlacionarla con la calidad seminal.
Materiales y métodosMuestras de semenOchenta y cuatro muestras de semen de voluntarios aparentemente sanos, mayores de edad, sin signos ni síntomas de infección urogenital o alteraciones del tracto reproductivo fueron obtenidas mediante masturbación y colectadas en un recipiente estéril después de una abstinencia sexual de 2 a 5 días, entre agosto del 2014 y septiembre del 2015. Se evaluaron los parámetros seminales de acuerdo con lo establecido por la Organización Mundial de la Salud16 y la concentración espermática se determinó empleando la cámara de Makler (Sefi-Medical Instruments, Israel)17.
Extracción de ADNSe realizó extracción de ADN de los espermatozoides usando el protocolo de fenol-cloroformo previamente estandarizado en nuestro grupo. Brevemente, las muestras de semen fueron centrifugadas a 200g/10 min y se les adicionaron 0,5ml de solución de lisis (Tris 1M, EDTA 0,5M, NaCl 5M, SDS 10% y tritón 0,1%) y 5μl de proteinasa K (20mg/ml, Thermo-Scientific, MA, USA) durante 12 h a 54°C. Posteriormente, se adicionó 1ml de fenol-cloroformo-isoamílico (Amresco, Ohio, EE. UU.) y se centrifugó a 5.000g/10min; al sobrenadante recuperado se le adicionó 1ml de etanol absoluto (–20°C), 50μL de acetato de sodio 3M y se dejó a -20°C toda la noche para precipitar el ADN. Finalmente, se lavó con 1ml de etanol al 70%, se dejó secar el etanol, el ADN fue diluido en agua libre de DNAsa/RNAsa (Gibco, Life Techonologies, EE. UU.) y cuantificado en Nanodrop (ND1000 Spectophotometer, Thermo-Scientific, EE. UU.).
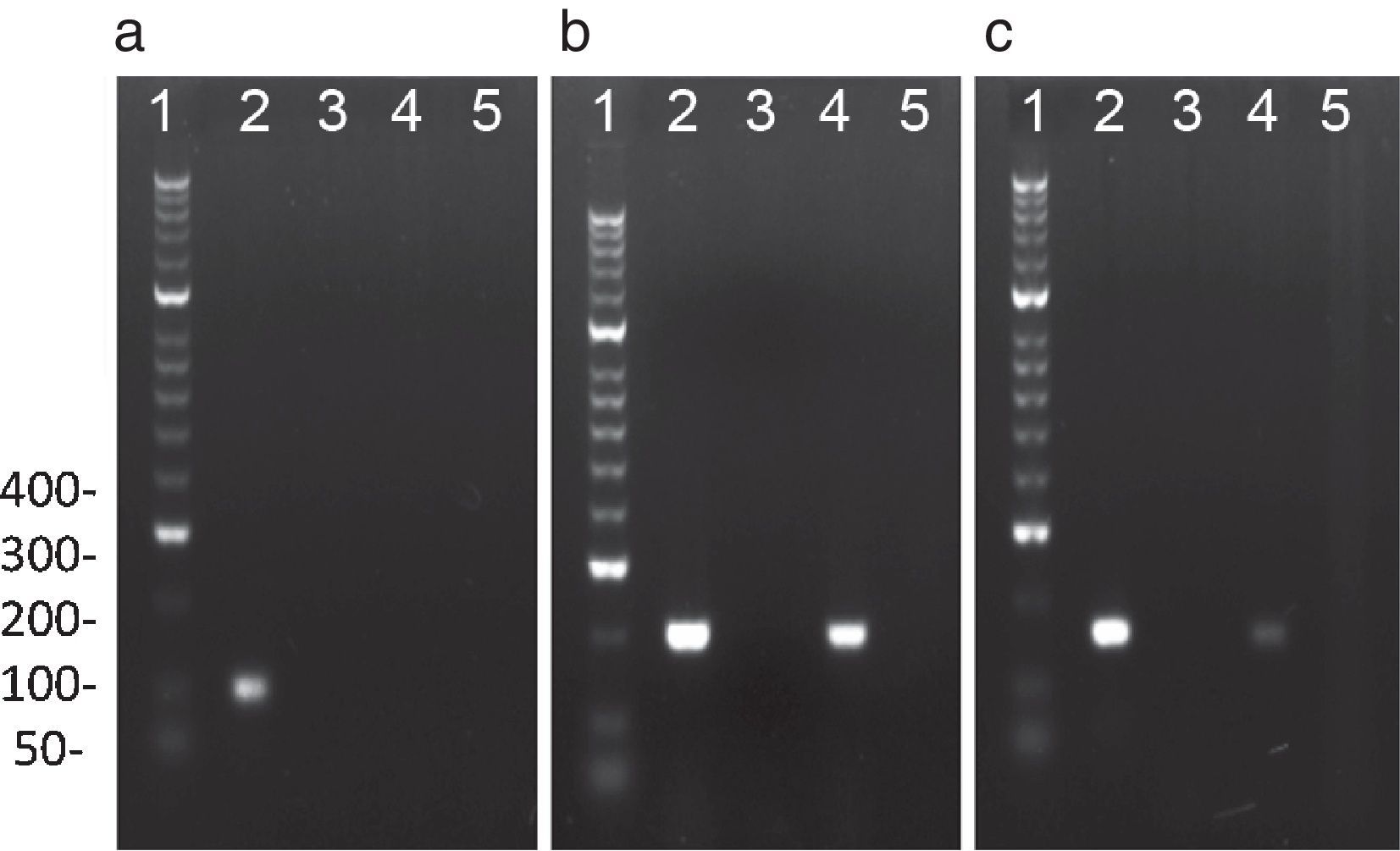
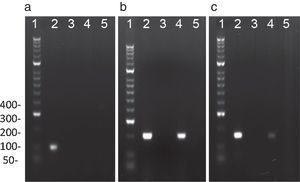
Reacción en cadena de la polimerasa para detectar el ADN de cada bacteria en semenSe empleó un volumen final de reacción de 25μl que contenía 12,5μl de Master Mix (Thermo-Scientific, EE. UU.), solución que contiene 0,025U/μl de Taq DNA polimerasa, 2mM de MgCl2 y 0,2mM de cada dNTP (dATP, dCTP, dGTP y dTTP) diluidos en solución tampón de reacción. A cada reacción se le adicionó 1μM de cada cebador (tabla 1), 6μL de ADN (200ng) y 5,5μL de agua. La PCR se realizó en un termociclador (T3000, Whatman, Biometra, Goettingen, Alemania) bajo las condiciones descritas en la tabla 1. Como control positivo, se empleó el ADN extraído de las cepas C. trachomatis serovar E (donada por el Dr. Rubén Motrich, Centro de Investigaciones en Bioquímica Clínica e Inmunología-CIBICI, Universidad Nacional de Córdoba, Argentina) y N. gonorrhoeae ATCC 43069. Como control positivo de U. urealyticum se empleó ADN de muestras de semen positivas para este microorganismo (donadas por el Dr. Pedro Martínez, Centro Latinoamericano de Diagnóstico Genético Molecular-CELAGEN, Bogotá, Colombia). El control negativo consistió en la mezcla de reacción sin ADN (fig. 1). Finalmente, se realizó una electroforesis en gel de agarosa al 3% teñido con Sybr Safe (Invitrogen Life Technologies, EE. UU.) en solución tampón TAE durante 23 min a 135V. Los productos de la reacción fueron comparados con el marcador de peso molecular de 100pb (Hyperladder II 100 lines, Bioline, Life Sciencie Company, Londres, Reino Unido) y fueron visualizados en un fotodocumentador Molecular Image Gel Doc TM XR (Bio-Rad, CA, EE. UU.) bajo iluminación ultravioleta con el programa Image Lab 5.1 (Bio-Rad, CA, EE. UU.).
Cebadores y condiciones de la PCR
| Microorganismo | Cebadores | Fragmento | Condiciones PCR | ||
|---|---|---|---|---|---|
| Desnaturalización inicial | Ciclos | Elongación final | |||
| C. trachomatis | OMP1 5’-GCT CGG ATG CCT TGT TAA CAC-3’ 5’-TCC AAA ATG TGC TCC GGA TT-3’ | 100 pb | 95°C 5min | 35 ciclos 94°C: 30 s 55°C: 30 s 72°C: 30 s | 72°C 5min |
| N. gonorrhoae | Ngu3 y Ngu4 5’-CGT TCA TCG GCG TAG GGT AA-3’ 5’-CAC TTC TCG GTG TTA AGA AA-3’ | 200 pb | 94°C 5min | 40 ciclos 94°C: 30 s 52°C: 30 s 72°C: 1min | 72°C 10min |
| U. urealyticum | U9 y U8 5’-GAG ATA ATG ATT ATA TGT CAG GAT CA-3’ 5’-GAT CCA ACT TGG ATA GGA CGG-3’ | 167 pb | 94°C 5min | 35 ciclos 95°C: 45 s 50°C: 30 s 72°C: 45 s | 72°C 10min |
PCR representativa para la amplificación de C. trachomatis, N. gonorrhoeae y U. urealyticum: El análisis electroforético de los productos de amplificación de: a) C. trachomatis (100pb), obtenido con los cebadores OMP1; b) N. gonorrhoeae (200pb) obtenido con los cebadores Ngu3 y Ngu4; c) U. urealyticum (167 pb) obtenido de los cebadores U8 y U9. Línea 1: Marcador de peso molecular de ADN de 100pb; Línea 2: control positivo; Línea 3: control negativo; Línea 4 y 5: Muestras voluntarios.
Los resultados obtenidos se expresaron como la mediana y el rango. Para comparar los parámetros seminales de las muestras positivas versus las negativas para la detección de alguno de los microorganismos; se empleó estadística no paramétrica utilizando la prueba de Mann-Whitney, considerando significación estadística de p<0,05, usando el programa GraphPad Prism 6 (Graphpad, CA, EE. UU.).
ResultadosDe las 84 muestras evaluadas se detectó el ADN de alguno de los microorganismos en 8 muestras (9,5%), 6 (7,1%) fueron positivas para U. urealyticum y 3 muestras (3,6%) fueron positivas para N. gonorrhoeae. Además, una muestra (1,0%) presentó coinfección por U. urealyticum y N. gonorrhoeae, y ninguna muestra fue positiva para el ADN de C. trachomatis. No se encontraron diferencias estadísticamente significativas entre los parámetros seminales de las muestras positivas y negativas para la presencia de alguno de los microorganismos estudiados; el volumen, la viabilidad y la movilidad es menor (el 20,0, el 13,1 y el 12,9%, respectivamente) en las muestras positivas para la detección de ADN de cualquiera de los microorganismos comparadas con las muestras negativas (tabla 2).
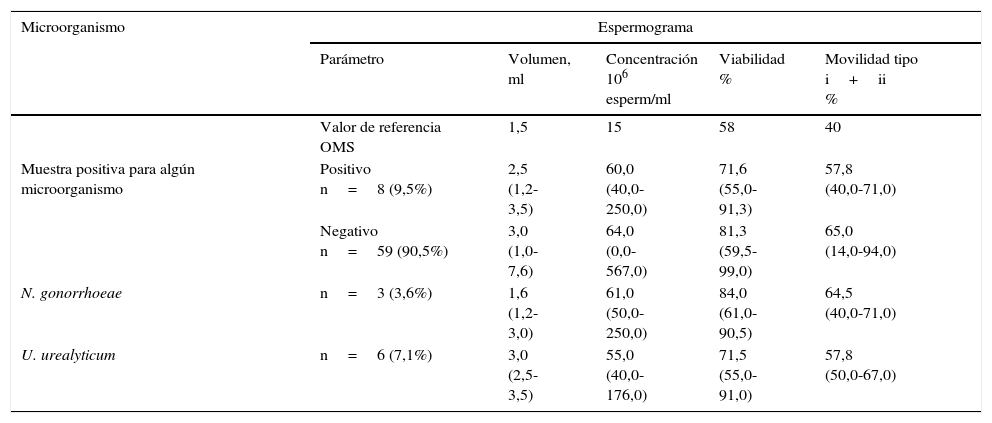
Parámetros seminales y detección por PCR de Ureaplasma urealyticum y Neisseria gonorrhoeae (mediana y rango)
| Microorganismo | Espermograma | ||||
|---|---|---|---|---|---|
| Parámetro | Volumen, ml | Concentración 106 esperm/ml | Viabilidad % | Movilidad tipo i+ii % | |
| Valor de referencia OMS | 1,5 | 15 | 58 | 40 | |
| Muestra positiva para algún microorganismo | Positivo n=8 (9,5%) | 2,5 (1,2-3,5) | 60,0 (40,0-250,0) | 71,6 (55,0-91,3) | 57,8 (40,0-71,0) |
| Negativo n=59 (90,5%) | 3,0 (1,0-7,6) | 64,0 (0,0-567,0) | 81,3 (59,5-99,0) | 65,0 (14,0-94,0) | |
| N. gonorrhoeae | n=3 (3,6%) | 1,6 (1,2-3,0) | 61,0 (50,0-250,0) | 84,0 (61,0-90,5) | 64,5 (40,0-71,0) |
| U. urealyticum | n=6 (7,1%) | 3,0 (2,5-3,5) | 55,0 (40,0-176,0) | 71,5 (55,0-91,0) | 57,8 (50,0-67,0) |
Movilidad tipo i: espermatozoides móviles progresivos. Movilidad tipo ii: espermatozoides móviles no progresivos.
El semen es un medio de transmisión de bacterias18-20, parásitos21 y virus22-26 entre hombres y mujeres, siendo su calidad un indicativo de la fertilidad27. Durante el estudio de los procesos infecciosos del tracto urogenital masculino se ha determinado que la presencia de microorganismos en este fluido está asociada a un alto porcentaje de casos de infertilidad1,10,27,28.
En este estudio se logró detectar ADN bacteriano en el 9,5% de las muestras de semen de hombres sin síntomas de infecciones urogenitales, realizando búsqueda de 3 de las principales bacterias (U. urealyticum, C. trachomatis y N. gonorrhoeae) responsables de un alto número de infecciones del tracto urogenital masculino usualmente asintomáticas1, las cuales pueden afectar la calidad seminal; sin embargo, aunque se observaron reducciones de hasta el 20% en los valores de los parámetros seminales, estas cifras no fueron estadísticamente significativas, por lo que no se logró evidenciar una relación clara entre la detección mediante PCR de estos microorganismos y los parámetros espermáticos. Golshani et al.1 encontraron una prevalencia del 33% de ADN de los microorganismos C. trachomatis, N. gonorrhoeae y U. urealyticum, y la correlacionaron con un menor porcentaje de espermatozoides móviles, menor concentración y alteración en la morfología, empleando una metodología similar en 200 muestras de semen de pacientes infértiles asintomáticos para la infección del tracto urogenital.
El microorganismo más prevalente en este estudio fue U. urealyticum (7,1%). Otros autores reportan prevalencias del 12 al 25% en hombres asintomáticos29, del 76% en los individuos infértiles y del 19% en los fértiles9, siendo aún controversial el papel de este microorganismo en la fertilidad10. Las diferencias entre las prevalencias reportadas por otros autores en cuanto a las infecciones causadas por este microorganismo pueden estar relacionadas con el tipo de población evaluada1 y se sugiere que la evaluación cuantitativa de U. urealyticum en muestras de semen permitiría establecer la patogenicidad de este microorganismo en el tracto urogenital14.
La presencia de U. urealyticum en el semen puede estar relacionada con su papel de colonizador frecuente del tracto genital de hombres y mujeres11,29,30, aunque puede incrementar el porcentaje de espermatozoides inmóviles por su capacidad de unión a la célula espermática, sin ser eliminado con técnicas como la selección espermática por gradiente o el swim-up9.
Aunque en este estudio no se logró detectar ADN de C. trachomatis, otros autores han detectado este microorganismo en el 2,2% de las muestras de semen6 y su presencia se asocia a un alto número de casos de infertilidad en hombres de 20 a 30 años de edad1,6. La prevalencia de C. trachomatis y de N. gonorrhoeae en muestras urinarias y seminales en el estudio de Samra et al. fue del 11,3 y el 13,3%, respectivamente2. De otro lado, Krieger y Riley5 reportan una prevalencia de estos microorganismos en semen del 8% en pacientes con prostatitis crónica, infección que ocupa el tercer lugar entre las causas de infertilidad masculina28,31. Factores como el tamaño muestral o el tipo de población evaluada pueden estar relacionados con la ausencia de casos de infección por C. trachomatis.
N. gonorrhoeae fue detectada en el 3,6% de las muestras de semen de hombres asintomáticos para esta infección, contrario a lo reportado en hombres con uretritis de una cohorte de 572 pacientes que presentó una prevalencia aproximadamente 12 veces mayor (44,6%)14 que la reportada en este estudio; sin embargo, se puede concluir que el gonococo sigue siendo un factor importante en la uretritis, especialmente en países en vía de desarrollo15.
En ninguna de las muestras analizadas, inclusive las positivas para algún microorganismo, se observó leucocitospermia, resultado acorde con lo reportado por otros autores1,8,10; por lo tanto, la leucospermia e incluso la inflamación4 no son los mejores indicadores de la presencia de procesos infecciosos en el tracto urogenital masculino.
Finalmente, cabe aclarar que no solo los microorganismos analizados en este estudio son responsables de procesos infecciosos del tracto urogenital; en la gran mayoría de los estudios solo se realiza cultivo de microorganismos aeróbicos de especímenes prostáticos, a pesar de que microorganismos exigentes y no cultivables también son importantes en la etiología de la prostatitis29. En 2008, Kiessling et al.8, empleando PCR para detección de microorganismos en semen, encontraron una prevalencia bacteriana del 56%, identificando tanto cocos aerobios como anaerobios que pueden influir en la fertilidad. Entre los microorganismos anaerobios no identificados por los métodos rutinarios de diagnóstico de semen se encuentran Anaerococcus27 y Corynebacterium8.
En conclusión, la presencia de los microorganismos como N. gonorrhoeae y U. urealyticum en individuos de población general asintomáticos para infecciones urogenitales puede ser común sin afectar la calidad seminal.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste trabajo fue financiado por Colciencias (111556933373) y por la Estrategia de Sostenibilidad 2014-2015, Grupo Reproducción, de la Universidad de Antioquia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosA los profesores Pedro Martínez, Rubén Motrich y sus equipos de trabajo. JPS fue Joven Investigadora de Colciencias.