La clasificación tradicional del hipogonadismo está basada en el comportamiento del eje hipotálamo-hipófiso-gonadal, que genera tres posibles grupos de diagnóstico: hipogonadismo primario o testicular, secundario o hipofisiario y terciario o hipotalámico; el síndrome de androgen deficiency of aging male (ADAM) o deficiencia androgénica de la edad madura (DAEM), por sus características, queda incluido de manera forzada en esta clasificación, que es de corte endocrinológico. Este artículo propone una nueva clasificación basada en el mecanismo inductor del déficit de testosterona, que incluye cinco grupos: hipogonadismo del envejecimiento; hipogonadismo testicular; hipogonadismo de la obesidad; hipogonadismo del estrés, e hipogonadismo ambiental o por interruptores endocrinos. Esta visión permite al urólogo situarse mejor frente a las enfermedades que afronta en la consulta diaria, entre las que el hipogonadismo tiene importancia clínica. Un grupo adicional de enfermedades llamado condiciones con alta prevalencia de hipogonadismo (CAPHI) también puede comprenderse mejor en la nueva clasificación.
© 2014 Sociedad Colombiana de Urología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
The traditional classification of hypogonadism is based on the behavior of the hypothalamic-pituitary-gonadal axis, which generates three possible diagnostic groups: primary or testicular, secondary or pituitary, and tertiary or hypothalamic. ADAM syndrome (androgen deficiency of aging male) or DAEM (androgen deficiency middle age), by its characteristics, is forcibly included in this classification due to the endocrinological influence. In this article, a new classification is proposed, based on the testosterone deficiency inductor mechanism, which includes five groups: hypogonadism of aging; testicular hypogonadism; hypogonadism of obesity; hypogonadism of stress, and hypogonadism of environmental or endocrine disruptors. By using these, it will enable urologists to be in a better position when facing these conditions in daily practice, and where hypogonadism is clinically important. An additional group of diseases called CAPHI (conditions with high prevalence of hypogonadism) can also be understood better in the new classification.
© 2014 Sociedad Colombiana de Urología. Published by Elsevier España, S.L. All rights reserved.
La clasificación del hipogonadismo está centrada tradicionalmente en el comportamiento del eje hipotálamo-hipófiso-gonadal (HHG), y aunque esa visión endocrinológica del hipogonadismo permite cubrir una amplia gama de enfermedades, no representa adecuadamente el tipo que el urólogo, más si es experto en medicina sexual, afronta en su quehacer diario. La antigua clasificación ha limitado la mejor comprensión de la testosterona y su disminución como un factor de riesgo independiente en las enfermedades del varón, como el síndrome metabólico y el estrés1–3.
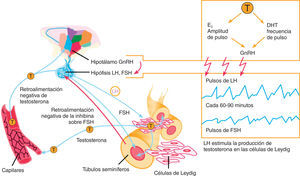
Clasificación tradicionalLa clasificación tradicional del hipogonadismo, según el sitio del eje HHG afectado, tiene tres cuadros definidos que cumplen un axioma básico: cuanto más baja la testosterona, más se elevan las gonadotrofinas, en una respuesta regulada por la retroalimentación o biofeedback del sistema.
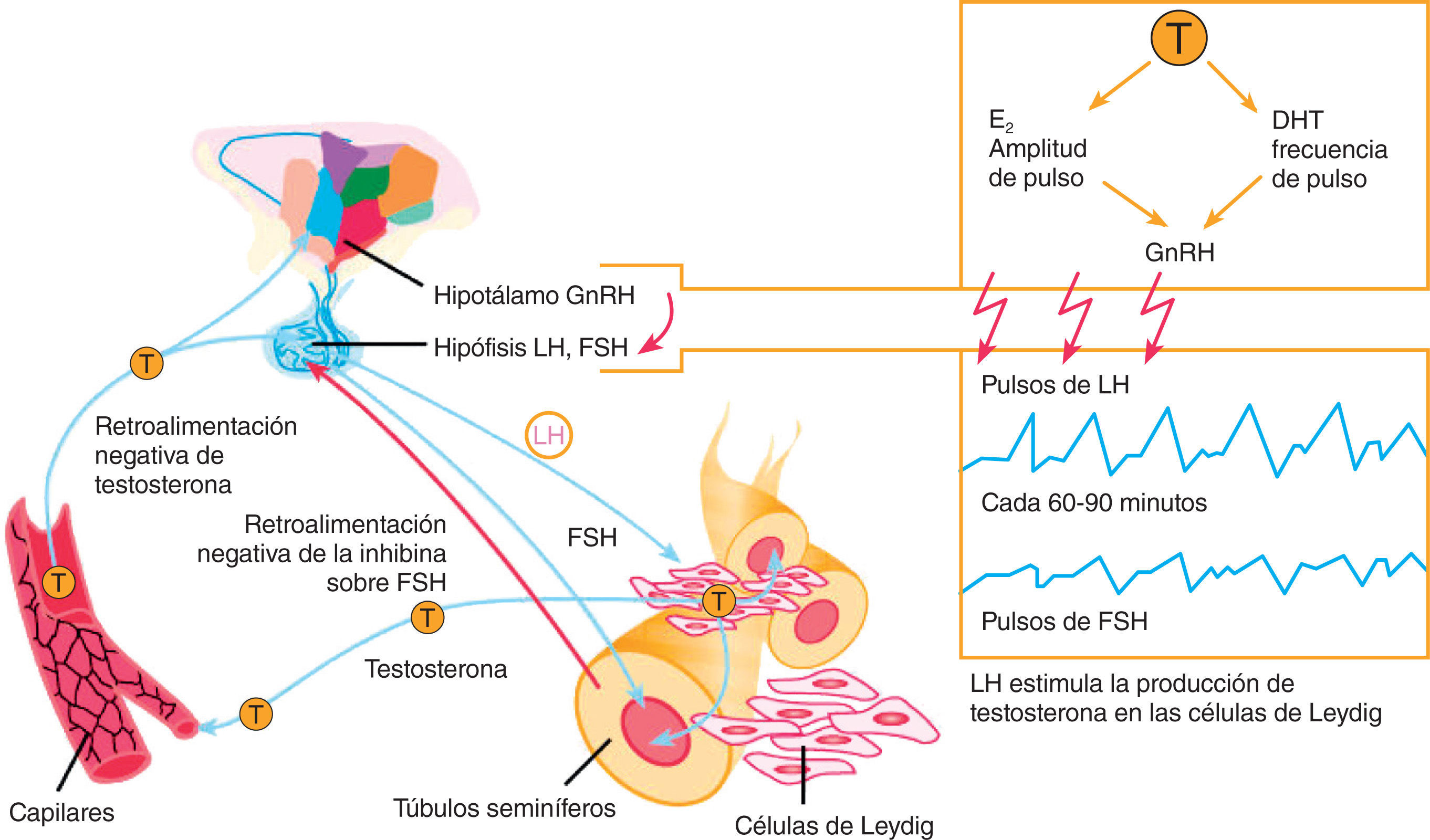
Hipogonadismo primario (HP) o tipo 1El HP quizá sea el cuadro más fácil de comprender. Implica la desaparición, alteración o distorsión del testículo como órgano efector donde se sintetiza la testosterona, el andrógeno principal. La cantidad de testosterona es muy baja y la de las gonadotrofinas lutropina (LH) y folitropina (FSH), muy alta, intentando que el testículo funcione produciendo testosterona (table 1 y fig. 1). Las causas más frecuentes son anorquia congénita, anorquia adquirida (traumatismo, torsión o cirugía), disgenesia gonadal mixta, disgenesia gonadal pura, aplasia de células de Leyding, seudohermafroditismo masculino, síndrome de Klinefelter, síndrome XYY, síndrome XX masculino, síndrome de Noonan, tumor testicular, varicocele, orquitis grave (en especial urliana), radioterapia testicular, hemocromatosis y virus de la inmunodeficiencia humana (VIH)5–11.
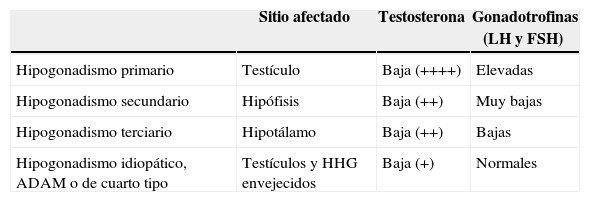
Clasificación tradicional del hipogonadismo según el sitio afectado en el eje hipotálamo-hipófiso-gonadal incluyendo el hipogonadismo idiopático, que no siempre está incluido
| Sitio afectado | Testosterona | Gonadotrofinas (LH y FSH) | |
|---|---|---|---|
| Hipogonadismo primario | Testículo | Baja (++++) | Elevadas |
| Hipogonadismo secundario | Hipófisis | Baja (++) | Muy bajas |
| Hipogonadismo terciario | Hipotálamo | Baja (++) | Bajas |
| Hipogonadismo idiopático, ADAM o de cuarto tipo | Testículos y HHG envejecidos | Baja (+) | Normales |
ADAM: androgen deficiency of aging male; FSH: folitropina; HHG: eje hipotálamo-hipófiso-gonadal; LH: lutropina.
En cualquier clasificación (tradicional o modificada), estará incluido el (HP); en ella una subdivisión posible es separar los HP de origen genético (como Klinefelter o disgenesias gonadales) de los que siendo HP testiculares son secundarios a otros eventos de interés en urología, como varicocele, traumatismo o torsión testicular.
Hipogonadismo secundario (HS) o tipo 2El HS implica una alteración en el funcionamiento de la hipófisis y, por ende, en la producción de gonadotrofinas hipofisiarias LH y FSH, que impiden el adecuado funcionamiento del eje. Como las gonadotrofinas suelen estar muy bajas, se lo denomina también hipogonadismo hipogonadotrófico (table 1 y fig. 1). Las causas más frecuentes son infiltración, hemocromatosis, enfermedades por parásitos centrales, adenoma, isquemia, síndrome de la silla vacía, radioterapia, medicamentos y drogas de abuso, hiperprolactinemia, enfermedad de Crohn y LH inactiva biológicamente4–10,12,13.
Es frecuente que las listas de HS no incluyan la obesidad y el estrés como causas potenciales, y quizá sea esta categoría la que más claramente obliga a buscar alternativas en la clasificación del hipogonadismo, puesto que son un tipo de pacientes frecuente en la práctica diaria.
Hipogonadismo terciario (HT) o tipo 3El HT implica una alteración en el hipotálamo y, por ende, en la liberación pulsátil de la gonadorrelina (GnRH) que distorsiona el funcionamiento del eje. Por falta del estímulo cerebral, las gonadotrofinas LH y FSH estarán bajas y la testosterona también, es decir, se trata también de un hipogonadismo hipogonadotrófico, lo que se confunde con la clasificación anterior (table 1 y fig. 1). Las causas más frecuentes son hipogonadismo hipogonadotrofico idiopático, síndrome de Kallman, síndrome de Pasqualini, síndrome de Prader-Labbart-Willi, síndrome de Laurence-Moon-Bardet-Biedl, ataxia cerebelar familiar, pubertad retardada constitucional, tumores cerebrales, traumatismo, radioterapia, desnutrición, infección, medicamentos y drogas de abuso4–10.
El HT a menudo se comprende mal e incluso se suprime de la clasificación al incluirlo en el mismo grupo del HS o hipofisiario, y es evidente que lo causa un grupo de afecciones que pertenecen a la órbita del endocrinólogo o el neurólogo.
Hipogonadismo idiopático o tipo 4El hipogonadismo idiopático, del cuarto tipo, o androgen deficiency of aging male (ADAM) o deficiencia androgénica de la edad madura (DAEM) es el cuadro clásico del envejecimiento masculino que a menudo está fuera de la clasificación tradicional, puesto que no cumple el axioma básico autorregulado de presentar un aumento de las gonadotrofinas, que tienden a estar normales a pesar de la caída de la testosterona (table 1)11,15,16.
Nueva clasificación propuestaCualquier intento de clasificación diferente debe propender a una mejor comprensión de la enfermedad que clasifica. En la nueva propuesta se cambia el foco de la clasificación del «sitio afectado» en el eje HHG por el «mecanismo» que induce o produce el hipogonadismo y el «verdadero órgano afectado», aunque este se encuentre fuera del eje. En esta nueva clasificación aparecen cinco categorías.
1Hipogonadismo del envejecimiento o idiopáticoEsta categoría corresponde al síndrome de ADAM o DAEM o hipogonadismo del cuarto tipo, y a diferencia de la clasificación previa, tiene un lugar privilegiado y coherente, por ser una enfermedad fundamental en medicina sexual que suele responder bien al reemplazo hormonal. Como ya se mencionó, aunque la testosterona está baja, no hay una contrarrespuesta de las gonadotrofinas, y esto suele ser un factor de confusión para quienes usan la clasificación tradicional. La fisiopatología específica está centrada en el envejecimiento del eje HHG (table 2)17,18.
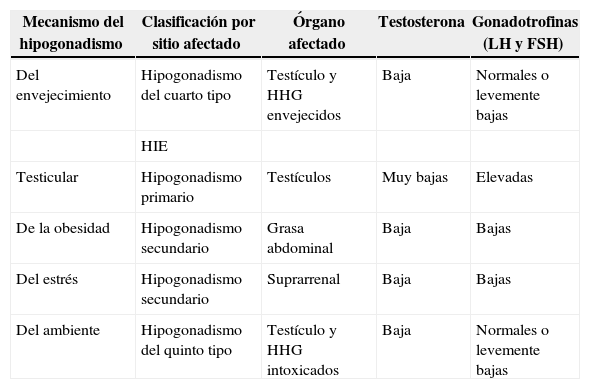
Nueva clasificación del hipogonadismo según el mecanismo
| Mecanismo del hipogonadismo | Clasificación por sitio afectado | Órgano afectado | Testosterona | Gonadotrofinas (LH y FSH) |
|---|---|---|---|---|
| Del envejecimiento | Hipogonadismo del cuarto tipo | Testículo y HHG envejecidos | Baja | Normales o levemente bajas |
| HIE | ||||
| Testicular | Hipogonadismo primario | Testículos | Muy bajas | Elevadas |
| De la obesidad | Hipogonadismo secundario | Grasa abdominal | Baja | Bajas |
| Del estrés | Hipogonadismo secundario | Suprarrenal | Baja | Bajas |
| Del ambiente | Hipogonadismo del quinto tipo | Testículo y HHG intoxicados | Baja | Normales o levemente bajas |
FSH: folitropina; HHG: eje hipotálamo-hipófiso-gonadal; HIE: hipogonadismos independientes de la edad; LH: lutropina.
El hipogonadismo testicular es el mismo HP de la clasificación tradicional e implica pérdida o alteración del órgano efector (testículo), sin cambios; como ya se reseñó, en esta categoría se destacan especialmente los pacientes con antecedentes de traumatismo testicular, torsión y varicocele, que tienen una importancia especial en urología (table 2).
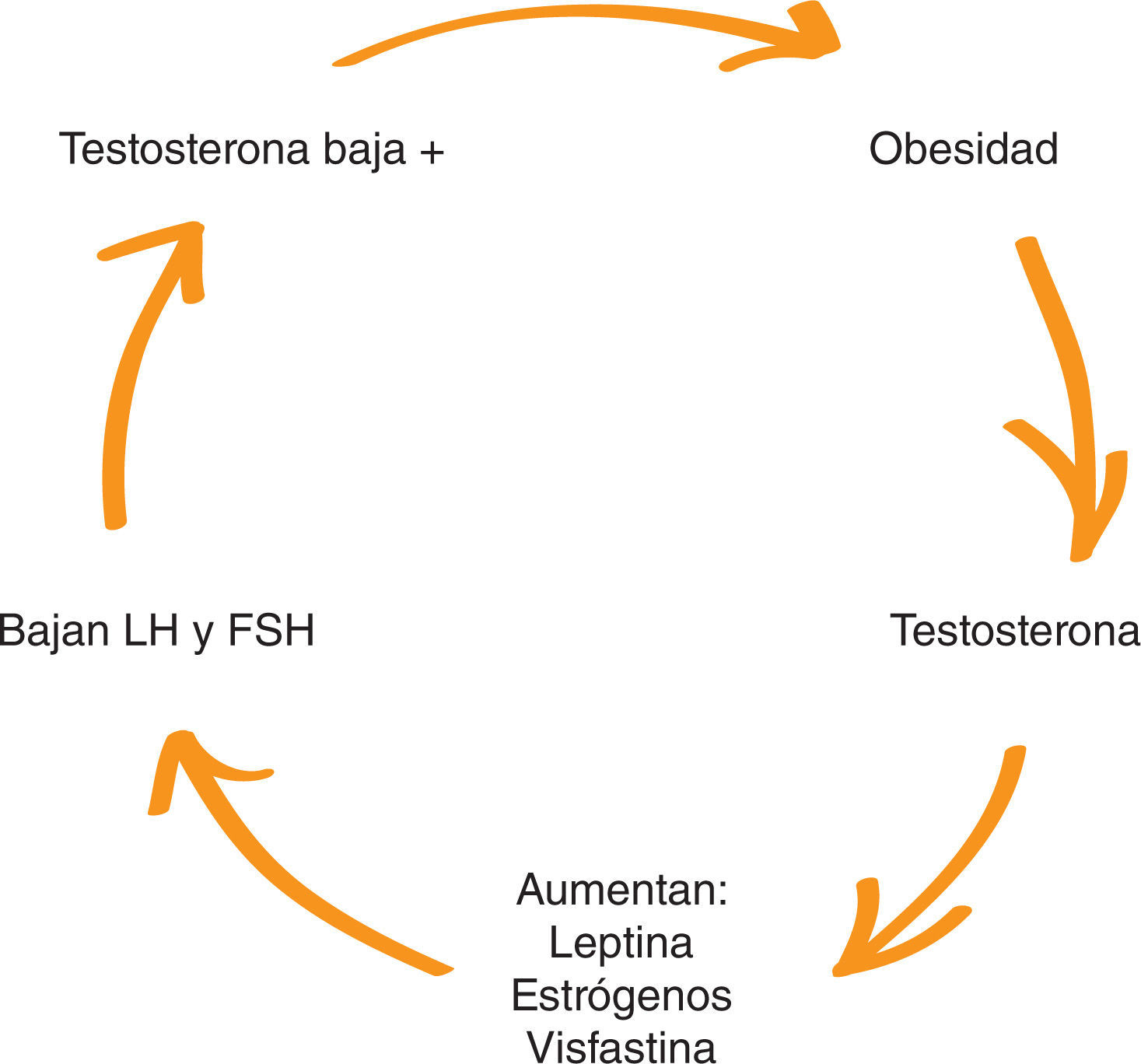
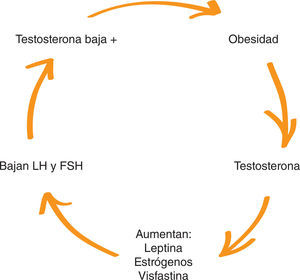
3Hipogonadismo de la obesidadDemostrar que el hipogonadismo relacionado con la obesidad es un tipo de HS es fundamental para justificar una nueva clasificación. El aumento de la grasa abdominal crea un neoórgano adiposo que tiene múltiples funciones endocrinas. El aumento de la grasa abdominal disminuye la testosterona y aumenta la aromatización a estrógenos y sustancias como leptinas, adiponectinas, visfastinas, resistinas y otras citocinas energéticas. Estas sustancias producen un biofeedback negativo, y disminuyen las gonadotrafinas y aún más la testosterona. Se considera que es un hipogonadismo independiente de la edad (HIE) (fig. 2 y table 2)21–24.
Según el estudio Tromsø, el peor escenario para la dis-minución de la testosterona no es, como podría pensarse, en los pacientes con mayor índice de masa corporal (IMC), sino en los pacientes con mayor diámetro de cintura, que se constituye en el mayor factor de riesgo de hipogonadismo por obesidad (fig. 3)25,26.
Correlación entre concentración de testosterona, índice de masa corporal (IMC) y perímetro abdominal.
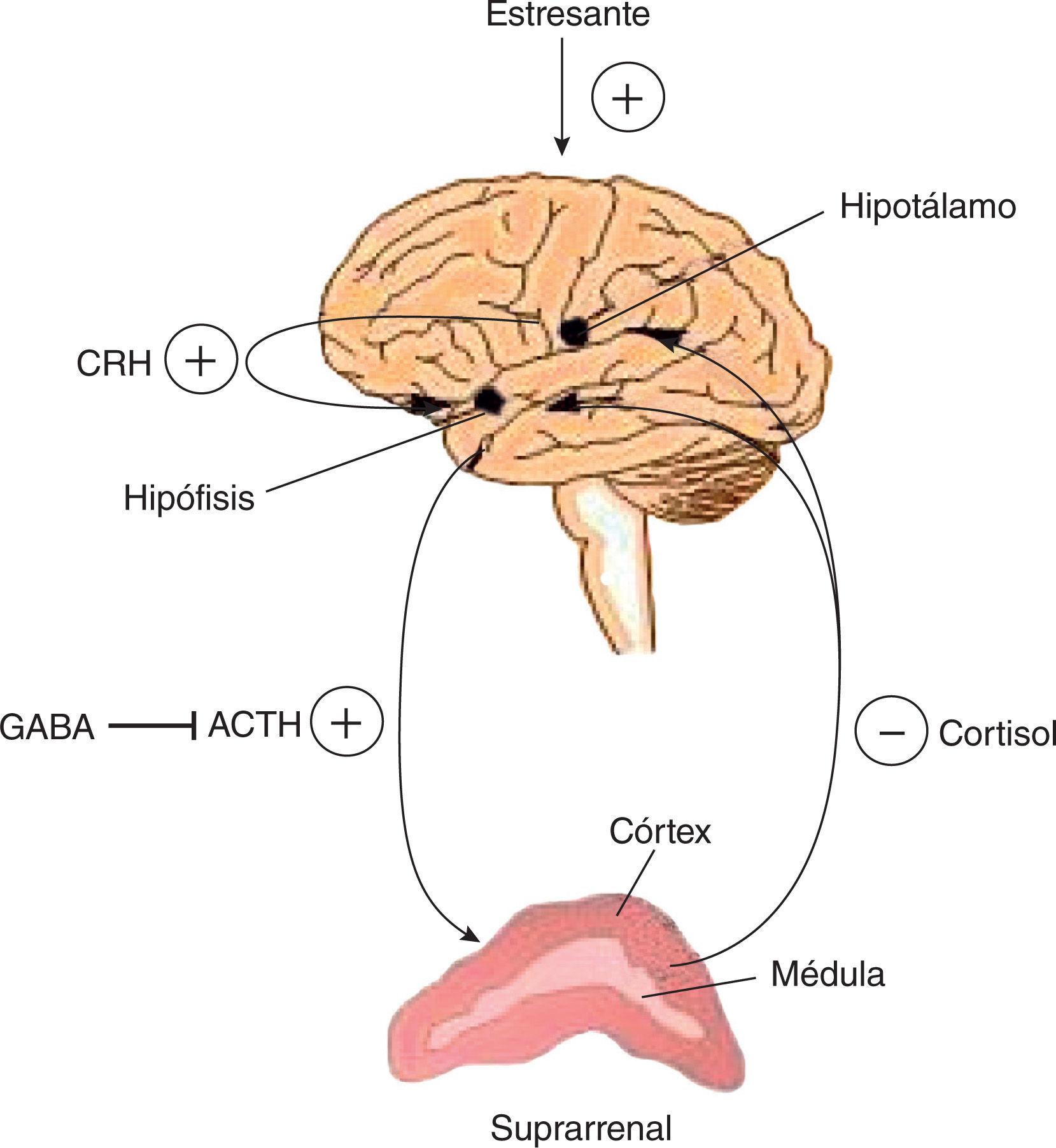
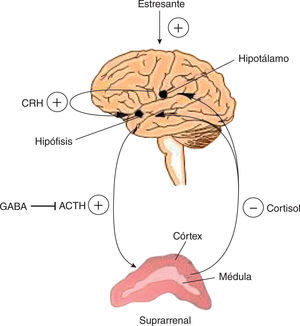
Igual que la categoría anterior, el hipogonadismo relacionado con el estrés es un típico HS. El mecanismo supresor del eje HHG en este caso es el cortisol que se libera en la glándula suprarrenal ante mecanismos estresantes. La acción del cortisol en la hipófisis es de biofeedback negativo, que disminuye notablemente la testosterona. Este mecanismo es uno de los menos estudiados y, sin embargo, es muy frecuente en la vida diaria. No solo debe tomarse en cuenta al paciente con alguno de los síndromes ansiosos reconocidos, sino a los pacientes burn out y aun los que tienen alteraciones del ritmo circadiano por causas laborales (table 2 y fig. 4).
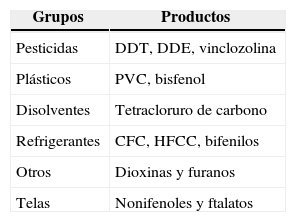
5Hipogonadismo del ambiente o quinto mecanismoEl hipogonadismo ambiental, o por interruptores endocrinos o contaminantes de largo plazo, es el verdadero hipogonadismo idiopático y se comporta desde el punto de vista bioquímico de manera muy semejante al hipogonadismo del envejecimiento. Sustancias que se encuentran en anticongelantes, fumigantes para cítricos y hasta en las ropas infantiles se han estudiado poco en los círculos urológicos; la razón del daño es la toxicidad directa en el eje que no le permite reaccionar adecuadamente ante los cambios en los tres niveles, lo que disminuye la testosterona sin alterar de manera proporcional las gonadotrofinas. Esta contaminación de largo plazo causa «andropausia precoz» y graves alteraciones en la fertilidad y lo causan diferentes sustancias químicas que se utilizan en la vida diaria (tables 2 y 3)28,29.
Otras condiciones asociadas con hipogonadismo (CAPHI)Un grupo de gran importancia para el hipogonadismo en el momento actual son las condiciones con alta prevalencia de hipogonadismo (CAPHI), que agrupan afecciones de distinta etiología que tienen en común la alta prevalencia de hipogonadismo y no se incluyen en la clasificación anterior:
- •
Tratamientos con ketoconazol o espironolactona: son antiandrógenos de base.
- •
Tratamiento con esteroides: bloquean el eje HHG como en el mecanismo del estrés del cortisol.
- •
Tratamiento con opiáceos: se produce hipogonadismo por varios mecanismos, el principal parece ser el bloqueo de la liberación pulsátil de la LH30,31.
- •
VIH: se asocia con la pérdida de peso y la disminución de las proteínas como la albúmina y la globulina fijadora de hormonas sexuales (SHBG).
- •
Enfermedad renal avanzada (insuficiencia renal crónica): se asocia con la hemodiálisis y el barrido de las proteínas.
- •
Quemaduras: pérdida aguda de proteínas y uso de opiáceos.
- •
Enfermedad pulmonar obstructiva crónica: uso habitual de esteroides.
- •
Diabetes mellitus tipo 2: por obesidad y síndrome metabólico, tal como se muestra en el grupo 3 de la nueva clasificación.
- •
Infertilidad: por la asociación con daño testicular (la infertilidad no causa hipogonadismo, pero tener infertilidad puede indicar mayor posibilidad de tenerlo).
- •
Osteoporosis o fracturas en jóvenes: igual que el anterior; si un varón tiene osteoporosis, es necesario descartar causas de hipogonadismo.
- •
Sarcopenia: igual que el anterior. La sarcopenia en un varón es altamente sospechosa de hipogonadismo de cualquier etiología.
La clasificación tradicional del hipogonadismo no permite situar adecuadamente las enfermedades que inducen disminución de la testosterona y se tratan habitualmente en las consultas urológicas. Podría facilitar la compresión y el manejo de estos pacientes una clasificación alternativa del hipogonadismo, basada en el mecanismo inductor y que consta de cinco grupos: hipogonadismo del envejecimiento o DAEM, testicular, de la obesidad, del estrés y del ambiente (table 4).
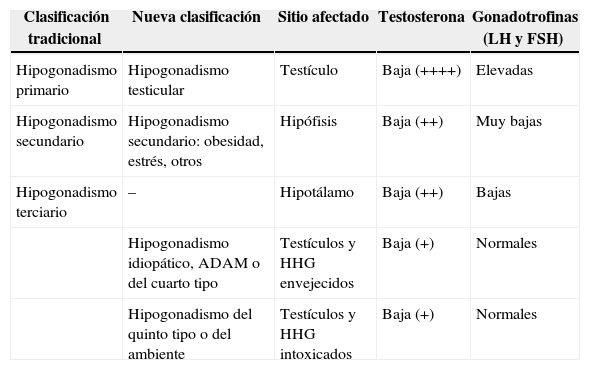
Comparación entre las dos clasificaciones del hipogonadismo
| Clasificación tradicional | Nueva clasificación | Sitio afectado | Testosterona | Gonadotrofinas (LH y FSH) |
|---|---|---|---|---|
| Hipogonadismo primario | Hipogonadismo testicular | Testículo | Baja (++++) | Elevadas |
| Hipogonadismo secundario | Hipogonadismo secundario: obesidad, estrés, otros | Hipófisis | Baja (++) | Muy bajas |
| Hipogonadismo terciario | – | Hipotálamo | Baja (++) | Bajas |
| Hipogonadismo idiopático, ADAM o del cuarto tipo | Testículos y HHG envejecidos | Baja (+) | Normales | |
| Hipogonadismo del quinto tipo o del ambiente | Testículos y HHG intoxicados | Baja (+) | Normales |
ADAM: androgen deficiency of aging male; FSH: folitropina; HHG: eje hipotálamo-hipófiso-gonadal; LH: lutropina.
III.
Conflicto de interesesEl autor declara que no tiene conflicto de intereses.
Diseño del estudio: artículo de revisión.