La adaptación de estas guías fue realizada empleando la metodología del NZGG, que incluyó la revisión sistemática de la literatura y el análisis crítico utilizando la herramienta AGREEII de las guías disponibles hasta diciembre de 2012. Las diferentes publicaciones y guías fueron analizadas y puntuadas por miembros de la Sociedad Colombiana de Urología y fueron aprobadas para su adaptación e implementación por esta sociedad. Finalmente, la guía fue revisada por un par externo, el Doctor Juan Fernando Uribe.
Población blanco de la guíaEsta guía está dirigida a médicos urólogos y especialidades médicas y no médicas afines al área de disfunción sexual.
MétodosSe realizó el análisis de las guías más importantes en el tema de disfunción eréctil (DE), incluyendo las de la Sociedad Europea de Urología (EAU), la Sociedad Americana de Urología (AUA) y la Sociedad Japonesa de Urología, publicadas hasta diciembre del 2012. Esto se realizó mediante la aplicación de la herramienta AGREEII, que permite evaluar su calidad, proporcionar una estrategia metodológica para la adaptación y establecer qué información debe ser presentada y cómo debe hacerse. Las guías fueron analizadas por un comité evaluador determinado por la Sociedad Colombiana de Urología, que puntuó y cruzó los resultados de este análisis para escoger la información relevante y de mejor calidad en el tema de DE. La puntuación otorgada por esta herramienta permitió la identificación de la mejor guía para su adaptación.
Se solicitó autorización a los autores para la adaptación y aplicación de la guía seleccionada por parte del comité evaluador.
Adicionalmente se llevó a cabo una búsqueda utilizando el motor FABUMED (un metabuscador basado en las estrategias de búsqueda de McMaster University, con la capacidad de seleccionar ensayos clínicos y revisiones sistemáticas con alta sensibilidad y especificidad), el cual complementó el contenido de esta guía.
Epidemiología de la disfunción eréctilSe estima que del 5 al 47% de la población adulta presenta o manifiesta DE moderada a completa1. Esta proporción aumenta en relación directa con la edad1. El estudio Disfunción Eréctil en el Norte de Sudamérica (DENSA) reveló que más de la mitad de los hombres mayores de 40 años de edad en Venezuela, Colombia y Ecuador sufren algún grado de alteración con su erección2.
EtiologíaLa DE puede clasificarse de la siguiente manera.
- 1.
Orgánica.
- I.
Vasculogénica.
- A.
Arteriogénica.
- B.
Cavernosa.
- C.
Mixta.
- A.
- II.
Neurogénica.
- III.
Anatómica.
- IV.
Endocrinológica.
- 2.
Psicógena.
- I.
Generalizada.
- II.
Situacional.
- I.
- I.
(Adaptado de Campbell-Walsh Urology, 10.a ed. Cap. 23: Physiology of Penile Erection and Pathophysiology of Erectile Dysfunction, pág. 709.)
Factores de riesgoEdadLa prevalencia de DE aumenta con la edad, que está directamente relacionada con el proceso de envejecimiento. La edad se relaciona además con otros factores de riesgo descritos a continuación.
TabaquismoEl cigarrillo es una causa conocida de daño vascular endotelial que aumenta el riesgo para enfermedad coronaria y enfermedad cerebrovascular. El tabaquismo aumenta el riesgo de DE significativamente en pacientes con enfermedad coronaria e hipertensión3.
El estudio de envejecimiento de Massachusetts demostró que el riesgo relativo (RR) para DE en los fumadores versus los no fumadores fue de 1,974. Un metaanálisis arrojó una prevalencia de DE del 40% en fumadores, significativamente superior a la del 28% en la población general5. Al subclasificar a los fumadores según su nivel de adicción al tabaquismo se evidenció que el riesgo de DE aumenta de forma dosis dependiente4. Se ha demostrado una relación directa entre el tabaquismo y la reducción en las erecciones nocturnas6. Un estudio realizado con 4.500 militares retirados demostró menor prevalencia de DE en exfumadores que en fumadores permanentes (2% vs. 3,7%)6.
HipertensiónSe ha demostrado que el 15% de los pacientes en tratamiento para la hipertensión tienen DE completa3. El RR para la hipertensión en DE fue de 1,3 después de la corrección por edad y otros factores de confusión7. Además, la medicación antihipertensiva es una posible causa adicional de DE como efecto adverso en pacientes hipertensos. Es decir, consistentemente en todos los estudios se ha demostrado un aumento de la incidencia de DE en los hombres hipertensos, pero esta es aún mayor en los hipertensos tratados que en los no tratados8.
DiabetesUna revisión sistemática de la literatura de publicaciones después de 1958 estimó la prevalencia de la DE en pacientes diabéticos en el 26-35%9. De acuerdo con MMAS, el riesgo de DE completa en los diabéticos es 3 veces mayor que en no diabéticos3. Un estudio de cohorte de más de 30.000 pacientes de edad mediana y de edad avanzada calculó un RR de 1,32 para DE en diabéticos vs. no diabéticos9. La DE puede ser uno de los primeros síntomas de la diabetes. La libido es generalmente normal en este grupo de pacientes. Una parte esencial de la evaluación de los pacientes con DE es la evaluación y descarte de la diabetes como posible factor etiológico. En los pacientes diabéticos, la prevalencia de enfermedad coronaria silente es muy alta, y esta patología es un predictor fuerte de eventos coronarios y muerte por causa cardiaca.
Se sugiere realizar una prueba de esfuerzo antes de comenzar un tratamiento para DE en pacientes diabéticos10 (grado de recomendación B). Los mecanismos etiopatogénicos de la DE en pacientes diabéticos se fundamentan en la neuropatía autónoma, los trastornos de la vasculatura del pene y el daño endotelial segundario a la diabetes.
DislipidemiaLos niveles de colesterol están aumentados en el 26% de los hombres con DE11,12. El RR calculado para DE en pacientes con niveles de colesterol >240mg/ vs. niveles <180 fue de 1,83. En sujetos con HDL>60mg/dl vs. <30 fue de 0,311. En un estudio de pacientes con DE quienes solo tenían hipercolesterolemia como único factor de riesgo y recibieron atorvastatina, se demostró una mejoría significativa de 14,2 a 20,7 en el cuestionario de función sexual masculina, con una p<0,00113.
El uso de estatinas y fibratos se han definido, en algunas publicaciones, como posibles causas de DE secundaria a medicamentos14.
Se cree que el efecto etiológico de la DE inducida por dislipidemia es la ateroesclerosis de los vasos pélvicos secundaria a esta.
Sobrepeso y ejercicioEl RR para DE en hombres obesos es 60% mayor que en hombres saludables con peso normal15.
Un estudio de Boston que siguió a 1.000 hombres con edades entre 40 y 70años durante 8,8años encontró una correlación positiva entre el sobrepeso y la DE, con una p<0,006 y una correlación negativa entre ejercicio y DE p<0,0116.
En un estudio tipo cohorte de más de 30.000 trabajadores médicos con edades entre 53-90años el riesgo de DE en el grupo que hacía por lo menos 32,6 MET (equivalentes metabólicos) por semana vs. el grupo que solo realizaba 2,7 MET a la semana fue de 0,7 (IC95: 0,6-0,7)17.
Síndrome metabólicoMuchos de los factores mencionados anteriormente, se agrupan para conformar el denominado síndrome metabólico. Está claramente demostrada la mayor prevalencia de DE en personas sedentarias que adicionalmente tienen hipertensión y sobrepeso. Esto llama la atención sobre el valor de la actividad física regular en la protección de enfermedad endotelial arteriosclerótica sistémica18.
Los factores de riesgo relacionados con enfermedad vascular revisten cada vez mayor importancia. De allí que la DE puede ser una manifestación clínica del compromiso de la circulación peneana y a su vez se constituye en centinela de enfermedades vasculares en otros órganos, especialmente de enfermedad coronaria y cerebrovascular19,20.
Esto significa que aquellos sujetos que la padecen tienen mayor riesgo de presentar eventos coronarios en los siguientes 4años después de su aparición, cuando se comparan con aquellos que no la padecen. La evidencia es clara para demostrar esta afirmación, especialmente en pacientes menores de 60años y diabéticos21,22.
DepresiónMúltiples estudios han demostrado fuerte correlación entre depresión y DE, con RR de 1,82 (1,21-2,73)23.
Síndrome urinario obstructivo bajo/hiperplasia prostática benignaEl mecanismo planteado para DE y síndrome del tracto urinario bajo se cree que involucra factores comunes como la isquemia pélvica24. Se percibe que los tratamientos para LUTS y la hiperplasia prostática benigna (HPB), tanto farmacológico con alfa-bloqueadores como quirúrgicos, podrían acompañarse de mejoría en la función eréctil25,26.
Se ha señalado que hay asociación entre los altos puntajes de calificación del IPSS y un bajo puntaje en el cuestionario IIEF-5, donde los síntomas urinarios obstructivos bajos más severos demuestran mayor compromiso de la erección27.
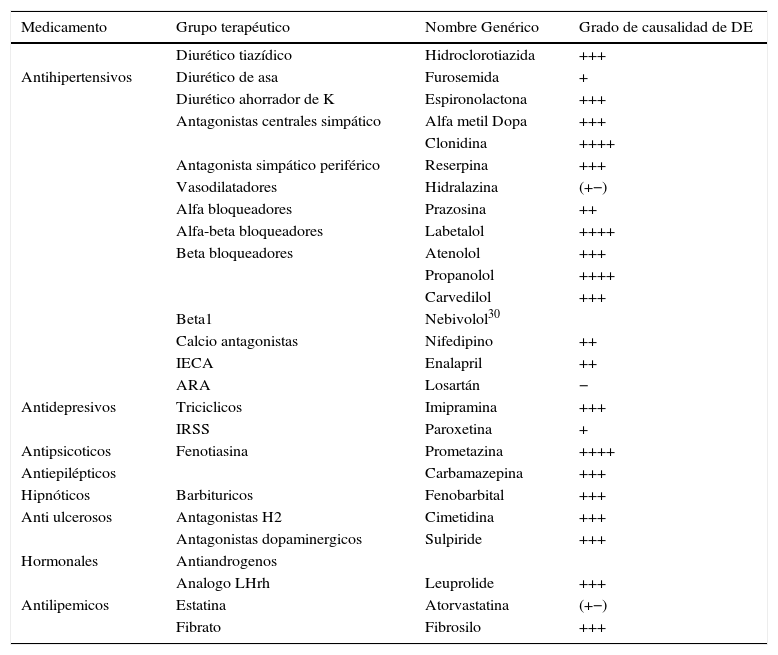
MedicamentosVarios medicamentos son conocidos por desencadenar DE. Los agentes usados para tratar la hipertensión y algunos trastornos psiquiátricos son los medicamentos principalmente asociados con DE. Para el tratamiento de la hipertensión se recomiendan los inhibidores de la enzima convertidora de angiotensina (IECA) y los bloqueadores del receptor de angiotensina (ARAII) porque es menos probable que causen DE. Es importante, por parte del especialista y del no urólogo, conocer los efectos secundarios de los fármacos más frecuentemente utilizados en el tratamiento de las enfermedades crónicas para discutir este efecto adverso con los pacientes antes de prescribirlos (tabla 1).
Grupos de medicamentos y su grado de causalidad de DE
| Medicamento | Grupo terapéutico | Nombre Genérico | Grado de causalidad de DE |
|---|---|---|---|
| Diurético tiazídico | Hidroclorotiazida | +++ | |
| Antihipertensivos | Diurético de asa | Furosemida | + |
| Diurético ahorrador de K | Espironolactona | +++ | |
| Antagonistas centrales simpático | Alfa metil Dopa | +++ | |
| Clonidina | ++++ | ||
| Antagonista simpático periférico | Reserpina | +++ | |
| Vasodilatadores | Hidralazina | (+−) | |
| Alfa bloqueadores | Prazosina | ++ | |
| Alfa-beta bloqueadores | Labetalol | ++++ | |
| Beta bloqueadores | Atenolol | +++ | |
| Propanolol | ++++ | ||
| Carvedilol | +++ | ||
| Beta1 | Nebivolol30 | ||
| Calcio antagonistas | Nifedipino | ++ | |
| IECA | Enalapril | ++ | |
| ARA | Losartán | − | |
| Antidepresivos | Triciclicos | Imipramina | +++ |
| IRSS | Paroxetina | + | |
| Antipsicoticos | Fenotiasina | Prometazina | ++++ |
| Antiepilépticos | Carbamazepina | +++ | |
| Hipnóticos | Barbituricos | Fenobarbital | +++ |
| Anti ulcerosos | Antagonistas H2 | Cimetidina | +++ |
| Antagonistas dopaminergicos | Sulpiride | +++ | |
| Hormonales | Antiandrogenos | ||
| Analogo LHrh | Leuprolide | +++ | |
| Antilipemicos | Estatina | Atorvastatina | (+−) |
| Fibrato | Fibrosilo | +++ |
(+) Reporte de caso.
(++) Baja frecuencia.
(+++) Moderada frecuencia.
(++++) Alta frecuencia.
(+−) Reportes indican mejoría de DE.
No hay estudios específicos donde se evalúe el efecto de los calcioantagonistas directamente sobre la función eréctil como objetivo primario, pero la literatura existente no ha reportado un efecto relevante28. En cuanto a aquellos medicamentos que actúan sobre el sistema renina-angiotensina, la evidencia sugiere que no hay un efecto deletéreo sobre la función eréctil y en algunos casos se ha indicado un efecto benéfico. En especial, los bloqueadores del receptor de angiotensina y el nebivolol parecen tener efectos benéficos potenciales, mientras estos efectos no se observan en los calcioantagonistas o atenolol. Otros beta-bloqueadores de última generación pares de nebivolol como carvedilol, labetalol y celiprolol, que manifiestan propiedades vasodilatadoras, se pensaría que podrían ejercer también un efecto benéfico sobre la función eréctil; sin embargo, este efecto no es el visto, ya que algunos de sus pares no solo no han demostrado no tener ningún efecto, sino tener un efecto deletéreo sobre la función eréctil, siendo al parecer el nebivolol la única excepción29.
En cuanto a medicamentos como telmisartán y/o ramipril, se encontró que no disminuyen la DE en pacientes de alto riesgo con DE previa, y además no previenen la aparición de DE de novo, aunque tampoco aumentan su incidencia29–32.
El uso de inhibidores de fosfodiesterasa5 (PDE5) en pacientes con tratamiento médico para hipertensión arterial se ha visto que es seguro, aun en pacientes de alto riesgo y polimedicados, dado que se ha visto que su efecto hipotensor es clínicamente imperceptible. Sin embargo, sí se ha llamado la atención sobre el uso de estos medicamentos en conjunto con los alfa bloqueadores ampliamente usados en la consulta urológica, siendo estos y los nitritos las contraindicaciones reales para el inicio del inhibidor PDE5, así como una HTA maligna o mal controlada8. En el caso de los nitratos la contraindicación es absoluta por el riesgo de hipotensión severa. En el caso de los alfa bloqueadores, el riesgo disminuye si31:
- 1.
Los medicamentos son usados y vigilados estrictamente por el especialista y se administran con la titulación adecuada.
- 2.
Los 2 medicamentos no se administran de forma simultánea sino con varias horas de diferencia.
- 3.
Uso de alfa bloqueadores selectivos de receptores a1A y a1D (tamsulosina, alfuzosina) en lugar de los no selectivos, que actúan principalmente sobre los receptores a1B (prazosina, doxazosina, terazosina).
- 4.
Los pacientes que llevan varios meses con alguno de los 2 medicamentos de forma estable8.
Diferentes publicaciones reportan que pacientes con enfermedad cardiovascular tiene síntomas de DE, y que las enfermedades cardiovasculares y la DE tienen una base fisiopatológica común (daño endotelial).
La DE en pacientes diabéticos es uno de los predictores más efectivos de enfermedad coronaria10.
Manejo de pacientes con factores de riesgo cardiovascularUn grupo de cardiólogos y urólogos de la Universidad de Princeton dieron en 1999 y 2004 recomendaciones para enfrentar la asociación entre DE y enfermedad cardiovascular20,33. La evaluación de la función cardiaca debe efectuarse periódicamente, con un intervalo recomendado de 6 meses20.
Categorías del panel consenso de Princeton34Bajo riesgo- •
Asintomáticos, menos de 3 factores de riesgo.
- •
Hipertensión controlada.
- •
Angina leve, angina estable.
- •
Revascularización coronaria exitosa.
- •
Asintomático, sin isquemia en la prueba de estrés postinfarto de miocardio (6-8 semanas).
- •
Enfermedad valvular leve.
- •
Disfunción ventricular izquierda (NYHA clasei).
- •
Asintomáticos, 3 o más factores de riesgo.
- •
Angina moderada, angina estable.
- •
Antecedente de infarto de miocardio (2-6 semanas).
- •
Disfunción ventricular izquierda (NYHA claseii).
- •
Secuela no cardiaca de enfermedad aterosclerótica (p.ej., enfermedad cerebrovascular).
- •
Angina inestable o angina refractaria.
- •
Hipertensión no controlada.
- •
Insuficiencia cardiaca congestiva (NYHA claseiii/iv).
- •
Infarto de miocardio reciente (<2 semanas).
- •
Arritmia de alto riesgo.
- •
Miocardiopatía hipertrófica obstructiva.
- •
Enfermedad valvular moderada a severa.
En términos generales, se deben seguir las recomendaciones de la Asociación Americana del Corazón (AHA) sobre enfermedad cardiovascular y actividad sexual:
- 1.
Es razonable que los pacientes con enfermedad cardiovascular que quieran iniciar o reiniciar su actividad sexual tengan una historia clínica completa y un examen físico (claseiia; nivel de evidencia C).
- 2.
Es razonable la actividad sexual para pacientes con enfermedad cardiovascular en quienes en su evaluación clínica se haya determinado que son de bajo riesgo de complicaciones cardiovasculares (claseiia; nivel de evidencia B).
- 3.
Se justifica una prueba de esfuerzo para aquellos pacientes que no son de bajo riesgo o en aquellos con riesgo indeterminado para evaluar su capacidad de ejercicio y el desarrollo de síntomas, isquemia o arritmias (claseiia; nivel de evidencia C).
- 4.
La actividad sexual es razonable para pacientes que pueden ejercitarse hasta >3 a 5 MET sin angina, disnea excesiva, cambios en el segmento ST, cianosis, hipotensión o arritmia (claseiia; nivel de evidencia C).
- 5.
La rehabilitación cardiaca y el ejercicio regular pueden ser útiles para reducir el riesgo de complicaciones cardiovasculares durante la actividad sexual en pacientes con enfermedad coronaria (nivel de evidencia B).
- 6.
Los pacientes con enfermedad cardiovascular inestable, descompensada y/o sintomática severa deben aplazar su actividad sexual hasta que su condición cardiaca sea estabilizada y manejada adecuadamente (claseiii; nivel de evidencia C).
- 7.
Los pacientes con enfermedad cardiovascular que experimenten síntomas cardiovasculares precipitados por la actividad sexual deben aplazar su actividad sexual hasta que su condición cardiaca sea estabilizada y manejada adecuadamente (claseiii; nivel de evidencia C)35.
Los síntomas sexuales como baja libido y la DE se asocian con una disminución de la testosterona relacionada con la edad, condición conocida como síndrome de deficiencia de testosterona36. La prevalencia de la deficiencia de testosterona en hombres de mediana edad y adultos mayores está en rangos tan variables como entre el 2,1%37 a cerca del 39%38, aunque recientemente es más aceptada una incidencia de hipogonadismo más cercana al porcentaje inferior.
Existe una relación clara entre la presencia de factores de riesgo para síndrome metabólico, niveles bajos de testosterona circulante y pacientes con DE. En una serie de 1.922 pacientes se encontró que a mayor número de factores de riesgo para síndrome metabólico, mayor posibilidad de disminución en los valores de testosterona39.
Antes se consideraba que la DE no era más que una condición frustrante, ahora se sabe que las condiciones subyacentes a la DE como el hipogonadismo, la diabetes, la resistencia a la insulina, la obesidad y el síndrome metabólico deben, por su relevancia y riesgo, motivar al hombre a mejorar su estilo de vida. El diagnóstico debe tomarse como una oportunidad de cribado para comorbilidades, y al final el hombre no solamente mejorara su salud sexual sino que tal vez, y más importante, su salud general tendrá un impacto positivo40.
Aunque existe en la actualidad controversia sobre si el reemplazo hormonal con testosterona disminuye o aumenta el riesgo cardiovascular41, cada vez más la literatura encuentra una asociación entre los niveles bajos de testosterona con aparición de morbilidades e incremento en la mortalidad37,38,42–45. Se ha identificado particularmente una asociación fuerte entre síndrome metabólico y baja testosterona42, siendo ahora el síndrome metabólico considerado como el problema más importante de salud pública en el mundo asociado a un elevado riesgo cardiovascular. Los niveles de testosterona bajos pueden ser causa de síndrome metabólico46, pero a su vez el síndrome metabólico será un factor de riesgo para tener niveles bajos de testosterona47. La alta prevalencia de síndrome metabólico en pacientes con DE y deficiencia de testosterona refleja la fuerte correlación entre estas condiciones, lo cual puede llevar a un incremento del riesgo cardiovascular48.
En conclusión, un gran número de estudios de reemplazo androgénico sugieren que el déficit de testosterona juega un papel central en las diferentes patologías que conforman el síndrome metabólico, incluyendo la resistencia a la insulina, diabetes mellitus tipo2, HTA, hiperlipidemia, obesidad y DE, como mencionábamos previamente, lo cual no es sorprendente, dado que la etiología del síndrome metabólico es la misma que la de la DE en la mayoría de los casos. Se debe entonces mejorar los hábitos de vida, pero igualmente se plantea la posibilidad de iniciar reemplazo hormonal en aquellos con déficit androgénico para disminuir el riesgo cardiovascular. Y aunque se ha visto que el reemplazo con testosterona modificará de una forma más definitiva los componentes del síndrome metabólico, se debe realizar un abordaje multimodal para obtener mejores resultados49.
La testosterona tiene una actividad tanto directa como indirecta sobre todo el mecanismo de erección. Ella se encarga de activar las células madre para convertirse en músculo liso cavernoso, regula la formación de óxido nítrico (ON) actuando en la óxido nítrico sintetasa endotelial y neuronal (eNOS, nNos). Igualmente la testosterona regula negativamente la actividad de la vía RhoA-RoCK, que disminuye la sensibilidad al calcio50. Además, la testosterona regula la expresión de la PDE551. La testosterona controla positivamente los pasos enzimáticos necesarios para la iniciación de la erección, un efecto positivo sobre la ONs y un efecto negativo sobre la vía RhoA-RoCK, con un efecto final positivo sobre la PDE539.
Las concentraciones de testosterona total (TT) se afectan por alteraciones en la proteína transportadora de hormonas sexuales (PTHS), que a su vez se ve alterada por la edad, medicamentos, índice de masa corporal y comorbilidades como diabetes mellitus tipo2, depresión, ansiedad, trastornos tiroideos, desnutrición y alcoholismo52. Igualmente, los niveles de TT y testosterona libre tienen un ritmo circadiano y son elevados en la mañana y tienden a bajar durante el día, patrón que se va perdiendo con los años53,54.
La Administración de Alimentos y Medicamentos (FDA) sugiere un valor de corte de 300ng/dl para definir hipogonadismo. El consenso de la declaración de la Sociedad Internacional de Andrología (ISA), la Sociedad Internacional para el Estudio del Hombre mayor (ISSAM), la Asociación Europea de Urología (EAU), la Asociación Europea de Andrología y la Asociación Americana de Andrología recomienda que los niveles por encima de 350ng/dl no requieren tratamiento, y los niveles por debajo de 230ng/dl (con síntomas) podrían requerir tratamiento de reemplazo hormonal55. Para niveles entre 230-350ng/dl se recomienda solicitar TT más PTHS para el cálculo de testosterona libre56. Igualmente, en la literatura se ha sugerido un valor de TT<200ng/dl como límite para el manejo del hipogonadismo y TT>400ng/dl como normal, considerándose aquellos valores entre 200-400ng/dl para ser tratados solo si hay síntomas57. La testosterona libre y la testosterona biodisponible pueden ser útiles para el diagnóstico de hipogonadismo en caso de que la TT haya sido no conclusiva o resulte normal con síntomas sugestivos de hipogonadismo. La testosterona circula en el cuerpo ligada a la PTHS, a la albúmina o a la globulina transportadora de corticosteroides o viaja en su forma libre. La testosterona unida a la PTHS representa aproximadamente el 44% de la TT y no está disponible para su uso en las células. La testosterona unida a la albúmina representa el 50% de la TT, pero la unión es débil y se disocia con facilidad. La testosterona unida a CBG representa el 4% de la TT también débilmente unida y se disocia con facilidad. La testosterona libre representa el 2-3% de la TT58. El término «testosterona biodisponible» se refiere a la suma de la testosterona libre, la unida a albúmina y la unida a CBG, que son realmente la fracción de testosterona disponible para las células.
La causa del hipogonadismo deberá siempre ser evaluada e identificada antes de iniciar el tratamiento con testosterona, y eso no implica que la DE será curada; se deben realizar las evaluaciones previas pertinentes e igualmente seguir el monitoreo de seguridad de acuerdo con los lineamientos actuales59,60.
Existe una gran variedad de presentaciones de testosterona bien toleradas disponibles en el mercado61:
- -
Testosterona ×250mg intramuscular quincenal, cada 3 semanas o mensual.
- -
Undecanoato de testosterona 1.000 unidades, depósito intramuscular por 3 meses.
- -
Gel transdérmico 5mg, uso de lunes a viernes.
El hipertiroidismo puede influir sobre la función eréctil incrementando la PTHS y, por lo tanto, disminuyendo los niveles de testosterona. El tratamiento eficaz del hipertiroidismo puede resolver la DE coexistente62.
HiperprolactinemiaLa hiperprolactinemia está asociada con DE, pérdida del deseo sexual y anorgasmia. Se presenta con una disminución androgénica causada por el feedback negativo que producen los altos niveles de prolactina sobre la producción de LH causando hipogonadismo. La hiperprolactinemia deberá ser descartada en todos los hombres con pérdida de deseo sexual. Las elevaciones moderadas de la prolactina (<1.000mU/l) pocas veces causan DE61.
Causas de hiperprolactinemia:
- –
Estrés.
- –
Medicamentos (tranquilizantes mayores y antieméticos).
- –
Una proporción pequeña de pacientes con esta sintomatología tendrán un tumor hipofisario productor de prolactina.
- –
Falla renal crónica.
Cabe anotar que en enero de 2014 la FDA emitió una alerta acerca del uso de la testosterona donde nuevamente indican la posibilidad de aumento de riesgo cardiovascular, dadas 2 publicaciones63,64 nuevas relacionadas con el tema. La indicación no es a suspender las preparaciones de testosterona sino a realizar un seguimiento continuo y estricto hasta que se haya llegado a una conclusión sobre el tema y hacer los reportes de eventos adversos relacionados con estas preparaciones65.
Diagnóstico y plan de trabajoLa consulta de DE debe llevarse a cabo en una atmósfera cómoda, sin apuros y en un lugar que respete la intimidad.
HistoriaDebe concentrarse en el momento de aparición de la DE y en los diferentes factores de riesgo si es súbita o progresiva, y la asociación con otras disfunciones sexuales (eyaculación precoz, deseo sexual hipoactivo, disfunción sexual femenina), la relación con la pareja y los tratamientos previos recibidos.
La historia clínica debe enfatizar los factores de riesgo mencionados y centrarse en la información de la esfera sexual. La historia sexual indaga sobre la esfera del deseo, la eyaculación, la erección y la satisfacción global.
Se debe preguntar sobre la frecuencia con que aparece el deseo sexual y las tentativas de relaciones sexuales, la presencia de eyaculación, el volumen percibido, la latencia eyaculatoria, la eyaculación dolorosa o ausente y la sensación orgásmica. En relación con la erección, es necesario precisar la calidad en cuanto firmeza y prontitud, la dificultad para obtenerla o mantenerla hasta lograr una penetración satisfactoria, el grado de rigidez, turgencia y ángulo, la calidad de las erecciones obtenidas durante el sueño y las matutinas, y la tasa de fallas para obtener la erección y para penetrar.
Esta información puede ser recopilada y analizada de manera libre o sistemática mediante el uso de los cuestionarios internacionales validados para calificar la erección.
Cuestionario de función eréctilEl índice internacional de función eréctil, también llamado test IIEF-5, permite evaluar la DE a partir de 5 preguntas precisas. Este cuestionario se encuentra validado en español para su implementación de manera fácil (tabla 2).
Índice internacional de función eréctil IIEF5
| Pregunta 1. Durante los últimos 6 meses, ¿con qué frecuencia logró una erección durante las relaciones sexuales? |
| 1. Casi nunca o nunca |
| 2. Menos de la mitad de las veces |
| 3. La mitad de las veces |
| 4. Más de la mitad de las veces |
| 5. Casi siempre o siempre |
| Pregunta 2. Cuando tuvo relaciones con estimulación sexual ¿con qué frecuencia la rigidez del pene fue suficiente para la penetración? |
| 1. Casi nunca o nunca |
| 2. Menos de la mitad de las veces |
| 3. La mitad de las veces |
| 4. Más de la mitad de las veces |
| 5. Casi siempre o siempre |
| _ No hubo estimulación sexual |
| Pregunta 3. ¿Con qué frecuencia logró mantener la erección después de la penetración? |
| 1. Casi nunca o nunca |
| 2. Menos de la mitad de las veces |
| 3. La mitad de las veces |
| 4. Más de la mitad de las veces |
| 5. Casi siempre o siempre |
| _ No he tenido relaciones sexuales |
| Pregunta 4. ¿Cuál fue el grado de dificultad para mantener la erección hasta completar la relación sexual? |
| 1. Extremadamente difícil |
| 2. Muy difícil |
| 3. Difícil |
| 4. Un poco difícil |
| 5. No fue difícil |
| _ No he tenido relaciones sexuales |
| Pregunta 5. Las relaciones sexuales que ha tenido durante este tiempo ¿resultaron satisfactorias para usted? |
| 1. Casi nunca o nunca |
| 2. Menos de la mitad de las veces |
| 3. La mitad de las veces |
| 4. Más de la mitad de las veces |
| 5. Casi siempre o siempre |
| _ No he tenido relaciones sexuales |
Resultados del test: disfunción eréctil grave: de 5 a 10 puntos; disfunción eréctil media: de 11 a 15 puntos; disfunción eréctil ligera: de 16 a 20 puntos; función eréctil normal: de 21 a 25 puntos.
El IIEF-15 (International Index of Erectile Function) y el IIEF-5 o SHIM (Sexual Health Inventory for Men) son cuestionarios abreviados que se centran específicamente en la erección. Son los más recomendados, y el hecho de tratarse de instrumentos de uso generalizado y validados en más de 30 idiomas los hace imprescindibles en investigación. Facilitan calificar la severidad de la disfunción, aunque no permiten determinar la etiología.
EjercicioEs recomendable registrar el tipo de ejercicio (caminar, correr, golf, ciclismo, etc.) efectuado rutinariamente, su frecuencia e intensidad. Esto se hace para determinar la falta de ejercicio, y también como una medida aproximada de función y reserva cardiaca.
AntecedentesPatológicosAdemás de los factores de riesgo anteriormente mencionados, debe indagarse si hay otras condiciones tales como enfermedad renal, enfermedades neurológicas, traumatismos, cirugía o radiación pélvica y trastornos del sueño.
Farmacológicos y tóxicosLos medicamentos mencionados anteriormente no son los únicos que causan DE, así que siempre se debe verificar el consumo fuera de prescripción (medicamentos naturistas, homeopáticos, entre otros). Pregunte también sobre tabaquismo (registre la relación paquetes-año) y la frecuencia y cantidad del consumo de alcohol.
Quirúrgicos- -
Manejo de patología benigna prostática.
- –
RTUP.
- –
Prostatectomía transvesical o retropúbica.
La aparición de DE como consecuencia del manejo quirúrgico de la patología benigna fue reportada inicialmente desde un 0 hasta un 40%, pero en las últimas series se ha hablado de una incidencia entre el 3 y el 5%.
- -
Manejo quirúrgico de cáncer de próstata.
- –
Prostatectomía radical.
- •
Retropúbica.
- •
Laparoscópica.
- •
Robótica.
Este ítem será evaluado de forma independiente en el capítulo «Cáncer de próstata».
- -
Manejo quirúrgico de patología vertebral.
- -
Cirugía de cáncer rectal (tasas de DE del 20 al 46%)66.
Debe incluir la medición del índice de masa corporal (IMC) y del perímetro abdominal, marcadores cardiovasculares (presión arterial y pulso) y un examen neurológico básico (sensibilidad perineal, reflejos cremasterianos y bulbocavernoso, reflejos rotulianos, fuerza y sensibilidad de miembros inferiores). Se deben examinar además las características sexuales secundarias y los genitales externos en busca de deformidades, hipotrofias y placas fibróticas de los cuerpos cavernosos, así como atrofias testiculares, ginecomastia, galactorrea y alteraciones visuales. El examen de próstata en los casos indicados también es parte de la recomendación.
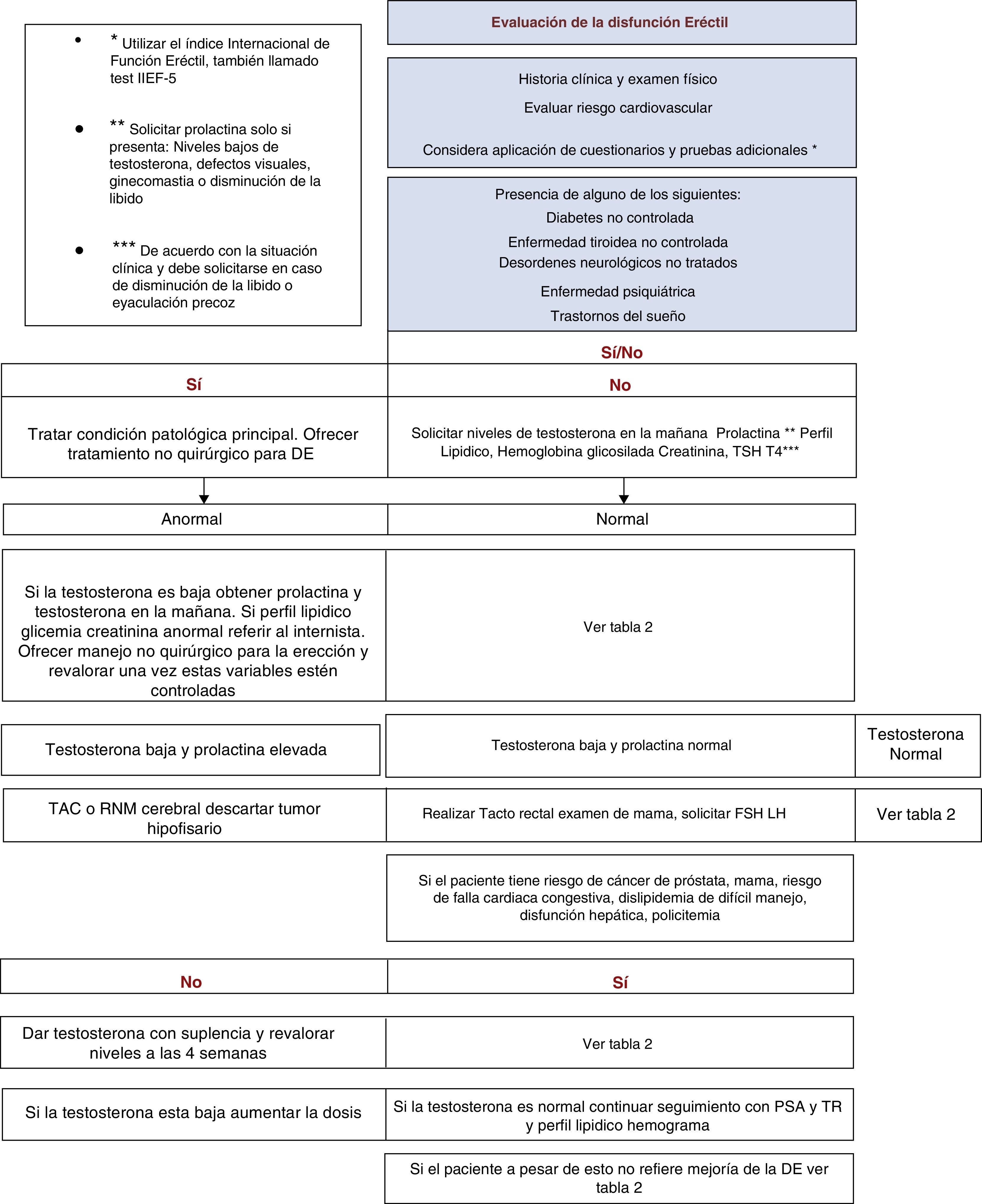
Exámenes de laboratorioDentro de los estudios recomendados se incluyen:
- 1.
Perfil lipídico y glucemia. Un estudio metabólico inicial con mediciones de colesterol total, colesterol de baja y alta densidad, triglicéridos y glucemia (grado de recomendación B).
- 2.
Testosterona total. Los valores de TT bajos encontrados en las diferente series oscilan entre el 2 y el 35%37,38, por lo que se recomiendan las mediciones rutinarias y no condicionadas de este paraclínico ante un cuadro de DE (grado de recomendación C).
Se deberán ampliar estudios con testosterona biodisponible o libre en caso de alta sospecha de alteración. En caso de anormalidad en este parámetro inicial, se ampliará el estudio con prolactina FSH LH y se repetirá la testosterona en la mañana para confirmar la presencia de hipogonadismo.
La disminución de la testosterona se asocia frecuentemente a la disminución del deseo sexual y DE secundaria. Es por esto que está indicado el uso de la terapia de remplazo hormonal en varones con niveles de TT<2ng/ml10 (ver discusión previa sobre valores aceptados).
El hipogonadismo masculino asociado al síndrome metabólico y al envejecimiento es una patología común en la población general pero frecuentemente subtratada. En estos casos es necesario contar con la determinación de testosterona libre calculada y de testosterona biodisponible, mediante la medición explícita de globulina transportadora de hormonas sexuales (SHBG)67.
Este trastorno afecta a 4 millones de norteamericanos, de los cuales solo el 5% reciben tratamiento68–70.
- 3.
Prolactina. Se ha reportado hiperprolactinemia desencadenada por patología hipofisaria o la inducida por medicamentos dr entre el 1,5 y el 9% en centros de referencia18. Para efectos de esta guía se recomienda su solicitud en caso de: niveles bajos de testosterona, defectos visuales, ginecomastia o disminución de la libido (grado de recomendación C).
- 4.
TSH y T4. Alteraciones del deseo sexual y DE se han relacionado con la presencia de síntomas de hipertiroidismo y menos frecuentemente hipotiroidismo. De allí que la recomendación consista en tener en cuenta las cifras de TSH de acuerdo con la situación clínica y solicitarse en caso de disminución de la libido o eyaculación precoz18 (grado de recomendación B).
En la tabla 3 se recogen las indicaciones en las que conviene realizar pruebas especiales según la guía Europea de la Disfunción Sexual 2013.
Indicaciones que requieren pruebas especiales
| DE primaria (no causada por enfermedad orgánica o psicógena) |
| Pacientes jóvenes con historia de trauma pélvico o perineal |
| Paciente con deformidades peneanas que pueden requerir corrección quirúrgica; por ejemplo, enfermedad de Peyronie, curvatura congénita |
| Paciente con trastornos psiquiátricos o psicosexuales complejos |
| Pacientes con trastornos endocrinos complejos |
| Razones medicolegales, previa inserción de prótesis peneana o abuso sexual |
Adaptado de Guía Europea de Disfunción Sexual Masculina, 2013.
Aunque las imágenes vasculares peneanas en los últimos 10 años han disminuido cada vez más su importancia luego de la introducción de los medicamentos vaso-activos orales y el reconocimiento de que la cirugía vascular tiene malos resultados a largo plazo, aún encontramos indicaciones precisas para realizar imagenología peneana71.
I. Ecografía doppler dúplex peneanaLas 3 principales indicaciones para realizar una eco doppler color peneana es el trauma de pene, la enfermedad de Peyronie y la sospecha de enfermedad arterial. Se usa un transductor de alta resolución de 7 o 10mHz para visualizar el pene inicialmente en flacidez, tanto ventral como longitudinalmente, y después de la administración de agente intracavernoso, generalmente PGE1, para disminuir efectos secundarios, a una dosis que puede ser de 10μg en paciente joven o potente pero que se ha estandarizado en 20μg. El doppler color es un estudio dinámico cuyas características e interpretación varían del estado de flacidez, al comienzo de la erección, pasando por erección plena, hasta la detumescencia.
El flujo arterial es examinado en cada una de las arterias cavernosas en el estado basal antes de la inyección y cada 5min de ahí en adelante durante 20min. Los diámetros de las arterias cavernosas también son medidos. Se deben anotar las comunicaciones anatómicas entre las arterias cavernosas o entre la arteria dorsal y las cavernosas. Igualmente se debe describir la rigidez de la erección.
Arterias cavernosasLa onda espectral de las arterias cavernosas debe ser evaluada desde su estado basal hasta la finalización de la erección. Por tal motivo, los cambios de esta onda espectral se han clasificado en 6 fases, de 0 a 572. En el estado flácido (fase0) la onda es de baja velocidad con alta resistencia en el flujo entre 15-25cm/s. En la aparición de la erección (fase1), la velocidad sistólica pico es >35cm/s y la velocidad diastólica >8cm/s. Cuando la presión sanguínea comienza su ascenso en el cuerpo cavernoso (fase2) aparece una muesca en la onda al final de la sístole y se identifica una disminución del flujo diastólico. Cuando la presión cavernosa iguala la presión diastólica, el flujo diastólico baja a cero (fase3). Una presión cavernosa por encima de la presión diastólica está presente con la erección plena y se evidencia como flujo holodiastólico reverso (fase4). Durante la erección rígida el flujo sistólico se reduce y el flujo diastólico desaparece (fase5)73, reflejando la presión cavernosa cercana o por encima de la presión sistólica; esto requiere la contracción del músculo bulbocavernoso y no se observa durante la estimulación farmacológica, pero se puede estimular con la compresión del glande74.
Arterias dorsalesEstos vasos se encuentran por fuera de la túnica albugínea, condición que produce un flujo diastólico anterógrado persistente; en general su velocidad pico sistólica aumenta de 20cm/s en flacidez a >40cm/s en erección75.
Arterias helicoidalesSe ha determinado una velocidad sistólica pico de 21-23cm/s y una velocidad diastólica promedio de 2-3cm/s en las fases 1 y 2 de la erección en la base de estas arterias y disminuye distalmente. En las fases 3 y 4 disminuye la velocidad sistólica pico y la velocidad diastólica baja a 0. En la fase 5 las arterias helicoidales desaparecen76.
Comunicaciones cavernoesponjosasHay cambios identificados durante las diferentes fases de la erección con un incremento de la velocidad sistólica pico desde 6cm/s en estado de flacidez hasta 10cm/s durante la erección. Cuando se alcanza la erección completa estas comunicaciones tienden a desaparecer y la velocidad diastólica puede llegar a 036.
VenasLa identificación del sistema venoso peneano en la ecografía no es fácil debido a su alta variación y al bajo flujo en las diferentes etapas de la erección y en flacidez. Sin embargo, varias estructuras venosas pueden ser evaluadas: una o más venas superficiales, una vena larga ventral entre los cuerpos cavernosos y una vena dorsal profunda o, en su defecto, varias venas dorsales más pequeñas bajo la fascia de Buck.
Hallazgos anormales en disfunción eréctil- •
Origen arterial. En términos generales en la ecografía con escala de grises se pueden identificar con facilidad calcificaciones en las arterias, cortes abruptos de las arterias y se pueden establecer los cambios en diámetro con la erección después del agente intracavernoso. Sin embargo, la imagen en color es crucial para identificar las arterias cavernosas adecuadamente y detectar la presencia y la dirección del flujo77.
Entre los diferentes parámetros usados en el diagnóstico vascular para la cuantificación de flujo, solo algunos pocos son útiles en el estudio de la DE, como la velocidad sistólica pico (PSV), el tiempo de aceleración (AT), el tiempo de elevación sistólica (SRT), la velocidad de final de diástole (EDV) y el índice de resistencia (RI).
Antes también se evaluaba el grado de distensión de las arterias cavernosas, pero se abandonó por no ser consistente en predecir una rigidez adecuada78. El diámetro flácido normal de la arteria cavernosa es igual a 0,3 a 0,4mm, y en erección es de 0,7 a 1,2mm. La insuficiencia arteriogénica se sospecha si el diámetro de la arteria cavernosa erecto es menor a 0,7mm. No existe una relación entre el diámetro de la arteria y la magnitud de la DE.
El PSV (expresado en centímetros/segundo) muestra la mayor velocidad de flujo detectable en una arteria durante la sístole. Cabe anotar que la mayor PSV se produce 5-6min desde la aplicación del alprostadil, pero el 22% de los pacientes tiene un periodo de latencia mayor, hasta de 18min, por lo cual las mediciones doppler de la PSV deben ser monitoreadas al menos durante 20min. El pico de velocidad sistólica de la arteria cavernosa normal debe ser >35cm/s, y la insuficiencia arterial se diagnostica con valores <25cm/s, con una sensibilidad del 100% y una especificidad del 95%79.
Los valores intermedios son considerados indeterminados y son frecuentes en hombres mayores con DE moderada por adelgazamiento de la íntima o baja respuesta a PGE1. La suma de la PSV derecha e izquierda debe ser mayor de 50-60cm/s para descartar DE arteriogénica80. Una diferencia entre las 2 arterias de más del 20% o de 10cm/s debe ser sospechosa y hacer pensar en una insuficiencia arterial unilateral73.
La EDV y la medición correspondiente semicuantitativa de RI pueden ser informativas sobre la disfunción venooclusiva. En asociación con una respuesta arterial normal, una EDV >5cm/s se acepta como una medición en la cual está presente una fuga venosa. La verdadera limitante de esta medición es interpretar su resultado cuando además se está frente a una insuficiencia arterial. La velocidad de fin de diástole de la arteria cavernosa normal es <3cm/s80.
Se recomienda la evaluación de AT o SRT aun si la PSV es normal, ya que algunos pacientes pueden tener este parámetro prolongado (>100cm/s). En estos casos la DE está ocasionada por una reducción en el diámetro de las arterias cavernosas que limita la velocidad del flujo. Debido a su variabilidad, el diagnóstico de DE de origen vascular no se puede basar en el valor del SRT81,82.
Además de la medición de PSV, la ecografía doppler permite igualmente la visualización de estenosis en forma de jets de alta velocidad u ondas aplanadas en el caso de estenosis proximales83. En los hombres posprostatectomía radical, Kim et al.84 mostraron que el flujo sanguíneo peneano disminuye después de la prostatectomía radical, especialmente en el sitio donde el fascículo vasculonervioso haya sido lesionado. De igual forma se demostró una fuga venosa progresiva con fibrosis del cuerpo cavernoso y acortamiento peneano. El doppler es una herramienta indispensable para todos los estudios realizados en rehabilitación peneana posprostatectomía radical.
No se requieren más estudios vasculares cuando el doppler es normal.
- •
Origen venoso. Es frecuente en hombres jóvenes con DE sin patología arterial. En los pacientes con DE de origen venoso el flujo cavernoso es elevado, los vasos se aprecian de calibre mayor y se pueden seguir en un trayecto prolongado. Las arterias helicoidales son numerosas y visibles hasta la albugínea. El diagnóstico se basa en una velocidad pico sistólica persistentemente elevada por encima de los valores de corte de 35cm/s, y una velocidad de fin de diástole elevada, con una sensibilidad del 90-94%. La desaparición o la inversión del flujo diastólico son indicativas de un mecanismo venooclusivo indemne, caso en el cual se deben descartar otros factores causales de DE85.
En cuanto al RI, su medición no es superior a la medición de la velocidad diastólica. Un RI de 0,9-1,0 es normal, mientras que valores menores sugieren fuga venosa. La presencia de una velocidad diastólica elevada es indicativa de una presión intracavernosa baja inadecuada para la erección86.
II. Cavernosometría y cavernosografíaAnteriormente era usada como la prueba gold standard para detectar disfunción venooclusiva. Sin embargo, con la mejoría en los transductores ecográficos y por ende en la imagen, este estudio ha quedado relegado al estudio de factores puntuales en pacientes ya diagnosticados con doppler peneano.
Los siguientes son los valores diagnósticos usados en la cavernosometría:
Indicadores de DE venooclusiva:
- •
Cavernosometría: flujo de mantenimiento >3ml/min (a una presión intracavernosa de 150mmHg, la presión intracavernosa decae >45mmHg en 30s o la inhabilidad para aumentar la presión intracavernosa cercana a la presión arterial media.
- •
Fuga venosa evidenciada en la cavernosografía.
- •
Velocidad de fin de diástole intracavernosa >3cm/s.
Esta prueba se desarrolla al mismo tiempo que la cavernosometría. Después de la aplicación de agente erectogénico se infunde medio de contraste al cuerpo cavernoso y se obtienen placas oblicuas y AP. Esta prueba se utiliza para identificar la localización de la fuga venosa80.
Angiografía por TAC multicorte. Arteriografía de vasos pudendos y arteria epigástrica inferiorAnteriormente la arteriografía era el gold standard para el diagnóstico de la insuficiencia arterial. Esta prueba está indicada en pacientes jóvenes en quienes se sospecha insuficiencia arterial y son candidatos a manejo quirúrgico con revascularización80. Sin embargo, en la actualidad el estudio de primera línea es la angiografía por TAC multidetector con reconstrucción en 3D, que permite la definición completa de las arterias cavernosas y pudendas en este tipo de pacientes76.
De la misma forma se puede usar la RNM para realizar angiografía o para determinar mejor la anatomía en el caso, por ejemplo, del estudio y seguimiento de las placas de Peyronie.
Cáncer de próstataLa prostatectomía radical, cualquiera que sea su abordaje (abierta, laparoscópica o robótica), es un procedimiento ampliamente usado para pacientes con cáncer de próstata localizado. Este procedimiento tiene una alta incidencia de DE en el postoperatorio, alcanzando cifras reportadas entre el 25 y el 75%87. Aunque las tasas reportadas en este rango tan amplio han sido similares para cualquier técnica usada, un metaanálisis reciente ha mostrado una tendencia más favorable en cuanto a la recuperación de la función eréctil a 12 meses en pacientes llevados a cirugía robótica en comparación con los llevados a prostatectomía radical retropúbica88, aunque no se han podido hallar diferencias significativas con la laparoscópica. En términos generales, esta incidencia está relacionada estrechamente con la experiencia del cirujano.
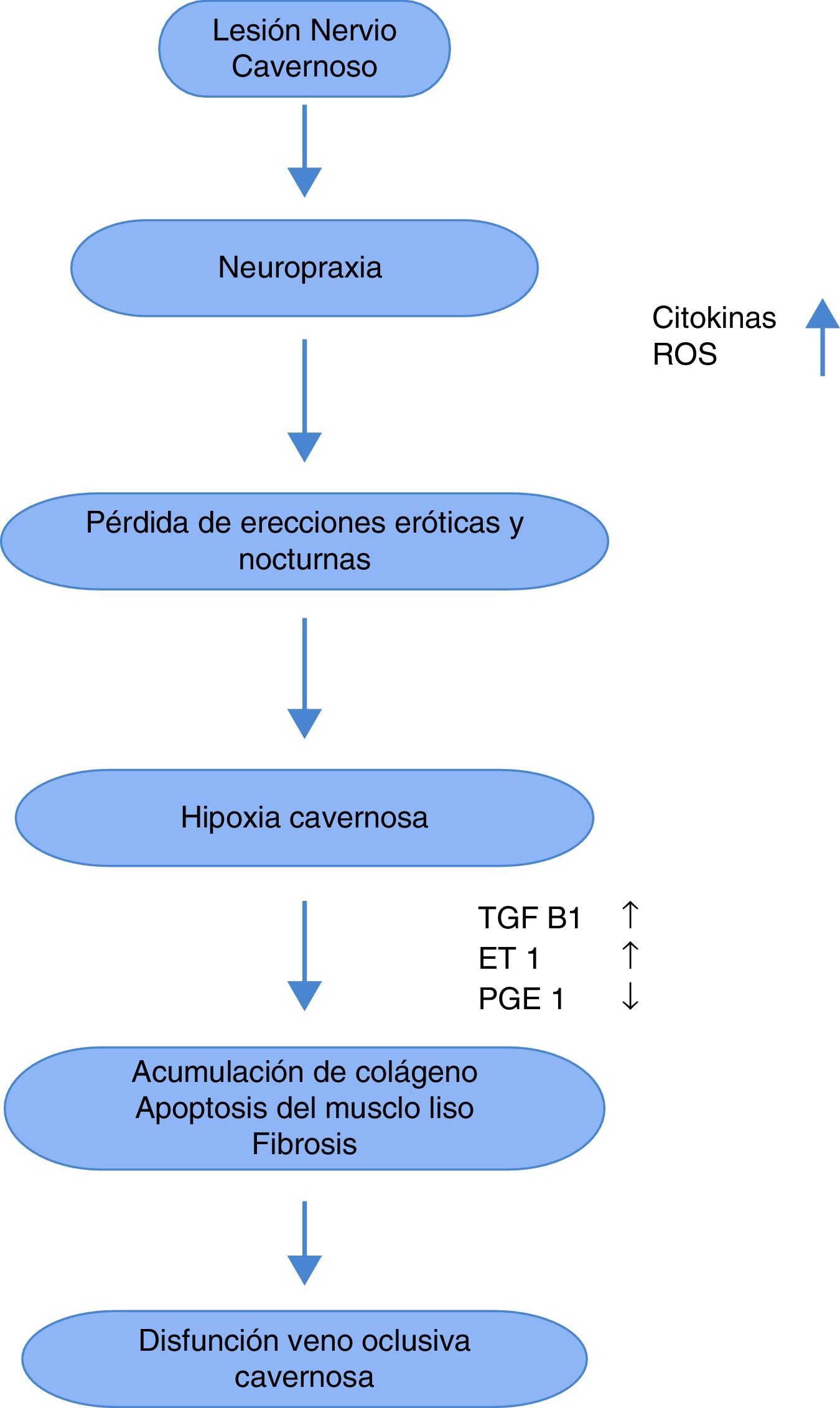
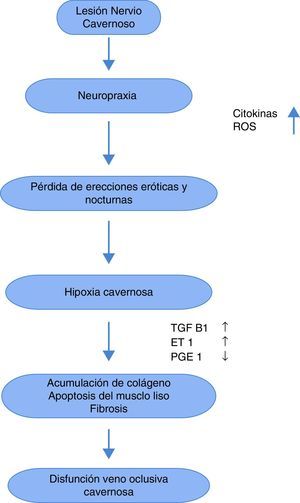
Se sabe que las causas de la DE posprostatectomía radical son multifactoriales89, ya que interfiere con el mecanismo neurológico que facilita la oxigenación peneana. Este trauma neurológico (neuropraxis) no está bien dilucidado, pero se han hecho hipótesis sobre el papel de los retractores, el electrocauterio, la disrupción de tejido neurovascular y la inflamación local generada durante el evento quirúrgico. Esto produce la manifestación aguda, la cual se intensifica con la pérdida de erecciones nocturnas y está marcada por la presencia de TGFβ, endotelina 1, y óxido nítrico sintetasa inducible, así como la reducción de mediadores antifibróticos como la PGE1 y el AMPc, lo cual produce hipoxia del tejido cavernoso, formación de fibrosis por depósitos de colágeno y apoptosis de las células lisas musculares90. Este proceso (fig. 1) es el que genera la manifestación crónica de la DE91,92.
El impacto de la radioterapia y la braquiterapia y otras técnicas usadas como crioterapia aún esta subestimado, y aunque es reconocido, su efecto sobre la DE se cree que puede ser mucho mayor al reportado93, siendo inclusive mayor el efecto deletéreo sobre la función eréctil que con los tratamientos convencionales debido a un daño multimodal en fascículos neurovasculares, vasculatura peneana y tejido estructural cavernoso.
El manejo del cáncer de próstata con bloqueo hormonal produce igualmente un efecto deletéreo sobre la función sexual no solo en cuanto a la DE, sino también en una disminución importante de la libido, como es de esperar. Igualmente, no solo en aquellos pacientes en los que realizamos algún tipo de manipulación hormonal, sino en los pacientes en postoperatorio o posradioterapia hay una alteración global en su esfera sexual condicionada por el estrés del diagnóstico de su patología, la percepción de un posible acortamiento peneano o curvaturas secundarias al procedimiento, la depresión que causa la patología y sus comorbilidades y todos los ajustes que debe realizar en su vida de pareja94, por lo cual es mandatorio que durante la rehabilitación peneana todos estos tópicos sean evaluados.
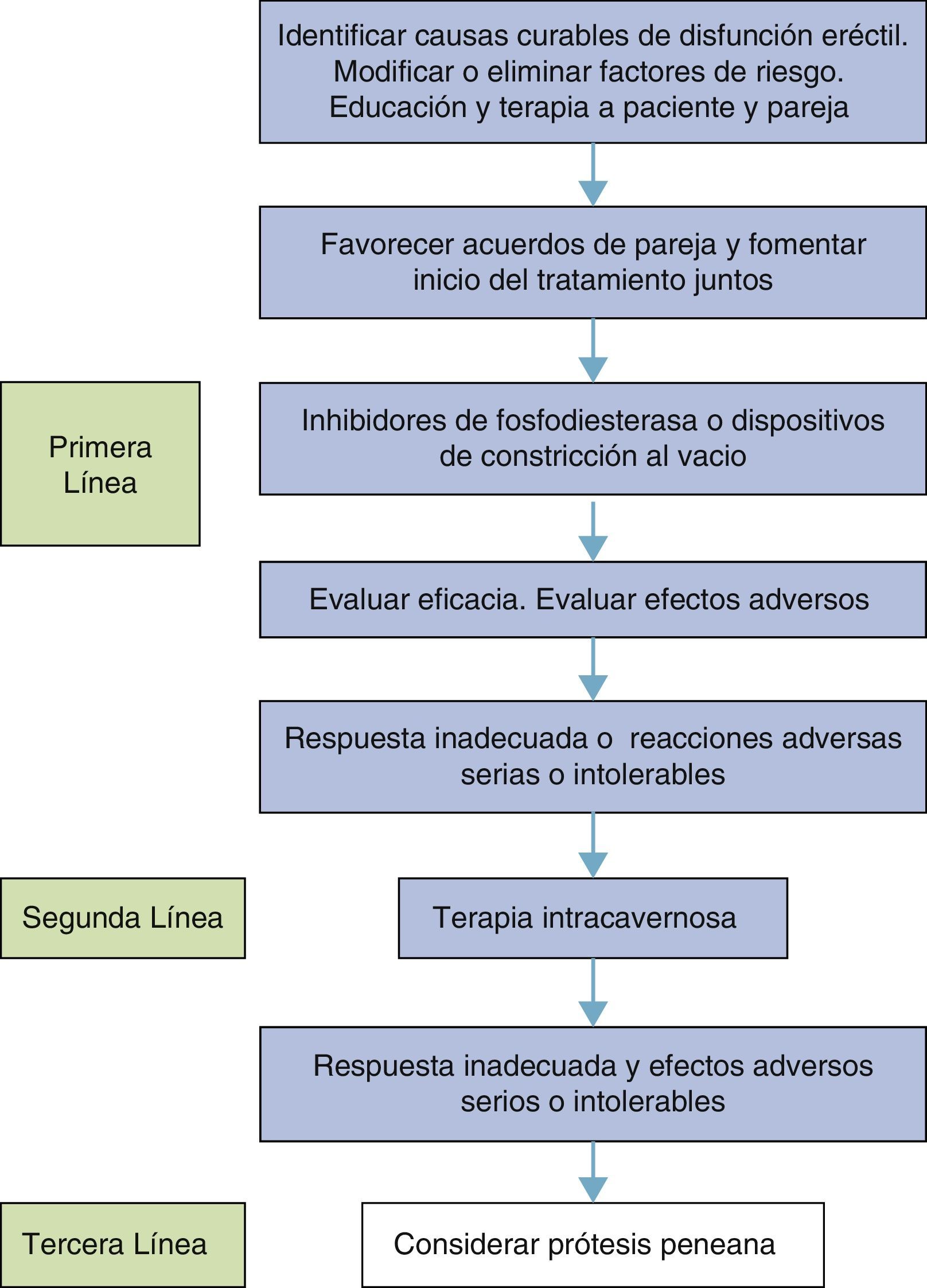
TratamientoEl objetivo de la terapia debe ser restaurar la satisfacción de la vida sexual y no solo la erección rígida.
Manejo de los factores de riesgo y enfermedades asociadas- •
Asesorar los cambios de estilo de vida (suspensión del consumo de alcohol y tabaco) y el incremento de la actividad física.
- •
Remisión a los especialistas en casos de hipertensión, diabetes o depresión de aparición temprana y la integración y comunicación con ellos para establecer un tratamiento coordinado.
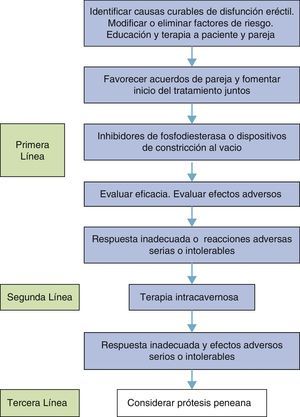
Es una premisa que la DE puede ser manejada adecuadamente pero en términos generales no es curable. Las causas curables de la DE se limitan a las causas hormonales, la psicógena y la arterial postraumática en hombres jóvenes. Es por este motivo que estas causas deben identificarse (fig. 2) en primera instancia93.
Deficiencia de testosteronaUn metaanálisis de los efectos de la testosterona sobre la función sexual masculina concluyó que el reemplazo de testosterona es un tratamiento eficaz para los pacientes con DE vasculogénica y déficit de testosterona95. Sin embargo, existe la idea de que la respuesta a este tipo de tratamiento disminuye con el tiempo.
El uso de suplemento con testosterona está contraindicado en pacientes con cáncer prostático activo sin tratamiento, y en pacientes ya tratados debe ser evaluada muy bien su condición libre de enfermedad antes de ser iniciado, evaluando con el paciente claramente las posibilidades, riesgos y complicaciones del uso de la suplencia; de allí que el tacto rectal y la determinación del antígeno específico de próstata (PSA) sean prerrequisito para comenzar la terapia. Los pacientes tratados con suplementos deben ser controlados periódicamente en cuanto a la eficacia, y también en cuanto a los efectos secundarios en la función hepática (controversial) y la próstata. Otro efecto secundario es la aparición de policitemia.
Un metaanálisis examinó datos de 17 estudios controlados con 656 pacientes (grupo de testosterona: 284 sujetos; grupo placebo: 284)96. Los resultados de este metaanálisis indican que la administración de testosterona a hombres cuyos niveles de testosterona no son bajos no mejora la función eréctil. Preparaciones de testosterona disponibles en Colombia son: enantato y undecanoato de testosterona (inyectables) y preparado de testosterona gel, de uso tópico.
Disfunción eréctil psicógenaAunque este factor etiológico puro es raro, en algunos casos puede ser útil que tanto el individuo enfermo como su pareja reciban asesoramiento y educación al tiempo con la farmacoterapia. En general, la psicoterapia suele ser prolongada95. Se debe tener en cuenta la participación del psiquiatra en algunas situaciones especiales, como:
- 1.
DE primaria, sin causa orgánica aparente.
- 2.
Fallas con los inhibidores de la PDE5 en ausencia de trastornos neurológicos y vasculares (evaluados por los especialistas correspondientes).
- 3.
Antecedente de abuso sexual o trauma sexual en alguno de los miembros de la pareja.
- 4.
Antecedente de un trastorno depresivo o del afecto no tratado97.
Los inhibidores de la PDE5 son antagonistas competitivos de la acción de la PDE5 que inducen aumento intracelular de los niveles de GMP cíclico en el músculo cavernoso, lo que conlleva la relajación del músculo liso y la erección en respuesta al estímulo sexual. En Colombia, los 3 agentes de esta clase actualmente de venta libre son sildenafilo, vardenafilo y tadalafilo.
Los estudios de preferencia disponibles no muestran diferencias mayores entre las 3 moléculas en cuanto a eficacia. De la intensidad de la actividad sexual y de la presencia de efectos secundarios y su duración depende la preferencia individual por cada uno de los medicamentos disponibles98.
Está contraindicado el uso de inhibidores de PDE5 en hombres que consumen nitratos simultáneamente.
SildenafiloFue el primer inhibidor de la PDE5 clínicamente utilizado en todo el mundo. El inicio de la acción se produce 30-60min después de la administración oral99. Un metaanálisis de 11 estudios mostró una tasa de éxito del 76% vs. el 22% del grupo placebo100.
Si el sildenafilo se toma después de una comida, la absorción se retrasa, se reducen los niveles plasmáticos y, por ende, su eficacia. Un estudio que examina la interacción entre el alcohol y el sildenafilo, que es una combinación frecuente, ha encontrado que el alcohol (0,5g/kg de peso corporal) no tuvo efecto sobre la farmacocinética del sildenafilo.
VardenafiloEl inicio de acción se produce 30min tras la administración oral101. Un metaanálisis de 9 estudios clínicos aleatorizados controlados recopiló datos de más de 4.286 sujetos. La mejoría de las erecciones fue reportada en el 69% del grupo de vardenafilo, con el 26% en el grupo de placebo (p<0,00001)102,103.
Vardenafilo está contraindicado en los pacientes que toman antiarrítmicos de clase iA (quinidina, procainamida) o antiarrítmicos de clase iii (p.ej., amiodarona) y en pacientes con QT prolongado104.
Las dosis disponibles en Colombia son 5, 10 y 20mg. La eficacia de vardenafilo disminuye si se toma después de una comida rica en grasas. Un estudio de vardenafilo y alcohol, en el que se incluyeron 12 individuos sanos, encontró que el alcohol (0,5g/kg de peso corporal) no tenía efecto sobre la farmacocinética del vardenafilo.
TadalafiloEl inicio de acción se produce 30min después de la administración oral, y se mantiene por 36h105. Esta prolongada duración de la acción es la gran diferencia entre este agente y los 2 anteriormente mencionados. Otra característica del tadalafilo es que también inhibe la PDE11. La importancia de la inhibición de la PDE11, que se encuentra principalmente en la próstata, el testículo y el músculo esquelético, es desconocida.
En un metaanálisis de 5 estudios clínicos aleatorizados, del 41 al 81% de 1.112 sujetos con insuficiencia renal leve a moderada con DE informaron mejoría de la erección frente al placebo (35%). Se informó además coito exitoso en el 73-80% de 30min a 36h después de tomar la tableta de tadalafilo106. El dolor lumbar es una reacción adversa típica de tadalafilo, que ocurre el 5% de las veces107.
En estudios recientes se ha estudiado la administración de tadalafilo en pacientes diabéticos con DE solo y en asociación con losartán, encontrando que este puede mejorar la función eréctil y que la asociación es más efectiva que la monoterapia108.
Las dosis disponibles en Colombia son de 5 y 20mg. La absorción de tadalafilo se ve afectada muy poco por las comidas. La interacción entre el alcohol y el tadalafilo se examinó en un estudio de alrededor de 100 sujetos, llegando a la conclusión de que el alcohol (0,6g/kg de peso corporal) no tiene ningún efecto sobre la farmacocinética del tadalafilo109.
La eficacia y la tolerabilidad de estos 3 agentes se han estudiado en diferentes ensayos comparativos que han pretendido identificar la superioridad de alguno de estos medicamentos sin lograr identificar superioridad entre uno y otro.
Los pacientes se deben aconsejar con cuidado en el uso óptimo de la medicación. Por lo tanto, se debe recomendar el uso repetido del medicamento incluso después de una falla de respuesta a la medicación. No debe llamarse fracaso terapéutico hasta no valorar los factores asociados que puedan explicar este fracaso.
En un estudio de 236 pacientes referidos por su médico general, debido a la aparente falta de respuesta al sildenafilo, se encontró que 98 sujetos (41,5%) respondieron después de re-educación mediante vídeos y material escrito. La razón del 81% de los fracasos del tratamiento inicial fue el uso inadecuado (después de una comida pesada, sin la estimulación sexual, en un momento no propicio, en casos de intento único)110.
La tasa de recuperación de los fracasos al tratamiento inicial es del orden del 42-59%, lo que indica que la mitad de estos pacientes pueden ser rescatados con re-educación111.
La Asociación Europea de Urología define en consecuencia que se requiere un mínimo de 4 dosis fallidas para diagnosticar fracaso terapéutico. Se han descrito tasas de deserción hasta del 57% en 3 años112.
Reacciones adversasEl uso concomitante de inhibidores de la PDE5 y nitratos disminuye la presión arterial a cifras peligrosas; por lo tanto, está contraindicada esta combinación.
Se recomienda precaución cuando se administra un inhibidor de PDE5 en conjunto con un bloqueador alfa, ya sea para el tratamiento de la hipertensión o para la hiperplasia prostática benigna, debido a la posible potenciación del efecto hipotensor, por lo que se aconseja titular este último104.
Los inhibidores de la PDE5 tienen reacciones adversas específicas de clase. Algunas reacciones adversas típicas son dolor de cabeza, dispepsia, enrojecimiento facial, congestión nasal y alteraciones visuales en la percepción de los colores, causada por la inhibición de la PDE6. Estas reacciones adversas suelen ser leves a moderadas y transitorias.
Otra reacción adversa es la neuropatía óptica isquémica anterior no arterítica (NOIANA), que se reportó por primera vez en 2000 y atrajo la atención en 2005. La NOIANA es una enfermedad que afecta el nervio óptico, de etiología desconocida, que se presenta como un defecto del campo visual repentino y dolor (generalmente unilateral). A menudo se observa por primera vez al despertar. El examen del fondo de ojo revela hallazgos de edema del nervio óptico. La incidencia anual en los caucásicos es de 2,3 a 10,2 por cada 100.000113–116. No existen tratamientos eficaces o medidas preventivas para esta condición. Los objetivos del tratamiento son prevenir el aumento del daño del ojo afectado y proteger al no afectado. Los pacientes deben ser informados de esta reacción adversa y aconsejados para consultar a un oftalmólogo si experimentan cualquier perturbación visual.
Tratamiento de uso diarioDesde 2005, en la literatura se encuentran numerosos estudios sobre el uso crónico de los inhibidores PDE5 en modelos animales, sugiriendo un evento benéfico o aun preventivo en las alteraciones estructurales del tejido cavernoso bajo diversas condiciones, bien sea solo por edad o enfermedades crónicas con conocido efecto deletéreo sobre el tejido eréctil. Aunque en los humanos no se encuentran estudios que puedan identificar este mismo efecto debido a que sería necesaria la invasión de y la extracción de tejido ya en riesgo, sí se ha intentado evaluar de forma indirecta el beneficio del uso diario de estos medicamentos basándose en el IIEF-EF, calidad de vida y, en términos generales, la posibilidad de terminar con éxito una relación sexual.
En los primeros artículos reportados sobre tadalafilo 20mg a demanda o 10mg diarios se encontró que las 2 presentaciones del medicamento mejoraron significativamente el dominio de función eréctil del IIEF desde la base, pero además se mostró que el cambio desde la base fue significativamente mayor para la dosis diaria que para la dosis a demanda (p<0,05) y la relación sexual fue exitosa en el 69 y el 84%, respectivamente, partiendo con un 30% basal (p<0,001)117. Posteriormente los estudios se enfocaron en determinar cuál era la dosis que más se ajustaba a los requerimientos del paciente y que tuviera el mejor resultado con los menores efectos secundarios posible. Estos estudios dependientes de dosis no fueron comparativos con brazo a demanda, pero sin embargo ratificaron la eficacia del medicamento para toma crónica118,119.
No solamente se han realizado estudios con tadalafilo en uso crónico. Un estudio doble ciego controlado con placebo en grupos paralelos en pacientes con DE de leve a moderada tratados con vardenafilo 10mg diarios vs. placebo a demanda o placebo diario vs. vardenafilo 10mg a demanda encontró que el vardenafilo diario no produce efectos sostenidos en la función eréctil diferentes a los de la dosis a demanda120, sugiriendo que los IPD5 no tendrían un efecto adicional en su uso crónico sobre aquellos que se dan por evento, siendo este un hallazgo persistente en la mayoría de los estudios iniciales. Sin embargo, 2 estudios adicionales en tadalafilo y uno realizado con sildenafilo121–123 más recientes, aunque en un número menor de pacientes, demostraron que los medicamentos suministrados de forma crónica no solo tendrían el beneficio inmediato sobre la función eréctil, sino que además tendrían un efecto permanente tras suspender el medicamento sobre la erección.
En resumen, aunque el medicamento suministrado de forma crónica no ha demostrado en forma consistente en la literatura el beneficio a largo plazo sobre la función erectiva; tiene una gran efectividad sobre la función eréctil, con una tasa muy baja de efectos secundarios, y debería pensarse como primera línea no solamente en aquellos pacientes en los que sospechemos un origen vascular en la DE, sino además en los pacientes que tienen una frecuencia sexual elevada y desean mantener su espontaneidad en la relación sexual. La duración del tratamiento debe ser reevaluada periódicamente en cada paciente, al igual que la dosis final.
Tratamientos localesInyección intracavernosaEsto implica la inyección de prostaglandina E1 (PGE1) en el cuerpo cavernoso. La dosis habitual es de 5-20mg de PGE1 disuelto en 1ml de solución salina fisiológica. La PGE1 actúa produciendo un aumento de AMPc que conduce a la rigidez peneana. No precisa estimulación sexual e induce rigidez peneana entre los 5 y 10min subsiguientes. La administración intracavernosa de PGE1 produce rigidez adecuada para la penetración en más del 73% de los pacientes con DE orgánica.
La triple asociación de papaverina, fentolamina y PGE1 ha demostrado una eficacia entre el 80 y el 92%124. Este tratamiento presenta a su vez alta tolerabilidad. Los principales efectos adversos son de naturaleza local, dolor (50%) y rara vez priapismo (que se inicia de alto flujo y puede desembocar en la forma isquémica, 1%), placas fibróticas de la albugínea y los cuerpos cavernosos (2%) con el uso crónico y el hematoma/hemorragia subcutánea (8%)124,125.
Una erección rígida descarta alteración venooclusiva pero no descarta insuficiencia arterial como causa de la DE cuando se realiza el test con agente intracavernoso.
Dispositivos de constricción al vacíoEstos dispositivos de presión negativa causan estasis de sangre en los cuerpos cavernosos que se mantiene allí gracias a la aplicación de un torniquete de caucho en la base del pene, para alcanzar una erección.
Aunque no es una erección fisiológica, el pene adquiere rigidez suficiente, capaz de permitir la penetración vaginal en el 90% de los casos. Las tasas de satisfacción varían ampliamente del 27 al 94%126. Dentro de los efectos no deseados se incluyen dolor en el pene y entumecimiento, hemorragia subcutánea y problemas eyaculatorios.
La terapia anticoagulante es una contraindicación relativa para el uso de un dispositivo de erección al vacío.
En conclusión, se pueden acoger algunas conclusiones de las guías europeas sobre DE que se resumen en la tabla 4):
Resumen de conclusiones de las guías europeas sobre el tratamiento de la DE
| Nivel | Grado | |
|---|---|---|
| Cambios en estilo de vida y modificación de factores de riesgo deben preceder o acompañar el tratamiento de la DE | 1a | A |
| Los tratamientos pro erección deben ser suministrados lo más tempranamente posible después de prostatectomía radical | 1b | A |
| Cuando se encuentre una causa curable de DE debe ser tratada primero | 1b | B |
| Los inhibidores PDE5 son la primera línea de tratamiento | 1a | A |
| La prescripción incorrecta y la pobre educación del paciente son las principales causas de falla de respuesta a los inhibidores PDE5 | 3 | B |
| La inyección intracavernosa es la segunda línea de tratamiento | 1b | B |
| La prótesis peneana es la tercera línea de tratamiento | 4 | C |
Adaptado de Guía Europea de Disfunción Sexual Masculina, 2013.
El cáncer de próstata es el más frecuente de los cánceres (independientemente de los canceres de piel) en la población masculina y la segunda causa de mortalidad por cáncer, sobrepasada solamente por el cáncer gástrico, aumentando su incidencia y triplicando la mortalidad por cáncer de próstata en los últimos 30años en Colombia (datos extractados de la Liga contra el cáncer), datos que se correlacionan con los reportados en el mundo.
Debido a la variabilidad de aparición y progresión del cáncer de próstata, este es susceptible de múltiples aproximaciones y manejos en intento curativo, llevando a una tasa de mortalidad por cáncer de próstata de aproximadamente el 16%, siendo entonces la calidad de vida y el tratamiento de los efectos originados por los manejos instaurados un punto clave sobre el que la literatura se ha volcado127. La DE es un evento adverso potencial frecuente en los pacientes tratados por cáncer de próstata, y en la literatura se ha reportado una incidencia variable entre el 30 y el 87%128–130. Las tasas de DE han sido reportadas progresivamente en valores más bajos debido a la mejoría en el conocimiento de la anatomía y la introducción de técnicas preservadoras de los paquetes vasculonerviosos por Walsh131, así como otras modificaciones a la técnica, así como abordajes mínimamente invasivos como la laparoscopia o la prostatectomía laparoscópica asistida por robot.
El término rehabilitación peneana fue usado por primera vez en el 2006 por Briganti, y se define como el tratamiento médico al momento o después de la prostatectomía radical para mejorar la restauración de la función eréctil132. El concepto de la rehabilitación peneana se basa en toda la investigación realizada sobre la hipoxia en el tejido cavernoso que ocurre al perderse las erecciones espontáneas con atrofia peneana, disfunción venooclusiva y apoptosis del músculo liso descritas en parágrafos anteriores.
La documentación de la DE posradical es muy dispendiosa, ya que el periodo de recuperación varía de 24 a 40meses133 y su recuperación es un proceso multifactorial que depende de la edad del paciente, sus patologías de base, el estado de su función eréctil previo a la cirugía, la técnica quirúrgica, el tipo de abordaje y la experiencia del cirujano. El concepto de rehabilitación peneana va mucho más allá del simple manejo de la DE; es un concepto innovador que implica la mejoría de la función sexual134.
Papel de los Inhibidores PDE5El uso de los inhibidores PDE5 se justifica en los pacientes posprostatectomía radical, ya que estos incrementan los valores de cGMP, lo cual a su vez produce un efecto antifibrótico en el tejido cavernoso. La producción del cGMP es dependiente del óxido nítrico (NO). Dado que la producción del NO por la óxido nítrico sintetasa neuronal (nNOS) está deteriorada después de la cirugía, el NO es producido principalmente por la inducción de la isoforma de la óxido nítrico sintetasa (iNOS) y la óxido nítrico sintetasa endotelial (eNOS). El uso a largo plazo de los IPDE5 puede amplificar la vía de señalización del NO deprimido disminuyendo por ende la hipoxia y el proceso fibrótico135.
Es decir, en términos generales:
- 1.
Prevención del daño endotelial.
- 2.
Prevención de las alteraciones en músculo liso.
- 3.
Preservación del perfil de relajamiento del músculo liso.
- 4.
Neurorregeneración.
- 5.
Oxigenación cavernosa independiente de la erección127.
Los inhibidores PDE5 deben ser usados como manejo de primera línea en rehabilitación peneana, y aunque la literatura disponible muestra tanto resultados positivos con terapia diaria como resultados no estadísticamente significativos en relación con el uso a demanda, basándose en la teoría de la hipoxia como generador del riesgo al perder las erecciones nocturnas, está indicado el uso diario del medicamento en el postoperatorio136. Existen diferentes esquemas que generalmente comienzan al momento del retiro de la sonda antes de terminar el primer mes POP:
- 1.
Sildenafilo 50-100mg diarios136,137.
- 2.
Vardenafilo 20mg 3 veces por semana138.
- 3.
Vardenafilo 5 -10mg diarios139.
- 4.
Tadalafilo 20mg inter-diario140.
- 5.
Tadalafilo 5mg diario141,142.
Existe gran cantidad de literatura sobre sildenafilo a demanda y de uso permanente a diferentes dosis y de tadalafilo, y en su mayoría tienden a reportar el beneficio del uso crónico sobre demanda en rehabilitación peneana. La literatura sobre vardenafilo no ha demostrado su beneficio en uso permanente sobre uso a demanda120.
Inyección intracavernosa y dispositivos de vacíoLas inyecciones intracavernosas y el dispositivo de vacío pueden ser usados también como tratamiento de primera línea, ya que su mecanismo de acción no es dependiente de una transmisión neural indemne143. Debido a esta característica, algunos estudios indican que en los primeros meses del postoperatorio deberían usarse estos dispositivos o inyecciones antes de comenzar con medicamento oral. El estudio más citado para justificar su uso es el de Montorsi et al.144, que iniciando su uso a demanda un mes después de cirugía preservadora de paquetes neurovasculares reportó una alta tasa de recuperación de erecciones espontáneas después de 6 meses comparado con aquellos pacientes que no tuvieron ningún tratamiento (67% frente a 20%, respectivamente). Aunque fue un estudio criticado por no presentar control con placebo y tener definiciones de «recuperación» diferentes en los 2 grupos, tiene unos datos valiosos con una radical diferencia entre hacer una intervención terapéutica y no hacerla. Igualmente, estos hallazgos han sido corroborados posteriormente con otros estudios. En cuanto a los dispositivos de vacío, existen estudios donde se evaluó la mejoría en las erecciones espontáneas con su aplicación diaria sin encontrar datos concluyentes sobre erecciones espontáneas pero sí una diferencia significativa en la percepción de disminución del tamaño del pene (23% reportaron acortamiento en el grupo de dispositivo vs. 60% en el grupo sin dispositivo de vacío)145.
En estudios recientes de rehabilitación peneana en pacientes después de prostatectomía radical asistida por robot se encontró que el escenario ideal es el uso de IPDE5 asociado a dispositivos de vacío146.
La rehabilitación peneana es cada vez una conducta más adoptada y seguida por la comunidad urológica en el mundo debido al alto número de pacientes que ven alterada su calidad de vida no solo por el cáncer sino por las consecuencias que su tratamiento conlleva. Independientemente de que no haya una evidencia irrefutable de su beneficio, nos da la oportunidad de lograr algún beneficio para el paciente. Muchas variables afectarán el resultado final de la rehabilitación, como la edad, el estado previo, las comorbilidades asociadas, el tipo de abordaje, la experiencia del cirujano o la preservación nerviosa realizada. La mayoría de urólogos comienzan la rehabilitación tempranamente en el POP al retirar la sonda e inician con inhibidores PDE5, aunque también pueden ser usados de primera línea los dispositivos de vacío y la terapia intracavernosa. El resultado final puede no identificarse sino hasta después de 2 años de cirugía, en donde se reflejará el esfuerzo previo realizado para preservar la oxigenación peneana. La mayor limitante de la rehabilitación son sus costos y la baja adherencia de los pacientes al no ver un resultado inmediato147.
Conclusiones sobre rehabilitación peneana- 1.
Los pacientes deben ser advertidos de que puede tomar como mínimo 2 años llegar a su máxima función sexual.
- 2.
Aunque la hipoxia asociada a la flacidez puede contribuir a la DE, la etiología de la DE después de una prostatectomía radical es multifactorial.
- 3.
Existen gran cantidad de estudios sobre el efecto de la inducción de erección artificial bien sea con inhibidores PDE5, medicamentos vasoactivos intracavernosos o intrauretrales, dispositivos de vacío, etc., todos con diferentes hallazgos pero en términos generales mostrando un beneficio sobre la función sexual global; luego, es mejor realizar rehabilitación peneana que no hacerla.
- 4.
Hay datos limitados sobre la terapia intracavernosa, pero sí parece tener un efecto benéfico sobre la reaparición de las erecciones espontáneas.
- 5.
No está claro si los dispositivos de vacío tienen un efecto real sobre la aparición de erecciones espontáneas en pacientes en postoperatorio de prostatectomía radical, pero sí minimizan el posible efecto de acortamiento peneano probablemente reduciendo la fuga venosa.
- 6.
La mejoría global de la función de la célula endotelial observada con la administración crónica de inhibidores PDE5 determina un papel en este grupo de pacientes con neuropraxia después de prostatectomía radical preservadora de nervios91,148.
- 7.
Aunque no hay un esquema específico de medicamento o dosis, se aconseja usar inhibidores PDE5 de forma crónica en primera línea con o sin dispositivo de vacío. Los agentes intracavernosos pueden ser usados de primera línea o de segunda línea tras la falla del medicamento oral.
- 8.
Pese al gran número de posibles aproximaciones de rehabilitación, estos deben considerarse solo como estrategias y no como una guía, ya que no hay evidencia incontrovertible92.
- 9.
No siempre es posible regresar al estado basal en que se encontraba la erección antes de la cirugía.
- 10.
El uso de las prótesis peneanas deberá entonces aconsejarse a los pacientes que hallan fallado a este tratamiento después de como mínimo 2 años de manejo.
Bajo criterios estrictos, la cirugía vascular continúa reservada para aquellos pacientes jóvenes con un antecedente claro de trauma pélvico. Expresado en términos generales, sería en hombres jóvenes con disfunción endotelial focal y ausencia de disfunción endotelial sistémica (fig. 3).
En esta modalidad de tratamiento el éxito esperado se aproxima al 50%: el 30% presentarán erecciones espontáneas suficientes para penetrar y el 20% necesitarán tratamiento adyuvante con inhibidores de PDE5 o agentes vasoactivos. La respuesta positiva es más esperable en pacientes no fumadores. De todas maneras, la calidad de la evidencia en este tipo de tratamiento vascular es limitada, debido a la falta de aleatorización, a los seguimientos insuficientes y a las diferentes técnicas descritas. De allí que la cirugía vascular deba considerarse un procedimiento experimental tanto en las técnicas de revascularización con la arteria epigástrica, como en las formas endovasculares de angioplastia intraluminal149.
Prótesis peneanasEl consenso general ubica esta modalidad de tratamiento en tercera línea (fig. 4). Por tratarse de un procedimiento invasivo e irreversible, debe limitarse a quienes tienen un componente orgánico severo irreversible, refractario a los tratamientos orales e intracavernosos150.
Aun en estudios que incluyen DE primaria se describe notable mejoría de los cuestionarios IIEF-5 y QOL149. El índice de satisfacción en el hombre y la pareja se encuentra por encima del 90%150. Las complicaciones (infección, erosión, perforación, falla mecánica y dolor) no son comunes en seguimientos a 5 años. Las infecciones ocurren según el tipo de paciente y su comorbilidad asociada, entre el 1 y el 5%, de acuerdo con diferentes series68.
Múltiples publicaciones confirman que se trata de una alternativa eficiente y segura que conduce a altas tasas de satisfacción. Los modelos disponibles en Colombia consisten en prótesis maleables: más económicas, menos sujetas a fallas mecánicas, pero que tienen el inconveniente de que producen una erección sostenida que disminuye el grado de satisfacción. Por otro lado, se dispone también de prótesis inflables de 3 componentes, y actualmente son los modelos más recomendados. Existen diferencias puntuales entre las marcas presentes en el mercado que determinan en muchos casos la selección. Están sujetas a problemas mecánicos hidráulicos y a las complicaciones ya mencionadas.
El futuroLos avances en la medicina actual en la terapia medicamentosa, aunque excelentes y prometedores, no cumplen los objetivos de un tratamiento ideal. El tratamiento debe ir más allá en la búsqueda de la cura de la patología y el restablecimiento de la función sexual masculina. Se aproximan grandes avances no solo en el área farmacológica, sino igualmente en terapia génica, tratamiento con células madre e ingeniería tisular para la regeneración de la cédula endotelial y la recuperación del tejido cavernoso.
Conflicto de interesesDos de los miembros del comité evaluador reportaron pagos por parte de la industria farmacéutica en los últimos 5 años.
El comité evaluador manifiesta su gratitud al doctor Yasuke Kimoto, líder en disfunción eréctil de la Sociedad de Urología de Japón, del Departamento de Urología del Centro de Lesiones Espinales en Fukuoka (Japón), por la colaboración prestada; de igual forma y muy especialmente al Dr. Juan Fernando Uribe por su valiosa asesoría y revisión final de esta guía.