El grupo de trabajo recibió una invitación en agosto de 2012 para participar en la elaboración de las guías por parte de la Sociedad Colombiana de Urología a través del director de la sección de Guías clínicas e investigación Dr. Hugo Enrique López Ramos.
Ninguno de los participantes en la adaptación de la guía tiene conflictos de intereses de tipo económico personal, de un familiar o no personal. Se firmó una declaración por cada uno de los participantes.
Se utilizó el instrumento para la evaluación de guías de práctica clínica (AGREE II) para la calidad de evaluar las guías1.
Se realizó una reunión inicial donde se determinó revisar diferentes guías que incluyeron: Guía de la National Comprehensive Cancer Network, Consenso canadiense de cáncer de testículo, Guías de la European Association of Urology (EAU), Guías de cáncer testicular del grupo escocés intercolegiado de guías.
Después de evaluar las guías de acuerdo a los diferentes dominios de la herramienta AGREE II:
Dominio 1. Alcance y objetivo.
Dominio 2. Participación de los implicados o interesados.
Dominio 3. Rigor en la elaboración.
Dominio 4. Claridad en la presentación.
Dominio 5. Aplicabilidad.
Dominio 6. Independencia editorial.
Definimos la Guía de la Sociedad Europea de Urología como la que más se ajustaba a nuestras necesidades.
Procedimos entonces a realizar la adaptación de la guía siguiendo los lineamientos propuestos por la New Zealand Guideline Group2. Para tal fin convinimos una segunda reunión a la cual todos los miembros del equipo asistimos con la guía debidamente revisada y con propuestas acerca de la adaptación de la misma.
Se solicitó autorización escrita a la EAU para la adaptación de la guía. Recibimos respuesta positiva el 10 de julio de 2013.
En una reunión posterior se realizó un borrador de la adaptación y se revisó el mismo llegando al documento final.
No se incluye en la guía el manejo de tumores en niños, mujeres con tumores de células germinales, tumores extragonadales, ni tumores estromales testiculares.
La guía está dirigida a la población médica en contacto con pacientes que tengan diagnóstico de tumores testiculares como: urólogos, radiólogos, patólogos, oncólogos clínicos, médicos de dolor, medicina de rehabilitación, residentes de las áreas mencionadas y enfermeras dedicadas al manejo de los pacientes con este tipo de patología. El enfoque principal es a orientar al urólogo frente a los casos de tumores testiculares con un menor énfasis en el tratamiento con agentes citotóxicos (manejo que corresponde a oncología clínica).
IntroducciónEl cáncer testicular es poco frecuente, sin embargo es el tumor maligno sólido más común en hombres entre los 15 y 34 años. El pico de incidencia se presenta en la tercera década de la vida para las neoplasias no seminomatosas y en la cuarta década para los seminomas.
Los tumores testiculares corresponden al 1–1,5% de las neoplasias masculinas.
De acuerdo a las estadísticas de Globocan (proyecto de la organización mundial de la salud) la incidencia de tumores testiculares en Colombia es de 2 x 100 mil habitantes (y 2,8 realizando estandarización para la edad) con una mortalidad del 0,4% y prevalencia a 5 años del 2,9%. Debemos enfatizar que la calidad de la información tomada por la Organización Mundial de la Salud es catalogada como C (cubrimiento de menos del 10%)3.
Los factores de riesgo identificados incluyen: historia de criptorquidea o testículo no descendido, disgenesia gonadal (síndrome de Swyer), síndrome de insensibilidad androgénica, historia familiar de tumores testiculares en familiares en primer grado (padre-hermanos), presencia de tumor contralateral o carcinoma in situ, infertilidad, exposición a dietilestilbestrol4,5.
El diagnóstico histológico es fundamental dado que las recomendaciones de manejo están basadas en una adecuada patología del tumor primario, los hallazgos radiológicos y los marcadores tumorales.
Las tasas de curación en cáncer de testículo son excelentes. Los factores que han contribuido a esta curación han sido: la estadificación adecuada al momento del diagnóstico, tratamiento temprano basado en cirugía y combinación de agentes de quimioterapia con o sin radioterapia; asociado a un estricto seguimiento y a terapias de salvamento.
No podemos desconocer que el manejo de los tumores de testículo igual que el de los demás tumores urológicos es un esfuerzo multidisciplinario donde el urólogo, el oncólogo clínico, el radioterapeuta y el patólogo, entre otros, intervienen. El manejo en centros de referencia ha hecho que las tasas de recurrencia disminuyan6.
Clasificación histológicaLos tumores testiculares se dividen en germinales y no germinales.
Los tumores germinales corresponden al 90-95% de los casos y se componen de cinco tipos básicos de células: seminoma, carcinoma embrionario, tumor de saco vitelino, coriocarcinoma y teratoma.
Las células germinales vienen de células pluripotenciales lo que explica los diferentes elementos celulares germinales tanto en el tumor primario como en las metástasis.
Existe una división importante entre los seminomas y los tumores no seminomatosos que determina el manejo de la enfermedad locorregional y de las metástasis a distancia.
Cerca de la mitad de los tumores germinales tienen más de un tipo celular y se denominan tumores germinales mixtos.
Los tumores no germinales corresponden al 5-10% de los tumores testiculares e incluyen tumores de las células del estroma del cordón sexual (tumores de células de Sertoli-Leydig), tumores de origen linfático y hematopoyético y los tumores metastásicos (secundarios a otras neoplasias) (tabla 1).
Clasificación de los tumores testiculares (Organización Mundial de la Salud)7
| Tumores de Células Germinales |
| Lesión precursora: neoplasia germinal intratubular (Carcinoma in situ) |
| Tumores de un tipo histológico: |
| Seminoma |
| • Seminoma o variantes: seminoma con células de sincitio-trofoblasto. |
| • Seminoma espermatocítico. o Variante espermatocitica. |
| Tumores No seminomatosos |
| • Carcinoma embrionario. |
| • Tumor del saco vitelino. |
| • Tumores trofoblásticos. |
| • Coriocarcinoma |
| • Tumores trofoblásticos diferentes a carcinoma. |
| • Coriocarcinoma monofásico. |
| • Tumor trofoblastico de sitio placentario. |
| • Teratoma |
| • Quiste dermoide. |
| • Teratoma monodérmico. |
| • Teratoma con malignidad somática. |
| Tumores de más de un tipo histológico (formas mixtas) |
| • Carcinoma embrionario y teratoma (Teratocarcinoma). |
| • Teratoma y seminoma. |
| • Coriocarcinoma y teratoma / Carcinoma embrionario. |
| • Otros. |
| Tumores Misceláneos del Testículo |
| • Tumor carcinoide. |
| • Tumores de tipo epitelial ovárico. |
| • Nefroblastoma. |
| • Paraganglioma. |
| Tumores Linfoides y Hematopoyéticos |
| • Linfoma |
| • Plasmacitoma |
| • Leucemia |
| Tumores No Germinales (Tumores de células del estroma – cordón sexual) |
| Formas Puras |
| • Tumor de células de Leydig. |
| • Tumor maligno de células de Leydig. |
| • Tumor de células de Sertoli. |
| • Tumor de células de Sertoli variante rica en lípidos. |
| • Tumor esclerosante de Sertoli. |
| • Tumor de células grandes – calcificado de Sertoli. |
| • Tumor maligno de células de Sertoli. |
| • Tumor de células de la granulosa. |
| • Tipo adulto. |
| • Tipo juvenil. |
| • Tumores del grupo Tecoma/Fibroma. |
| • Tecoma. |
| • Fibroma. |
| • Tumor del cordón estromal – gonadal con diferenciación incompleta. |
| • Tumor del cordón estromal – gonadal, formas mixtas. |
| • Tumor del cordón estromal – gonadal. |
| • Tumores que contienen elementos del cordón estromal – gonadal. |
| • Gonadoblastoma. |
| • Tumores del cordón estromal – gonadal no clasificados. |
| • Tumores del ducto colector y del rafé. |
| • Adenoma. |
| • Carcinoma. |
| • Tumores secundarios (Metastásicos). |
En promedio el diagnóstico se retrasa 5 meses a partir de los síntomas iniciales y la explicación se debe a un retraso por parte del paciente en la consulta inicial y a un diagnóstico errado incialmente8.
El tumor se presenta generalmente como una masa no dolorosa unilateral escrotal (55%) o como un hallazgo incidental (<5%). En el 20% de los casos puede asociarse a dolor como primer síntoma. Ginecomastia puede presentarse en tumores no seminomatosos (1-7%)9.
Entre el 5-20% se presentan síntomas relacionados con enfermedad metastásica al momento del diagnóstico y pueden presentarse con dolor lumbar, disnea, tos, hemoptisis, anorexia, náuseas, emesis, dolores óseos y edema de miembros inferiores por oclusión de la vena cava inferior.
El exámen físico debe incluir palpación abdominal y supraclavicular en busca de masas o adenopatías.
Una masa testicular debe considerarse un tumor hasta que se pruebe lo contrario.
Estudios de imagenLa ecografía testicular se considera una extensión del examen físico y ayuda a confirmar la presencia de una masa testicular y a diferenciar de masas extratesticulares. Es un estudio económico y tiene una alta sensibilidad10.
Aunque no se requiere necesariamente la ecografía para el diagnóstico de una masa testicular (pero se recomienda aún en casos de masas clínicamente evidentes) sí existen aplicaciones útiles en casos de sospecha de masa testicular o en otros casos especiales11:
- •
Paciente con hidrocele u otras condiciones inflamatorias testiculares donde el examen físico sea limitado.
- •
Pacientes con masa en retroperitoneo con examen físico testicular normal o aquellos pacientes con elevación de marcadores tumorales (para definir la presencia de masa testicular no palpable).
- •
Hombres con infertilidad.
- •
Hombres con atrofia testicular (<12mL).
- •
Más adelante se tratarán los estudios de extensión utilizados aparte de la ecografía.
Son fundamentales en el manejo de los tumores testiculares. Sirven para el diagnóstico y estadificación. Determinan el pronóstico y ayudan a monitorear la respuesta al tratamiento y detectar recaídas11.
Los marcadores utilizados en la práctica clínica son:
- •
Alfafetoproteína (AFP) producida por las células del saco vitelino.
- •
La hormona gonadotropina coriónica humana (hCG) que está expresada por los trofoblastos.
- •
Lactato deshidrogenasa (LDH).
En el 51% de los tumores testiculares se presenta elevación de marcadores. La alfafetoproteína se aumenta en el 50-70% de pacientes con tumores no seminomatosos y la hCG en 40-60% de los mismos. Cerca del 90% de los tumores no seminomatosos presentan elevación de uno o ambos marcadores.
El 30% de los seminomas presentan elevación de la hCG durante la enfermedad.
La vida media de la alfafetoproteína es de 5 a 7 días. Otras causas de elevación de la AFP diferentes a tumores testiculares son: embarazo, ataxia-telangiectasia, tirosinemia hereditaria, toxicidad hepática a la quimioterapia, anestésicos, antiepiléticos, hepatitis y alcoholismo; cáncer broncogénico, gástrico, de páncreas y hepatocarcinoma.
Los niveles de AFP son normales en caso de coriocarcinoma puro y seminoma puro. Si se eleva en casos histológicos de seminoma puro se debe revaluar el espécimen para definir presencia de otros elementos germinales o áreas de cicatriz que sugieran tumor evanescente («burned out tumor») diferente a seminoma. Pacientes con seminomas en la histología y elevación de la AFP se clasifican como tumores no seminomatosos.
La hCG: existen dos subunidades. La subunidad alfa es homóloga a las hormonas pituitarias (hormona luteinizante, folículo estimulante y hormona estimulante de la tiroides). La subunidad beta es homóloga de la hormona luteinizante en un 70% de su cadena. Su vida media es de 24-36 h.
Por su posible reacción cruzada con la LH, condiciones que eleven la misma pueden elevar falsamente los valores de beta-hCG, ej.: hipogonadismo. Una inyección de testosterona de 200mg puede diferenciar entre las dos. Otras causas de elevación de la beta-hCG pueden ser: uso de marihuana, cáncer hepático, de páncreas, gástrico, broncogénico, mama, riñón o vejiga.
La beta-hCG se eleva en todos los pacientes con coriocarcinoma, 40-60% de pacientes con carcinoma embrionario y 10-25% de pacientes con seminoma puro.
La LDH se produce por el músculo, hígado y otros órganos y puede elevarse falsamente por hemólisis. Su elevación no es específica y se utiliza para determinar el volumen tumoral o como marcador de enfermedad avanzada.
La medición de la fosfatasa alcalina placentaria (PLAP) no se usa de forma rutinaria. Tiene utilidad en el seguimiento de pacientes con seminoma puro.
Exploración testicular y orquidectomíaLos pacientes con sospecha de tumor testicular deben ser llevados a exploración testicular vía inguinal con exteriorización del testículo y sus túnicas. La orquidectomía debe realizarse con control y división del cordón espermático a nivel del anillo inguinal interno en caso de encontrar tumor. Si el diagnóstico no es claro, se debe realizar biopsia testicular y enviar a patología por congelación para aclarar el diagnóstico y definir la conducta.
En casos de enfermedad metastásica con riesgo de muerte, puede iniciarse quimioterapia previa a la orquidectomía y realizar la misma una vez se estabilice la enfermedad.
Orquidectomía parcial (cirugía conservadora de testículo)12Es una opción en pacientes bien escogidos (pacientes con testículo único y algunos con tumores testiculares bilaterales). La intención es evitar la necesidad de suplementación hormonal y preservar la fertilidad en un número limitado de pacientes. Antes de considerar esta opción deben seguirse ciertos lineamientos para escoger el candidato ideal:
- •
Los pacientes deben tener niveles preoperatorios normales de hormona luteinizante y de testosterona.
- •
La cirugía se realiza vía inguinal siguiendo los principios oncológicos de la orquidectomía.
- •
El tumor se localiza por ecografía intraoperatoria.
- •
Utilizar isquemia fría.
- •
Los tumores deben ser pequeños, menores a 20-25mm.
- •
Realizar patología por congelación para asegurar márgenes negativos.
- •
Tomar muestras de las zonas cercanas al tumor para descartar carcinoma in situ (CIS).
- •
Considerar radioterapia para aquellos pacientes con CIS.
La orquidectomía parcial debe realizarse por personal entrenado y no se recomienda su uso rutinario.
Diagnóstico y tratamiento del carcinoma in situLa incidencia de CIS en el testículo contralateral después de la orquidectomía es aproximadamente el 9% y el riesgo de un tumor metacrónico es del 2,5%.
En general no se recomienda la biopsia del testículo contralateral a excepción de pacientes con alto riesgo de CIS contralateral: volumen testicular de <12mL, historia de criptorquídea, pobre espermatogénesis, etc. No se recomienda la biopsia en mayores de cuarenta años.
El riesgo de desarrollar tumor invasivo por progresión de CIS es 50% a 5 años13.
Los marcadores no se elevan en el CIS excepto que exista tumor invasivo concomitante.
Cuando se está definiendo qué tratamiento realizar para el CIS se debe tener en cuenta: edad, necesidad de fertilidad, estado del testículo contralateral, CIS unilateral o bilateral, presencia de atrofia testicular y posibilidad de seguimiento del paciente.
En caso de diagnóstico de CIS el tratamiento de elección para pacientes con testículo contralateral normal va a ser la orquidectomía. Pacientes hipogonádicos que requieran suplemento hormonal y pacientes con compromiso de la fertilidad también deben considerarse para orquidectomía radical.
El manejo de CIS en testículo único se realiza con radioterapia local (dosis de 16-20Gy), se alertará acerca de la infertilidad que genera el tratamiento con el fin de tomar medidas para la fertilidad previas al mismo. El tratamiento puede dilatarse en hombres que deseen hijos o realizar congelación de esperma14.
Reporte de patologíaLos especímenes quirúrgicos deben ser valorados idealmente por un patólogo entrenado en uropatología y el reporte histopatológico debe incluir:
- •
Hallazgos macroscópicos: lado y tamaño del testículo, máximo tamaño tumoral, epidídimo, cordón espermático y túnica vaginal.
- •
Muestra: mencionar los márgenes, que deben tener por lo menos 1cm de diámetro con parénquima normal. Por lo menos un corte proximal y distal del cordón espermático más alguna área sospechosa.
- •
Hallazgos microscópicos y diagnóstico.
- •
Tipo histológico: especificar los componentes de forma individual con su porcentaje, presencia o ausencia de invasión peritumoral venosa o linfática, presencia o ausencia de invasión a albugínea, túnica vaginal, rete testis, epidídimo o cordón espermático, presencia o ausencia de neoplasia de células germinales intratubular en parénquima no tumoral.
- •
De acuerdo con la clasificación patológica de tumor, nódulo, metástasis (TNM): de acuerdo al TNM del 2009.
- •
Estudios de inmunohistoquímica: en seminoma y tumores mixtos de células germinales.
La estadificación de los tumores testiculares requiere de los marcadores tumorales, estudios imagenológicos y resultado histológico después de la orquidectomía.
Se debe estudiar:
- •
Cinética de los marcadores (preorquidectomía– postorquidectomía).
- •
Estado ganglionar retroperitoneal, supraclavicular y hepático.
- •
Metástasis mediastinales o pulmonares.
- •
Estado óseo y de sistema nervioso central.
- •
(SNC) en caso de síntomas.
Los marcadores tumorales se realizan previo a la orquidectomía y se revalúan después de la misma para determinar la vida media. Su descenso en pacientes con estadio I debe realizarse hasta que se normalicen.
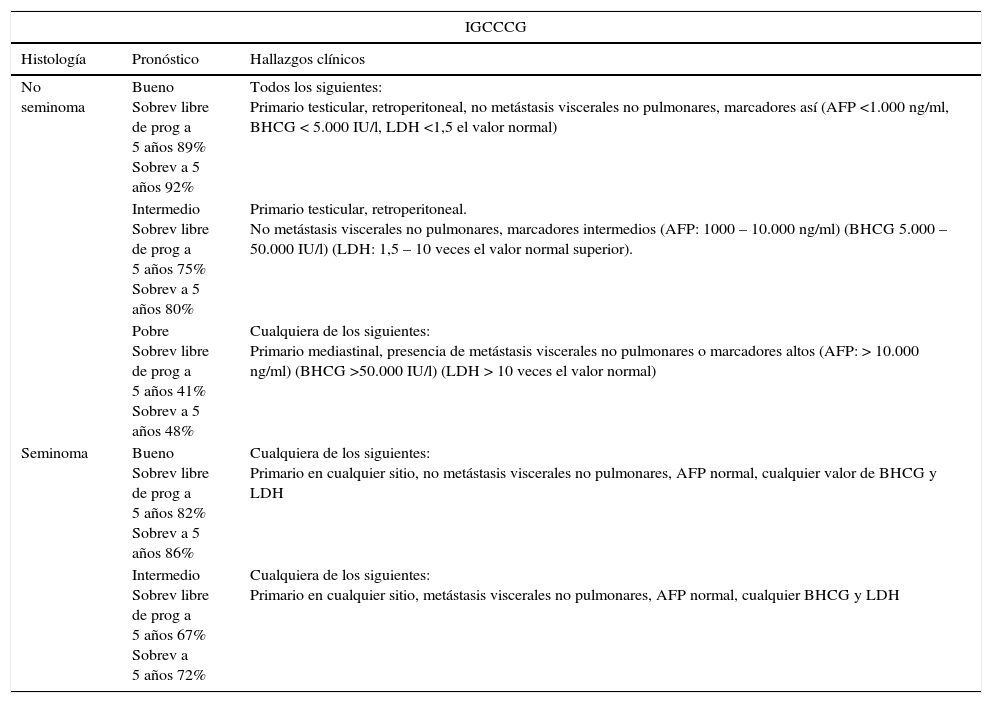
Los marcadores previos al inicio de quimioterapia en pacientes con enfermedad metastásica o marcadores persistentemente elevados son importantes para la clasificación de acuerdo al grupo colaborativo internacional de cáncer de células germinales International Germ Cell Cancer Collaborative Group (IGCCCG) el cual clasifica el riesgo15 (tabla 2).
Sistema de pronóstico para pacientes con tumores germinales metastásicos por el grupo colaborativo internacional de Cáncer de células germinales Germ Cell Cancer Collaborative Group (IGCCCG)
| IGCCCG | ||
|---|---|---|
| Histología | Pronóstico | Hallazgos clínicos |
| No seminoma | Bueno Sobrev libre de prog a 5 años 89% Sobrev a 5 años 92% | Todos los siguientes: Primario testicular, retroperitoneal, no metástasis viscerales no pulmonares, marcadores así (AFP <1.000 ng/ml, BHCG < 5.000 IU/l, LDH <1,5 el valor normal) |
| Intermedio Sobrev libre de prog a 5 años 75% Sobrev a 5 años 80% | Primario testicular, retroperitoneal. No metástasis viscerales no pulmonares, marcadores intermedios (AFP: 1000 – 10.000 ng/ml) (BHCG 5.000 – 50.000 IU/l) (LDH: 1,5 – 10 veces el valor normal superior). | |
| Pobre Sobrev libre de prog a 5 años 41% Sobrev a 5 años 48% | Cualquiera de los siguientes: Primario mediastinal, presencia de metástasis viscerales no pulmonares o marcadores altos (AFP: > 10.000 ng/ml) (BHCG >50.000 IU/l) (LDH > 10 veces el valor normal) | |
| Seminoma | Bueno Sobrev libre de prog a 5 años 82% Sobrev a 5 años 86% | Cualquiera de los siguientes: Primario en cualquier sitio, no metástasis viscerales no pulmonares, AFP normal, cualquier valor de BHCG y LDH |
| Intermedio Sobrev libre de prog a 5 años 67% Sobrev a 5 años 72% | Cualquiera de los siguientes: Primario en cualquier sitio, metástasis viscerales no pulmonares, AFP normal, cualquier BHCG y LDH | |
La persistencia de marcadores elevados después de la orquidectomía indica enfermedad metastásica (macro- o microscópica). Su normalización sin embargo no descarta completamente la ausencia de metástasis (20-50% de pacientes con enfermedad estadio I y marcadores normales pueden tener enfermedad al momento de la linfadenectomía retroperitoneal).
Hasta el 10% de los pacientes con marcadores normales después de quimioterapia pueden tener células germinales que no elevan marcadores. Durante la quimioterapia los marcadores deben descender en caso contrario se requiren otras líneas de quimioterapia (ver más adelante).
Las imágenes que se indican en la estadificación de pacientes con tumores testiculares para definir presencia o ausencia de metástasis son:
- •
Tomografía axial computarizada de abdomen y pelvis: se utiliza en la búsqueda de adenopatías retroperitoneales. Sensibilidad y valor predictivo negativo aumentan utilizando cortes de 3 mm16.
- •
Resonancia magnética de abdomen y pelvis: se utiliza en pacientes con contraindicación para la tomografía.
- •
Tomografía del tórax: es la forma más sensible de identificar lesiones a este nivel y debe hacerse en todos los pacientes con tumores testiculares pues hasta un 10% pueden presentar nódulos subpleurales pequeños no identificables por otros métodos17.
- •
Tomografía por emisión de positrones (PET-CT): utilizando fluorodesoxiglucosa no se debe utilizar en la estadificación inicial (en tumores no seminomatosos no tiene utilidad, no diferencia teratoma de fibrosis. Los pacientes con tumores no seminomatosos y masa residual posquimioterapia en caso de marcadores negativos son llevados a linfadenectomía retroperitoneal). Solo tiene utilidad demostrada para el seguimiento de pacientes con seminoma (estadio II o III) después del tratamiento y que persisten con masa residual al menos 6 semanas después de haber terminado el tratamiento con el fin de decidir tratamiento activo vs. seguimiento (tradicionalmente estos pacientes son tratados con cirugía en caso de masas mayores o iguales a 3cm o vigilancia si menores de 3 cm)18,19.
- •
En caso de sospecha de metástasis óseas o a sistema nervioso central se realizarán otros estudios: tomografía o resonancia magnética de SNC, gamagrafía ósea.
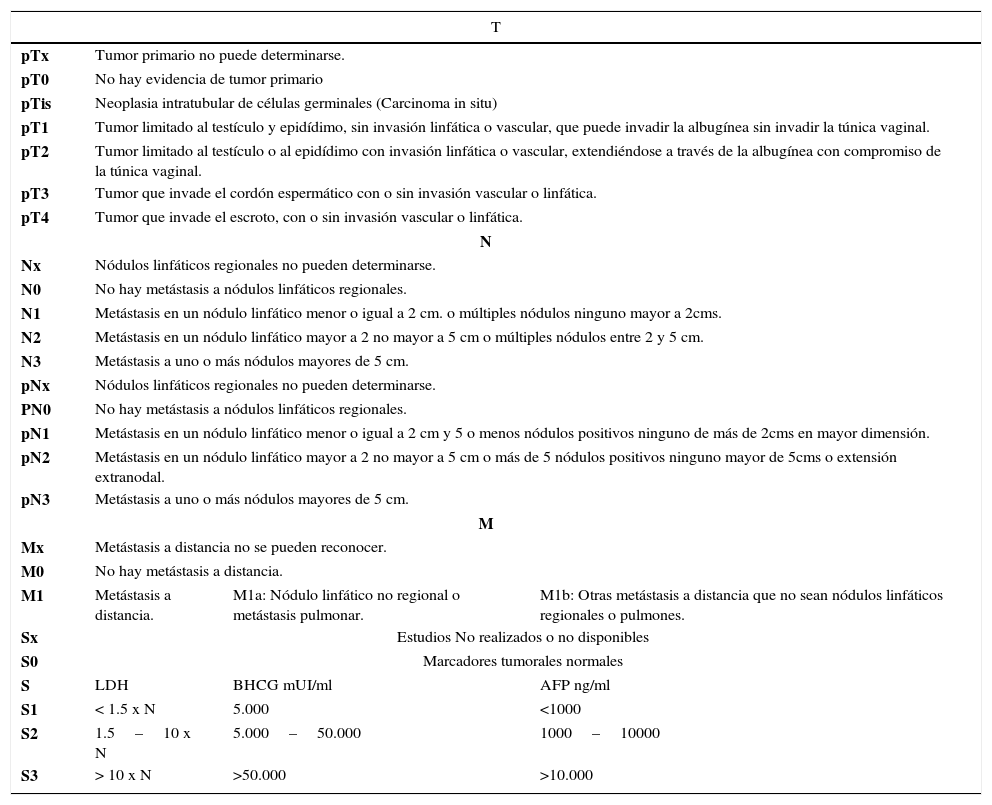
Inicialmente en 1997 y posteriormente actualizado en 2002 el American Joint Committee on Cancer adoptó un sistema de estadificación aplicable para pacientes con seminomas y tumores no seminomatosos. Este sistema incluye los marcadores para el criterio de estadificación y pronóstico20 (tablas 3 y 4).
Clasificación del TNM para cáncer testicular (UICC, 2009, 7th Ed)
| T | |||
|---|---|---|---|
| pTx | Tumor primario no puede determinarse. | ||
| pT0 | No hay evidencia de tumor primario | ||
| pTis | Neoplasia intratubular de células germinales (Carcinoma in situ) | ||
| pT1 | Tumor limitado al testículo y epidídimo, sin invasión linfática o vascular, que puede invadir la albugínea sin invadir la túnica vaginal. | ||
| pT2 | Tumor limitado al testículo o al epidídimo con invasión linfática o vascular, extendiéndose a través de la albugínea con compromiso de la túnica vaginal. | ||
| pT3 | Tumor que invade el cordón espermático con o sin invasión vascular o linfática. | ||
| pT4 | Tumor que invade el escroto, con o sin invasión vascular o linfática. | ||
| N | |||
| Nx | Nódulos linfáticos regionales no pueden determinarse. | ||
| N0 | No hay metástasis a nódulos linfáticos regionales. | ||
| N1 | Metástasis en un nódulo linfático menor o igual a 2 cm. o múltiples nódulos ninguno mayor a 2cms. | ||
| N2 | Metástasis en un nódulo linfático mayor a 2 no mayor a 5 cm o múltiples nódulos entre 2 y 5 cm. | ||
| N3 | Metástasis a uno o más nódulos mayores de 5 cm. | ||
| pNx | Nódulos linfáticos regionales no pueden determinarse. | ||
| PN0 | No hay metástasis a nódulos linfáticos regionales. | ||
| pN1 | Metástasis en un nódulo linfático menor o igual a 2 cm y 5 o menos nódulos positivos ninguno de más de 2cms en mayor dimensión. | ||
| pN2 | Metástasis en un nódulo linfático mayor a 2 no mayor a 5 cm o más de 5 nódulos positivos ninguno mayor de 5cms o extensión extranodal. | ||
| pN3 | Metástasis a uno o más nódulos mayores de 5 cm. | ||
| M | |||
| Mx | Metástasis a distancia no se pueden reconocer. | ||
| M0 | No hay metástasis a distancia. | ||
| M1 | Metástasis a distancia. | M1a: Nódulo linfático no regional o metástasis pulmonar. | M1b: Otras metástasis a distancia que no sean nódulos linfáticos regionales o pulmones. |
| Sx | Estudios No realizados o no disponibles | ||
| S0 | Marcadores tumorales normales | ||
| S | LDH | BHCG mUI/ml | AFP ng/ml |
| S1 | < 1.5 x N | 5.000 | <1000 |
| S2 | 1.5–10 x N | 5.000–50.000 | 1000–10000 |
| S3 | > 10 x N | >50.000 | >10.000 |
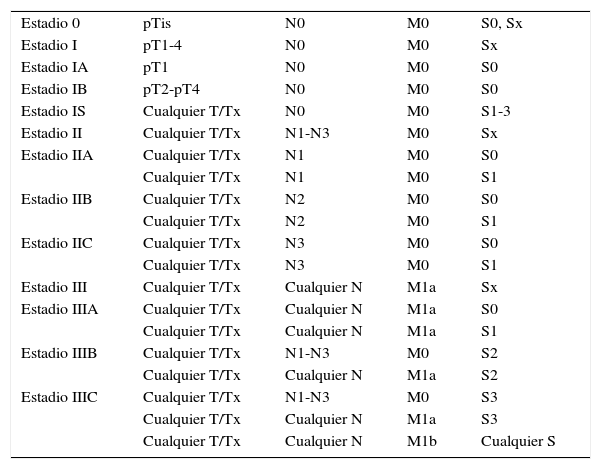
Estadios
| Estadio 0 | pTis | N0 | M0 | S0, Sx |
| Estadio I | pT1-4 | N0 | M0 | Sx |
| Estadio IA | pT1 | N0 | M0 | S0 |
| Estadio IB | pT2-pT4 | N0 | M0 | S0 |
| Estadio IS | Cualquier T/Tx | N0 | M0 | S1-3 |
| Estadio II | Cualquier T/Tx | N1-N3 | M0 | Sx |
| Estadio IIA | Cualquier T/Tx | N1 | M0 | S0 |
| Cualquier T/Tx | N1 | M0 | S1 | |
| Estadio IIB | Cualquier T/Tx | N2 | M0 | S0 |
| Cualquier T/Tx | N2 | M0 | S1 | |
| Estadio IIC | Cualquier T/Tx | N3 | M0 | S0 |
| Cualquier T/Tx | N3 | M0 | S1 | |
| Estadio III | Cualquier T/Tx | Cualquier N | M1a | Sx |
| Estadio IIIA | Cualquier T/Tx | Cualquier N | M1a | S0 |
| Cualquier T/Tx | Cualquier N | M1a | S1 | |
| Estadio IIIB | Cualquier T/Tx | N1-N3 | M0 | S2 |
| Cualquier T/Tx | Cualquier N | M1a | S2 | |
| Estadio IIIC | Cualquier T/Tx | N1-N3 | M0 | S3 |
| Cualquier T/Tx | Cualquier N | M1a | S3 | |
| Cualquier T/Tx | Cualquier N | M1b | Cualquier S |
La clasificación S de el TNM está basada en el valor nadir de la HCG y alfa fetoproteína después de la orquidectomía.
Los niveles de marcadores se deben medir previo a la orquidectomía pero los niveles después de la misma son los utilizados para dar la categoría S del TNM. La categoría IS entonces requiere elevación persistente de los marcadores después de la orquidectomía.
En 1997 el grupo colaborativo internacional de cáncer de células germinales IGCCCG basados en la identificación de factores de riesgo adversos desarrolla un sistema de estadificación para tumores metastásicos. Este sistema se ha incorporado al TNM y utiliza localización del tumor primario, localización de las metástasis y nivel de marcadores prequimioterapia como factores de pronóstico para categorizar los pacientes en pronóstico bueno, intermedio o pobre. Los marcadores que se toman para definir el pronóstico de acuerdo a la clasificación de la IGCCCG son los marcadores postorquidectomía y previos el primer ciclo de quimioterapia15 (tabla 2).
Todo paciente con diagnóstico de masa testicular sospechosa de tumor debe tener:
- •
Marcadores tumorales (AFP, Beta-hCG, LDH).
- •
Tomografía abdomino-pélvica.
- •
Tomografía de tórax.
- •
Ecografía testicular bilateral.
- •
Opcional de acuerdo a síntomas:
Gamagrafía ósea. Tomografía o resonancia de sistema nervioso central.
De acuerdo al caso, se recomienda:
- •
Estudios de fertilidad: testosterona total, hormona luteinizante, hormona folículo estimulante, espermograma.
A todos los pacientes se les debe ofrecer la opción de banco de semen. En caso de criopreservación esta debe realizarse preferiblemente antes de la orquidectomía y obviamente antes de la quimioterapia.
Factores de riesgo (pronóstico)Para los tumores no seminomatosos estadio I, está bien establecido como factores de riesgo de enfermedad metastásica ocultas: la invasión vascular o linfática del tumor primario (es el más importante), la rata de proliferación, o el porcentaje de carcinoma embrionario. Estos dos últimos aumentan la probabilidad cuando se encuentran en pacientes con invasión linfovascular21.
En tumores seminomatosos estadio I existen algunos factores de riesgo para predecir enfermedad metastásica oculta, aunque estos no están validados de forma prospectiva. Son tumores mayores de 4cm con invasión de la rete testis.
Sin embargo, la ausencia de estos marcadores indica una baja probabilidad de recurrencia22.
Estudios recientes dan menos peso a estos factores de riesgo en los pacientes con seminoma23.
TratamientoTratamiento de los seminomasCerca del 70% de los pacientes con seminomas puros se presentan con estadio I de la enfermedad. Aquellos con enfermedad metastásica la hacen a retroperitoneo (20%) y una minoría (10%) a pulmón y a sitios viscerales. El 90% de los pacientes con seminoma metastásico tienen buen pronóstico de acuerdo a la clasificación de la ICCCG. Los seminomas, sin embargo, pueden ser mortales, la mayoría de los pacientes que mueren tienen enfermedad metastásica hepática y pulmonar al momento de la muerte, 50% metátasis óseas y 25% a sistema nervioso central.
Seminoma estadio IEl 15% de los pacientes con seminoma estadio I tienen metástasis ocultas al momento del diagnóstico (principalmente en retroperitoneo) y estos son los que recaerán después de la orquidectomía si no realizamos ningún tratamiento después de la misma.
Opciones de manejo: vigilancia, adyuvancia con quimioterapia, adyuvancia con radioterapia.
- •
Vigilancia: la probabilidad de recaída a 5 años en seminomas estadio I es de aproximadamente 15 a 20%. En pacientes con tumores menores o iguales a 4cm y sin invasión de la rete testis la probabilidad de recaer es de aproximadamente 6%24,25.
La mayoría de las recaídas se presentan en el retroperitoneo, el promedio de tiempo a la recaída es de 12 a 18 meses.
Es importante el seguimiento a largo plazo, pueden existir recaídas después de 5 años.
Las recaídas de pacientes en vigilancia pueden tratarse con quimioterapia. Sin embargo el 70% de los pacientes presentan recaídas de bajo volumen que se pueden manejar con radioterapia y en caso de falla el rescate puede realizarse con quimioterapia.
La sobrevida cáncer específica de las series de vigilancia son de 97-100% en centros con experiencia.
Desventaja del seguimiento es la necesidad de imágenes repetidas (pues muchos pacientes no pueden ser seguidos con marcadores debido a que estos son negativos en estos pacientes).
La ventaja principal de la vigilancia es evitar el sobretratamiento. Se debe escoger el paciente de forma adecuada (paciente confiable para el seguimiento).
- •
Adyuvancia con quimioterapia: un estudio reciente prospectivo de la Organización Europea para la Investigación y Tratamiento del Cáncer que comparó un ciclo de carboplatino con radioterapia adyuvante a 5 años sin evidencia de recurrencia en 94,7% del brazo de quimioterapia y 96% en el de radioterapia26.
Estudios previos prospectivos no aleatorizados han mostrado buena respuesta con dos ciclos de carboplatino.
- •
Adyuvancia con radioterapia: los seminomas son altamente radiosensibles. La dosis recomendada actualmente en adyuvancia es de 20-24Gy.
La zona a irradiar es el área paraaórtica u otro esquema es área paraaórtica más los ganglios linfáticos iliacos ipsilaterales (conocida como «pata de perro» o «bastón de hockey»). En un estudio aleatorizado se compararon ambas áreas y se definió la radioterapia al área paraaórtica como estándar27.
El riesgo de recaída después de radioterapia es del 0-7%. El principal temor de la radioterapia es la posibilidad de tumores secundarios radioinducidos28. La tendencia es cada vez mayor a realizar vigilancia en estos pacientes.
En pacientes en los que se defina dar adyuvancia (o en los que se defina dar tratamiento activo, en estadios metastásicos) tener en cuenta las contraindicaciones de la radioterapia: radioterapia abdominal previa, enfermedad inflamatoria intestinal, riñón en herradura. En estos pacientes si se define dar tratamiento activo, la quimioterapia será la opción.
Tratamiento de los seminomas metastásicosSeminoma estadio IIA/B (enfermedad metastásica de bajo volumen)El tratamiento de elección para estos pacientes es la radioterapia. La dosis utilizada es de 30Gy para los tumores IIA y 36Gy para los IIB.
El área de irradiación incluye: paraaórtica y el campo iliaco ipsilateral. Y se recomienda un margen de seguridad lateral a nivel de los ganglios metastásicos de 1cm a 1,5cm en los tumores IIB.
Las tasas de sobrevida libre de recaída son de 92% en el IIA y 90% en el IIB29.
A pacientes que recaen se les da tratamiento de salvamento con quimioterapia basada en platinos.
En pacientes con estadio IIB la quimioterapia utilizando 4 ciclos de etopósido (EP) más cisplatino o 3 ciclos de cisplatino más EP más bleomicina en pacientes de buen pronóstico son alternativas a la radioterapia. Resultados de ambos esquemas son similares30.
En pacientes con enfermedad metastásica IIB cerca al hilio renal la quimioterapia tendría la ventaja sobre la radioterapia de evitar dosis de radioterapia a esta área anatómica.
Seminoma estadio IIC/IIIPacientes con tumores IIC (N3, ganglios mayores de 5cm) tienen una posibilidad de recaída mayor al 50%.
El tratamiento se basa en quimioterapia y de acuerdo a la clasificación de riesgo de la IGCC-CG se define el esquema y número de ciclos.
Todos los pacientes con seminomas IIC o III se consideran de riesgo favorable excepto pacientes con estadio III con metástasis viscerales no pulmonares (hueso, hígado, SNC) que se consideran de riesgo intermedio.
Para pacientes de riesgo favorable se recomienda 3 ciclos de BEP o 4 ciclos de EP. Para pacientes de riesgo intermedio se recomiendan 4 ciclos de BEP.
Nota: se utilizan los mismos principios que para los pacientes con tumores no seminomatosos metastásicos.
Manejo posquimioterapia de los seminomas metastásicosPacientes con marcadores negativos y sin masas residuales o con masas residuales menores de 3cm no requieren otro tratamiento. Se dejan en vigilancia (ver más adelante).
Pacientes con tumores residuales de más de 3cm y marcadores negativos. Se recomienda PET-CT con fluorodesoxiglucosa, para definir persistencia de la enfermedad después de quimioterapia.
El PET-CT debe realizarse después de un mínimo de 6 semanas de terminada la quimioterapia con el fin de disminuir la posibilidad de falsos positivos. Si el PET es negativo se deja en vigilancia. Si el PET es positivo, considerar linfadenectomía retroperitoneal. Si no es posible, otra opción es quimioterapia de segunda línea. (El tratamiento de segunda línea de quimioterapia es igual al de los pacientes con tumores no seminomatosos; ver más adelante.)
En masas residuales de menos de 3cm la utilización del PET es opcional18.
En pacientes que progresan está indicada la terapia de salvamento (quimioterapia, cirugía de salvamento, radioterapia). En caso de elevación concomitante de la hCG en seminomas que progresan después de quimioterapia de primera línea deben tratarse como quimioterapia de salvamento (o radioterapia en caso de poco volumen tumoral). Paciente con progresión sin elevación de la hCG deben llevarse a verificación histológica (biopsia o cirugía abierta) previo a tratamiento con quimioterapia de salvamento.
Tratamiento de los tumores no seminomatososTumores no seminomatosos estadio IHasta el 30% de los pacientes con tumores germinales no seminomatosos tienen metástasis ocultas y recaerán tras la orquidectomía si no se hace tratamiento activo. Las recaídas se presentan en el retroperitoneo el 60%. Es importante enfatizar que hasta el 30-40% de los pacientes pueden tener marcadores negativos al momento de la recaída.
- •
Vigilancia: la mayoría de las recaídas (80%) se presentan a los 12 meses de seguimiento, 12% en el segundo año y 6% en el tercero disminuyendo a 1% en los años 4 y 531.
La presencia de invasión microscópica vascular o linfática en el tumor primario, es el factor de predicción de recaída más importante, si hay invasión (alto riesgo) existe un 50% de riesgo de recaída, si no hay invasión (bajo riesgo) el riesgo de recaída es del 15-20%, la ausencia de invasión, confiere un valor predictivo negativo del 77%.
El paciente óptimo para vigilancia será aquel con enfermedad T1 clínica, N0, M0, S0 con bajo porcentaje de tumor embrionario y sin invasión linfovascular.
Es una opción en pacientes sin factores de riesgo (ver más arriba factores de riesgo) para enfermedad metastásica, que cumplan con el seguimiento y que conozcan las implicaciones del tratamiento en caso de recaer durante la vigilancia.
- •
Quimioterapia primaria: el riesgo de recaída en pacientes con tumores testiculares no seminomatosos con factores de riesgo es de aproximadamente el 50%. Diferentes estudios han mostrado la efectividad de 2 ciclos de PEB (cisplatino más etopósido más bleomicina) con riesgo de recaída de 2 a 4% posterior32.
No se conoce el efecto a largo plazo de dos ciclos de quimioterapia y debe considerarse cuando se defina que el paciente se beneficia de la misma.
El estudio del Swedish Norwegian Testicular Cancer Group (SWENOTECA) que comparó quimioterapia vs. vigilancia activa, en pacientes con tumores no seminomatosos Estadio I de acuerdo a la presencia o ausencia de invasión linfovascular aleatorizó los pacientes a uno o dos ciclos de PEB. Y a aquellos sin invasión linfovascular se aleatorizaron a un ciclo de PEB o vigilancia. A 4,7 años de seguimiento el 3,2% de los pacientes con invasión linfovascular recayeron y 1,3% de aquellos sin invasión vs. el 14,5% de los pacientes en vigilancia. No se recomienda todavía la utilización de un solo ciclo (excepto en protocolos de investigación), pues no se ha probado que sea superior a dos ciclos33.
- •
Linfadenectomía retroperitoneal (primaria): es una opción en pacientes con estadio I que tengan riesgo alto de albergar micrometástasis. La linfadenectomía es diagnóstica y terapéutica y asegura el retroperitoneo. Son raras las recaídas después de la cirugía en estos pacientes. Las desventajas son el riesgo de eyaculación retrógrada.
Un estudio reciente del grupo alemán de estudio en cáncer testicular comparó la linfadenectomía retroperitoneal primaria con un ciclo de BEP con una ventaja en disminución de recurrencias a favor de la quimioterapia (con críticas acerca de la calidad de la linfadenectomía retroperitoneal pues un porcentaje de estas fueron realizadas en hospitales comunitarios con bajo volumen de linfadenectomía retroperitoneal). Se requiere mayor seguimiento para definir la superioridad de la quimioterapia34.
El seguimiento después de linfadenectomía retroperitoneal es menos intenso en cuanto a número de tomografías abdominales.
Tumores no seminomatosos estadio IS (marcadores persistentemente elevados)El manejo de estos pacientes es controversial. Se recomienda tratamiento con tres ciclos de PEB (especialmente en pacientes con presencia de invasión linfovascular). Puede usarse también 4 ciclos de EP y seguimiento igual a estadio IB después de quimioterapia o tras linfadenectomía retroperitoneal.
Recomendaciones para pacientes con tumores no seminomatosos estadio I:
- •
Realizar tratamiento basado en el riesgo de pacientes con invasión linfovascular se recomienda tratamiento y a aquellos sin invasión linfovascular se recomienda vigilancia (individualizar de acuerdo al paciente).
- •
Estadio IA (pT1 sin invasión linfovascular).
- -
Si es un paciente que se pueda vigilar o realizar vigilancia estrecha por al menos 5 años.
- -
Paciente que no pueda seguirse o que no desee esta conducta puede ofrecerse qumioterapia o linfadenectomía retroperitoneal. (Si hay nódulos positivos en linfadenectomía, considerar 2 ciclos de PEB).
- -
- •
Estadio IB (pT2-4 de alto riesgo):
- -
Quimioterapia (2 ciclos de PEB).
- -
Vigilancia o linfadenectomía retroperitoneal sigue siendo una opción en aquellos que no deseen quimioterapia.
- -
Si en la linfadenectomía se evidencia estadio II, dar ciclos extra de quimioterapia.
- -
El tratamiento inicial en los tumores no seminomatosos estadio II se realiza con quimioterapia, 3 ciclos de BEP o 4 ciclos de EP.
Para los pacientes con marcadores negativos después de orquidectomía y estadio II la linfadenectomía retroperitoneal es una opción (considerar realizar linfadenectomía bilateral con preservación nerviosa en estos casos). Los pacientes con estadio IIB son candidatos a linfadenectomía retroperitoneal solo si las metástasis se encuentran
en el área retroperitoneal primaria de acuerdo al lado. Si hay metástasis multifocales o ganglios por fuera de las zonas primarias de metástasis se recomienda quimioterapia35.
También es una opción la vigilancia para clarificar el estadio. Si se determina realizar vigilancia, se debe realizar seguimiento a las 6 semanas para documentar si la lesión crece, se estabiliza o disminuye de volumen. Si la lesión disminuye de tamaño probablemente se trata de una lesión benigna y puede continuar observándose. Una lesión que aumenta de tamaño o se estabiliza indica teratoma o un tumor maligno indiferenciado. Si la lesión crece sin incremento de marcadores tumorales se debe llevar a linfadenectomía retroperitoneal por la sospecha de teratoma (esta debe realizarse en centros con experiencia en linfadenectomía retroperitoneal).
Pacientes en los cuales hay aumento de la masa y aumento de los marcadores requieren quimioterapia con PEB de acuerdo a las recomendaciones de la IGCCCG.
Pacientes que no deseen quimioterapia (en presencia de marcadores negativos) existe la opción de linfadenectomía retroperitoneal y quimioterapia adyuvante (dos ciclos de PEB) de acuerdo al resultado de la patología (estadio patológico IIA/B).
Tratamiento de los tumores testiculares avanzados-metastásicosEl tratamiento de elección en pacientes con enfermedad avanzada son tres ciclos o cuatro ciclos de PEB de acuerdo a la clasificación de riesgo de la IGCCCG21.
Para pacientes de pronóstico favorable (aquí se incluyen pacientes con estadio IS, IIA y IIB con persistencia de elevación de marcadores; IIC y IIIA) de acuerdo a la clasificación de la IGCCCG el tratamiento estándar son tres ciclos de PEB. Únicamente para pacientes muy seleccionados (con contraindicación para utilización de bleomicina) se utilizan 4 ciclos de EP.
Para pacientes en el grupo de riesgo intermedio (IIIB) y riesgo alto (IIIC) de la clasificación de IGCCCG el tratamiento estándar son 4 ciclos de PEB. Una alternativa es el esquema con etopósido más ifosfamida más cisplatino (ICE) que comparativamente tiene la misma efectividad pero mayor toxicidad.
Pacientes de pobre pronóstico deben tratarse en centros de referencia. La literatura demuestra mejores resultados en centros de alto volumen36.
Reestadificación y tratamiento posteriorNuevas imágenes (tomografía de tórax, abdomen y pelvis) más nuevos marcadores se realizan al finalizar el tratamiento.
Si hay disminución del valor de los marcadores, pero aumento del volumen de las metástasis está indicado resecar el tumor.
Si después de dos ciclos de quimioterapia hay aumento de marcadores se indica cambio de terapia temprana (considerar estudios de investigación).
Pacientes con niveles bajos de hCG después del tratamiento deben observarse hasta la completa normalización.
Paciente con niveles bajos de alfafetoproteína después de quimioterapia y con masa residual se sugiere tratamiento quirúrgico y monitoreo de los niveles de alfafetoproteína.
Quimioterapia de salvamento se indica si se documenta aumento de marcadores tumorales.
Resección de masa residual(Ver Manejo de masas residuales de seminomas, mas arriba.)
En pacientes con tumores no seminomatosos y respuesta completa después de quimioterapia no está indicada la linfadenectomía retroperitoneal37.
En caso de lesiones residuales visibles con marcadores negativos en pacientes con tumores no seminomatosos, la resección está indicada (linfadenectomía retroperitoneal bilateral). Los pacientes se llevan a linfadenectomía entre 4 a 6 semanas después de terminada la quimioterapia. El 10% de los pacientes con tumores no seminomatosos contienen tumor viable, 50% teratoma y 40% fibrosis.
Es importante enfatizar que en estos casos el PET-CT no tiene ninguna utilidad.
Realizar resección únicamente de la masa no tiene utilidad (se debe llevar a linfadenectomía retroperitoneal bilateral). Algunos estudios recientes muestran cómo la linfadenectomía unilateral podría ser equivalente. Mientras esto no sea completamente validado la recomendación será llevar los pacientes con masa residual posquimioterapia y marcadores negativos a linfadenectomía retroperitoneal bilateral38.
La linfadenectomía retroperitoneal posquimioterapia debe realizarse en centros especializados pues requiere no solo entrenamiento sino el trabajo multidisciplinario para lograr resecciones oncológicas de buena calidad. En un porcentaje importante se requiere resección de otros órganos y resecciones vasculares requiriendo el trabajo concomitante con cirujanos vasculares, cirujanos hepatobiliares, cirugía de tórax, etc.
Quimioterapia de consolidación después de cirugíaTras la linfadenectomía retroperitoneal, si la patología final reporta necrosis o teratoma inmaduro no se requiere de otros tratamientos.
En caso de tumor viable se recomiendan dos ciclos más de quimioterapia basada en platinos.
En pacientes con resección de tumores que comprometen menos del 10% del volumen total de tejido resecado especialmente en pacientes con pronóstico inicial favorable. La tasa de recaídas es muy baja y la quimioterapia adyuvante no previene recaídas posteriores. El pronóstico se deteriora cuando se encuentra masa residual después de quimioterapia de segunda o tercera línea.
Tratamiento sistémico de salvamento para recaídas o enfermedad refractariaEl 50% de los pacientes que recaen tras la primera línea de quimioterapia pueden ser rescatados con regímenes basados en platinos con una respuesta del 50%. Se utiliza para el salvamento con cuatro ciclos de cualquiera de estos:
- •
Etopósido, ifosfamida, cisplatino (PEI/ICE).
- •
Paclitaxel, ifosfamida, cisplatino (TIP).
- •
Vinblastina, ifosfamida, cisplatino (VIP).
Deben considerarse estudios de investigación para estos pacientes.
En estos pacientes puede utilizarse el score pronóstico IGCCCG-2 para determinar la sobrevida libre de progresión39.
Recaídas tardíasSon las que se producen dos años o después del tratamiento con quimioterapia en pacientes con tumores no seminomatosos. Se recomienda resección de lesiones visibles si técnicamente es posible, independientemente del valor de los marcadores tumorales. La excepción serían pacientes con aumento rápido de la hCG en los cuales puede darse quimioterapia de salvamento previo a la resección.
Si las lesiones no son resecables deben biopsiarse para orientar el tratamiento con quimioterapia. Si hay respuesta al tratamiento llevar a cirugía cuando sea posible.
En caso de tumores irresecables pero localizados considerar radioterapia.
Cirugía de salvamentoLos tumores residuales después de quimioterapia de salvamento deben ser resecados.
En caso de progresión de los marcadores después de tratamiento de salvamento y cuando no existen otras opciones de tratamiento con quimioterapia se puede considerar linfadenectomía retroperitoneal, denominada de «desesperación» y se debe considerar cuando la resección de los tumores es factible40.
Tratamiento de las metástasis a SNCGeneralmente ocurren cuando se presenta recaída sistémica. La sobrevida a largo plazo es pobre. El tratamiento inicial es con quimioterapia y puede utilizarse radioterapia de consolidación.
Cirugía solo se considera en casos de lesiones únicas, de acuerdo al estado sistémico, la localización del tumor primario y de la metástasis.
Seguimiento después de terapia curativa- •
La mayoría de las recurrencias se presentan en los primeros dos años y por esto el seguimiento es más frecuente.
- •
Existen recurrencias después de 5 años por esto el seguimiento anual debe continuarse.
- •
Después de linfadenectomía retroperitoneal recaídas a este nivel son raras, más frecuentes en el tórax.
- •
La tomografía del tórax tiene mayor valor predictivo positivo para el seguimiento que la radiografía de tórax.
Los resultados del tratamiento dependerán del volumen tumoral. Por esto el diagnóstico temprano de las recaídas puede hacer la diferencia.
Seguimiento de tumores no seminomatosos estadio ISeguimiento mínimo para pacientes posquimioterapia adyuvante o linfadenectomía retroperitoneal (estadio I)| Examen físico | 4 veces | 4 veces | Anual | Anual |
| Marcadores tumorales | 4 veces | 4 veces | Anual | Anual |
| RX de tórax | 2 veces | 2 veces | ||
| TAC abdomen | 1 vez | 1 vez |
Tomado de: Albers et al.41.
| Procedimiento | Año 1 | Año 2 | Año 3 – 5 | >5 Años |
|---|---|---|---|---|
| Examen físico | 4 veces | 4 veces | 2 por año | Anual |
| Marcadores | 4 veces | 4 veces | 2 por año | Anual |
| Rx de tórax | 4 veces | 4 veces | 2 por año | Anual |
| TAC abdomino-pélvico | 2 veces | 2 veces | Según indicación | Según indicación |
| TAC tórax | Según indicación | Según indicación | Según indicación | Según indicación |
| TAC de cráneo | Según indicación | Según indicación | Según indicación | Según indicación |