Las aflatoxinas (AF) son metabolitos secundarios tóxicos principalmente de los hongos Aspergillus flavus y A. parasiticus, son potentes mutágenos y cancerígenos de alimentos y la exposición del hombre a ellas es continuo. Las AF se ligan al ADN, ARN y proteínas formando aductos AFB1-ADN que se acumulan por años y dañan desde los virus hasta el hombre. Es importante identificar y cuantificar estos aductos como biomarcadores de largo tiempo de riesgo de enfermedad, ya que originan mutaciones y cáncer, y están validados en animales y humanos. Las AF se activan en presencia del citocromo P450 como una molécula inestable 8,9 epóxido AFB1, que se liga al N7 de la guanina, y se transforma en los cancerígenos activos o aductos AFB1-Gua y, finalmente, en los aductos AFB1-FAPY y son una medida objetiva de la exposición humana a cancerígenos ambientales. Los aductos representan la exposición, absorción, distribución, metabolismo, reparación del ADN y cambio celular. Los temas tratados aquí son la formación de aductos AFB1-ADN, estudios in vitro e in vivo, exposición a una dieta con AFB1, efectos, desarrollo de cáncer y mutaciones en el gen supresor p53, rutas de exposición, vitaminas, tipos de aducto AFB1-ADN, metodología y su control.
Aflatoxins (AF) are secondary toxic metabolites formed mainly by the molds Aspergillus flavus and A. parasiticus; they are potent mutagens and carcinogens of foods, and human exposure to them is continuous. AF bind to DNA, RNA and proteins forming AFB1-DNA adducts that accumulate for years and damage from viruses to humans. To identify and quantify the chemical reactions and molecular biology of these adducts is of primary importance because they are long-term biomarkers validated as a source of mutagenicity and risk of cancer in animals and humans. The cytochrome P450 activates AF as an unstable molecule called 8,9 AFB1 epoxide, that binds mainly to the N7 of the guanine nucleotide forming adducts that are the active carcinogens themselves and, as biomarkers, an objective measure of human exposure to environmental carcinogens. Adducts represent an integration of exposure, absorption, distribution, metabolism, DNA repair, and cell turnover. The different issues presented here are the formation of AFB1-DNA adducts, in vitro and in vivo studies, dietary AFB1 exposure, effects, development of human cancer and mutations in the p53 tumor suppressor gene, the effect of diet, routes of exposure, vitamins, kinds of AFB1-DNA adducts, methodology used for their study and their control.
La palabra “aflatox in a” viene de a = Aspergillus, fla = flavus y toxina = veneno. Las aflatoxinas (AF) son metabolitos secundarios que corresponden químicamente a bis dihidro-furano-cumarinas. Las A F se descubrieronen Gran Bretañaen 1960, después de la muerte de 100,000 pavos alimentados con cacahuate contaminado con el moho Aspergillus flavus y AF provenientes de Brasil.
Hongos productores de aflatoxinas y condiciones de producciónLos 3 principales hongos o mohos que producen a las AF son Aspergillus flavus Link, Aspergillus parasiticus Speare y Aspergillus nomius Kurtzman con propiedades bien conocidas [1,2]. Los cereales se invaden con hongos en el campo desde la semilla hasta la post-cosecha, transporte y almacén. Los hongos reducen la viabilidad, cualidades nutricionales y sanitarias de los granos y semillas.
Los mohos aflatoxicógenos[3] crecen de 8 a 55 °C con temperaturas óptimas de 36 a 38 °C, la producción de AF se inicia de 11 a 14 °C cesando a menos de 10 °C o a más de 45 °C, la producción óptima de AF va de 25 a 35 °C[4]. La producción de AF se favorece según el sustrato, por factores bioquímicos, biológicos y ambientales a una humedad de 10-20% y a una humedad relativa de 70-90%, equivalente a un contenido de humedad del grano de 16.5 a 18%. Las AF se pueden producir en condiciones de campo o almacén al quinto día y disminuyen al octavo. La presencia de hongos aflatoxicógenos no significa la existencia de AF[4]. Las especies productoras de AF de Aspergillus requieren estar en cultivos puros, pues A. chevalieri, A. candidus y A. niger, compiten e interfieren con ellos, y se han usado como control biológico[3,4].
OcurrenciaLos hongos son capaces de colonizar y producir AF en diferentes medios como son los alimentos para animales y para humanos. Las AF son toxinas de alimentos y la exposición del hombre a ellas es continuo, están en cereales (maíz, arroz, trigo, sorgo, cebada, avena, milo, centeno y sus productos derivados como tortillas, cereales para el desayuno, harinas, pastas, etc.), en semillas oleaginosas (cacahuate, nueces, avellanas, pistaches, piñones, semillas de girasol, de algodón, ajonjolí y almendras), en especias (chiles, condimentos, paprika, comino, mostaza, etc.)[4], higos y frutas secas. Las AF son las micotoxinas más tóxicas y dañan a todos los animales (ganado bovino, aviar, equino, porcino, peces, ratas y mascotas como perros y gatos, etc.). Contaminan los productos derivados como huevos, lácteos (leche, yogurt, quesos y crema), también derivados cárnicos como salami, jamón, pechugas de pollo, pathés, embutidos y cervezas, en alimentos balanceados para animales y humanos[4,5] y sólo hay trazas en vinos. La contaminación por AF en alimentos se produce en almacenes, especialmente si la cosecha está húmeda o en las camas de las aves.
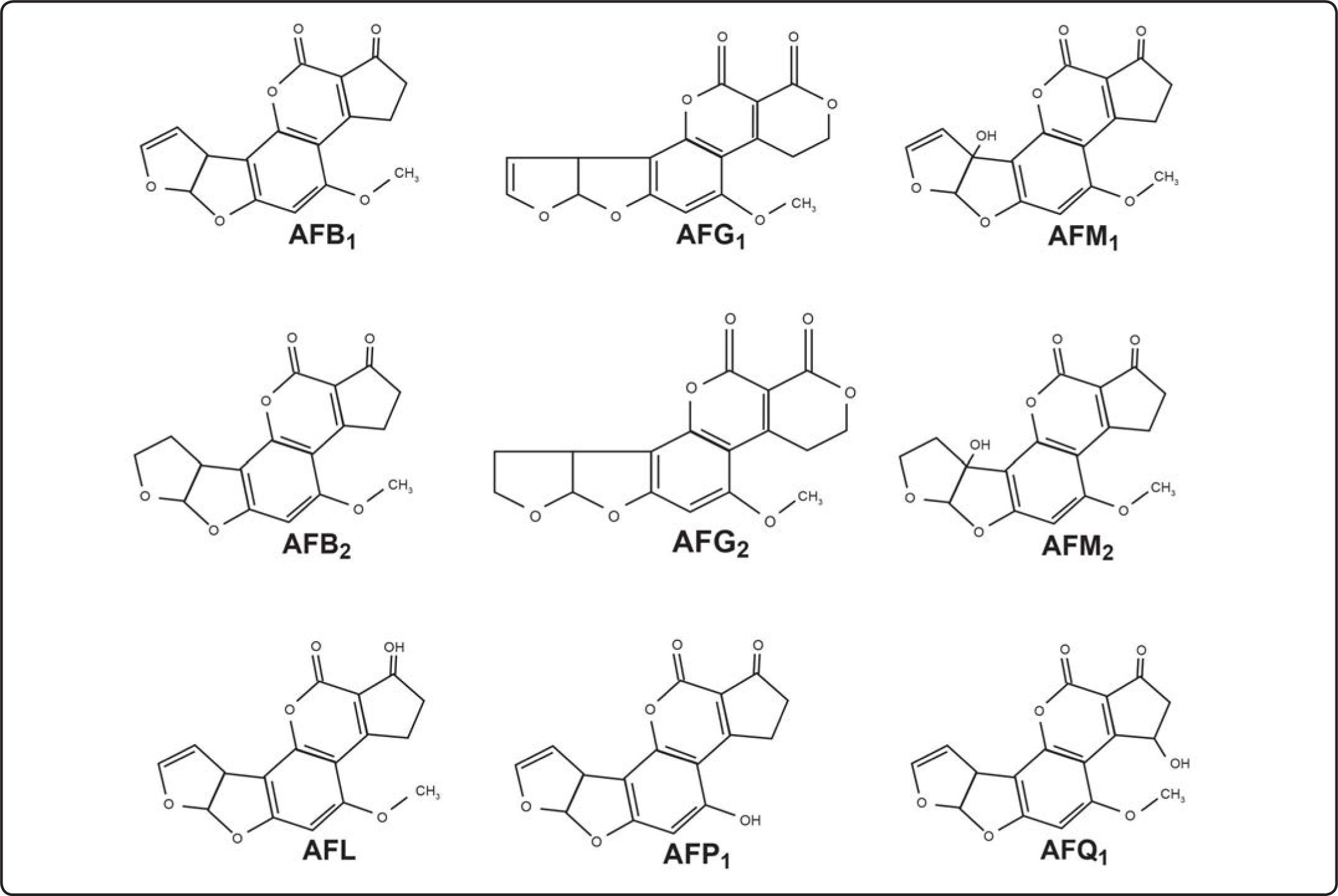
Estructura química y tipos de AFLa estructura básica de las AF[6] es un anillo dihidrodifurano o tetrahidrodifurano unido a una cumarina con un anilllo de cinco o seis átomos de carbono (Figura 1). Las difuranocumarinas ciclopentanonas de AF de las series B, M, P y Q son las AFB1, AFB2, AFB2a, AFM1, AFM2, AFM2a, AFQ1, AFP1 y AFL.
Estructuras químicas de las principales aflatoxinas[7].
El segundo subgrupo corresponde a las lactonas difuranocumarinas de la serie G como son AFG1, AFG2, AFG2a. Hay alrededor de 20 diferentes tipos de AF, las más importantes por su alto potencial cancerígeno, mutágeno y teratógeno son: B1 (AFB1), B2 (AFB2), G1 (AFG1), G2 (AFG2), M1 (AFM1), M2 (AFM2), P1 (AFP1), Q1 (AFQ1) y D (AFD), este último derivado del tratamiento de la AFB1 con amonio. Otro metabolito muy tóxico de la AFB1 es el aflatoxicol (AFL)[7]. Sólo las AFB1, AFB2, AFG1 y AFG2 se sintetizan naturalmente de la AFB1; las otras AF (M1, M2, P1, Q1, G2a, B2a y AFL) son hidroxilados productos del metabolismo animal o microbiano. La AFB1 es la más peligrosa y tóxica de todas[7].
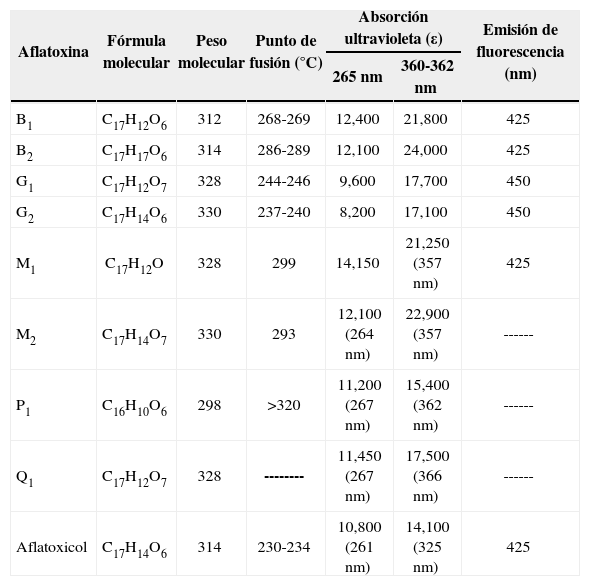
Propiedades fisicoquímicas de las AFLas AF son cristales sólidos de color que va del blanco al amarillo, sin olor, sin sabor e incoloros, son insolubles en agua y solubles en solventes orgánicos (metanol, cloroformo, acetona, acetonitrilo y dimetilsulfóxido), cuando las AF están en cloroformo o benceno son estables por años en refrigeración y oscuridad. Las AF en solución son sensibles a la luz, se descomponen en el aire, oxígeno, soluciones alcalinas o de ácidos suaves y se nombran según el color de la fluorescencia que emana con luz UV de onda larga, en color azul B (= blue) con anillo de ciclopentano o verde G (= green) con anillo de lactona, lo que permite detectarlas en trazas de 0.5 ng o menos, en cromatografía de capa fina. Las AFB2 y AFG2 tienen difuranos saturados, y AFB2a y AFG2a tienen una unidad difurano hidratada. Los subíndices 1 ó 2 de las AF tipo B, G, M o P indican la movilidad que tienen en la cromatografía de capa fina según su peso molecular, de 298 (AFP1) a 330 (AFG2 y AFM2), que da diferentes coeficientes de retención (RF) que las identifican. Los máximos picos de absorbancia de luz UV son de 265 nm a 362 nm, con una emisión a 425 nm. La Tabla I muestra las propiedades fisicoquímicas de las AF y sus hidroxilados naturales[4].
Propiedades fisicoquímicas de las aflatoxinas[4].
| Aflatoxina | Fórmula molecular | Peso molecular | Punto de fusión (°C) | Absorción ultravioleta (ε) | Emisión de fluorescencia (nm) | |
|---|---|---|---|---|---|---|
| 265 nm | 360-362 nm | |||||
| B1 | C17H12O6 | 312 | 268-269 | 12,400 | 21,800 | 425 |
| B2 | C17H17O6 | 314 | 286-289 | 12,100 | 24,000 | 425 |
| G1 | C17H12O7 | 328 | 244-246 | 9,600 | 17,700 | 450 |
| G2 | C17H14O6 | 330 | 237-240 | 8,200 | 17,100 | 450 |
| M1 | C17H12O | 328 | 299 | 14,150 | 21,250 (357 nm) | 425 |
| M2 | C17H14O7 | 330 | 293 | 12,100 (264 nm) | 22,900 (357 nm) | ------ |
| P1 | C16H10O6 | 298 | >320 | 11,200 (267 nm) | 15,400 (362 nm) | ------ |
| Q1 | C17H12O7 | 328 | -------- | 11,450 (267 nm) | 17,500 (366 nm) | ------ |
| Aflatoxicol | C17H14O6 | 314 | 230-234 | 10,800 (261 nm) | 14,100 (325 nm) | 425 |
Las AF entran al organismo con la comida, a través de la piel o son inhaladas, resisten altas temperaturas de 237 °C (AFG2) a 320 °C (AFP1), se descomponen de 237 °C a 306 °C, según el tiempo de calentamiento, la humedad del alimento y el pH. Así, las AF no se rompen con la ultrapasteurización, cocción, freido o hervido, fermentación, ni nixtamalización, pero se pueden destruir si se calientan en autoclave con amonio o hipoclorito de sodio. Actúan en trazas de millonésimas de gramo (microgramos por kilogramo = µg kg-1) o menos[4].
Durante la nixtamalización (pH de 8 a 12), el anillo de lactona de la AF se abre y pierde su fluorescencia y se puede pensar que están ausentes, pero en contacto con soluciones ácidas (pH de 1 a 3) del jugo gástrico, y regresando después a un pH neutro, las AF se reactivan y fluorescen otra vez[8].
Pérdidas económicas por contaminación con AFEl impacto de la contaminación por AF en cultivos se estima en millones de US dólares. La FAO declaró que el 25% de todos los cultivos tienen AF, principalmente cereales, oleaginosas y especias. Una contaminación de 60 a 800 mg kg-1 de AF en alimentos balanceados para animales bajan su producción, causan diarrea, vómitos, abortos en bovinos y las vacunas no sirven. En los humanos los daños por AF causan gastos por días no laborados, hospitalizaciones, medicinas, abortos, etc.[7]
Biosíntesis de las aflatoxinasLos patrones de formación de las AF y de lípidos son similares, vienen de un acetato que es el precursor común. Cuando la glucosa C14 se incorpora en posición uno en condiciones anaeróbicas, la vía catabólica de la glucosa Emblem Meyerhoff se rompe y favorece la producción de AF. Los precursores metabólicos de la biosíntesis de AFB1 tienen una estructura básica C20 poli-β-quétido y pertenecen a diferentes grupos como: xantonas (esterigmatocistina, O-metil-esterigmatocistina, aspertoxina), poli-hidroxi-antraquinonas (averufina, O-dimetil nidurufina, ácidos solorínico y norsolorínico, averantina, 1-O-dimetilaverantina, averitrina y acetato versiconal), AF y parasiticol[9].
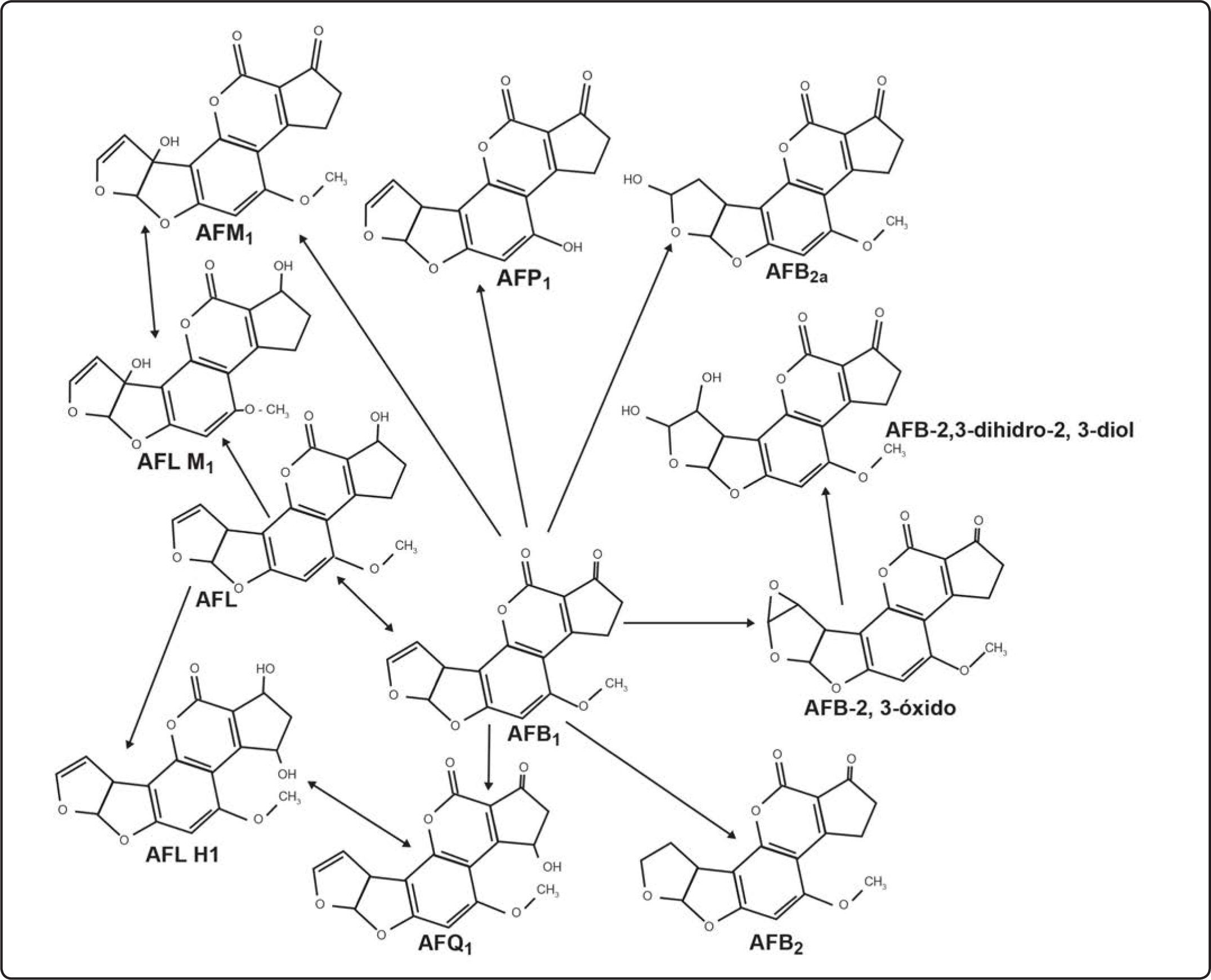
Las AF se producen por hongos filamentosos cuando la reducción de grupos cetónicos se interrumpe y se favorecen las reacciones de condensación en la ruta metabólica de la producción de ácidos grasos. Este proceso trae la síntesis de compuestos policetónicos (aflatoxinas)[9]. La ruta bioquímica aceptada para la síntesis de AF comprende alrededor de 23 reacciones enzimáticas, y la mayoría de los genes responsables se han caracterizado y aislado (Figura 2)[10].
Ruta de biotransformación de AFB1[10].
Las AF se ligan o adhieren a ácidos nucleicos ADN y ARN, y a proteínas, y afectan a todos los seres vivos con ácidos nucleicos, desde virus a vegetales y al hombre[11]. El ADN afectado puede almacenar las moléculas de AFB1 por años, y al tratar de regenerarse corta la porción de nucleótidos donde se pegó la AFB1 y la elimina por orina, leche o heces fecales. Las AF son compuestos peligrosos y muy tóxicos, son los más potentes cancerígenos biológicos para animales y el hombre[12], son mutágenos y teratógenos, de acuerdo al siguiente orden: AFB1 > AFG1 > AFB2 > AFG2. La AFB1 es la más tóxica con LD50 bajo, junto con la AFM1 y el aflatoxicol (AFL), y la AFB2 es 10 veces menos mutágena que la AFB1[7]. Cuando se ingieren altas concentraciones de AF en los alimentos, se producen efectos agudos a corto plazo (vómitos, diarreas, hemorragias, necrosis, abortos, defectos en coagulación y muerte), en bajas concentraciones por largo tiempo sus efectos son crónicos (teratogénesis, inmunodepresión, mutagénesis, hepatitis, cirrosis, aplasia del timo y cánceres diversos) y se han asociado con el Síndrome de Reye[13], con encefalitis y degeneración grasa de las vísceras de los niños, amar illamiento, inmunosupresión, falla renal, neurotóxica o gástrica, kwashiorkor y marasmo[14]. Las AF afectan la absorción y el metabolismo de lípidos, carbohidratos, proteínas, vitaminas y minerales, y su toxicidad afecta el transporte electrónico de la cadena respiratoria y las membranas celulares y subcelulares. Las AF ingeridas con los alimentos se absorben por la mucosa intestinal, pasando de la sangre al hígado, riñón, conductos biliares y sistema nervioso. Los cambios citológicos causados por las AF en las células vegetales y animales son similares: nucléolos en forma de anillo con capas diferenciadas, numerosos cuerpos lipídicos, mitocondrias con cisternas alargadas, retículo endoplásmico desgranulado, núcleos alargados e irregulares y cromatina con muchos gránulos[11]. La AFB1 actúa como un antimetabolito que se liga al ADN e interfere con el ARN y la síntesis de proteínas[4,15].
En China, África y Asia hay evidencias epidemiológicas que relacionan la ingestión de AFB1 con un aumento de cáncer hepatocelular primario (HCC)[16]. Los países donde se consumen alimentos enmohecidos tienen mayor incidencia de HCC. En India[17], tuvieron maíces con 6.25 a 15.6 mg de AF por kg, que causaron daño hepático. En 1974, se presentaron 108 casos de niños que comieron maíz con AF y todos desarrollaron cirrosis hepática. En Tailandia[18] las AF son endémicas, y se han aislado AFB1, AFG1 y AFB2 de hígado humano y sus metabolitos AFP1 y AFQ1 se cuantificaron, y relacionaron con cáncer de colon. Todos los compuestos hidroxilados de AF se han asociado al cáncer humano. En Guangxi, China[19], hubo HCC por la ingestión diaria de 1 a 2 µg AF/kg de peso corporal. Se correlacionó la susceptibilidad a AF con infecciones de SIDA y con presencia de virus de la hepatitis B (VHB). En 65 mercados de Kenia aparecieron 350 maíces con AF (de 20 a 1000 µg kg-1) que causaron hepatotoxicidad a 317 personas y 125 muertes[20]. La ingestión diaria en el sureste y noroeste de Estados Unidos es de 0.11 y 0.0002 µg AF por kg diarios[21].
Han sido reportados diferentes tumores cancerosos por la exposición a AF: HCC, de colon, recto, estómago, glándulas lagrimales, lengua y esófago. Hay una relación directa entre la ingestión de AF y estudios de HCC en Tailandia, Kenia, Mozambique y Suazilandia, más agudos en hombres que en mujeres. La presencia de la infección por VHB es un cofactor importante en la etiología del HCC. El hígado humano parece ser más resistente a desarrollar cáncer por AF que el de rata. La formación reversible del AFL constituye una reserva metabólica de AF relacionada con una alta susceptibilidad al HCC[16]. Las AF en células embrionarias del pulmón humano inhiben la síntesis de ADN en la mitosis causando vacuolas y células gigantes. Las partículas de polvo y tamo de granos de maíz pueden tener AF y al inhalarlas causar cáncer de pulmón[22].
Aún se desconocen todas las fuentes de exposición del hombre a las AF y el hígado no es el único órgano blanco, aunque sí el más afectado. La determinación precisa de los daños por AF requiere de la medición de biomarcadores de largo tiempo de consumo, que predigan el estado de salud e inmunología humana[23]. Muy pocos biomarcadores de largo plazo se han validado en animales experimentales y en el hombre. Las AF son cancerígenos químicos e iniciadores de cáncer y actúan sobre el ADN por un mecanismo genotóxico que requiere una conversión metabólica hacia formas reactivas (electrofílicas) para transformarse en aductos mutágenos, acumularse y producir sus efectos[24]. El daño al ADN por oxidación o por radiación afecta al metabolismo celular[25]. El monitoreo de aductos en tejido humano informa sobre la exposición a AF, su relación con el VHB, exposición a una dieta con AFB1 y al HCC[26].
La AFB1 causa aberraciones cromosómicas, ruptura del ADN en células vegetales y animales y mutaciones genómicas en prueba de Ames[11,27].
La activación metabólica de AFB1 inicia la formación de aductos que originan al cáncer. La AFB1 se liga a proteínas como la albúmina, ovalbúmina, ADN y ARN, formando conjugados o aductos que se pueden detectar en sangre, orina y tejidos del organismo que las ingirió[24]. Los aductos de los tejidos son la medida de la exposición crónica a las AF y reflejan el bombardeo que el ADN sufre en años de exposición. La presencia de un aducto en 1,000,000 de nucleótidos es medida de malignidad en tumores en rata alimentada con AFB1[21]. Tan pronto como una persona envejece, su ADN acumula más aductos capaces de producir una mutación o iniciar un cáncer[28].
Activación del proto-oncogénLos aductos AFB1-FAPY se acumulan y con el tiempo, pueden producir mutaciones que inician el proceso canceroso pues son activadores del proto-oncogén H-ras[29]. Los proto-oncogenes celulares de la familia ras codifican la proteína p21, que tiene una afinidad por el guanidín-trifosfato (GTP), que es importante en la traducción de proteínas. Estas proteínas p21 se activan al asociarse a GTP y se inactivan al hidrolizarse en presencia de las enzimas GTPasas (GAP)[30]. Los proto-genes ras sufren mutaciones puntuales y los oncogenes resultantes están activos y producen proteínas que disminuyen la actividad de las enzimas GAP, con menos capacidad para inducir hidrólisis de la GTP en el complejo activo. Es probable que la continua transmisión de las formas mutadas contribuya a la transformación maligna, así como el papel de los genes ras en la hepatocarcinogénesis por AFB1[28]. El desarrollo de zonas transformadas en el hígado y las células transfectadas originan células tumorales cuando se inyectan en nódulos hepáticos de ratones sin timo. Hay oncogenes en muestras de ADN que vienen de HCC, hay K-ras activados en algunos tumores[31]. Los tumores con K-ras activados tienen sustituciones G-C a T-A o G-C a A-T en el codón 12 que coinciden con las producidas cuando la guanina es blanco de AF[31].
De los más de 100 genes relacionados con el cáncer, la mutación en el gen p53 es la alteración genética más frecuente asociada a neoplasias[32]. Las funciones de la proteína del gen p53 incluyen: control del ciclo celular, síntesis y reparación del ADN, diferenciación celular, plasticidad genómica y muerte celular programada. Los efectos se asocian con la modulación de la transcripción medida por el gen p53, otros genes supresores y a proto-oncogenes relacionados con el control del crecimiento celular[32,33]. La alta frecuencia de la mutación específica G a T en el codón 249 del gen p53 en HCC humanos de chinos y africanos, por la ingestión de altas concentraciones de AF, es de gran interés pues otros cánceres humanos tienen mutaciones en el gen p53[32,33].
La infección crónica por hepatitis B ligada a la proteína, aumenta la mutación del hepatocito por AFB1 o por su epóxido, quizá por alteración del equilibrio entre la reparación del ADN y la apoptosis, que son mecanismos de defensa contra el estrés genotóxico[32,33].
Los cambios en el codón 249 repercuten en la proteína p53, y se induce un crecimiento agresivo en el hepatocito mutante del hígado crónicamente infectado con el VHB, que incrementan las mutaciones en tumores avanzados[33]. La importancia de las mutaciones en el gen p53 codón 249 por la toxicidad de las AF es controversial[33], ya que otros cancerígenos diferentes de la AFB1 produjeron mutaciones en este codón[32]. Cuando se compararon tumores de pacientes que vivían en áreas con riesgos alto y bajo de daño por AF, la frecuencia de mutaciones en el codón 249 gen p53 no se correlacionaron con la frecuencia de aductos AFB1-ADN[32].
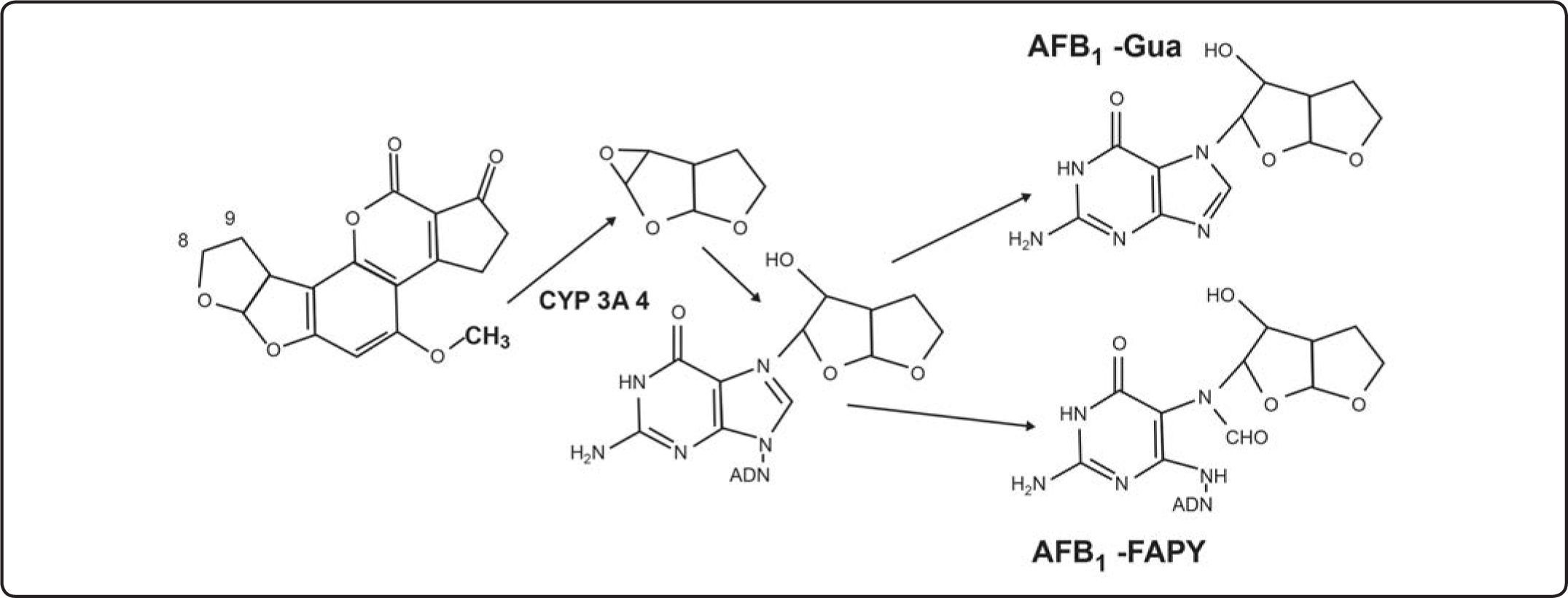
Tipos de aductos de AFB1-ADN1Exo-epóxido-8,9-AFB1Las AFB1 y AFB2 no son mutagénicas en sí mismas, requiren de bioactivación, para transformarse en exo-epóxido-8,9-AFB1 o exo-epóxido-8,9-AFB2[34]. Estos epóxidos no se han aislado debido a su alta reactividad e inestabilidad para ligarse al ADN y ser cancerígenos[29]. La AFB1-2,3-dicloro (AFB1-Cl2) se sintetizó como un análogo electrónico del epóxido-8,9-AFB1[25]. La toxicidad y potencia cancerígena de las AFB1 y AFB2 es por su bioactivación (Figura 3).
Activación de la AFB1 para formar el aducto 8,9-AFB1 epóxido. Estructura parcial de los dos aductos más abundantes[15].
La AFB1 se activa en el hígado, como epóxido-8,9-AFB1 que se liga al ADN, ARN o proteínas, primero se liga al N7 de la guanina del ADN, sitio de unión y mutación preferente, para formar al aducto 8,9-dihidro-8-(N7-guanil)-9-hidroxi-AFB1 abreviado como AFB1-Gua, que representa al 90% del total de aductos formados en roedores y en el hígado humano[24,29,35,36], ya sea a partir de la AFB1 o la AFB2[37], con ayuda de la enzima C Y P1A 2 [38], eliminado en un 70% por la orina o leche, o puede quedarse en tejidos tumorales, indicando exposición reciente y la medida de reparación del ADN[24,29], además se comporta como biomarcador de riesgo de enfermedad[10]. La dosis de AF excretada en orina no es indicativa de la cantidad que se queda adentro, los aductos de orina dan datos complementarios a los aductos de tejidos. La formación del aducto AFB1-Gua depende de las bases que flanquean la guanina, hay una baja eficacia de la unión cuando la guanina está flanqueada por secuencias ricas en adenina (A)-timina (T), mientras que cuando está flanqueada por otra guanina, la eficacia de la ligadura aumenta[24,29]. El aducto AFB1-Gua es un isómero electrofílico muy inestable y puede zafarse del ADN dando un sitio apurínico. No se han detectado aductos estables con la adenina, citosina o timina[36]. La unión del epóxido - 8,9 - AFB [39] con ADN es por una intercalación covalente entre la doble cadena de ADN y el AFB1-exo-8,9-epóxido[40].
Otros aductos N7 menores pueden formarse de la oxidación enzimática de AFP1, AFM1 y de otros metabolitos insaturados de AFB1 en la posición 8,9[41]. No todas las AFs con doble enlace 8,9 forman aductos directamente. El AFL es un metabolito altamente cancerígeno que actúa como un reservorio que extiende la cancerogenicidad de AFB1 en algunas especies, especialmente en trucha[42]. Al menos el 95% del AFL se reconvierte a AFB1 antes de formar el aducto[43]. Más del 99% de los aductos de AFL-ADN producidos in vivo son idénticos a los producidos por AFB1[44].
3Aducto AFB1-FAPYEl aducto AFB1-Gua es muy inestable y puede zafarse del ADN dando un sitio apurínico o bien el anillo imidazol se abre, se hidroliza y forma al aducto ligado a las pirimidinas 8,9 dihidro-8-(N5-formil-2,5,6-triamino-4-oxo-N5-pirimidil)-9-hidroxilafatoxina B1, abreviado como AFB1-FAPY, que se acumulan por años y causan mutaciones en el gen p53 y se asocian frecuentemente a neoplasias según los factores hereditarios del organismo[24,45]. El aducto AFB1-FAPY se libera del ADN con ácido fórmico[29]. Después de una exposición aguda o crónica, los aductos AFB1-FAPY quedan fijados al ADN de los tejidos de especies animales susceptibles y tienen cromatogramas complejos de los aductos[41,46,47].
La acumulación del aducto AFB1-FAPY persiste mucho más tiempo en el ADN, y es más importante en los estudios oncológicos aunque es menos frecuente. El mayor nivel de aductos unidos al ADN fue a las 24 h de aplicar 500 µg kg-1 de AFB1 a unas ratas. A las 96 h el nivel decreció ligeramente, sin embargo los aductos AFB1-FAPY ahora representaron el 50% de las AF hidrolizadas[41,47]. El metabolismo y formación de aductos AF-ADN en trucha arcoiris y en salmón han servido para establecer una dosimetría molecular para comparar diferentes susceptibilidades y predecir tumores de cáncer entre especies[48].
4Aductos de AFB1-proteínasaAductos de hemoglobinaLos aductos de proteína en la sangre se usan para calcular la exposición a cancerígenos electrofílicos. La hemoglobina es abundante y el tiempo de vida de los eritrocitos humanos es de 120 días. Los aductos de hemoglobina son estables y se pueden detectar varias semanas después de la exposición, facilitando un monitoreo retrospectivo. En exposiciones crónicas, los aductos de aminoácidos se acumulan en la hemoglobina y se pueden medir en los eritrocitos[49,50].
bAductos de albúminaLa albúmina es una proteína abundante en la sangre reconocida como medidor de dosis ingerida y que se sintetiza en los hepatocitos, sitio donde muchos cancerígenos se metabolizan a sus formas reactivas, y con una vida de 20 días. La AFB1 se liga más a la albúmina que a la hemoglobina. La albúmina es un componente del fluido intersticial que rodea a las células y que puede reaccionar con los metabolitos electrofílicos de cualquier tejido. Los aductos formados en el suero de la albúmina tienen una dosimetría similar a la hemoglobina, indican exposición e identifican riesgos. El suero de la albúmina es un medidor más efectivo que la hemoglobina respecto a cancerígenos de alimentos.
Los aductos unidos a la proteína no se reparan y pueden dar lugar a moléculas inestables que pueden desestabilizarla[51].
cAductos de AFB1- lisinaLos aductos de la AFB1-albúmina indican la exposición de AF en sangre, donde la AFB1-lisina es el producto de la digestión de la AFB1-albúmina usada en estudios animales y humanos. Este aducto muestra la exposición a AF y las relaciones del aducto interno en humanos[51]. El promedio diario de exposición a las AF, en Gran Bretaña, es de 3 µg de AFB1 y el promedio interno en ADN de hígado es de 5.9 aductos/107 nucleótidos[51]. Para facilitar el estudio de aductos de AFB1-lisina, se desarrollaron anticuerpos monoclonales de ratón que detectarán al conjugado de albúmina de suero bovino de AFB1-lisina sintética[52]. El isotipo de uno de estos anticuerpos, IIA4B3, se ha clasificado como inmunoglobulina G1 (λ, lambda). Las afinidades de IIA4B3 por la AFB1 y sus aductos asociados y metabolitos son: AFB1-lisina > AFB1-FAPY > AFB1 > AFM1 > AFQ1. Un método analítico basado en radioinmunoensayo competitivo con IIA4B3 y [3H]-AFB1-lisina se validó con un límite de detección de 10 fmol de aducto de AFB1-lisina[52]. Se correlacionaron los niveles de aductos de la albúmina de suero con los niveles de aducto de AFB1-ADN en hígado de diferentes especies de roedores (rata sensible a hámster y ratón resistentes) para ver si puede servir como biomarcador de cualquier especie y conocer las diferentes susceptibilidades a la inducción de tumores por AFB1 en cualquier especie y en el hombre[53]. Se puede usar este aducto como biomarcador en estudios de exposición humana a AF y da además el riesgo de alteraciones genéticas consecuentes[54].
5Aductos de AFB1 adenosina y citosinaSe ha reportado menor aducción de AFB1 a adenina[55] y citosina[30] en ADN in vitro y falta evidencia de su importancia en la producción de cáncer in vivo. Otros biomarcadores son aductos de AFB1 en ADN de linfocitos y de albúmina de suero.
Los factores relacionados a la formación de aductos AFB1-ADN son la edad, tabaquismo, alcoholismo, susceptibilidad del órgano para formar aductos (ej. células parenquimales hepáticas, tejido pulmonar, intestino delgado, cultivo traqueal, placenta, radicales intermedios de la bilis, etc.) y modulación de la temperatura del metabolismo hepático de AFB1. Con respecto a la edad y a la susceptibilidad de diferentes órganos a formar aductos, la glutatión transferasa disminuye cuando hay muchos aductos AFB1-ADN en el hígado y se correlacionan con el aumento de tumores por AFB1 en ratones recién nacidos[15]. La hidrólisis de los aductos AFB1-ADN es mayor en ratones recién nacidos y contribuye a remover más rápido los aductos. Hay factores endógenos que afectan, como la edad, el hábito de fumar tabaco o tomar alcohol y se asocian a un mayor porcentaje de aductos AFB1-Gua excretados, indicando más actividad de la AFB1. No hubo relación entre aductos AFB1-ADN y el antígeno al VHB, nivel educacional o raza[14].
Otros factores del huésped pueden modificar los efectos tóxicos de las AF, principalmente hormonas relacionadas con el sexo, la cantidad de alimento ingerido y otras interacciones ambientales. Hay estudios[56] acerca de la influencia de la grasa de la dieta en la bioactivación hepática de AFB1 en ratas. Dietas altas en azúcares y bajas en grasa reducen los microsomas y favorecen la epoxidación de AFB1, más que las dietas altas en grasa. El daño en ADN se relaciona con la aparición de tumores malignos[57]. El ayuno y la restricción calórica reducen la activación metabólica, y bajan tanto la cantidad de aductos (un 50%) como el riesgo de cáncer[58-60].
La luz, riboflavina y carotenos afectan la respuesta de la rata a la toxicidad aguda por AF y se desconoce la influencia de las hormonas y de la nutrición en el cáncer inducido por AF. Las ratas tratadas con fenobarbital, y a las que se les extrajo la hipófsis, presentan cambios en el metabolismo de la AFB1 y muy pocos aductos AFB1-ADN unidos a las macromoléculas en los hepatocitos.
Enzimas. Las lipoxigenasas y la prostaglandina H sintetasa son enzimas que juegan un papel importante en la bioactivación de la AFB1 en tejidos hepático y extra-hepático[61]. Vitaminas. Hay una asociación entre la presencia del aducto de orina AFB1-Gua con los niveles de á-tocoferol (vitamina E), licopeno (pigmento vegetal anti-oxidante rojo), con á y ß-caroteno (precursores de la vitamina A) y colesterol en el plasma sanguíneo a diferentes niveles de exposición de AFB1. No hubo asociación entre la presencia de aductos y los niveles de retinol, testosterona, vitamina E y ß-caroteno, los cuales aumentaron la formación de aductos AFB1-ADN, y hay una relación entre los micronutrientes del plasma y el riesgo de AFB1-relacionada con HCC[62]. Otros datos contrarios reportan que el ß-caroteno controló la formación de aductos de AFB1[63]. Con respecto a las vitaminas y carotenoides[64], en la carcinogénesis del hígado por AFB1, el licopeno y un exceso de vitamina A no tuvieron efecto, pero el ß-apo-8’-carotenal, cantaxantina y la astaxantina redujeron el tamaño de focos preneoplásticos[63].
Rutas de exposición para la formación de aductos en ADN.La inhalación de AFB1 es una ruta efectiva de exposición en ratas y hámsters que produce daño genotóxico en el hígado[65]. La administración intratraqueal de AFB1 aumentó un poco su presencia en ADN hepático en contraste con la gran fijación observada con animales que recibieron la AFB1 en forma intraperitoneal. Los pulmones son el segundo órgano en importancia en retener un 66% de [3H] AFB1 tritiada. Los macrófagos alveolares poseen una función oxidativa específica para activar la AFB1 y formar epóxido[66]. La mucosa nasal con las enzimas de la familia P450 del gen 2A de algunos mamíferos (conejo, rata y humano), los hace susceptibles a la formación del aducto AFB1-Gua. La formación de aductos de AFB1-ADN por microsomas nasales decrece con la nicotina[67].
MetodologíaLos métodos para estudiar a los aductos de AFB1-ADN, son un muestreo representativo del lote con muestras bien homogeneizadas. En el caso de alimentos balanceados o granos, una submuestra de 50 g se licúa con solventes orgánicos (metanol, cloroformo o acetonitrilo) para extraer a las AF y se filtra. La concentración y purificación de AF del filtrado diluido en amortiguador de fosfatos (PBS) 1:5 v/v a pH 7.4, se realiza utilizando columnas de inmunoafinidad para AF totales previamente activadas con 20 mL de PBS a pH 7.4. La columna debe recibir 1 g de muestra, se eluye con 2 mL de metanol, ACN o cloroformo.
En el caso de aductos de AFB1-ADN la muestra de tejido, orina, leche o sangre animal o humana se homogeneiza, se purifica el ADN con proteasa y se elimina al ARN con nucleasas, se hidroliza hirviéndolo con HCl hasta depurinarlo para romper el ADN y se pasa por una columna de inmunoafinidad. Finalmente se aplica el método de ELISA Inhibitorio Indirecto que detecta desde picogramos hasta fentogramos de aducto[68], o sea una molécula de aducto de AFB1-ADN en un universo de 10,000,000,000,000,000 (10-15) nucleótidos de ADN.
Los métodos para analizar aductos de AFB1-ADN son: a) cromatografía de líquidos (HPLC) a alta presión y fase reversa[29]; b) HPLC con detección de fluorescencia[69]; c) HPLC con electrospray y espectrometría de masas (LC-ESI-MS/MS)[70]; d) reacción de polimerasa en cadena (PCR) con radioinmunoensayo competitivo[51]; e) métodos radioactivos con ADN marcado con C14[37]; f) espectroscopía de resonancia electro spin[71]; g) ELISA con anticuerpos monoclonales[72]; h) análisis de inmunofluorescencia indirecto[73] ; i) prueba de Ames[74,75]. Los métodos antes mencionados, junto con la espectrometría UV, espectroscopía de resonancia magnética nuclear (NMR) y espectrometría de masas (MS), fueron consistentes al probar que el fotoaducto AFB1-N7-guanina es el más frecuente y se encuentra en mayor cantidad.
ControlHay una tasa de reparación natural y remoción de aductos[76] que reducen la unión a ácidos nucleicos con resistencia a la AFB1, o bien con preexposición a AFM1[77,78]. Los aductos pre-existentes modulan la formación de aductos AFB1-ADN[26].
La actividad de las enzimas destoxificantes glutatión transferasa (GTS) se incrementa en animales que ingieren AFB1 crónicamente en los alimentos, y reduce la unión de la AFB1 a las macromoléculas[79-81]. En trucha, la enzima inhibitoria de aductos es la ß-naftofavona (BNF)[80,81]. La P450 2A5 es un citocromo de ratones que cataliza la oxidación de la AFB1 al epóxido 8,9 AFB1[82], para ello se usan levaduras recombinantes[83].
La etoxiquina (EQ) antioxidante y la reductasa aldehído-AFB1 (AFB1-AR), protegen contra la formación de aductos unidos a proteína[84] e inhiben las lesiones por AFB1.
Hay compuestos químicos protectores que retrasan o curan el cáncer como los antiestrógenos, antiinfamatorios, antioxidantes y otros agentes de la dieta[85]. La indometacina[22], ditioletiona de dieta (DTT)[86], hidroxitolueno butilado (BHT)[87], ácido nordihidroguaiarético[88] y selenio[89] son potentes protectores contra HCC por AFB1, que redujeron los aductos AFB1-N7-Gua por inducción de GSH-S-transferasas. La dosis alta de BHT causa efectos patológicos.
Alimentos como las crucíferas contienen ditioletionas que inhiben al cáncer[90], las coles de Bruselas disminuyeron un 50-60% la unión AFB1-ADN del aducto y aumentaron las actividades hepáticas e intestinales de la GST[91]. El indol-3-carbinol (I3C), de las crucíferas in hibieron in v ivo la formación de aductos AFB1- ADN un 68% y combinado con BNFinhibieron 5 1% [92]. El brócoli tiene glucorafanina que es un glucosinolato que se hidroliza como sulforafano por la microfora intestinal y es un inductor de enzimas destoxificantes [93,94]. El oltipraz[90] es un derivado sintético del brócoli, previamente usado en humanos como medicamento anti-schistosoma, útil para consumidores de comida con AFB1, en regiones con alta incidencia de cáncer de hígado[95], es un potente inductor de la GST, enzima destoxificadora de la Fase II que inhibe el cáncer de vejiga, colon, pecho, estómago y piel, pero no ha sido relevante en poblaciones humanas[96]. La cumarina [97] protege contra el origen del cáncer hepático por AFB1 en rata. El ácido elágico[75] es un fenol vegetal de varias frutas y nueces que inhibe la mutación por AFB1, y reduce los aductos AFB1- ADN y el daño en ADN en tejido traqueobronquial de rata y humano. El cafestol y el kahweol son diterpenos quimioprotectores y anticancerígenos de granos de café verdes y tostados[98]. Los monoterpenos redujeron la formación de aductos en ratas expuestas a AFB1[99]. El jugo de toronja suprime el daño al ADN por AFB1[100]. El ß-caroteno no protegió al ADN de las alteraciones producidas por AFB1 y causaron cambios menores en su metabolismo[63]. El efecto protector del ácido ascórbico fue ligero en los animales con toxicidad aguda por AFB1[101].
Oldenlandia diffusa y Scutellaria barbata son plantas usadas en medicina tradicional china para tratar tumores de hígado, pulmón y recto; ellas inhiben la mutagénesis, la fijación al ADN y el metabolismo de AFB1 bioactivado por Aroclor 1254 en S9 en rata [102].
La clorofila es un producto natural útil para reducir los aductos de AF-ADN[103]. Las bacterias probióticas pueden formar complejos con la AFB1, bloquear su absorción intestinal y reducir la excreción de AFB1-Gua asociados con aumento de riesgo de desarrollar HCC[104].
La información presentada aquí engloba algunos aspectos de los aductos que son interesantes para los científicos y otras especialidades, esperamos haber dado datos de vanguardia acerca de estos importantes biomarcadores.
A Georgina Ortega Leite y Gerardo Arévalo por su apoyo en la obtención de bibliografía; y a Joel Villavicencio, Jorge López y Alfredo Wong por su apoyo en computación, todos del Instituto de Biología, UNAM.




![Estructuras químicas de las principales aflatoxinas[7]. Estructuras químicas de las principales aflatoxinas[7].](https://static.elsevier.es/multimedia/1405888X/0000001600000002/v1_201505191536/S1405888X13720825/v1_201505191536/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Ruta de biotransformación de AFB1[10]. Ruta de biotransformación de AFB1[10].](https://static.elsevier.es/multimedia/1405888X/0000001600000002/v1_201505191536/S1405888X13720825/v1_201505191536/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Activación de la AFB1 para formar el aducto 8,9-AFB1 epóxido. Estructura parcial de los dos aductos más abundantes[15]. Activación de la AFB1 para formar el aducto 8,9-AFB1 epóxido. Estructura parcial de los dos aductos más abundantes[15].](https://static.elsevier.es/multimedia/1405888X/0000001600000002/v1_201505191536/S1405888X13720825/v1_201505191536/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)