Para sobrevivir, los organismos deben adaptarse a cambios ambientales repentinos que ejercen una presión selectiva y por lo tanto sus posibilidades de supervivencia, dependen de su capacidad para responder en forma rápida y precisa. La adaptación a estos cambios está estrechamente ligada a la correcta percepción y transmisión de los estímulos, así como a la generación de respuestas apropiadas. En diferentes bacterias, hongos, plantas y mohos mucilaginosos, los sistemas de dos componentes (SDC) permiten regular su fisiología de acuerdo a las condiciones ambientales. En estos circuitos moleculares, el mecanismo de comunicación entre módulos es la fosforilación consecutiva de residuos de His y Asp localizados en dos proteínas: una cinasa sensora (CS) y un regulador de la respuesta (RR). En este artículo de revisión, se destacan las características más relevantes de los SDC, así como su participación como sistemas de percepción-respuesta a muy diversos estímulos. Además se resaltan las diferencias entre los SDC en procariontes y eucariontes. Finalmente se ejemplifican algunas diferencias usando los circuitos de regulación osmótica de Escherichia coli y Saccharomyces cerevisiae.
To survive, organisms must adapt to sudden environmental changes that exert a selective pressure and therefore, their chances of survival depend on their ability to respond quickly and accurately. Adapting to these changes is closely linked to the correct perception and transmission of stimuli and the generation of appropriate responses. Two component systems (TCS) allow different bacteria, fungi, slime molds and plants to regulate their physiology according to the environmental conditions. In these molecular circuits, the mechanism of communication between modules is the consecutive phosphorylation of His and Asp residues located in sensor histidine kinase and response regulator protein pairs. This review highlights the most relevant features of TCS and their role in the perception and response to diverse stimuli. Finally, the differences between prokaryotic and eukaryotic TCS are illustrated using the osmotic response in Escherichia coli and Saccharomyces cerevisiae.
¿Como parte de sus funciones, los organismos perciben y responden a condiciones ambientales cambiantes. La percepción y procesamiento intracelular de estos estímulos se lleva a cabo por circuitos moleculares que detectan y amplifican las señales, permitiendo la generación de respuestas específicas. En eucariontes, abundan las cascadas de señalización que involucran la fosforilación consecutiva de proteínas generalmente en residuos de treonina, tirosina y serina (cascadas de MAP cinasas). A diferencia de esto último, en procariontes y algunos grupos de eucariontes, existe una amplia red de sensores y efectores llamados sistemas de dos componentes (SDC), que transmiten señales a través de la fosforilación sucesiva de dos proteínas, una sensora y una reguladora, en residuos conservados de histidina y aspartato respectivamente[1] (Fig. 1).
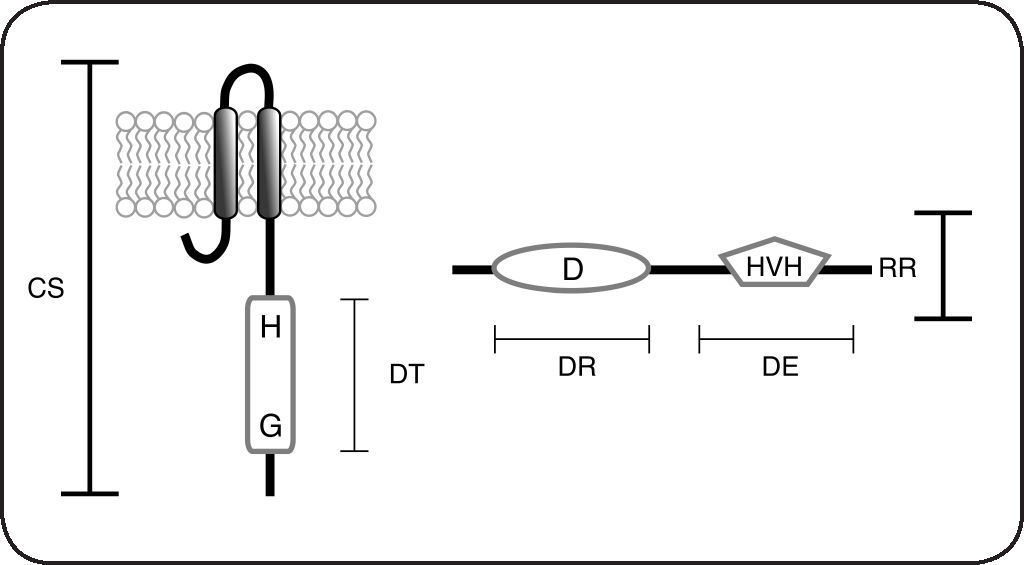
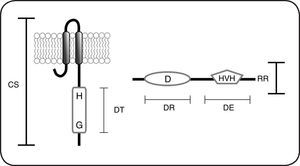
Esquema de las proteínas que forman parte de los sistemas de dos componentes. Los sistemas de dos componentes están constituidos por una cinasa sensora (CS) que posee un dominio transmisor (DT) que incluye el residuo His conservado (H) y un dominio de unión a nucleótidos, importante para la unión de ATP conocido como caja G (G). Los reguladores de respuesta (RR) poseen un dominio receptor (DR) en donde se encuentra el residuo Asp fosforilable (D), además poseen un dominio efector (DE) que frecuentemente es un dominio de unión al ADN tipo hélice-vuelta-hélice (HVH).
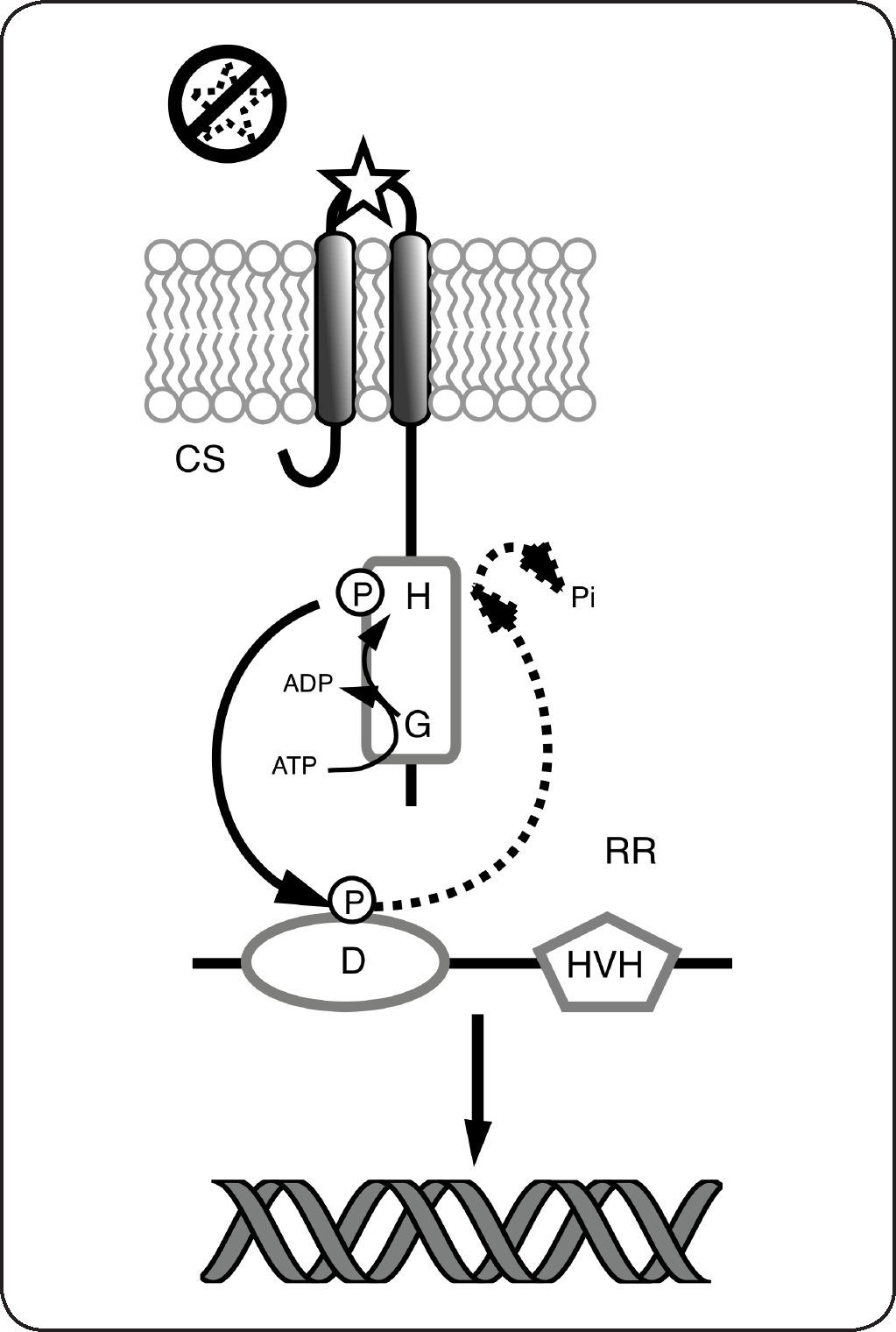
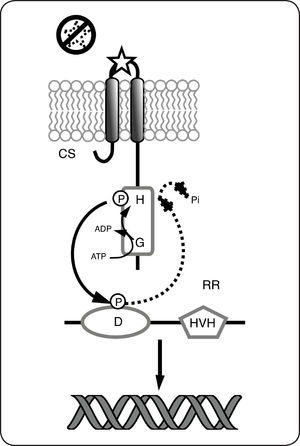
El paradigma de funcionamiento de los SDC incluye la transferencia consecutiva de un grupo fosforilo entre un residuo His y un Asp presentes en dos proteínas; una cinasa sensora de histidina (CS) y otra conocida como regulador de la respuesta (RR). Las CS se encuentran en su mayoría ancladas a la membrana, funcionan como dímeros e incluyen tres porciones principales: una región periplásmica relacionada con la percepción de estímulos, dos hélices transmembranales y una región intracelular que contiene los dominios catalíticos involucrados con la transmisión de la señal. La CS canónica está constituida por un dominio sensor localizado en el extremo N-terminal y un dominio transmisor localizado en el extremo C-terminal de la proteína. El dominio sensor monitorea el ambiente en búsqueda de estímulos y el dominio transmisor incluye grupos de residuos esenciales para la activación y regulación de la actividad de la CS. Algunos de estos residuos están involucrados en la unión al ATP (cajas G, N y F), en la autofosforilación (caja H) y en la dimerización o la regulación de la actividad de cinasa. Por su parte el RR está constituido por un dominio receptor localizado en el extremo N-terminal en el que destaca el residuo de aspartato y que cataliza la transferencia del grupo fosforilo de la histidina conservada en el dominio transmisor de la CS. Además los RR poseen un dominio efector en el extremo C-terminal. Existen diferentes dominios efectores pero la mayoría de los RR poseen un dominio de unión al ADN, por lo que actúan como factores de transcripción1Fig. 2. La señalización en los sistemas simples o canónicos inicia con la unión-detección del estímulo por la CS, esta unión-detección activa la autofosforilación de la CS en el residuo de His conservado, posteriormente el dominio receptor del RR cataliza la transferencia del grupo fosforilo al residuo de Asp conservado, que lo activa normalmente como regulador transcripcional. Se ha descrito que dependiendo de la presencia de la señal activadora del sistema, la mayoría de las CS pueden catalizar la fosforilación o desfosforilación específica de su RR, por lo que se conocen como CS bifuncionales. En ausencia del estímulo las CS bifuncionales catalizan la desfosforilación de su RR correspondiente liberando fosfato inorgánico (Pi) al medio (Fig. 2).
Paradigma de funcionamiento de los sistemas de dos componentes. El estímulo se percibe en el dominio sensor, lo que provoca la autofosforilación dependiente del ATP, en el residuo conservado de histidina (H). Posteriormente, el grupo fosfato se transfiere al residuo de aspartato (D) en el RR. La fosforilación del residuo Asp causa la activación del RR como factor de transcripción. En ausencia de la señal, la CS actúa como fosfatasa por lo que el grupo fosforilo se elimina del residuo Asp y se libera al medio como fosfato inorgánico (Pi).
Los elementos necesarios para la transferencia del grupo fosforilo, (dominio transmisor y dominio receptor), son homólogos en todos los sistemas lo que ha permitido agrupar a estas proteínas[2]. CS y RR se consideran proteínas modulares[3–5], ya que a pesar de contar con dominios transmisores y/o receptores que exhiben una gran variedad de arreglos (pueden presentarse aislados, en pares, o en combinación con otros dominios así como estar en una sola proteína o distribuidos en varias[6]), el mecanismo de fosforilación consecutiva His- Asp-His, se mantiene con todas estas configuraciones[6]. Inclusive se ha demostrado que para el caso de algunas cinasas como ArcB, los dominios pueden adoptar la conformación catalíticamente activa aún en ausencia de unión covalente entre dominios contiguos[7]. Esta propiedad ha sido muy útil en la caracterización del mecanismo de transducción y las propiedades bioquímicas de este sistema[8].
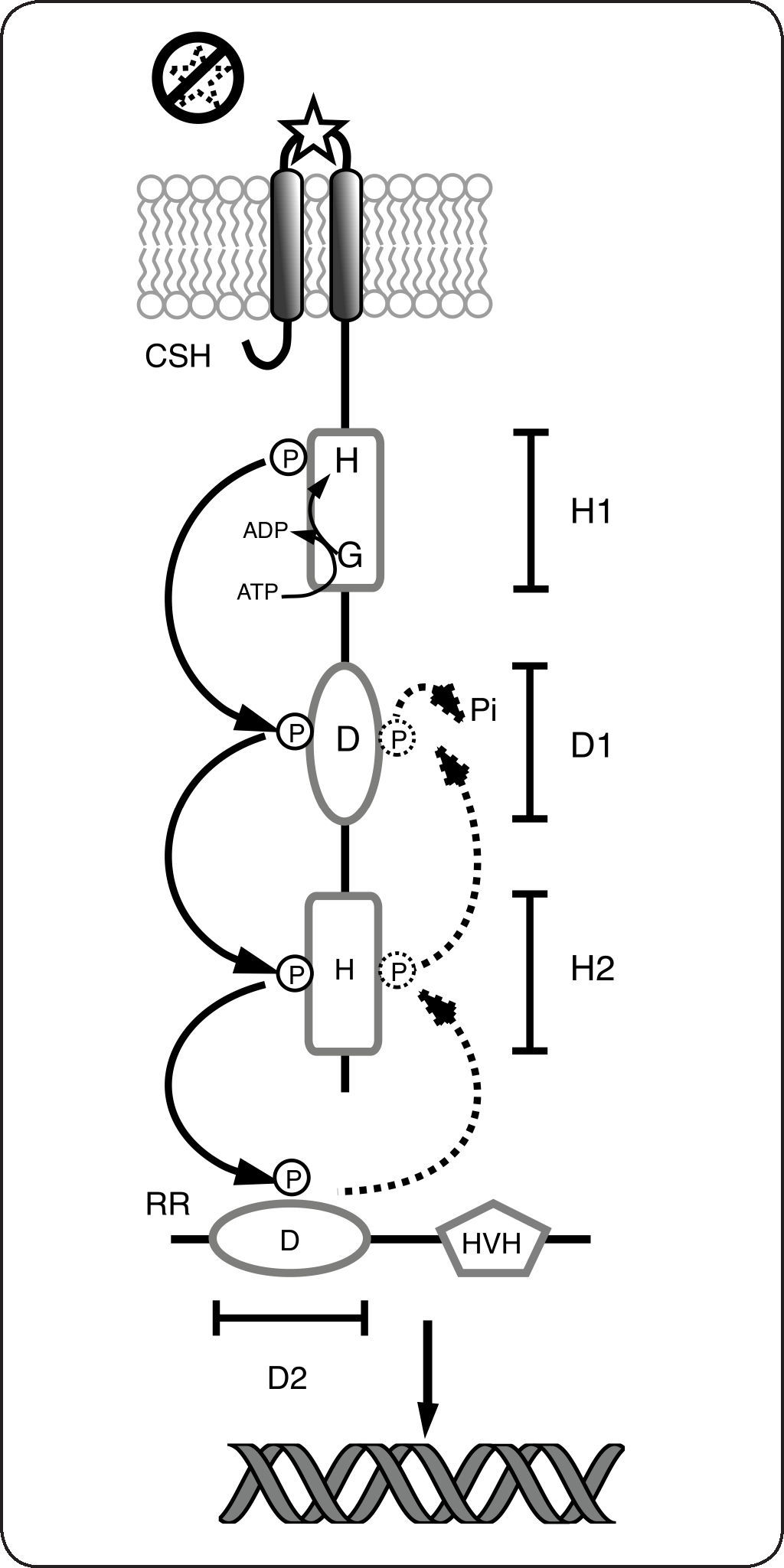
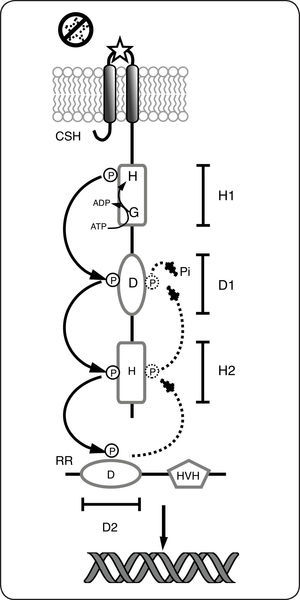
Además de los SDC hasta ahora mencionados, existen un importante número de sistemas conocidos como híbridos o de fosforrelevo, que incluyen CS híbridas (CSH), que se caracterizan porque además del dominio transmisor, tienen fusionado un dominio receptor similar al presente en los RR y un dominio intermediario en la transferencia (conocido como HPt) que contiene un residuo de histidina conservado y que puede encontrarse formando parte del mismo péptido o como una proteína independiente[6]. Debido a la particular organización en las CS híbridas, la transferencia del grupo fosforilo en estas proteínas ocurre en varios pasos consecutivos; primero entre los dominios de la CS híbrida y finalmente al dominio receptor del RR, por lo que este mecanismo de fosforilación se conoce como fosforrelevo. En respuesta a la percepción del estímulo, la CS se autofosforila a expensas de ATP en la histidina conservada en el dominio transmisor primario (H1) iniciando el fosforrelevo. Después, el grupo fosforilo se transfiere consecutivamente a los residuos conservados en los dominios receptor primario (D1), transmisor secundario (H2 o HPt) y finalmente al Asp conservado en el dominio receptor del RR. La fosforilación del dominio receptor propaga un cambio conformacional, esto activa el dominio efector que finalmente regula la expresión genética en respuesta al estímulo[1] (Fig. 3). En ausencia del estímulo, el RR es desfosforilado, ya sea por la misma CS (bifuncional) o por una fosfatasa independiente apagando así el sistema (Fig. 3). La participación de una fosfatasa independiente se considera una excepción a la regla, ya que la gran mayoría de las CS son bifuncionales. Es aceptado para la gran mayoría de las CS, que en su estado activo como cinasas funcionan al menos como dímeros y que las reacciones de autofosforilación y transferencia del grupo fosforilo ocurren de forma intermolecular entre monómeros[1]. A pesar de esto último y como ocurre con frecuencia, se han descrito excepciones a esta regla en las cuales la autofosforilación de la CS y los primeros pasos del fosforrelevo ocurren de forma intramolecular[9].
Sistemas de dos componentes híbridos o de fosforrelevo. El estímulo se percibe en el dominio sensor de la cinasa sensora híbrida (CSH), lo que provoca la autofosforilación (dependiente del ATP), en el residuo conservado de histidina (H), incluido en el dominio transmisor primario (H1). Posteriormente, el grupo fosfato se transfiere consecutivamente al residuo de aspartato (D) en el dominio transmisor receptor (D1) y al dominio transmisor secundario (H2). Finalmente el grupo fosforilo se transfiere al residuo Asp conservado en el dominio receptor (D2) del RR activándolo como factor de transcripción. En ausencia de la señal (líneas punteadas), la CS actúa como fosfatasa, por lo que el grupo fosforilo se elimina del residuo Asp y se libera al medio como fosfato inorgánico (Pi).
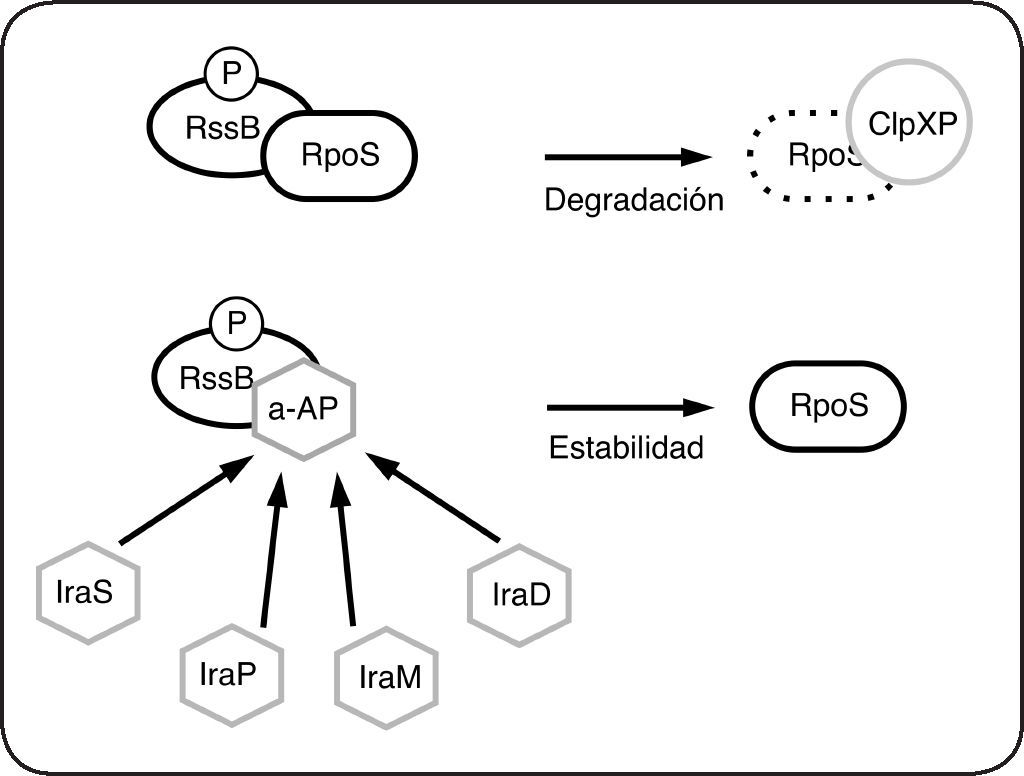
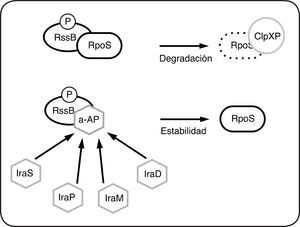
Aunque en la mayoría de los SDC los RR actúan como factores de transcripción[10,11], un importante grupo de RR regula las respuestas a través de otros mecanismos. La diversidad de dominios efectores es amplia. Además de los que poseen dominio de unión al ADN, se han encontrado reguladores de respuesta con actividad enzimática, con dominio de unión al ARN, dominios receptores sin dominio efector evidente o que regulan procesos a través de interacciones proteína-proteína (revisado en[10,11]). Por ejemplo, la fosforilación de CheY de E. coli, permite su interacción con el interruptor molecular del flagelo (FliM) e induce el cambio de dirección de rotación del flagelo lo que causa la reorientación de la bacteria[12]. Otro caso es RssB de E. coli. La subunidad σs (σ38 o RpoS) de la ARN polimerasa, es un regulador maestro de crecimiento en fase estacionaria y en diversas condiciones de estrés. La forma fosforilada de RssB se une directamente a RpoS y favorece su degradación por la proteasa ClpXP[13] (Fig. 4). En la fase exponencial de crecimiento RssB se encuentra fosforilada e interactúa con RpoS que es degradado por ClpXP, sin embargo, en diferentes condiciones de estrés, la interacción de RssB con proteínas conocidas como anti-adaptadoras (IraM, IraD, IraS, IraP, RssC, etc), impide la interacción de RssB con RpoS lo que evita su degradación por ClpXP[14] (Fig. 4).
Regulación de la degradación de RpoS mediada por RssB en E. coli. En las células en crecimiento exponencial, la interacción de RssB-P con σS (RpoS) favorece su degradación por la proteasa ClpXP. Las proteínas anti-adaptadoras (a- AP) IraP, IraD, IraM, IraS, se unen directamente a RssB-P e impiden la interacción de RssB con RpoS. El modelo sugiere que el complejo RssB-a-AP es incapaz de unirse a RpoS y ClpXP y por lo tanto RpoS no es degradada. Las proteínas anti-adaptadoras se expresan en diferentes condiciones de estrés y estabilizan a RpoS.
En los sistemas biológicos, un módulo se puede duplicar y modificar para ser utilizado en un contexto celular diferente
del original. Este proceso ha ocurrido a lo largo de la evolución y como consecuencia resulta la evolución de grandes familias de genes[15], entre las que se encuentran los SDC. Aunado a esto, la arquitectura modular de estos sistemas ha permitido la divergencia de una amplia gama de circuitos de señalización que conservan la transferencia de grupos fosforilo entre residuos de histidina y aspartato como mecanismo fundamental, pero que presentan adaptaciones al esquema básico para cumplir con una función de señalización particular.
Extensos estudios se han llevado a cabo en la última década y un número creciente de SDC se han identificado y caracterizado. A pesar de todo esto, aún no es posible predecir la señal o estímulo que es detectado por los dominios sensores. En procariontes y algunos eucariontes, se ha caracterizado la participación de estos circuitos de señalización en la respuesta a estímulos diversos; cambios en la osmolaridad[16,17], balance redox[18–20], disponibilidad de Mg2+[21], asimilación de nitrógeno[22,23], presencia de solventes[24], luz azul[25], luz roja[26] por nombrar sólo algunos. Además tienen un papel relevante en la regulación de diversos procesos celulares como esporulación[27,28], resistencia a antibióticos[29], motilidad[30], diferenciación[31,32] o regulación del ciclo celular[33]. También se han implicado en virulencia y colonización de hospederos[34,35]. En las plantas los SDC se han diversificado y adaptado para formar parte de diversas vías de señalización en respuesta a etileno[36], citocinina[37,38] o luz[39]. También se ha descrito que están involucrados en procesos diversos como el desarrollo de gametos, floración o regulación de ritmos circadianos[40,41].
A pesar de que la expansión de una familia de proteínas presenta ventajas para una respuesta a diversas condiciones como las ya mencionadas, las células deben mantener la especificidad y evitar interferencias no deseadas entre los componentes de diferentes vías de señalización. En las bacterias, múltiples SDC están presentes simultáneamente y con patrones de localización similar lo que aumenta la posibilidad de interacciones no específicas entre CS y RR. Una serie de estudios han proporcionado pruebas de que estas interacciones no específicas pueden ocurrir in vitro entre proteínas no correspondientes. Por ejemplo, se ha demostrado in vitro que las CS CheA, EnvZ y PhoR de E.coli, pueden catalizar la fosforilación de reguladores de la respuesta diferentes a los que en condiciones fisiológicas fosforilan (CheY, OmpR y PhoP respectivamente)[42–44].
La regulación cruzada en sistemas de dos componentes ha sido definida como el control (bajo condiciones fisiológicas), de un RR por un sistema de regulación diferente, pudiendo o no ser también un sistema de dos componentes[45]. De manera similar, el término crosstalk ha sido utilizado para describir las interacciones entre CS y RR no correspondientes pudiendo o no causar regulación cruzada. A pesar de las similitudes y la probabilidad de interacciones inespecíficas in vitro, múltiples evidencias experimentales demuestran que en condiciones fisiológicas, CS y RR interaccionan de forma muy específica. De acuerdo con esto, en condiciones fisiológicas CS y RR muestran una alta especificidad en muchos de los casos en ambas direcciones (como cinasa y como fosfatasa). Prueba de ello es que la regulación cruzada en SDC se ha observado sólo después de introducir múltiples alteraciones genéticas. Además aún en condiciones in vitro las CS muestran una marcada preferencia cinética por el RR correspondiente[44].
Sistemas de dos componentes en procariontesLos SDC se encuentran entre los grupos de genes más representados en los genomas de bacterias, y ambos (CS y RRs) constituyen las dos más grandes familias de genes parálogos en bacterias[46]. Análisis realizados a partir de las secuencias genómicas de múltiples bacterias han revelado que el número total de los SDC en un genoma, crece típicamente siguiendo una relación cuadrática con respecto al tamaño del genoma[46]. Los SDC están presentes en 864 de 899 genomas completos disponibles[47]. Entre los únicos grupos que carecen de los SDC se encuentran especies de Mycoplasma y endosimbiontes como especies de Amoebophilus con genomas muy reducidos[47]. Por otro lado, se ha descrito la existencia de una correlación entre el número de los SDC con el ambiente en que los organismos se desarrollan. Así pues, generalmente organismos que deben sobrevivir en una gran diversidad de ambientes destinan una importante proporción de su genoma a genes involucrados con la regulación del metabolismo, así como con circuitos de transducción de señales. Como ejemplo de esto último, la bacteria de vida libre Myxococcus xanthus, conocida por su complejo desarrollo multicelular codifica para 264 SDC[47]. En contraposición, el patógeno intracelular Mycobacterium leprae TN, codifica sólo para 10[47].
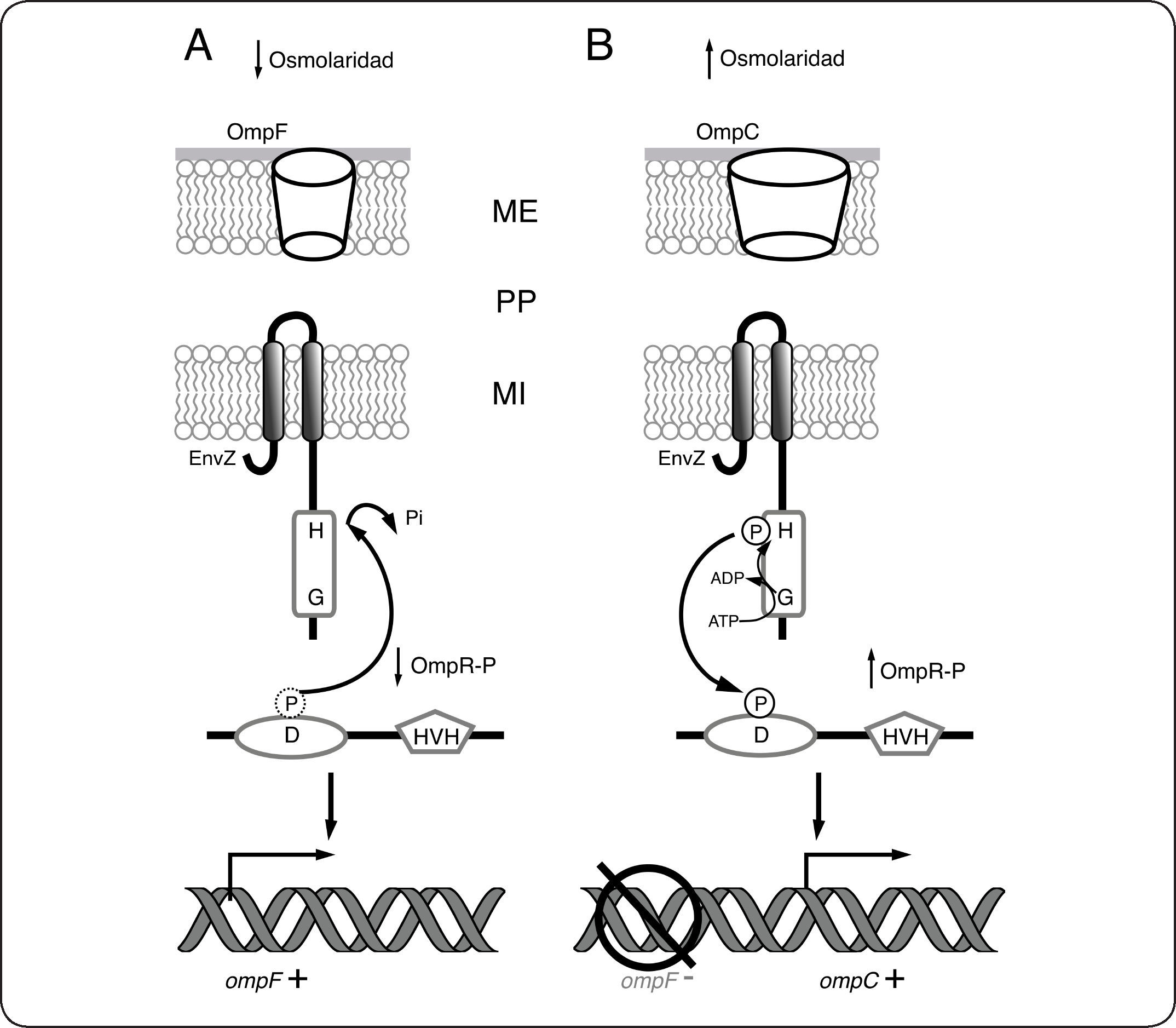
Adaptación a cambios osmóticos en E. coli: el Sistema EnvZ/OmpREn E. coli, dos porinas (OmpF y OmpC) regulan la difusión pasiva de moléculas pequeñas e hidrofóbicas a través de la membrana externa, permitiendo así la rápida adaptación de las células a cambios osmóticos. El sistema de dos componentes formado por la CS EnvZ y el RR OmpR desempeña un papel crucial en la regulación osmótica controlando de forma recíproca la expresión de los genes de las porinas OmpF y OmpC.
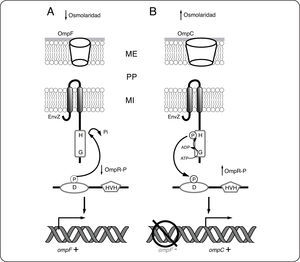
La CS EnvZ y el RR OmpR forman el SDC EnvZ/OmpR. EnvZ es una CS bifuncional que regula la relación OmpR/OmpR-P en respuesta a la osmolaridad del medio. EnvZ es una CS prototípica de 450 aminoácidos anclada a la membrana interna a través de dos hélices transmembranales en la que se distinguen varias regiones: un extremo N-terminal corto de localización citoplásmica, un dominio periplásmico de 115 aminoácidos que originalmente se creía involucrado con la percepción del estímulo. Posteriormente se demostró que esta región no es esencial para la percepción del estímulo en EnvZ. En mutantes en las que el dominio periplásmico de EnvZ se elimina o se sustituye parcial o totalmente por el dominio periplásmico de una CS no relacionada (PhoR en este caso), la osmoregulación y la producción de OmpC y OmpF es indistinguible de la observada para la cepa con EnvZ silvestre[48]. Finalmente posee un dominio citoplásmico grande[49] que contiene el dominio transmisor con el residuo His conservado en la posición 243[50]. OmpR por su parte, es una proteína citoplásmica que tiene el dominio receptor con el residuo de Asp conservado en la posición 55[51]. Además tiene como efector un dominio de unión al ADN tipo HVH. La fosforilación de OmpR aumenta su afinidad por los promotores de ompF y ompC[52], así como su interacción con la ARN polimerasa activando la transcripción. En baja osmolaridad, la actividad fosfatasa de EnvZ predomina por lo que OmpR se encuentra mayoritariamente defosforilada, activando la expresión de OmpF (Fig. 5A). En alta osmolaridad en cambio, EnvZ se encuentra activa como cinasa favoreciendo la acumulación de OmpR-P. En esa condición se reprime la expresión de OmpF, mientras que se activa la de OmpC (Fig. 5B). El mecanismo de regulación recíproca de los promotores de ambos genes ha sido descrito detalladamente[53].
Sistema de dos componentes EnvZ/OmpR. El sistema de dos componentes formado por la CS EnvZ y la RR OmpR controla la expresión de los genes de las porinas OmpF y OmpC. A. En ausencia de estrés osmótico, la actividad fosfatasa de EnvZ predomina, por lo que OmpR se encuentra mayoritariamente defosforilada, activando la expresión de OmpF. B. En presencia de estrés osmótico, EnvZ se encuentra activa como cinasa favoreciendo la acumulación de OmpR-P. En esta condición se reprime la expresión de ompF, mientras que se activa la de ompC. ME membrana externa, PP periplasma, MI membrana interna.
La regulación del tamaño de los poros de difusión pasiva de la membrana externa parece ser vital para E. coli, ya que permite a la bacteria, adaptarse a dos condiciones ambientales con claras diferencias en lo que a osmolaridad se refiere: una en presencia de una alta concentración de nutrientes (alta osmolaridad) en el intestino de los animales a 37°C y la otra con escasa fuente de nutrientes (baja osmolaridad), cuando se encuentra como organismo de vida libre. Se ha propuesto que en el caso de OmpF el poro de mayor tamaño es importante para la absorción eficiente en medios con escasa fuente de nutrientes, mientras que el poro de menor tamaño de OmpC es importante para impedir el paso de sales biliares a través de la membrana externa, ya que pueden resultar tóxicas para la bacteria[54].
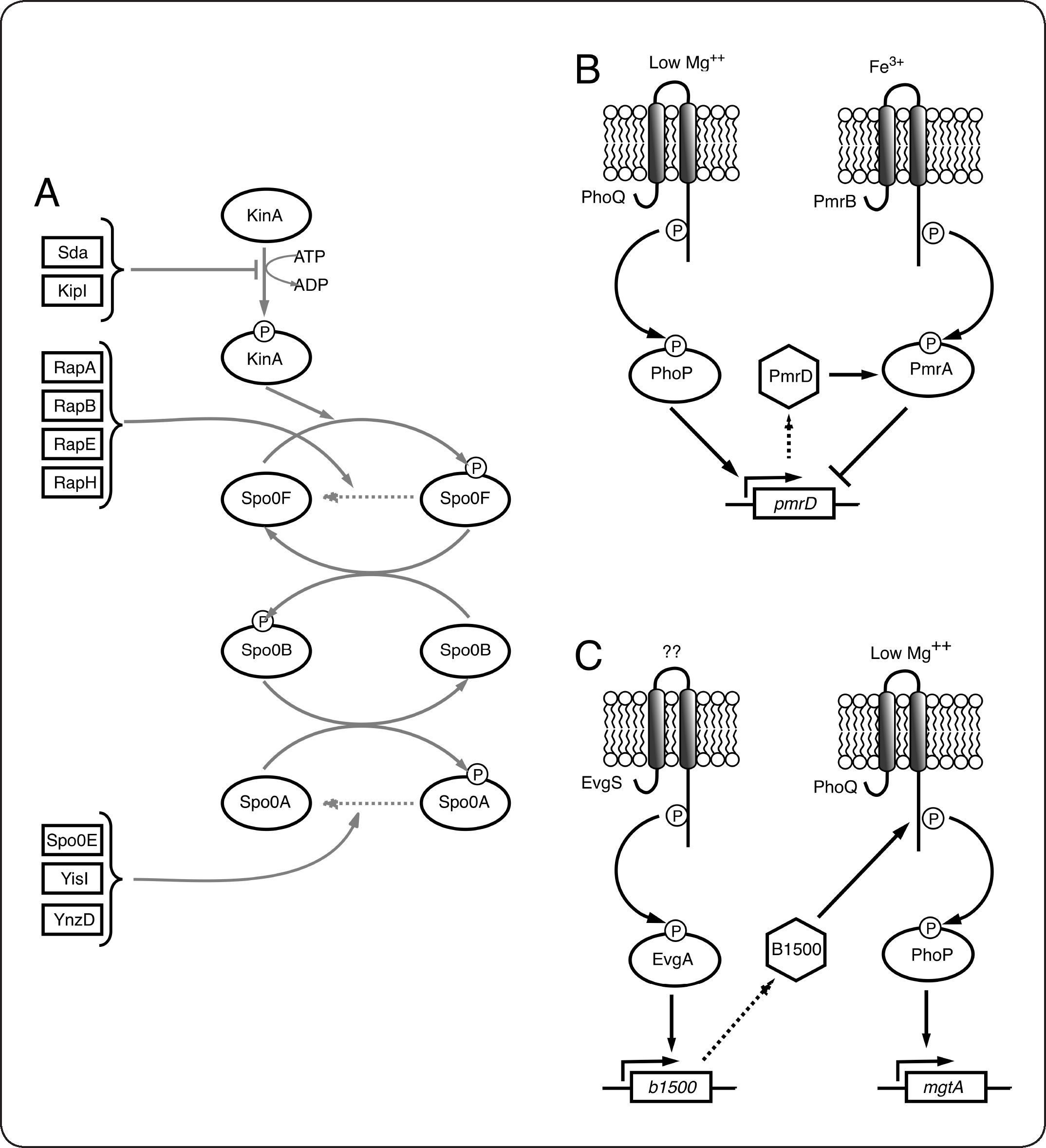
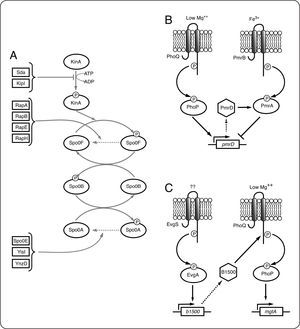
Conectores e integración de señales en SDC bacterianosA medida que más genomas se han secuenciado, la gran complejidad y variación posible en estos sistemas es cada vez más evidente. Además, dado que en la naturaleza las bacterias deben responder a una amplia gama de estímulos simultáneos, es posible pensar que los SDC estén interconectados[55]. De acuerdo con esta idea, se han caracterizado algunos SDC que regulan la actividad de otro SDC mediante el control de la expresión de proteínas llamadas conectores, que modifican los niveles de la forma activa de otra CS u otro RR, o que alteran su actividad. Otra característica de los conectores es que normalmente su expresión es activada por una señal diferente a la que activa al SDC correspondiente. En B. subtilis se han caracterizado conectores que actúan en diferentes niveles en la vía que regula la esporulación en esta bacteria (revisado en [56]). La CS KinA se autofosforila en respuesta a un estímulo aún desconocido y fosforila a Spo0F. Spo0F transfiere el grupo fosforilo a la proteína a Spo0B que finalmente fosforila al RR Spo0A. La forma fosforilada de Spo0A actúa como un factor de transcripción, siendo el activador maestro de la esporulación en este organismo. Los conectores Sda y KipI inhiben la autofosforilación de KinA[57,58]. Las fosfatasas de la familia Rap (RapA, RapB, RapE y RapH), promueven la desfosforilación de spo0F-P. Mientras tanto Spo0E, YisI y YnzD, actúan desestabilizando a Spo0A-P[59,60] (Fig. 6A). Otro ejemplo de regulación mediada por conectores ocurre en el circuito formado por los SDC PhoP/PhoQ y PmrB/PmrA de S. enterica. En condiciones de bajo Mg2+ PhoP/PhoQ se encuentra activo e induce la expresión del conector PmrD. PmrD es una proteína pequeña que se une a PmrA-P y evita su desfosforilación. PmrA-P reprime la transcripción del gen pmrD, lo que establece un circuito de retroalimentación negativa[61–63] (Fig. 6B). Finalmente la proteína B1500 de E. coli conecta los SDC EvgA/EvgB y PhoP/PhoQ[64]. En respuesta a una señal desconocida, el sistema EvgA/EvgB activa la expresión de B1500, que interactúa con la CS PhoQ y promueve la activación de PhoP (Fig. 6C).
Proteínas conectoras en SDC bacterianos. A. En B. subtilis Sda y KipI inhiben la autofosforilación de KinA. Las fosfatasas de la familia Rap promueven la desfosforilación de Spo0F-P. YnzD, YisI y Spo0E por su parte favorecen la desfosforilación de Spo0A. B. La proteína PmrD conecta los SDC PhoQP y PmrBA. La disminución de Mg++ causa la fosforilación de PhoP, que en su forma fosforilada, activa la expresión de pmrD. PmrD se une a PmrA-P y evita su desfosforilación. PmrA-P modifica la expresión de sus genes blanco, entre los cuales está pmrD que es regulado negativamente por PmrA-P. C. En respuesta a una señal no conocida, el RR EvgA-P activa la expresión de b1500. La interacción de B1500 con PhoQ promueve su activación y por lo tanto causa la expresión de los genes regulados por PhoP (mgtA, entre otros).
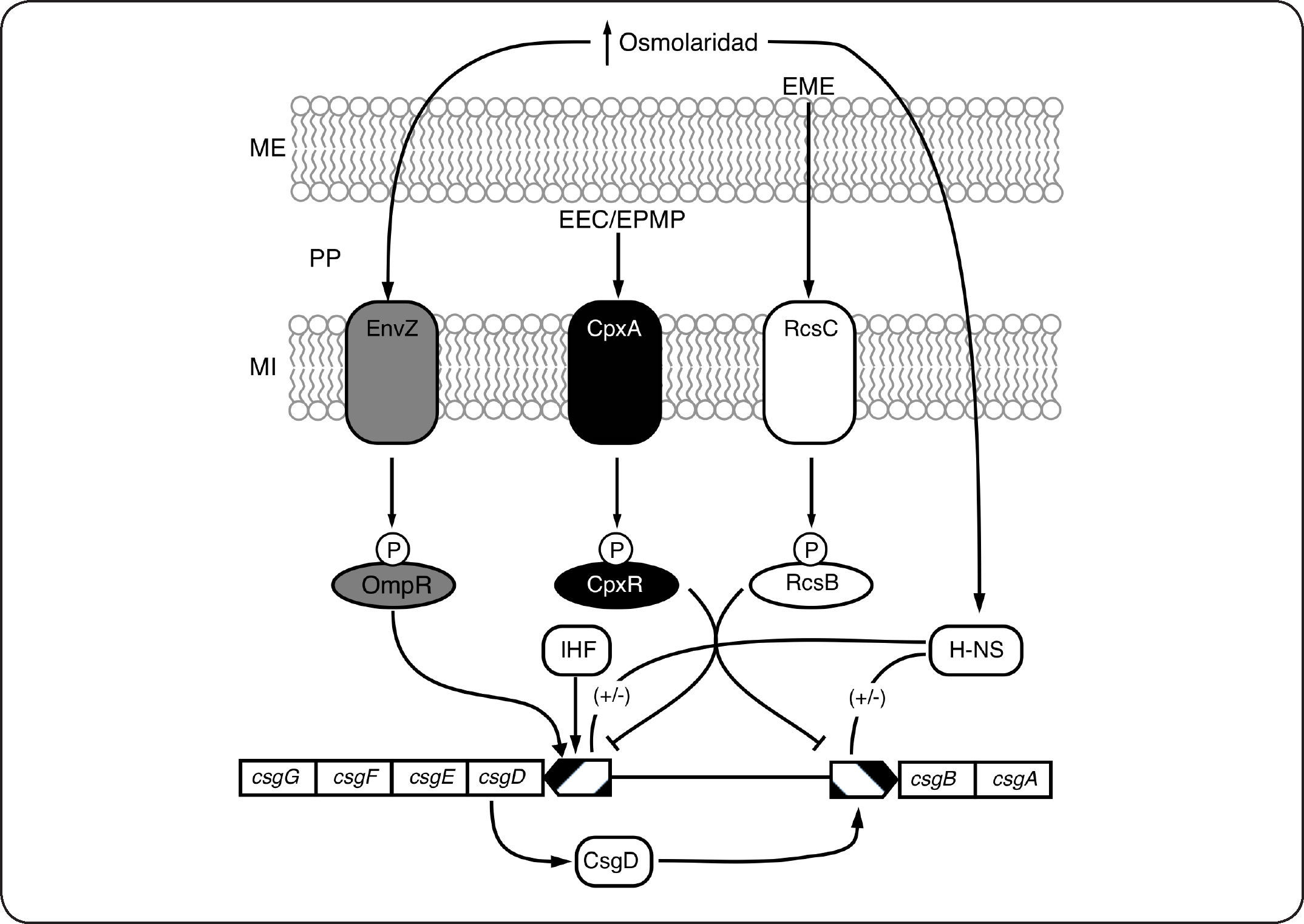
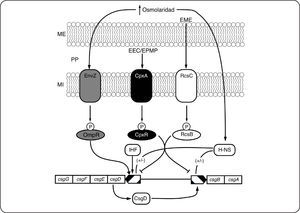
La regulación mediada por varios SDC, permite la integración de diferentes estímulos y la amplificación de las señales, garantizando fidelidad en la señalización. La regulación de los genes involucrados con la formación de curli en E. coli, es ejemplo de un sofisticado circuito formado por tres SDC (EnvZ/OmpR, CpxA/CpxR y RcsC/RcsB) así como por dos reguladores globales (H-NS e IHF) (Fig. 7). Los genes involucrados en la formación de curli están divididos en dos operones, el formado por los genes (csgBA) que codifican para las proteínas estructurales y el formado por los genes csgD (que codifica para el regulador maestro de la síntesis de curli) y csgGFE, que codifican para proteínas involucradas con la exportación y localización de las proteínas estructurales. El SDC EnvZ/OmpR, descrito en secciones anteriores, también regula la producción de curli[53,65]. Se ha descrito que Omp-P puede activar la expresión de csgD[66]. Otro SDC que se sabe está involucrado en la regulación de la producción de curli es el formado por la CS CpxA y el RR CpxR. Este SDC es activado en respuesta a estrés de envoltura celular y/o a estrés de proteínas mal plegadas en el periplasma[67,68]. Se ha demostrado que CpxR-P es un regulador negativo de la expresión de los operones csgBA y csgDEFG[69–71]. EL SDC RscC/RscB es conocido por regular positivamente la síntesis de cápsula en respuesta a estrés de membrana externa[72,73]. Se ha descrito también que RscB-P puede regular negativamente la expresión de csgD[69,74,75] (Fig. 7). En S. typhimurium la eliminación de ihf causa una disminución en la expresión de csgD y por lo tanto en la producción de curli[76]. Finalmente la regulación mediada por HN-S parece ser algo más complicada ya que en S. typhimurium HN-S actúa como regulador positivo[77], pero en E. coli K-12 parece funcionar como un regulador negativo[78]. La regulación de los genes que codifican para las tres enzimas que forman el sistema arginina deiminasa (AD) de Streptococcus gordonii es otro ejemplo de regulación mediada por múltiples SDC. El sistema AD es una vía de tres enzimas que convierte arginina en ornitina, CO2 y amoniaco, produciendo ATP[79] y aumentando la resistencia a estrés ácido[80,81]. Se ha sugerido que los SDC CiaR/CiaH y ComD/ComE se requieren para la expresión pH-dependiente de los genes AD en S. gordonii[82]. Además otro SDC (VicR/VicK) se requiere para la expresión de los genes AD en condiciones de crecimiento anaeróbico[82]. Estos ejemplos muestran que los SDC más que circuitos aislados de percepción y respuesta a estímulos, son una intrincada, compleja y dinámica red de regulación con interconexiones en diferentes niveles, que permite a las bacterias adaptarse a condiciones de crecimiento cambiantes en las que normalmente están expuestas a varios estímulos al mismo tiempo.
Regulación mediada por varios SDC. En respuesta a un incremento en la osmolaridad, el SDC EnvZ/OmpR regula positivamente la expresión de csgD. La proteína IHF también participa en este circuito como un regulador positivo de la expresión de csgD. Dependiendo del organismo y de las condiciones, el regulador global H-NS incide positiva (Salmonella) o negativamente (E. coli K-12) en la formación de curli. En respuesta a estrés de envoltura celular (EEC) y/o estrés de proteínas mal plegadas (EPMP), el SDC CpxA/CpxR regula negativamente la expresión de ambos operones involucrados en la formación de curli. Finalmente, activado por estrés de membrana externa (EME), el RR RcsB-P regula negativamente la expresión de csgD. Membrana externa (ME), membrana interna (MI), periplasma (PP)
A pesar de que estos sistemas de transducción se describieron originalmente en procariontes y han sido establecidos como uno de los mecanismos de señalización más frecuentes en bacterias, su existencia no es exclusiva de este grupo de organismos. Hasta la fecha se han descrito y caracterizado en diversos grupos de hongos, plantas y mohos[83–87]. De acuerdo a estos análisis y a todo lo descrito previamente, este grupo de proteínas no se encuentra en ninguno de los linajes metazoos.
El mecanismo básico de transferencia entre residuos de His y Asp se mantiene en los SDC de diferentes organismos. Sin embargo, en eucariontes se observan importantes modificaciones y adaptaciones con respecto al paradigma bacteriano. Algunas de las más frecuentes y representativas incluyen el predominio de las CS híbridas sobre las prototípicas en prácticamente todos los SDC eucariontes descritos[87]. Por otro lado, en contraste con lo que ocurre en gran parte de los sistemas bacterianos, las CS eucariontes son mayoritariamente citosólicas. Por otro lado, en todos los SDC eucariontes, las CS poseen dos de los tres dominios presentes en las CS híbridas de bacterias (dominio transmisor primario (H1) y dominio receptor primario (D1)), por lo que para completar el fosforrelevo de CS a RR es necesaria la participación de una proteína intermediaria con un dominio transmisor secundario o HPt similar al que en los sistemas bacterianos se encuentra fusionado a las CS híbridas. Este arreglo de los dominios catalíticos se encuentra conservado en diferentes grupos de eucariontes[87,88] y se ha sugerido que es importante para integrar múltiples estímulos a través de estas vías de señalización[89] o inclusive para transmitir las señales del citoplasma al núcleo[90].
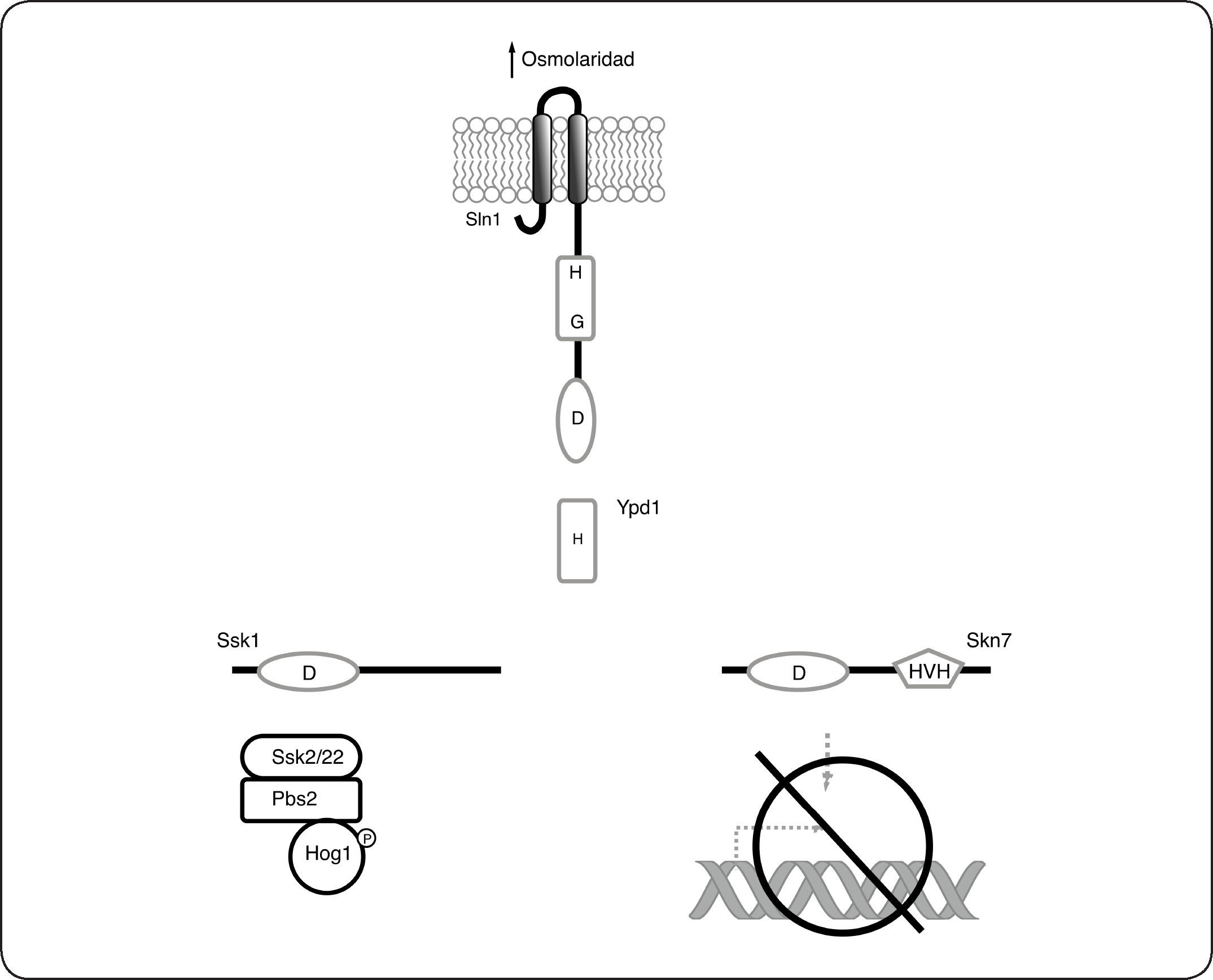
Finalmente a nivel de los RR también existen diferencias importantes. En diversos eucariontes se ha descrito que muchos RR en su estado fosforilado no se unen directamente al ADN para modificar la expresión de sus genes blanco, en lugar de esto, se han adaptado para regular corriente abajo la actividad de los sistemas de señalización típicos de eucariontes, las MAPK. Como ejemplo, la vía de respuesta al estrés osmótico formada por las proteínas Sln1-Ypd1-Ssk1 de S. cerevisiae, descrita en detalle en la sección posterior, regula la actividad de la MAPK Hog1[91]. Otros SDC que regulan la actividad de MAPK de forma similar a la de S. cerevisiae, se han descrito en diversas especies de hongos filamentosos, levaduras[92–94] y plantas[95,96]. Ejemplificando también las diferencias con los SDC procariontes, se ha descrito que en el RR Skn7 de S. cerevisiae, es necesaria la presencia del dominio receptor pero no del residuo Asp conservado[97,98]. Otras adaptaciones que se han encontrado en eucariontes y que difieren con el paradigma descrito en SDC procariontes incluyen el sistema híbrido RdeA-RegA de D. discoideum que regula los niveles de AMPc[99] y la CS híbrida DokA que puede ser regulada por fosforilación en un residuo de serina[100]. Se ha descrito que en diversos genomas bacterianos, el número de genes que codifican para CS y RR es similar, además como ya se ha comentado en secciones anteriores, en condiciones fisiológicas está demostrado que una CS fosforila preferentemente a su RR correspondiente. A diferencia de todo esto, en diversos genomas de hongos filamentosos se observa exclusivamente una expansión de la familia de las CS, por lo que en promedio, existen muchas más CS (entre 11 y 21) que RR (entre 2 y 4). En plantas se observa un mayor número de HPts y RR que de CS, en Arabidopsis thaliana como ejemplo, existen 5 HPts, 8 CS y 22 RR[95,101,102].
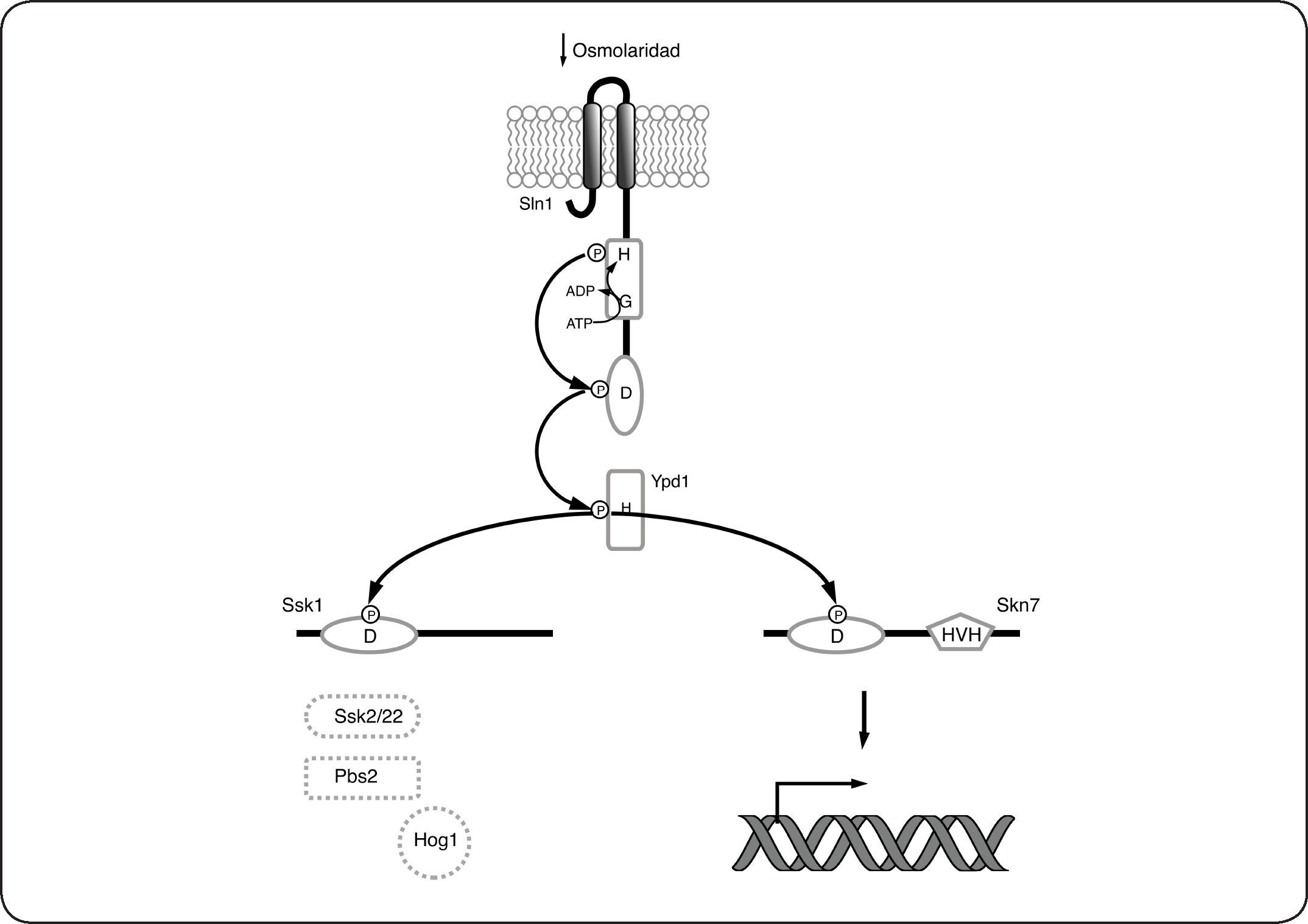
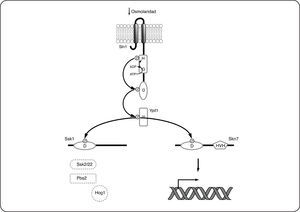
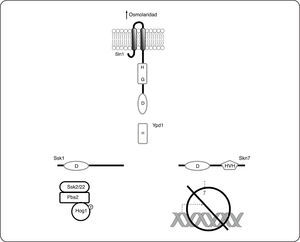
Adaptación a cambios osmóticos en Saccharomyces cerevisiae: el Sistema Sln1-Ypd1-Ssk1-Skn7El SDC más estudiado en eucariontes es el descrito en la levadura S. cerevisiae, y que está constituido por la CS híbrida Sln1, la proteína intermediaria Ypd1 y los RR Ssk1 y Skn7. El funcionamiento de este sistema ha sido usado como modelo en otras especies, porque además de haber sido de los primeros sistemas descubiertos en eucariontes, sus componentes presentan alta identidad con otras proteínas conservadas en diversos grupos de hongos filamentosos y levaduras. Sln1 es una CS híbrida de 1,220 aminoácidos, anclada a la membrana por dos hélices transmembranales (residuos 23 a 46 y 334 a 354). Contiene además un dominio transmisor (573-928) y un dominio receptor (1089-1210). En ausencia de estrés osmótico, Sln1 se encuentra activa como cinasa y se autofosforila en el residuo de histidina conservado (H576)[17,91]. E l g rupo f osforilo s e t ransfiere mediante un fosforrelevo al residuo de aspartato (D1144) y posteriormente al residuo de histidina conservado (H64) en la proteína intermediaria Ypd1, que consta de un único dominio similar al dominio HPt de las CS bacterianas. Finalmente, el grupo fosforilo se transfiere de Ypd1, al residuo de aspartato en el dominio receptor de los reguladores de respuesta Ssk1 (D554) y Skn7 (D427). En su estado fosforilado, Ssk1 no puede interactuar con los componentes corriente abajo en esta cascada de señalización y por lo tanto la vía de Hog1 se encuentra inactiva (Fig. 8). Contrario a lo que ocurre para Ssk1, Skn7 en su estado fosforilado, activa la expresión de genes involucrados con la progresión del ciclo celular y el mantenimiento de la pared celular[103,104] (Fig. 8). El incremento en la osmolaridad y otras condiciones que reducen la turgencia celular, disminuyen la actividad cinasa de Sln1, causando la acumulación de la forma desfosforilada de Sln1, Ypd1 y Ssk1. En su forma no fosforilada Ssk1 interactúa con las MAPKKKs Ssk2 y Ssk22 que fosforilan a la MAPK Hog1 activándola (Fig. 9). Hog1-P regula la expresión de múltiples genes involucrados en respuesta a estrés osmótico como los relacionados en la síntesis de los solutos compatibles trehalosa y glicerol. Las reacciones de fosforilación-desfosforilación de los componentes del sistema Sln1-Ypd1-Ssk1, así como la cinética de estas reacciones han sido bien caracterizadas, y varios estudios proporcionan una descripción detallada de esta vía[105–109] que se resume gráficamente en las Figuras 8 y 9.
Sln1-Ypd1-Ssk1 Skn7 de Saccharomyces cerevisiae en ausencia de estrés osmótico. En estas condiciones Sln1 está activa como cinasa, por lo que fosforila a Ypd1 que a su vez fosforila a Ssk1 y Skn7. La fosforilación de Skn7 lo activa como factor de transcripción, que regula a sus genes blanco, a diferencia de esto último, Ssk1 en su forma fosforilada (Ssk1-P) es incapaz de unirse a las MAPKKK Ssk2/22 por lo que la vía de Hog1 se encuentra inactiva.
SDC Sln1-Ypd1-Ssk1 Skn7 de Saccharomyces cerevisiae en condiciones de estrés osmótico. En presencia de estrés osmótico, Sln1 se inactiva como cinasa, por lo que Ypd1 Ssk1 y Skn7 se encuentran desfosforiladas. Skn7 en su estado no fosforilado no puede unirse al ADN. Al contrario, Ssk1 en su forma no fosforilada interactúa con las MAPKKK Ssk2/22, esta interacción permite la activación corriente abajo, de la MAPK Hog1 lo que ocasiona la expresión de genes relacionados con la síntesis de glicerol y trehalosa, así como otros genes importantes para contender con el estrés osmótico.
El estudio de los SDC en bacterias y eucariontes ha demostrado que estos sistemas representan una compleja y dinámica red de percepción y respuesta a estímulos. Por otro lado, su extensa distribución entre grupos de organismos diferentes, así como su participación en la percepción y respuesta a estímulos diversos, refleja la gran versatilidad de estos circuitos de señalización. La caracterización detallada a nivel estructural, bioquímico y genético de estos sistemas en bacterias ha permitido por un lado tener un panorama más completo de su funcionamiento y relevancia en diferentes grupos de procariontes, además con base en la gran versatilidad y el funcionamiento modular de los SDC, se han empezado a diseñar nuevos y/o modificar circuitos de señalización. A pesar de las similitudes que existen con los SDC de procariontes, en los SDC eucariontes aún se desconocen elementos para entender el funcionamiento detallado de estos sistemas de señalización.
Finalmente, la ausencia de proteínas homólogas a SDC en metazoos, así como su relevancia y amplia distribución en diversos patógenos ha incrementado el interés en el estudio de estos sistemas de señalización para el diseño de fármacos que permitan combatir infecciones causadas por bacterias, levaduras u hongos filamentosos en forma más específica. Además, recientemente se han desarrollado moléculas con gran potencial para el diseño de antibióticos, cuyos mecanismos de acción interfieren en el funcionamiento normal de algunos SDC[110,111]. En algunos casos, estos fármacos son efectivos aún en contra de cepas multi-resistentes a antibióticos.
Se agradece a los doctores Adrián F. Álvarez y Hortencia Silva Jiménez así como a la M. en C. Claudia Rodríguez Rangel (Instituto de Fisiología Celular, UNAM) por sus aportaciones a este manuscrito. También se reconoce el apoyo técnico de la M. en C. Claudia Rodríguez Rangel y el Sr. Pedro Guadalupe Hernández Trujillo. Este trabajo fue apoyado por los donativos 178033 (Consejo Nacional de Ciencia y Tecnología, CONACYT), por la Dirección General de Asuntos del Personal Académico (DGAPA-UNAM IN206412) y la beca 176903 que otorgó el CONACYT a al autor de este artículo para la realización de su proyecto doctoral.