La familia de proteínas Myb, ubicua en los eucariontes, se caracteriza por la presencia de un dominio de unión al ADN característico denominado dominio Myb. Éste consiste en una secuencia de aminoácidos conservados (50-53 aminoácidos) que puede estar repetida entre dos (dominio mínimo de unión al ADN) y hasta cuatro veces en la misma proteína. En las plantas, la familia Myb es muy numerosa, mientras que en los animales sólo se encuentran tres miembros, y en otros eucariontes se ha identificado al menos a un miembro de esta familia. Las proteínas Myb participan como activadores o represores transcripcionales en la regulación de procesos celulares fundamentales en el metabolismo o la diferenciación celular. La actividad de las proteínas Myb se regula a través de diversas modificaciones post-traduccionales dentro de las que destacan el estado redox, la fosforilación y la ubiquitinación.
Myb family proteins are ubiquitous in eukaryotes, and contain a characteristic DNA binding domain called Myb domain. The Myb domain consists in a conserved amino acid sequence (50-53 amino acids) that can be repeated from two (essential domain for DNA binding) to four times in the same protein. In plants, the Myb family is very numerous while in animals there are only three members; at least, one member of this family has been identified in other eukaryotes. Myb proteins participate as transcriptional activators or repressors in the regulation of fundamental cellular processes in metabolism or cell differentiation. Activity from Myb proteins is regulated through several post-translational modifications: redox state, phosphorylation and ubiquitylation stand out among them.
La regulación de la expresión genética a nivel de la transcripción es un mecanismo de control ubicuo en muchos procesos biológicos, como el crecimiento, la diferenciación celular y el metabolismo. Durante el proceso de la transcripción se requiere de la participación de varios factores, que incluyen los complejos remodeladores de cromatina, los factores del complejo de pre-iniciación y el complejo del ARN polimerasa II. Además, se requiere de otros factores que regulan la fuerza del promotor, los cuales se denominan factores de transcripción (FT). Los factores de transcripción son proteínas que reconocen y se unen al ADN (ácido desoxirribonucleico), reconociendo una secuencia específica. Una vez unidos a la región promotora, generalmente cerca del inicio de la transcripción de su gen blanco, aunque también pueden unirse a otros factores o incluso al ARN polimerasa directamente, regulan la frecuencia del inicio de la transcripción. Los FT pueden actuar como activadores, represores o ambos (si tienen una estructura modular) de la transcripción de su(s) gen(es) blanco. Con base en la estructura del dominio de unión al ADN, los factores de transcripción se han podido clasificar en familias, como los factores con: dedos de zinc, hélice-giro-hélice, cremallera de leucina y hélice-bucle-hélice, entre otros.
Dentro de la familia de FT hélice-giro-hélice se encuentran los factores de transcripción tipo Myb. El primer gen myb que se identificó fue el oncogen v-myb del virus del mieloblastoma aviar1. Desde entonces, se han identificado diversas proteínas con dominios Myb en los protozoarios, los hongos, las algas, las plantas y los animales2-7.
En general, los FT Myb se han implicado en la regulación de procesos fundamentales, como el control de la proliferación y la diferenciación celular, la regulación del metabolismo y la señalización celular en respuesta a estímulos externos.
En este trabajo, discutimos la clasificación de los factores Myb, con base en sus características estructurales, sus funciones y mecanismos de regulación, en diversos organismos eucariontes.
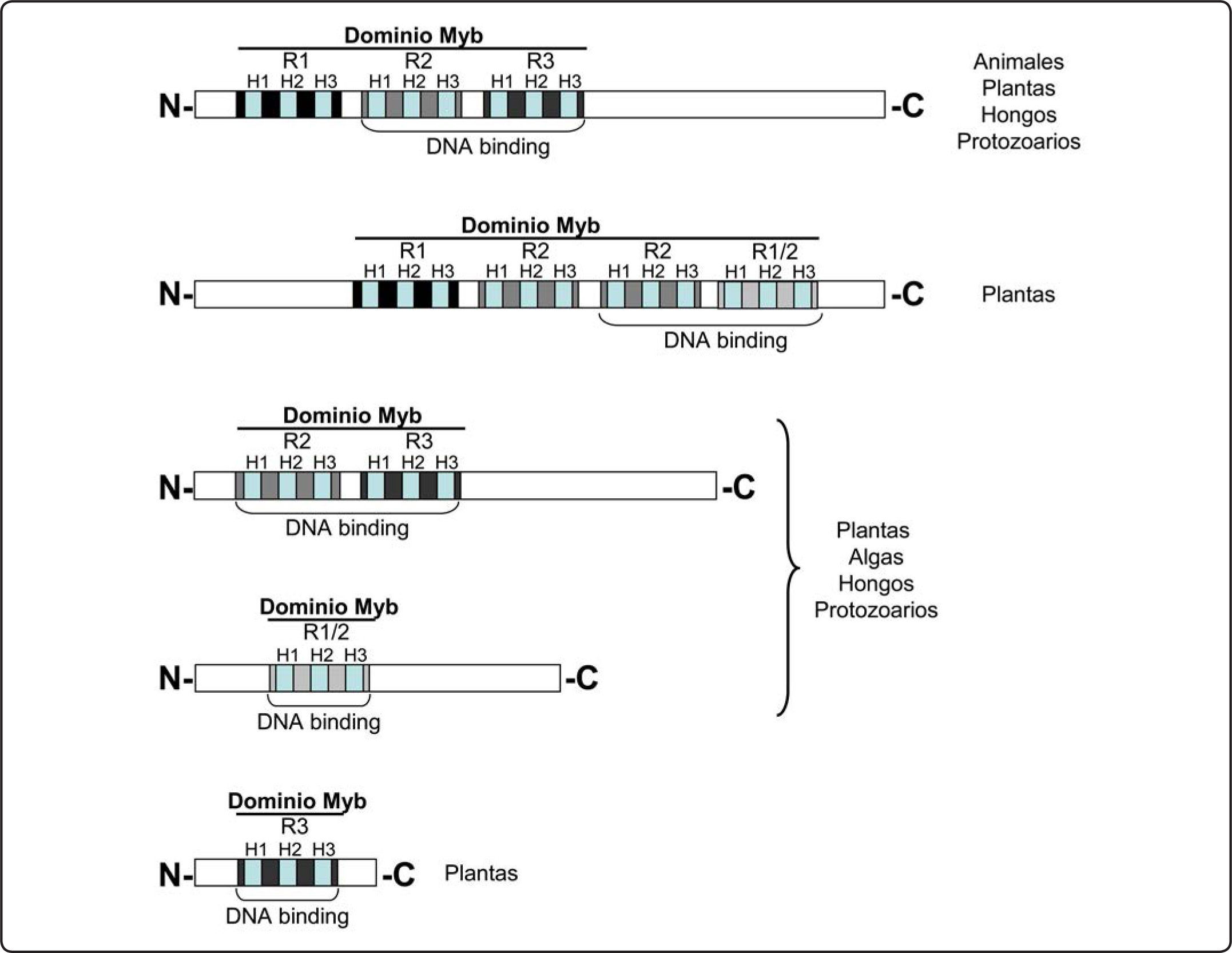
El dominio MybUna característica común de las proteínas Myb es la presencia de un dominio de unión al ADN que se encuentra conservado entre los animales, las plantas, los protozoarios y los hongos, típicamente cerca de la región N-terminal. Un dominio Myb mínimo consiste en dos regiones de cerca de 50 aminoácidos de longitud, que son capaces de formar tres hélices alfa (H1-H3) cada una, y así unirse al ADN8. Gran parte de las proteínas Myb presentan tres secuencias repetidas imperfectas (designadas como R1, R2 y R3)8 de esta región, aunque también se han identificado proteínas con cuatro o más segmentos repetidos9 (Figura 1). Cada una de estas secuencias repetidas imperfectas contiene tres residuos de triptófano (o aminoácidos hidrofóbicos) espaciados regularmente10 (Figura 2), los cuales constituyen un centro hidrofóbico en el plegamiento tridimensional hélice-giro-hélice de cada región repetida11, que le confiere estabilidad a la unión al ADN.
Clases de proteínas Myb. El esquema muestra las diferentes clases de proteínas Myb presentes en los organismos eucariontes dependiendo del número de secuencias repetidas, señaladas por R1, R2, R3. Se indica la estructura secundaria (hélice) mediante las barras H1, H2, H3 y el dominio de unión al ADN por medio de corchetes.
Aminoácidos conservados en dominios Myb R2R3 de distintos grupos filogenéticos. Se indica la longitud de la secuencia repetida R2 y R3 en color negro. Los asteriscos representan los residuos de triptófano o residuos aromáticos espaciados característicos de los dominios Myb. El residuo de cisteína conservado dentro del dominio Myb, el cual está involucrado en la regulación redox de algunas proteínas Myb in vitro se indica en un rectángulo.
Las secuencias repetidas de la proteína Myb prototipo, la proteína c-Myb, son referidas como R1, R2, y R3. Los segmentos repetidos de otras proteínas Myb se nombran de acuerdo a su similitud con R1, R2 ó R3 de c-Myb. Debido a la poca similitud en la secuencia fuera del dominio Myb, las proteínas Myb se han clasificado de acuerdo al número de secuencias repetidas adyacentes: Myb R1R2R3 (Myb 3R), Myb R2R3, Myb R (o relacionados a Myb) y Myb R1R2R2R1/2 (Myb 4R) (Figuras 1).
Sólo las secuencias R2 y R3 se requieren para la unión al ADN en forma específica (dominio mínimo de unión al ADN)8, mientras que R1 se piensa que estabiliza el complejo ADN-proteína a través de interacciones electrostáticas12,13. El elemento de reconocimiento de Myb en el ADN (MRE por sus siglas en inglés) se definió como la secuencia consenso PyAACG/TG14,15. Esta secuencia se reconoce a través del motivo doble HTH (hélice-giro-hélice), usando la tercer hélice alfa de reconocimiento (más conservada), una de R2 y una de R3, que unidas al ADN están empacadas en el surco mayor16. Los residuos clave que hacen contacto directo con las bases del ADN incluyen K128 (R2), N183 (R3) y K182 (R3)17. De este modo, la primera mitad del sitio, YAAC, es reconocido principalmente por R3 y la segunda mitad del sitio, NGHH, por R216, lo que da la apariencia de dímeros ligados covalentemente13. Las proteínas Myb R2R3 se cree que se unen al ADN en un modo similar.
Las proteínas Myb con sólo una secuencia repetida no se pueden unir al ADN como tal, sino que deben formar heterodímeros u homodímeros, lo que permite a estas proteínas reconocer al ADN con alta afinidad y especificidad9.
La estructura que muestran los segmentos repetidos de las proteínas Myb es parecida a la de los dominios SANT, éstos se han identificado previamente en proteínas reguladoras de la cromatina, como Swi3 de levadura, Ada2 de levadura, NcoR de humano, TFIIIB de levadura e ISWI18. Los dominios SANT son incapaces de unirse al ADN pero reconocen las colas de las histonas e interaccionan con enzimas modificadoras de histonas, como las acetilasas y desacetilasas, y complejos remodeladores de cromatina dependientes de ATP19, de este modo facilitan el reconocimiento del sustrato y aumentan la actividad de las enzimas modificadoras de histonas20.
Las proteínas Myb en los animalesDentro del genoma de los vertebrados se reportan pocos genes myb, sus productos se clasifican en tres formas generales, A-Myb, B-Myb y c-Myb, que comparten los dominios de unión al ADN con secuencias de aminoácidos similares y que se unen a la misma secuencia de reconocimiento3,21,22. Como se ha indicado, estas proteínas contienen en la parte amino terminal las tres secuencias repetidas características (R1, R2 y R3) (Figura 1). Además, se ha identificado un dominio de activación transcripcional como una región hidrofílica en la parte central de la proteína, mientras que la parte carboxilo terminal podría representar un dominio regulador negativo3.
c-myb se expresa en un número limitado de tipos celulares diferenciados y también tiene un papel crítico en las etapas tempranas de la hematopoyesis. En las células hematopoyéticas juega un papel en regular el balance entre la proliferación y la diferenciación. En efecto, la sobre-expresión de c-myb inhibe la diferenciación del precursor de células hematopoyéticas, mientras que la pérdida de expresión inhibe la proliferación y causa falla de la hematopoyesis intrafetal lo que lleva a la muerte3. A-myb se expresa en el sistema nervioso central durante el desarrollo, en la línea germinal de los linfocitos B, en el epitelio de los conductos de la glándula mamaria y en los testículos. A-Myb regula de manera positiva la proliferación celular, la inactivación de A-myb en ratón causa un bloqueo en el desarrollo de la glándula mamaria y una espermatogénesis restringida. B-myb es un gen que se expresa de forma ubicua y regula en forma positiva el crecimiento y la diferenciación celular; la inactivación de B-myb en ratones produce la muerte del feto en etapas tempranas del desarrollo23.
Se ha reportado que el domino de unión al ADN de c-Myb interacciona con la cola N-terminal de las histonas H3 y H3.3, lo que las hace accesibles para ser acetiladas en K18 y K23. La unión a la cola de la histona y la acetilación junto con las proteínas de unión al enhancer CCAAT (C/EBP, bZIP), son necesarias para la activación de los genes de diferenciación mim-1 y lisozima en células hematopoyéticas. La sustitución de los tres aminoácidos (I91N, L106H, y V117D) en R2 determina la carcinogenicidad de la oncoproteína retroviral v-Myb, ya que en estos casos se produce una interacción defectuosa con C/EBP y se elimina la interacción con la histona H3 y su acetilación, con lo que se inhibe la activación de los genes de diferenciación celular. Esto demuestra que Myb tiene u na función directa en la organización de la cromatina y la modificación de las histonas a través de su dominio de unión al ADN y que estas funciones están ausentes en la variante leucemogénica20. Estos datos indican que las proteínas Myb regulan la expresión genética, probablemente a través de la modificación del estado de la cromatina (acetilación).
Las proteínas Myb en las plantasA diferencia de lo que ocurre en los animales, la familia de proteínas Myb es una de las clases de factores de transcripción más numerosa en las plantas9,24. Se han identificado aproximadamente 200 genes myb en la planta de algodón25, más de 125 genes que codifican para proteínas Myb en el genoma de Arabidopsis, más de 80 genes en maíz y aproximadamente 30 genes myb en Petunia hybrida, los cuales exhiben entre el 40% y el 60% de identidad con el dominio Myb de la proto-oncoproteína c-Myb de los vertebrados26-28.
En las plantas se encuentran las cuatro clases o subfamilias de proteínas Myb descritas: Myb 4R, que contiene cuatro segmentos repetidos parecidos a R1/R2; Myb R, proteínas con un solo segmento repetido Myb o una secuencia repetida parcial; Myb 3R, que contiene tres segmentos repetidos y Myb R2R3, con dos segmentos repetidos (Figura 1), y que es la subfamilia más abundante. Se han identificado varias funciones bien definidas para los factores de transcripción Myb en las plantas: controlan el metabolismo primario y secundario (biosíntesis de flavonoides y antocianinas), el ciclo celular (regulación de la expresión de la ciclina B y otros genes en la transición de la fase G2/M29) y la morfogénesis celular (regulan la formación de los tricomas y los pelos de la raíz), tienen papeles en la embriogénesis30, controlan la diferenciación de la cubierta externa de la semilla, la forma de las células epidermales de los pétalos, el desarrollo de la inflorescencia temprana y la germinación de las semillas, regulan el crecimiento celular, la fotosíntesis, la foración y el movimiento de las hojas en relación al fotoperíodo29,31 al activar la expresión de genes diurnos mientras bloquean la expresión de genes nocturnos32. Además participan en el desarrollo y en la regulación de genes de respuesta al estrés biótico y abiótico, como el estrés osmótico y el salino, la desecación, la congelación, la limitación de fosfato, la presencia de hormonas y el ataque de patógenos2,5,9,29,33. Se ha visto que varias proteínas Myb R2R3 son necesarias para la formación de la raíz y el control de la biosíntesis de la pared celular: activan la síntesis de lignina en fibras y/o vasos; regulan la deposición de lignina en las raíces, la deposición de celulosa y xilano, el desarrollo y/o funcionalidad de las anteras, el grosor de la pared celular en fibras celulares, la producción de mucílago, el control de la apertura de los estomas, la biosíntesis de glucosinolato y glucosinolatos alifáticos en segmentos aéreos, la producción de glucosinolatos indólicos en raíces y en las hojas de roseta en estado tardío9.
Algunas de las funciones de diversos miembros de la familia Myb de plantas y otros organismos eucariontes como las algas y los protozoarios se resumen en la Tabla I. El estudio de diversas funciones biológicas en organismos unicelulares como las algas, resulta importante para entender el origen y evolución de los organismos eucariontes fotosintéticos. Asimismo la identificación y estudio de los homólogos del proto-oncogen myb en protistas ciliados apoya el origen en eucariontes unicelulares34.
Función de las proteínas Myb en diversos organismos.
| Organismo | Proteína y/o Familia | Función | Ref. |
|---|---|---|---|
| Arabidopsis thaliana | pc-Myb, MybR1R2R3 | Control del ciclo celular: regula la expresión de la ciclina B y otros genes en la transición de la fase G2/M | 9, 29, 31, 35, 36 |
| Arabidopsis thaliana | MYB12, PAP1, PAP2 | Síntesis de fLavonoides y antocianinas | 37 |
| Oryza sativa | OsMYB3R-2 | Regulación de la vía DREB/CBF de respuesta al estrés | 29 |
| Arabidopsis thaliana | CCA1, LHY, Myb SHAQK(F/Y) | Componentes del oscilador central circadiano: regulan el crecimiento celular, la fotosíntesis, la foración y el movimiento de las hojas | 9, 29, 31, 32 |
| Arabidopsis thaliana y otras plantas | Myb R2R3 | Regulación de la biosíntesis de fLavonoides y antocianinas, biosíntesis de la pared celular, embriogénesis | 9, 29, 30 |
| Plantas diversas | MybR1 | Control de la morfogénesis celular y el metabolismo secundario, respuesta a la limitación de fosfato | 5, 9, 29, 33, 37 |
| Chlamydomonas reinhardtii | Psr1, MybR1 | Respuesta a la limitación de fostafo | 33 |
| Cyanidioschyzon merolae | CmMYB1, MybR2R3 | Asimilación de nitrógeno | 38 |
| Entamoeba histolytica | EhMyb10, MybR2R3 Otros MybR2R3 EhMyb-dr, MybSHAQKY | Transducción de señales, transporte vesicular, respuesta a choque térmico y virulencia Regula genes de enquistamiento | 6 39 |
| Giardia lamblia | gMyb2, MybR1R1 | Síntesis de proteínas de la pared del quiste | 40 |
| Dictyostelium discoideum | DdMyb1, MybR1R2R3 | Desconocida | 4 |
| DdMYB2, MybR1R2R3 | Expresión del gen ACA y producción de cAMP extracelular (quimiotaxis, agregación y diferenciación) | 41 | |
| DdMyb3, MybR1R2R3 | Formación del tallo del cuerpo fructífero, síntesis de los factores peptídicos SDF-1 y SDF-2, maduración de esporas | 42 | |
| MybE, MybSHAQKY | Regula genes inducibles DIF en células para formar el tallo y genes del cuerpo fructífero | 43 | |
| Phytophthora infestans | MybR2R3 MybR1R2R3 | Esporulación y liberación de zoosporas | 44 |
| Sterkiella histriomuscorum | MybR1R2R3 | Crecimiento vegetativo | 34 |
| Euplotes aediculatus | MybR2R3 | Crecimiento vegetativo | 34 |
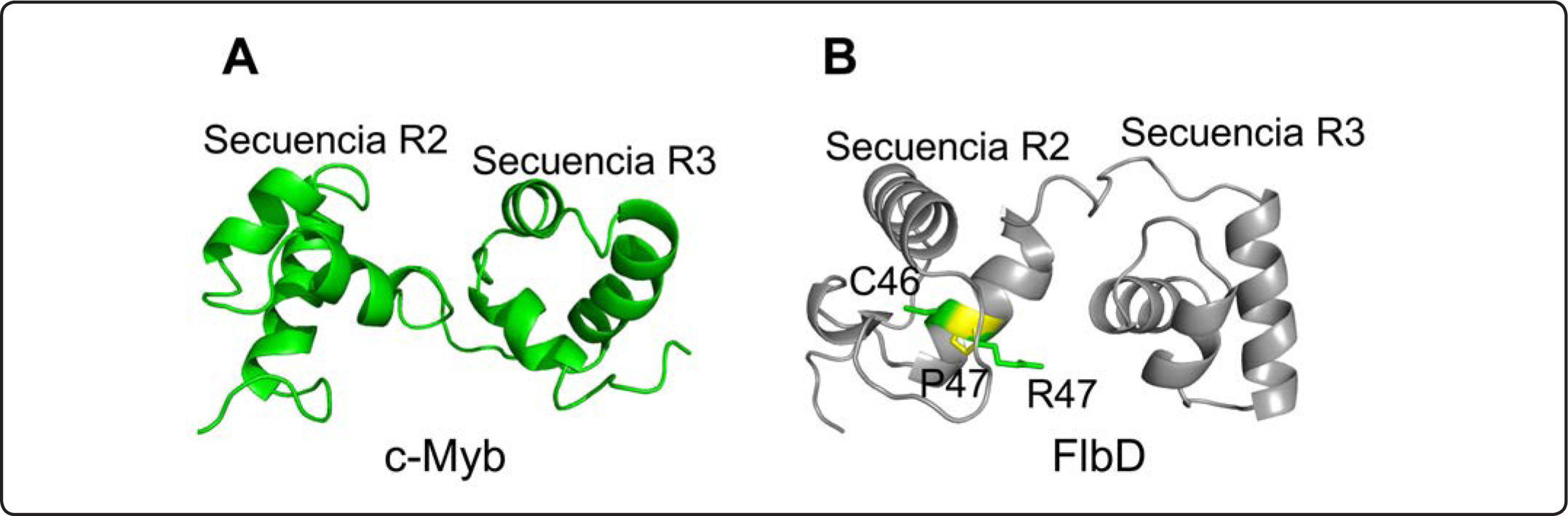
En el hongo filamentoso Aspergillus nidulans se identificó el gen flbD como miembro de la familia myb que incluye al proto-oncogen c-myb. El dominio de unión al ADN de FlbD contiene dos secuencias repetidas con un arreglo estructural clásico de la proteína c-Myb (Figura 3), pero a diferencia de los dominios clásicos que contienen tres residuos de triptófano críticos espaciados cada 18 ó 19 aminoácidos, cada uno presenta sólo dos triptófanos con una tirosina en la posición esperada para el tercer triptófano en la primer secuencia repetida, y una isoleucina en la posición del primer triptófano de la segunda secuencia repetida7 (Figura 2). Estas sustituciones han sido observadas en otras proteínas Myb de plantas que mantienen su función como activadores transcripcionales (Figura 2). Además contiene el residuo de cisteína altamente conservado entre los miembros de la familia Myb en la secuencia repetida R2 (Figura 2), el cual se ha propuesto que tiene un papel en la regulación redox de la unión de Myb al ADN46,47.
Dominio Myb de la proteína c-Myb y un modelo de la región correspondiente de FlbD. Representación de Ribbon del dominio de unión al ADN R2R3 de la proteína Myb FlbD de A. nidulans (color gris) (B) basado en el modelo de la proteína c-Myb (color verde) (código PDB 1MSF P06876) (A). Los residuos C46 y R47 corresponden a los aminoácidos conservados en diversos miembros de la familia Myb. Se ha reportado que C46 juega un papel en la regulación redox in vitro. El cambio R47P en FlbD resulta en una proteína inactiva45, lo cual podría deberse a la consecuente disminución del pKa de la C46 y la disminución de su reactividad. Las proteínas fueron modeladas con el programa PyMOL.
flbD se expresa de manera constitutiva en hifas vegetativas y en etapas tempranas del desarrollo asexual7,48. Recientemente, se ha encontrado que FlbB, un factor de transcripción bZIP, activa la expresión de flbD y que ambos factores en conjunto activan la expresión del gen brlA (codifica para un factor de transcripción con dos dominios de dedos de zinc), el regulador primario de la conidiación en A. nidulans48. Adicionalmente, se ha identificado una nueva función para FlbD en el desarrollo sexual, las mutantes en flbD son incapaces de desarrollar el peridio, un tejido externo especializado que se diferencia durante la formación de los cuerpos fructíferos y termina rodeando las ascas y las esporas sexuales. Las esporas desnudas producidas por una mutante en flb D son viables y su desarrollo depende de la NADPH oxidasa NoxA aun en un fondo flbD nulo45.
En el hongo Neurospora crassa se ha identificado el homólogo funcional del gen flbD de A. nidulans. Ese gen se denominó rca-1 (regulador de la conidiación en Aspergillus) y codifica para una proteína de 229 aminoácidos que muestra el 57% de identidad con FlbD en la región del dominio de unión al ADN. rca-1 puede complementar el defecto de conidiación de la mutante en flbD; además la expresión forzada de rca-1 induce la conidiación de A. nidulans en cultivos sumergidos como ocurre con la sobreexpresión de flbD. Sin embargo, no se ha demostrado si rca-1 también complementa los defectos de la mutante en flbD durante el desarrollo sexual. Por otro lado, la cancelación de rca-1 en N. crassa no tuvo efecto sobre el crecimiento, la macroconidiación, la microconidiación o la formación de ascosporas (la mutante nula se comporta igual a la cepa silvestre como cepa femenina o masculina en cruzas meióticas). El único fenotipo que presentó la mutante rca-1 fue un crecimiento hifal recto o en contra de las manecillas del reloj, en comparación con la cepa silvestre donde se observa crecimiento espiral en el sentido de las manecillas del reloj49.
En el ascomiceto patógeno de plantas Gibberella zeae se encontraron dos genes que codifican para un posible factor de transcripción tipo Myb (MYT1 y MYT2, respectivamente). MYT1 se expresa de manera constitutiva durante el estado vegetativo y el desarrollo sexual. La cancelación de MYT1 da por resultado la producción de peritecios con ascosporas inmaduras cuando se realizan cruzas homotálicas o en cruzas como cepa femenina. Una mutante nula no muestra un fenotipo en el crecimiento vegetativo, la producción de conidias, la germinación, la virulencia y la producción de micotoxinas. Sin embargo, la sobreexpresión de MYT1 acelera la germinación y el crecimiento, y reduce la producción de micotoxinas en comparación a la cepa silvestre, indicando que MYT1 afecta la expresión de los genes involucrados en el crecimiento vegetativo y el metabolismo secundario50. Por su parte, MYT2 regula el tamaño de los peritecios. La sobreexpresión de MYT2 muestra fenotipos pleiotrópicos que afectan el crecimiento vegetativo, la producción de conidias, la virulencia y la producción de micotoxinas51.
En Saccharomyces cerevisiae, Bas1p contiene el dominio de unión al ADN localizado en la parte N-terminal de la proteína. Este dominio está compuesto de tres secuencias repetidas en tandem conteniendo residuos de triptófano altamente conservados (Figura 2), que son esenciales para la unión al ADN y para su función in vivo52. Bas1p en conjunto con Bas2p, una proteína homeodominio, se requieren para activar la expresión de los genes de biosíntesis de AMP en levadura a partir de 5´fosforibosil-1-pirofosfato (genes ADE). La expresión de esos genes disminuye a nivel transcripcional en presencia de adenina exógena en el medio. De este modo, estos genes también se requieren para la regulación por adenina y además activan la expresión de tres genes en la vía de biosíntesis de la histidina53.
Además de los residuos de triptófano conservados, Bas1p contiene en la segunda secuencia repetida un residuo de cisteína, C153, que como se ha mencionado, está conservado en muchos de los miembros de la familia Myb (Figura 2). Este residuo ha sido mostrado como crítico para la regulación redox de la unión al ADN de c-Myb in vitro46,47. Sustituciones del residuo de cisteína C153 en Bas1p indican que no obstante su muy alta conservación, éste no es estrictamente requerido para llevar a cabo la función de Bas1p. Al sustituirlo por aminoácidos cargados (C153R, C153K y C153D) se obtuvo una proteína carente de función in vitro e in vivo. En cambio al reemplazarla con un residuo pequeño hidrofóbico (C153A, C153S y C153V) la proteína fue completamente funcional in vitro e in vivo. La C153 es accesible a un agente alquilante en la proteína libre y es protegida al ponerse en contacto con el ADN previamente, ya que al unirse con el ADN se genera un cambio conformacional en donde la cisteína queda empacada en el núcleo hidrofóbico de la secuencia repetida R254, como ocurre en el caso de c-Myb. Adicionalmente, dentro del dominio de unión al ADN, Bas1p contiene otros dos residuos de cisteína, uno en cada secuencia repetida. La mutación de los residuos C82A y C206V en el primer y tercer segmento repetido respectivamente, mostró que estos residuos tampoco son esenciales para la función de Bas1p. No obstante, se ha visto que la unión de Bas1p al ADN in vitro se inhibe completamente en presencia de diamida o selenito de sodio51, lo que indica que Bas1p es susceptible a la oxidación, dependendiendo principalmente del residuo de cisteína C153 localizado en el segundo segmento repetido del dominio de unión al ADN, ya que la mutación de los residuos C82A y/o C206V, sólo en combinación con la mutación en la C153V, muestran resistencia a la oxidación por diamida y son capaces de unirse al ADN in vitro54.
Para demostrar la función de Bas1p in vivo, se reemplazaron los tres residuos de cisteína por residuos hidrofóbicos (C82A, C153V, C206V), produciendo una proteína cuya capacidad de unión al ADN in vitro en condiciones de concentración elevada de diamida no se vio afectada. Sin embargo, en una mutante BAS1 carente de las tres cisteínas, la expresión de los genes ADE está reprimida después del tratamiento con diamida. Esto indica que la sensibilidad redox de la unión al ADN de Bas1p a través de los residuos de cisteína observada in vitro no es responsable de la regulación redox de los genes ADE in vivo. Asimismo, la regulación redox de los genes ADE requiere la interacción de las proteínas Bas1p y Bas2p para restaurar la expresión de los genes ADE aún en condiciones de estrés oxidante. Por otro lado, al estudiar la interacción de Bas1p y Bas2p se encontró que ésta es bloqueada por estrés oxidante como sugiere una fusión experimental Bas1p-Bas2p55, aunque no se ha demostrado el mecanismo por el cual la interacción Bas1p/Bas2p se daña en condiciones de estrés oxidante.
Regulación de las proteínas MybLos dominios de unión al ADN en un factor de transcripción tienen su principal función en reconocer una secuencia específica del ADN, pero además pueden llevar a cabo interacciones proteína-proteína. El dominio Myb puede ser modificado a nivel post-traduccional por fosforilación, ubiquitinación, acetilación, sumoilación y por el estado redox. Estas modificaciones pueden afectar la actividad de Myb al alterar el nivel de proteína, la unión al ADN o la capacidad de transactivación23,56,57. En las plantas se ha visto que los genes myb también pueden ser blanco de microRNAs (miRNAs) y de silenciamiento del RNAs (ta-siRNAs)9.
En estudios comparativos entre los tres DBD (DNA binding domain, por sus siglas en inglés) de A-Myb, B-Myb y c-Myb de vertebrados, se observó que éstos se comportan diferente como sustratos para diferentes cinasas: la proteína caseína cinasa II (CK2) y la cinasa dependiente de cAMP (PKA) fosforilan el DBD de c-Myb. Los tres DBD son fosforilados por CK2 en la región N-terminal, aunque en distintos sitios, probablemente en R1, mientras que sólo c-Myb es fosforilado por PKA. En cambio B-Myb no tiene conservado el sitio de fosforilación para PKA23.
Por otra parte, la proteína cinasa activada por mitógenos (MAPK), p42mapk, fosforila a c-Myb murino en S528, localizada cerca al dominio de regulación negativa hacia la parte carboxilo terminal de la proteína. El reemplazo de esta serina con alanina (S528A) mejora la habilidad de c-Myb para activar la expresión de un promotor sintético in vivo e incrementa la transcripción de algunos genes blanco58. Asimismo, durante el desarrollo temprano del xilema, la MAPK p42mapk (PtMAPK6) puede fosforilar la proteína Myb R2R3 PtMYB4 de la planta Pinus taeda en el residuo S236, localizado en el dominio de activación carboxilo terminal en un contexto que se comparte con otras proteínas Myb de plantas. La fosforilación de ese residuo no afecta la unión al ADN in vitro pero sí altera la habilidad de PtMYB4 para promover la activación transcripcional en la levadura59. Algunas proteínas Myb R1R2R3, Myb R1, Myb R4 o parecidas a Myb, son reguladas positivamente por fosforilación vía un complejo de cinasas dependiente de ciclinas en la etapa G2/M del ciclo celular, lo cual elimina la actividad reguladora negativa de la región C-terminal de Myb9,59.
La cisteína es uno de los residuos de aminoácido más conservados durante la evolución de las proteínas y ha sido implicado en unión al ADN, interacciones proteína-proteína y la regulación redox de varias proteínas60. Las proteínas Myb parecen regularse por redox. En la secuencia repetida R2 contienen un residuo de cisteína invariante (Figura 2), C130 (en c-Myb de humano), cuya reducción es esencial para la unión de c-Myb al ADN in vitro. Este residuo es sensible a condiciones oxidantes, impidiendo la unión específica al ADN, ya que controla el cambio conformacional en R2 inducido por la unión al ADN47. No obstante, en la proteína v-Myb la sustitución C65S (equivalente a la C130 de c-Myb) no activa la transcripción in vivo ni transforma células mieloides, aunque sí es transportada al núcleo60.
Las proteínas A-, B- y c-Myb de vertebrados tienen una cisteína adicional en R1, localizada en una posición que corresponde a C130 en R2. A-Myb contiene sólo esas dos cisteínas, pero c-Myb contiene una tercer cisteína en la región N-terminal, mientras que B-Myb contiene cuatro cisteínas distribuidas a través del DBD. La sensibilidad redox de A-Myb es comparable a c-Myb, mientras que B-Myb es mucho más sensible a condiciones oxidantes comparado con las otras dos proteínas23, lo cual podría explicarse por la presencia de los cuatro residuos de cisteína en el dominio de unión al ADN. Estos estudios acerca de la sensibilidad redox se realizaron incluyendo la región amino terminal y el dominio Myb R1R2R3 y no se observaron los mismos efectos con las secuencias repetidas R2R3 de c-Myb61. Esto sugiere que la cisteína de la segunda secuencia repetida en A- y c-Myb tienen un papel mayor en la modificación redox de unión al ADN. La hipótesis coincide con el análisis minucioso de la modificación de la cisteína C153 en Bas1p de S. cerevisiae, indicando que la sensibilidad redox de la cisteína de la segunda secuencia repetida es una característica altamente conservada de la familia Myb54. Dado que ni la región amino terminal ni la secuencia repetida R1 participan directamente en el reconocimiento del ADN, la oxidación de las cisteínas en esas regiones no parece tener efecto alguno sobre la interacción con el ADN.
En A. nidulans se evaluaron los efectos de alelos mutantes que afectan la actividad de unión de FlbD al ADN (R47P, R47K, C46D, C46S y C46A) en el desarrollo asexual y sexual. La modificación de R47P se presume que disminuye la reactividad de la cisteína C46 al modificar su pKa (Figura 3), mientras que R47K resulta equivalente en la carga aunque no en tamaño. Los diversos alelos mutantes en la C46 y R47 mostraron defectos en la conidiación, excepto la mutante flbDC46A que sólo mostró el defecto en cultivos líquidos en condiciones de limitación de nitrógeno. Este último dato sugiere que FlbD también participa en la respuesta a la limitación de nitrógeno45, como CmMYB1 en el alga Cyanidioschyzon merolae, e induce la expresión de genes necesarios para la asimilación de nitrógeno, CmNRT (codifica para un transportador de nitrato/nitrito), CmNAR (codifica una nitrato reductasa), CmNIR (codifica para una nitrito reductasa), CmAMT (codifica para un transportador de amonio de alta afinidad), y CmGS (codifica para una glutamino sintetasa)38. Durante el proceso de diferenciación sexual en A. nidulans y otros hongos se ha identificado la producción de especies reactivas del oxígeno62,63 lo que hace factible la regulación redox de FlbD durante esta etapa. Con respecto a esto, se observó que las mutantes R47K, R47P, C46D y C46S presentan defectos en el desarrollo del tejido peridial (tejido externo que rodea las ascas y las esporas sexuales), mientras que la mutante flbDC46A mostró desarrollo normal del peridio y un incremento en la producción de cuerpos fructíferos. Estos datos sugieren que los cambios en la cisteína conservada o en el residuo de arginina contiguo, que también está conservado en otras proteínas Myb, modifican la actividad de unión de FlbD al ADN, que es la responsable de regular la diferenciación asexual y sexual45.
Por otro lado, se ha visto que agentes que generan NO (óxido nítrico) inhiben la actividad de unión al ADN de c-Myb y esta sensibilidad depende de la C130 conservada en R264. En plantas también se ha reportado la regulación in vitro de la proteína Myb AtMyb2 (proteína Myb R2R3 típica de Arabidopsis thaliana) por S-nitrosilación involucrando al residuo de cisteína C53 (equivalente a C130)65.
A diferencia de las proteínas Myb R1R2R3 de animales que sólo tienen una cisteína a través de la cual parecen regularse por redox, muchas proteínas Myb R2R3 de plantas contienen dos cisteínas, C49 y C53, siendo la C53 la equivalente a la C130 en las proteínas Myb R1R2R3. La C49 se encuentra conservada en dominios Myb R2R3 típicos, pero no está presente en los dominios Myb atípicos o en los dominios Myb de proteínas PC-Myb (Myb R1R2R3)66.
Un ejemplo de proteínas Myb con dos cisteínas es P1, el regulador de la biosíntesis de los flavonoides en maíz, una proteína típica Myb R2R3. Un análisis in vitro indicó que la mutante en la C53S se une al ADN en condiciones reducidas, mientras que la C53A se une al ADN tanto en condiciones oxidantes como reductoras. Estos datos indican que la C53 no es esencial para la unión al ADN y en efecto, ninguno de los cambios realizados en C53 afectó la actividad reguladora de P1 in vivo. Por su parte, las mutantes C49S y C49A se unen al ADN independientemente de las condiciones redox. En condiciones oxidantes, la C49 y la C53 forman un puente disulfuro que impide la unión del dominio Myb R2R3 al ADN66. La formación de este puente disulfuro podría ser un punto de regulación de la actividad de unión al ADN de las proteínas Myb de plantas, que no se comparte con los dominios Myb de animales.
Adicionalmente, el hecho de que todos los genes regulados por proteínas Myb se expresan en tejidos específicos y sólo en algunas células es considerado como parte del mecanismo de regulación. La especificidad de las proteínas Myb y los genes que son regulados en cada tipo celular en muchas ocasiones requiere la participación de otros factores de transcripción, cofactores o proteínas accesorias cuyo sitio de unión se localiza adyacente a los sitios de unión Myb sobre los promotores. Es con dichas proteínas que los factores Myb cooperan para activar el promotor blanco57.
Mediante experimentos de activación transcripcional in vivo se ha indicado que para la actividad completa de v-Myb y c-Myb se requiere del MRE (elemento de reconocimiento de Myb) y una extensión adicional río abajo rica en timina, en una cadena específica. La secuencia repetida R1 de c-Myb parece funcionar como una cuña en la formación del complejo Myb-ADN, permitiendo que se abran las secuencias vecinas río abajo en presencia y ausencia de secuencias ricas en AT (adenina-timina), formando así un complejo estable67. Este complejo también puede obtenerse a través de otro factor regulador que se une a elementos adyacentes en una región específica del ADN y funciona como un co-activador, que induce de modo similar un asa en la estructura terciaria del promotor para así regular la expresión de genes blanco en conjunto con el factor de transcripción Myb. Algunos ejemplos de este tipo de co-regulación incluyen, c-Myb y AML1 (Runt) que regulan la expresión del receptor de células T murino; C1 (Myb) y R (hélice-giro-hélice) que regulan la expresión del gen Bronze1 de maíz; Bas1 (Myb) y Bas2/ Pho2 (homeodominio) que regulan la expresión del gen HIS4 de levadura67. La interacción proteína-proteína mejor descrita es la cooperación entre factores Myb R2R3 y proteínas del grupo hélice-bucle-hélice básico (bHLH). La especificidad de la interacción entre Myb y la región N-terminal de las proteínas bHLH se ha mapeado con la firma ((D/E)Lx2(R/K)x3Lx6Lx3R) en la secuencia repetida R3. La habilidad de las proteínas R3 para interactuar con proteínas bHLH es crucial para sus funciones reguladoras negativas porque éstas compiten por la unión con sus parejas Myb R2R3, sin embargo, las proteínas R3 no se unen solas al ADN9.
La actividad de los factores de transcripción Myb modulada por ubiquitinación ocurre en los residuos de lisina cercanos al dominio de activación de la transcripción, aumentando la actividad transcripcional y/o la degradación. En Arabidopsis, AtMYB18, se ubiquitina por COP1, pero la estabilidad de AtMYB18 puede ser incrementada por interacción con el factor bHLH, HFR1. Por su parte, la modulación de la actividad del factor de transcripción por sumoilación puede ocurrir por múltiples mecanismos incluyendo cambios en la localización celular, la actividad de unión al ADN o la disminución en la actividad del dominio de activación, como se describió para c-Myb en animales9.
ConclusionesLa familia de proteínas Myb se encuentra distribuida en todos los organismos eucariontes desempeñando funciones a nivel celular o bien tejido específicas que incluyen diversos procesos de diferenciación, desarrollo y regulación del metabolismo primario y secundario. Para llevar a cabo las diferentes funciones puede o no requerirse de la participación conjunta de otro tipo de factores de transcripción lo que favorece que la función sea aún más específica. Además las proteínas Myb son sujetos de modificaciones post-traduccionales que regulan la cantidad de proteína y la afinidad de unión al ADN. Dentro de los mecanismos de regulación el estado redox es primordial al determinar la unión al ADN, aunque no se ha demostrado que todas las proteínas Myb sean reguladas de esta forma, la cisteína involucrada se ha mantenido conservada a través de la evolución de la familia Myb.
Durante los estudios de doctorado Jenny Arratia Quijada contó con el apoyo económico de la DGEP-UNAM y del Consejo Nacional de Ciencia y Tecnología (CONACYT) (Número de becario 166609) para la elaboración del presente trabajo. Además, realizó una estancia de investigación en la Facultad de Ciencias de Orsay en París, Francia, la cual estuvo financiada por un donativo del Dr. Claudio Schazzocchio.
Este trabajo fue financiado por los donativos CB-2005-01-49667 y 153256 del CONACYT y IN209211-2 de la Dirección General de Asuntos del Personal Académico, UNAM (PAPIIT-UNAM), así como por el donativo en colaboración DFG-CONACYT Alemania-México 75306.
Se agradece la ayuda del M. en C. César Ismael Ortiz García para modelar la proteína FlbD.