El lupus eritematoso (LE) es una enfermedad inflamatoria autoinmune que incluye un amplio espectro de manifestaciones, desde el tipo sistémico (lupus eritematoso sistémico [LES]) a la variante limitada a la piel: lupus eritematoso cutáneo (LEC).
El compromiso cutáneo ocurre en el 90% de los pacientes con LES.
Se divide en 3 categorías: LEC crónico (LECC), subagudo (LECSA) y agudo (LECA), basándose en la morfología y en el examen histopatológico.
La etiología precisa del LE no se comprende totalmente, pero la enfermedad se manifiesta cuando factores medioambientales, drogas y agentes infecciosos desencadenan una respuesta inmune anormal en un individuo con factores genéticos predisponentes.
Para evaluar el compromiso cutáneo se han desarrollado varios sistemas de puntuación a lo largo de los años. El último, llamado CLASI (Cutaneous Lupus Erythematosus Disease Area and Severity Index), estadifica el daño mucocutáneo y la actividad de la enfermedad separadamente, permitiendo así estandarizar la evaluación de la respuesta terapéutica.
El manejo del LEC es un desafío. Aunque el tratamiento tradicional es la fotoprotección, los esteroides tópicos y los antipalúdicos, estas medidas a veces son inefectivas en un subgrupo de pacientes. A esta situación la denominamos LE cutáneo resistente.
Este artículo revisa las opciones terapéuticas tópicas y sistémicas, tanto los tratamientos clásicos como las nuevas alternativas disponibles en la actualidad.
Lupus erythematosus (LE) is an autoimmune inflammatory disease that includes a broad spectrum of manifestations, ranging from systemic disease (systemic lupus erythematosus [SLE]) to purely cutaneous forms (cutaneous lupus erythematosus [CLE]).
Cutaneous involvement occurs in 90% of patients with SLE.
Based on morphological and histopathological features, CLE can be divided into three categories: chronic CLE, subacute CLE and acute CLE.
The precise etiology of LE is not fully understood, but the disease occurs when environmental factors, drugs and infectious agents trigger an abnormal immune response in an individual with predisposing genetic factors.
To assess cutaneous involvement, several scores have been developed over the years. A recent study, called CLASI (Cutaneous Lupus Erythematosus Disease Area and Severity Index), staged mucocutaneous damage and disease activity separately, allowing assessment of therapeutic response to be standardized.
The management of CLE is challenging. Although treatment traditionally consists of photoprotection, topical steroids and antimalarial agents, these measures are sometimes ineffective in subgroup of patients, giving rise to what is called resistant CLE.
This article reviews the topical and systemic treatment options, both the classical and new treatment alternatives currently available.
El lupus eritematoso (LE) es una enfermedad inflamatoria de etiología desconocida. Es el prototipo de enfermedades autoinmunes determinadas, tanto en su desarrollo como en las reagudizaciones, por factores ambientales, genéticos y hormonales. Se caracteriza principalmente por la presencia de múltiples autoanticuerpos antinucleares (ANA). La enfermedad afecta en mayor medida a mujeres de entre 20 y 40 años, aunque puede presentarse en personas de cualquier edad y sexo1.
Se estima que alrededor de 5millones de personas en el mundo padecen lupus eritematoso sistémico (LES), y del 60 al 65% tienen síntomas cutáneos en algún punto de su enfermedad, los cuales constituyen la segunda causa más común por la que los pacientes con LES inicialmente buscan atención médica, por detrás del compromiso articular1,2.
Las manifestaciones clínicas del LE se presentan en un rango que va desde efectos leves, tales como enfermedad limitada a la piel en el lupus eritematoso cutáneo (LEC), hasta las manifestaciones serias y amenazadoras para la vida que pueden encontrarse en el LES.
El LES es definido basándose en los criterios de Colegio Americano de Reumatología (ARA) de 19823,4 y actualizados en 1997. Estas pautas contienen 4 criterios sistémicos, 3 componentes de laboratorio y 4 criterios cutáneos. Se puede diagnosticar LES con solo los criterios cutáneos (erupción malar, rash discoide, fotosensibilidad y úlceras orales)5.
El LEC es de 2 a 3 veces más común que el LES, y esto se debe a que no todas las personas con LEC reúnen la totalidad de criterios del ARA2.
La importancia del LEC radica en que puede manifestarse con clínica polimorfa, como lesiones aisladas; puede ser predictor de LES y servir para el diagnóstico de LES, como mencionamos en el párrafo anterior.
Aunque el tratamiento tradicional de LEC es la fotoprotección, los esteroides tópicos y los antipalúdicos, estas medidas a veces son insuficientes en un subgrupo de pacientes. A esta situación la denominamos LE cutáneo resistente6.
Las manifestaciones cutáneas pueden clasificarse como específicas (tabla 1) o no específicas, basándose en la morfología de las lesiones y en el examen histopatológico7.Los síntomas específicos se definen como aquellos que se encuentran exclusivamente en personas con LE y no se observan en otras enfermedades. Además, se clasifican en LEC agudos (LECA), subagudos (LECSA) y crónicos (LECC)7,8.
Manifestaciones cutáneas específicas de lupus eritematoso (LE)
| Lupus eritematoso cutáneo crónico (LECC) |
| LE discoide clásico (LED) |
| LED localizado |
| LED generalizado |
| LE hipertrófico/verrucoso |
| LE liquenoide (superposición LE/liquen plano) |
| LE sabañón |
| LE palmoplantar erosivo |
| LE túmidus |
| LE de mucosas (oral y conjuntival) |
| Lupus profundo/lupus paniculitis |
| Lupus eritematoso cutáneo subagudo (LECSA) |
| Tipo anular policíclico |
| Tipo papuloescamoso o psoriasiforme |
| Lupus eritematoso cutáneo agudo (LECA) |
| Eritema malar |
| Eritema maculopapular diseminado |
Adaptado de Fabbri et al.7.
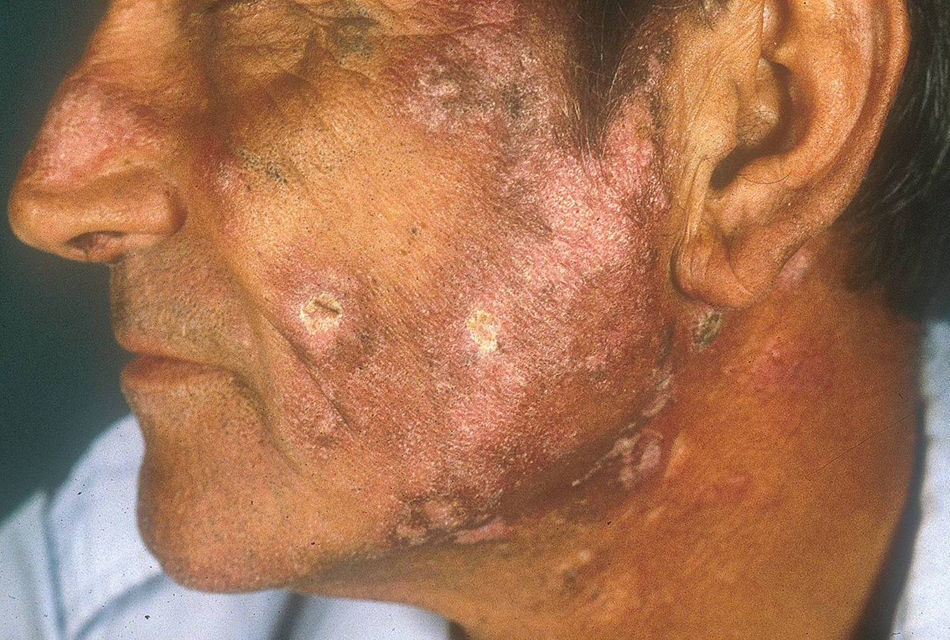
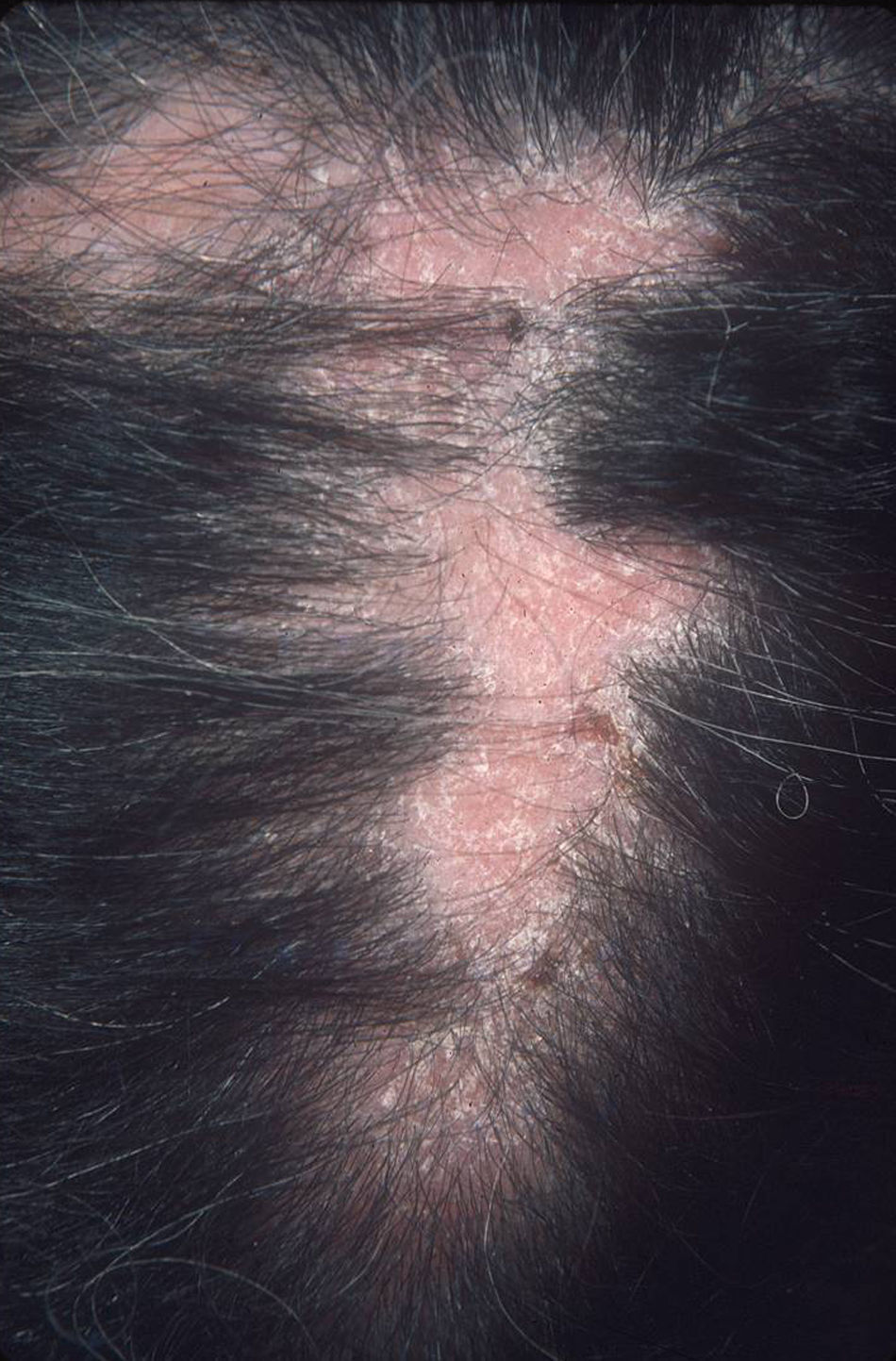
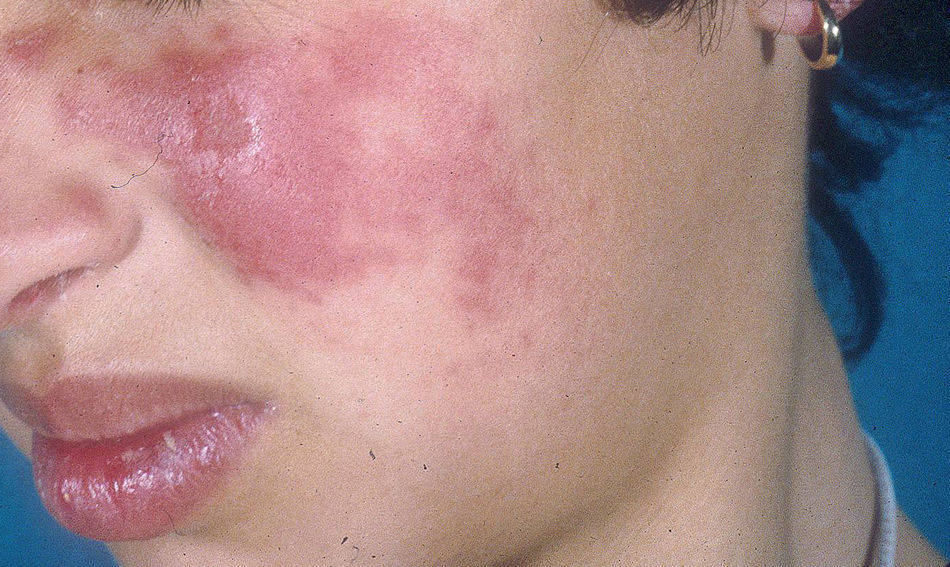
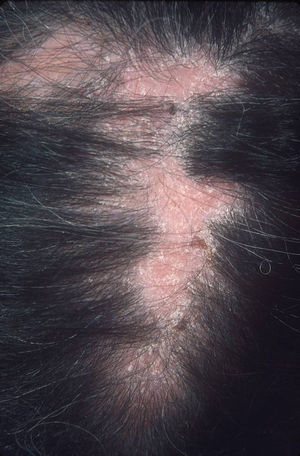
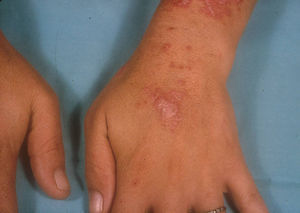
El subtipo más común de LECC es la forma discoide (LED)1,9. El 90% de las personas con LED nunca reunirán todos los criterios para LES, aunque un 10% eventualmente cumple los criterios de LES en el transcurso de los años. El LED clásico se divide en localizado (lesiones por encima del cuello), que es la forma más común, o generalizado (por encima y debajo del cuello con compromiso típico de las caras extensoras de antebrazos y manos). Clínicamente las lesiones comienzan como máculas o pápulas purpúricas de morfología discoide y extensión gradual, con escamas adherentes que se extienden hacia los folículos pilosos. El centro es generalmente atrófico e hipopigmentado y la periferia hiperpigmentada (fig. 1). La mitad de los pacientes pueden desarrollar cicatrices significativas, con alopecia cicatricial (fig. 2) en un tercio de ellos1,10. Las artralgias pueden ocurrir en LECC y pueden indicar riesgo incrementado de desarrollar LES1.
Entre otras variantes de LECC se incluyen: LED verrucoso/hipertrófico, síndrome overlap LE/liquen plano, LE paniculitis, LE tumidus, LE sabañón y LE de mucosas.
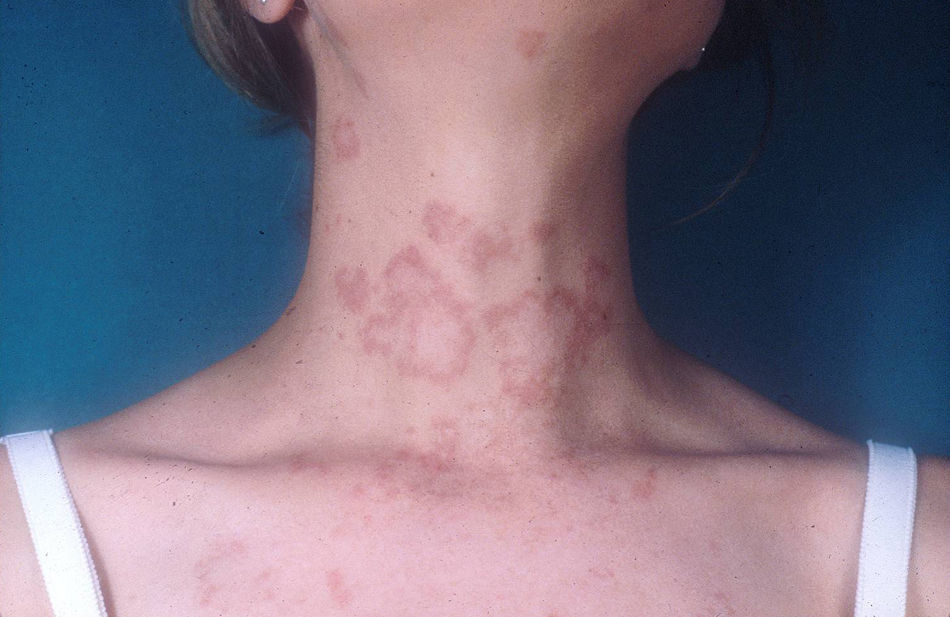
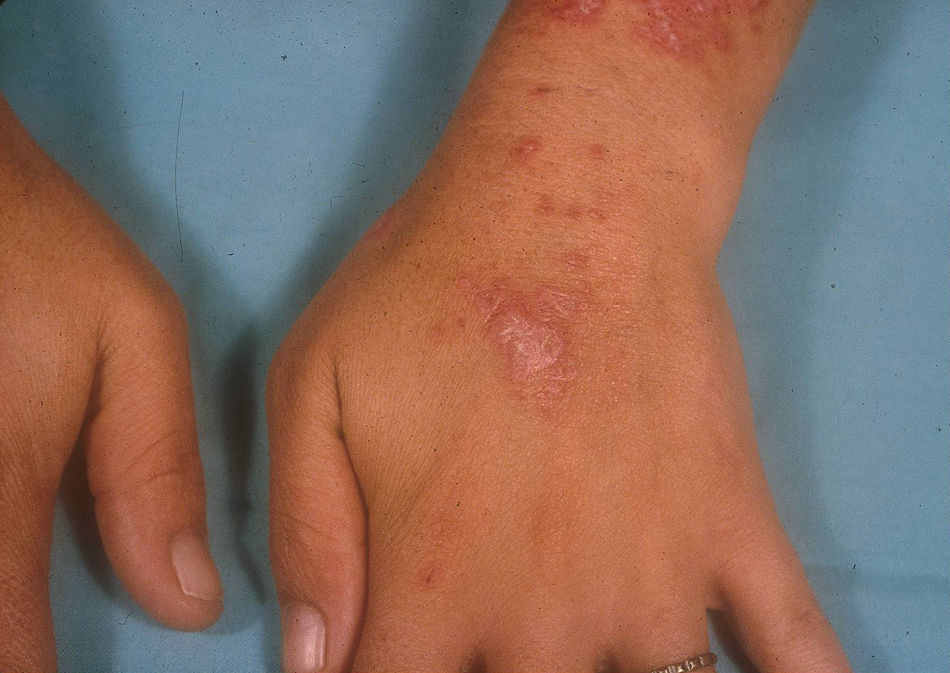
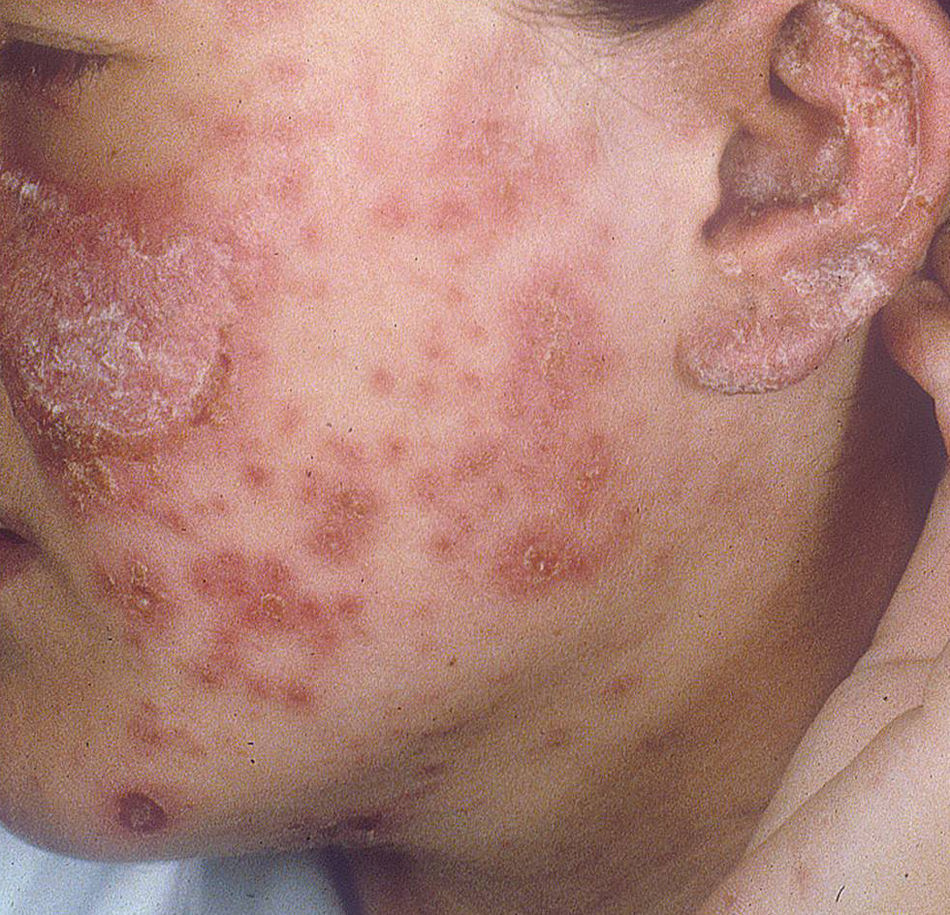
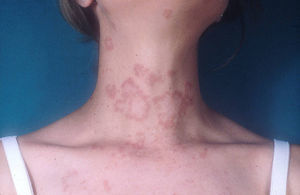
Lupus eritematoso cutáneo subagudoEl LECSA es un subgrupo distinto situado entre la variedad de lupus agudo (LECA) y el LECC. Incluye pacientes con lesiones no cicatriciales eritematosas, pápulas y placas cubiertas por finas escamas. Estas lesiones se expanden produciendo disposición retiforme o anular, a veces con aclaramiento central (fig. 3). La forma papuloescamosa ocurre más frecuentemente que la anular (fig. 4). También presentan pronunciada sensibilidad a la luz, síntomas musculoesqueléticos, anormalidades serológicas y variedad de síntomas sistémicos leves7. Aproximadamente la mitad reúne los criterios de LES2.
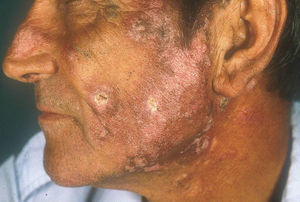
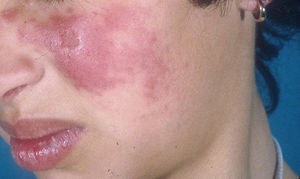
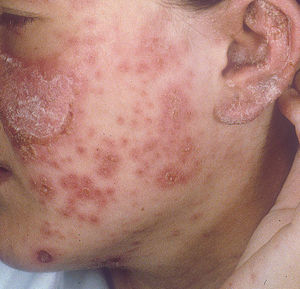
Lupus eritematoso cutáneo agudoLas lesiones de LECA aparecen casi exclusivamente en pacientes con LES activo. Se manifiesta como eritema y edema sobre las regiones malares, conocido como rash en mariposa (figs. 5 y 6). Ocurre en el 20 al 60% de los pacientes con LES. Existe una variante menos frecuente, generalizada, que se presenta como erupción morbiliforme o exantematosa; ambas formas son generalmente transitorias y duran días a semanas11,12.
Los síntomas cutáneos no específicos de LE se definen como aquellos que se presentan en personas con diagnóstico de LES pero que no son exclusivos de esta enfermedad y también se encuentran en otras patologías autoinmunes. Algunos de los más comunes son: fenómeno de Raynaud, vasculitis, fotosensibilidad (sensibilidad excesiva a la luz) y úlceras orales. Las lesiones cutáneas no específicas se asocian con una mayor actividad del LES1,2,11,12.
EtiopatogeniaLa etiología precisa de LE no se comprende totalmente, pero la enfermedad se manifiesta cuando factores medioambientales, drogas y agentes infecciosos desencadenan una respuesta inmune anormal en una persona con factores genéticos predisponentes. La enfermedad está asociada casi siempre con el desarrollo de autoanticuerpos que se han relacionado directamente con las manifestaciones patológicas. En un estudio se encontró que el 88% de los individuos con LES tienen al menos un autoanticuerpo en un promedio de 3,3años previo al diagnóstico13.
Los autoanticuerpos se desarrollan en presencia de células T disfuncionales o defectos en la señalización y tolerancia inmune, o cuando hay pérdida de células reguladoras que controlan la autorreactividad. La proliferación resultante de células B conduce a la formación de autoanticuerpos y complejos inmunes que producen inflamación y daño tisular.
Existe una inhibición de la estimulación de células B que se ha focalizado en las interacciones ligando-receptor vía estimulador-linfocito B (B-lymphocyte stimulator [BLyS]) y un ligando inductor de proliferación (proliferation-inducing ligand [APRIL]), los cuales son miembros de la familia del factor de necrosis tumoral (TNF). BLyS juega un rol clave en la diferenciación, la homeostasis y la selección de células B y sus niveles están aumentados en los brotes de LES14.
Además, hay una clara relación genética en el desarrollo de LES, como se evidencia por la concordancia de un 24 a 58% entre gemelos monocigotos15. Más de 30 genes han sido relacionados con LE, y entre ellos se incluyen los genes específicos del complejo mayor de histocompatibilidad (DR2, DR3, DR4, DR8) que están involucrados en el reconocimiento de lo propio, presentación de antígenos, señalización celular, regulación inmune; los genes receptores implicados en la respuesta inmune, y los alelos de citocinas (p.ej., interleucina10)11. Todos estos factores serían responsables del desarrollo de la enfermedad al actuar sobre un huésped susceptible genéticamente, alterando la respuesta inmune mononuclear-fagocítica y del complemento, y desencadenando la síntesis de autoanticuerpos citotóxicos y la formación de complejos inmunes circulantes.
Evaluación del compromiso cutáneoEl compromiso cutáneo ocurre en el 90% de los pacientes con LES12. Sin embargo, la afectación de piel y mucosas en el LE es uno de los aspectos menos estudiados de forma sistemática entre las enfermedades autoinmunes. Se han desarrollado varios instrumentos a lo largo del tiempo para cuantificar la afección de LE: índices como el SLEDAI (SLE Disease Activity Index), el LACC (Lupus Activity Criteria Count) o el SLICC/ACR damage Index for LES, pero solo documentan la presencia o ausencia de síntomas, entre los cuales se cuentan las manifestaciones cutáneas16. Werth et al.16,17 diseñaron un nuevo sistema que estandariza la enfermedad. Este sistema, llamado Cutaneous Lupus Erythematosus Disease Area and Severity Index (CLASI), estadifica el daño cutáneo y la actividad de la enfermedad por separado, permitiendo así estandarizar la evaluación de la respuesta terapéutica.
El índice evalúa, en 13 localizaciones anatómicas (cuero cabelludo, orejas, nariz, área malar, resto del rostro, V del escote, cuello posterior u hombros, tórax, abdomen, espalda y muslos, brazos, manos, piernas y pies), el grado de eritema (que oscila entre ausencia a rojo oscuro/púrpura en escala de 0 a 3) y escama/hipertrofia (ausente a verrucoso/hipertrófico en escala 0 a 2). Además estadifica el compromiso de mucosas (ausente o lesión/ulceración) y alopecia en cuero cabelludo (ausente, focal o diseminada en más de un cuadrante).
La evaluación del compromiso cutáneo en el LE, solo con el índice CLASI, es insuficiente. Es necesaria la evaluación de la calidad de vida, la respuesta global del paciente y el dolor para dar un enfoque completo de la enfermedad y, por consiguiente, del tratamiento adecuado18.
DiagnósticoComo se mencionó con anterioridad, el diagnóstico de LES se establece cuando se cumplen 4 de los 11 criterios establecidos por el ARA. El diagnóstico de todas las formas cutáneas de LE se determina por los hallazgos clínicos. La histopatología es cualitativamente similar en cada una de las formas específicas de LEC, y por lo tanto es útil para contribuir al diagnóstico pero no para determinar el subtipo clínico1. Con respecto a la serología, la evaluación de los autoanticuerpos nos orienta para descartar la presencia de LES, pero su rol es más limitado en las formas de LEC1,3.
Antes de iniciar el tratamiento de los pacientes con LEC es esencial buscar la presencia de signos de afectación sistémica, debido a que algunos casos de LES inicialmente se presentan con LEC1. El enfoque inicial debe incluir anamnesis completa, examen físico, hemograma, velocidad de sedimentación globular, ANA y análisis de orina. Si el paciente tiene ANA positivos o se sospecha que tenga LES aunque no tenga ANA, solicitamos anti-SSA (anti Ro), anti-SSB (anti La), anti-RNP, anti-DNA de doble cadena (ds), anti-Sm y complemento. Los pacientes con resultados positivos deben seguirse más estrechamente, en particular los pacientes con anti-DNA ds, ya que tiene un mayor riesgo de desarrollar patología renal y por lo tanto la analítica de orina y la creatinina deben determinarse con mayor frecuencia. Los anticuerpos anti-Sm aparecen solo en el 20% de los pacientes con LES, pero son muy específicos. Los anti-SSA son marcadores de LECSA y síndrome de Sjögren. Aproximadamente el 40% de los pacientes con LE presentan anticuerpos antifosfolípidos que se asocian con trombosis y abortos espontáneos18.
TratamientoUno de los aspectos más difíciles del LEC es su manejo1,7. Es muy importante diagnosticar el tipo específico de LEC y formular un esquema de tratamiento antes de iniciar la terapia, debido a las grandes diferencias en el pronóstico según la variedad clínica7.
Las opciones terapéuticas son similares para todos los tipos de LEC, aunque los pacientes con afectación sistémica pueden requerir tratamientos adicionales para sus manifestaciones extracutáneas12.
El tratamiento debería ser escalonado, y el primer paso debe incluir la educación de los pacientes sobre la protección solar, el uso de ropa adecuada y la modificación de los hábitos.
La elección del tratamiento depende de la gravedad, del tipo, de la extensión y de la respuesta clínica empírica de los síntomas cutáneos. El manejo de LEC consta de tratamientos locales y sistémicos2.
Como terapia sistémica de primera línea, los antipalúdicos son considerados la piedra angular debido a su eficacia y seguridad19. La dapsona es de elección para las formas ampollosas de LE y para los pacientes con vasculitis. La talidomida es una alternativa útil para LED refractario y por su actividad en estimular el recrecimiento capilar en pacientes con efluvio y alopecia asociada a LE. Análogo a la talidomida se ha desarrollado la lenalidomida, con menores efectos adversos. Los retinoides constituyen la terapia sistémica de segunda línea. La isotretinoína y etretinato han sido utilizados con éxito en el LED hipertrófico. La administración de metilprednisolona en pulsos parenteral y fármacos inmunosupresores citotóxicos —como azatioprina, metotrexato, ciclofosfamida y ciclosporina— se limita a los pacientes con LES, enfermedad severa o que no responden a otras terapias. Estos fármacos representan el tercer escalón de terapia sistémica7,2.
A continuación haremos hincapié en las opciones clásicas y en las nuevas alternativas para el tratamiento tanto local como sistémico del LEC.
Tratamientos tópicos clásicosFotoprotecciónDebido a que esta patología es altamente fotosensible y tanto los brotes cutáneos como la enfermedad sistémica pueden ser iniciados por la radiación ultravioleta, el consejo en cuanto a la protección solar beneficia a todos los pacientes1. Los filtros solares físicos que contienen dióxido de titanio y óxido de cinc son los que se deberían aconsejar.
CorticoidesLos corticoides tópicos pueden ser útiles en el tratamiento del LEC, pero usualmente son inadecuados como monoterapia20. Ejercen su efecto sobre células tanto B como T, y disminuyen la producción de inmunoglobulina y TNF alfa21.
Los esteroides tópicos de alta potencia parecen ser más eficaces que los de baja potencia en el tratamiento de LED, aunque, en el mejor de los casos, parecen ser eficaces solo para aproximadamente la mitad de las personas tratadas. Su uso durante 2 semanas, seguidas de una o 2 semanas sin aplicación, puede limitar los efectos adversos cutáneos, como atrofia y telangiectasias20.
Los corticoides intralesionales (triamcinolona, 5-10mg/ml) pueden ser usados para zonas localizadas de LEC7. Es particularmente útil en el tratamiento de lesiones crónicas hiperqueratósicas recalcitrantes localizadas en el cuero cabelludo. Los efectos adversos incluyen atrofia y despigmentación12.
RetinoidesLas lesiones hiperqueratósicas del LED pueden responder a los retinoides tópicos. La tretinoína y el tazaroteno han sido efectivos en reportes de casos aislados22, aunque el principal efecto adverso es la irritación cutánea.
Tratamientos tópicos: nuevas alternativasInhibidores de la calcineurina tópicosDebido a los efectos no deseados de los corticoides, especialmente con el uso a largo plazo, los inhibidores de la calcineurina son una alternativa a los tratamientos tópicos. Pertenecen al grupo de macrolactámicos12 y actúan disminuyendo o bloqueando la producción de citocinas por los linfocitos T activados. Están disponibles cremas de tacrolimus 0,03 y 0,1% y de pimecrolimus 1%. Mientras las lesiones cutáneas agudas del LES responden generalmente bien, se ha demostrado escasos beneficios en el LECSA. Para el LED los resultados son aún menos convincentes, debido a la hiperqueratosis y a la baja penetración23.
Un estudio demostró que, en el tratamiento de LEC, la asociación de tacrolimus con clobetasol ungüento fue más efectiva que el tacrolimus ungüento o el clobetasol ungüento solos12.
Estos fármacos tienen la particularidad de ser útiles para tratar áreas del rostro con tendencia a atrofia, como párpados y zonas intertriginosas donde el uso de los corticoides tópicos es limitado1.
R-salbutamolEl R-salbutamol sulfato es un tratamiento tópico con actividad antinflamatoria indicado en pacientes con LED resistente. Es un R-enantiómetro del salbutamol. Un ensayo doble ciego, aleatorizado y controlado de 37 pacientes con LED mostró mejoría en la descamación, la hipertrofia, la induración, el dolor y el prurito. Se ha demostrado seguridad y buena tolerancia12,24.
LáserEl tratamiento del LEC con pulsed dye laser (PDL) fue descrito por primera vez hace 15 años por Boixeada et al., que confirmaron los excelentes resultados de este método. Se desconoce el motivo por el cual longitudes de onda de 585-595nm son eficaces en el LEC, aunque se postula que destruyen la microvasculatura cutánea mediante la fototermólisis electiva, modulando así el proceso inflamatorio25.
Truchuelo et al. demostraron eficacia de PDL 595nm en 10 pacientes con LEC variedad túmidus, confirmado histológicamente. Sin embargo, 5 pacientes desarrollaron nuevas lesiones cerca de la inicial o a distancia después de finalizar el tratamiento26.
Tratamientos sistémicos clásicosAntimaláricosLos fármacos antimaláricos comprenden la cloroquina (CQ), la hidroxicloroquina (HCQ) y la quinacrina. Han sido utilizadas para el tratamiento del LEC desde 1894, cuando se comunicó la utilidad de la quinacrina27. El mecanismo de acción de la antimaláricos incluye inhibición de los Toll like receptors28, inhibición de la presentación y procesamiento de antígenos vía alcalinización de los endosomas y lisosomas, disminución de la presentación autoantigénicos por macrófagos y células T CD4, reducción de citocinas proinflamatorias IL-1, IL-6, IL-2, TNF alfa. Además de sus propiedades fotoprotectoras12, reducen la viscosidad sanguínea y la agregación plaquetaria, lo que explica su efecto antitrombótico28.
Un estudio aleatorizado mostró mejoría del LEC en 15 de 30 pacientes tratados con HCQ tras 8 semanas de tratamiento y mejor tolerancia comparado con acitretin. La HCQ sulfato es el fármaco preferido debido a su eficacia y su tolerabilidad. La dosis inicial es de 6,5mg/kg/día en dosis divididas (típicamente 200mg 2 veces al día), y generalmente se observa respuesta en 2 a 3 meses28. Si la mejoría es inadecuada, puede agregarse mepacrina (quinacrina) 100mg/día1. Si a pesar de la administración de HCQ más quinacrina la respuesta permanece insuficiente después de 4 a 6 semanas, se puede sustituir la HCQ por CQ 4mg/kg/día (250mg/día)26.
La HCQ y la CQ no deberían administrarse juntas debido al incremento del riesgo de retinopatía.
Una vez que se obtiene respuesta, se debe reducir la dosis de HCQ a la mitad (200mg/día). Se recomienda el tratamiento durante uno a 2 años para suprimir completamente la actividad del LEC1,28.
James et al. sugieren que el tratamiento con HCQ podría demorar y potencialmente inhibir la progresión a LES27.
Aunque la Food and Drug Administration (FDA) categorice a la HCQ en el embarazo como categoría C, recientes publicaciones apoyan su seguridad en el embarazo28.
El tabaquismo puede reducir la eficacia de los antipalúdicos. Se ha postulado que interfiere bloqueando su acumulación en los lisosomas, y además se aumenta su eliminación metabólica, ya que el tabaco induce al complejo citocromo P4501,29.
De todas maneras, el principal determinante de la respuesta a los antipalúdicos parece ser la gravedad del compromiso cutáneo. El LEC más extenso y en el contexto del LES tienen menor respuesta.
Debido a la posibilidad de retinopatía de la CQ e HCQ, se debe obtener un fondo de ojos y test de campo visual basal y repetir a intervalos de 5 años y de manera anual en pacientes con factores de riesgo. Además se debe realizar controles de función hepática y hematológicos completos de rutina1,30.
Corticoides sistémicosLos corticoides sistémicos tienen un efecto limitado en el LEC y pueden ser usados en la fase inicial del tratamiento, mientras las lesiones son altamente inflamatorias31. Además se pueden utilizar mientras se espera el efecto de los antipalúdicos. La dosis habitual es de 0,5 a 1mg/kg/día por vía oral, con descenso posterior tras 2 a 4 semanas o 3g/día en pulsos por vía intravenosa, como se describió para el LECSA32.
No se recomienda su uso de rutina debido a los efectos adversos. Por eso se sugiere, tras conseguir el control del brote, su descenso progresivo en 2 a 4 semanas18.
TalidomidaA pesar de que el gold standard en el tratamiento del LECC son los antipalúdicos y los corticoides tópicos, la talidomida es una opción de referencia en casos refractarios. Se ha demostrado su efectividad en el LED, con altos índices de recidiva al suspenderla, por lo que se sugiere mantener bajas dosis por períodos prolongados.
No existen ensayos clínicos controlados con talidomida y LES, pero numerosos estudios de casos han mostrado su eficacia. De hecho, ha demostrado estimular el recrecimiento capilar en pacientes con alopecia inducida por LES. También mejora las manifestaciones articulares33.
Stevens et al.34 han notado que no suprime significativamente la enfermedad sistémica en el LES. Por lo tanto, no se deberían discontinuar las otras opciones de tratamiento35.
Su mecanismo de acción no está totalmente comprendido, pero tiene propiedades antiinflamatorias, que incluyen la inhibición de la quimiotaxis de linfocitos y neutrófilos además de inhibir la fagocitosis, y propiedades inmunomoduladoras que disminuyen los niveles de citocinas, INF-γ y TNF-α y aceleran la degradación de su ARNm34.
Con todo, a causa de sus efectos adversos serios, como la teratogenicidad y la neuropatía, su uso clínico se limita a pacientes con enfermedad refractaria.
Entre otros efectos colaterales se incluyen fatiga, mareos, aumento de peso, constipación, amenorrea, sequedad oral y polineuropatía no relacionada con la dosis1.
MetotrexatoEl metotrexato (MTX) es un antagonista del ácido fólico desarrollado en la primera mitad del siglo pasado para el tratamiento de la leucemia. Actúa bloqueando irreversiblemente la síntesis de ácidos nucleicos a través de la inhibición de la síntesis de purinas35.
Puede ser un tratamiento complementario a los antimaláricos en los pacientes que no responden a estos agentes únicamente7.
Reduce la capacidad de circulación de linfocitos que migran a la piel, suprimiendo moléculas de adhesión celular ICAM1, disminuyendo la expresión del antígeno linfoide cutáneo en las células mononucleares en sangre periférica y disminuyendo la expresión de Eselectina endotelial.
En dosis altas provoca inmunosupresión directa, particularmente debido al incremento de la apoptosis. Bajas dosis de MTX constituyen un agente efectivo en varias enfermedades autoinmunes, incluyendo el LES35.
El efecto del MTX fue confirmado en un estudio que incluía 43 pacientes con diferentes subtipos de LEC refractario (16 con LECSA, 12 con LED, 3 con LE tumidus, uno con LE profundo, 4 con LE lupus sabañón y 7 con manifestaciones cutáneas de LES). Las lesiones cutáneas mejoraron en el 98% de los casos con bajas dosis de MTX administrado en forma oral o intravenosa.
Los pacientes con LECSA y LEC localizado mostraron mejoría superior que aquellos con LED diseminado.
En LEC se recomienda la aplicación de 7,5 a 25mg semanales, por vía subcutánea. Adicionalmente se administra ácido fólico 24h después de la inyección33.
DapsonaLa eficacia de la dapsona se ha comunicado en varios subtipos de LEC, vasculitis urticariana y úlceras orales. Es particularmente útil para el tratamiento de las variedades de lupus más inflamatorias, como el LE profundo y algunos casos de LED inflamatorio1. Es de elección para el LE ampollar, con una respuesta espectacular, cesando la formación de nuevas lesiones en 12 a 48h de iniciado el tratamiento36.
La dosis terapéutica es de 25 a 150 (máximo 200mg/día). Se debe administrar la dosis más baja efectiva para minimizar los posibles efectos adversos, tales como hemólisis y metahemoglobinemia. Previo al tratamiento hay que descartar la deficiencia de 6-fosfato deshidrogenasa, además de controlar las enzimas hepáticas y el recuento hematológico7.
Retinoides sistémicosEn un estudio aleatorizado doble ciego controlado multicéntrico, se comparó la eficacia de acitretino (50mg/día) con HCQ (400mg/día) en 28 y 30 pacientes, respectivamente. Hubo una importante mejoría o desaparición total en el 46% que recibieron acitretino y en el 50% de los que recibieron HCQ. El eritema mostró una mejoría más marcada en el grupo de HCQ y los efectos adversos fueron más frecuentes y más graves en el grupo de acitretino21.
La dosis recomendada para el acitretino y la isotretinoína en el LEC es de 0,2-1,0mg/kg/día. Estos fármacos se consideran de segunda línea para el LEC21, particularmente para el LE verrucoso e hiperqueratósico. Sin embargo, algunos autores no recomiendan los retinoides sistémicos como estrategia de largo plazo por la alta frecuencia de efectos colaterales, como sequedad de mucosas, y por la rápida recidiva de las lesiones cutáneas al suspender el medicamento1.
Tratamientos sistémicos: nuevas alternativasLenalidomidaDebido al vasto potencial de la talidomida para tratar patologías inflamatorias y neoplásicas, se han hecho esfuerzos para desarrollar un análogo de talidomida, la lenalidomida, a mediados de 1990. Actualmente está aprobada por la FDA para el tratamiento del mieloma múltiple y del síndrome mielodisplásico y en ensayos clínicos para el tratamiento de tumores sólidos.
Es un importante inmunomodulador y antiinflamatorio; inhibe la secreción de citocinas proinflamatorias tales como TNF-α, la co-estimulación de células T, y posee además actividad antiangiogénica21.
En comparación con la talidomida, tiene una potencia 2.000 veces mayor para inhibir el TNF-α, con menor frecuencia en la aparición de efectos adversos comunes a la talidomida, como sedación, constipación, neuropatía; estudios preclínicos han fallado en demostrar la teratogenicidad o mutación en animales. Uno de los efectos adversos más temidos es la mielosupresión, que puede ocurrir con dosis de 5 a 10mg/día, que es la dosis necesaria para el tratamiento del LEC. Werth et al.18 sugieren iniciar tratamiento con 5mg/día, observar respuesta a las 6 semanas y entonces incrementar a un máximo de 10mg/día si es necesario. Otro efecto colateral conocido de la lenalidomida es el incremento de la trombosis venosa profunda, por lo que se aconseja asociar el fármaco a antipalúdicos o antiagregantes37.
Según Braunstein et al., este fármaco puede activar células T y desencadenar enfermedad sistémica en algunos pacientes con LEC, por lo que estos autores sugieren que los pacientes con signos de compromiso sistémico, como artralgias, podrían no ser candidatos a la lenalidomida38.
Mofetil micofenolatoEs un potente inmunosupresor usado ampliamente para combatir el rechazo de trasplantes de órganos sólidos, particularmente trasplantados renales. Es un análogo de purinas similar a la azatioprina pero con inhibición más específica sobre los linfocitos.
Aunque los informes en la literatura en cuanto a su eficacia son contradictorios1,39, ha demostrado su eficacia en el tratamiento del LES con compromiso renal6 y en el tratamiento de lesiones de LEC refractarias a corticoides sistémicos y antimaláricos, con dosis de 2g/día6,12. Sin embargo, Pisoni et al.40 administraron micofenolato mofetil a 6 pacientes con LEC que habían fallado a distintos tratamientos previos, de los cuales 5 no obtuvieron respuesta y uno tan solo respuesta parcial, por lo que los autores recomiendan considerar su uso solo en el espectro de LEC severo.
Azatioprina, ciclofosfamida y ciclosporinaHay reportes contradictorios sobre estos fármacos en el LEC, con pobre eficacia en el tratamiento del LE. Por sus efectos adversos ya conocidos, su indicación no es de rutina32.
AbateceptEl abatecept es una proteína de fusión recombinante humana que modula selectivamente la activación de células T bloqueando la co-estimulación vía B7:CD28, lo que resulta en disminución de la activación de células T, proliferación y secreción de citocinas y producción de autoanticuerpos sin depleción de células B o T. Se ha utilizado para tratar brotes de lupus, algunas lesiones discoides, pericarditis y pleuresía. El tratamiento consiste en 4 dosis mensuales en bolo de 10mg/kg9,12.
RituximabEs un anticuerpo monoclonal con actividad anti-CD20. Induce la depleción de linfocitos B a través de la lisis dependiente del complemento e induce apoptosis9. Hay series de casos y ensayos no controlados que sugieren que es efectivo en la mejora de síntomas no cutáneos del LES y que podría ser utilizado para el tratamiento de manifestaciones cutáneas refractarias del LE, pero falta evidencia al respecto41.
Vitamina DLa deficiencia de vitamina D se ha correlacionado con cáncer y también con aumento de la autoinmunidad. La vitamina D produce y mantiene la tolerancia autoinmunológica12. Debido a que la fotoprotección es de suma importancia en la población lúpica, el suplemento de esta vitamina liposoluble asume un rol crítico.
Ruiz Irastorza et al.42 han encontrado deficiencia de vitamina D en pacientes con LES.
La suplementación de la dieta con vitamina D, al menos 400UI diarias, puede ser beneficiosa, e incluso se pueden requerir dosis más altas para lograr un efecto farmacológico (1.000 a 2.000UI diarias en adultos)12.
Inmunoglobulina intravenosaExisten 2 comunicados en la literatura que incluyen 17 pacientes con diferentes subtipos de LEC (LED, LECSA, LES ampollar) que muestran respuesta buena a completa con el tratamiento de inmunoglobulina intravenosa43.
En contraste, 5 pacientes con LES que presentaban rash malar y úlceras orales y 2 pacientes con LECSA no obtuvieron los mismos resultados: aunque mejoraron algunos parámetros clínicos e inmunológicos, en general las manifestaciones cutáneas no mostraron ninguna respuesta, y las lesiones del LECSA incluso empeoraron30,44.
ConclusionesEl LEC es una enfermedad relativamente rara. Hay varios subtipos clínicos muy heterogéneos, de los cuales algunos causan daño irreversible, como por ejemplo cicatrices antiestéticas y alopecia permanente.
La fotoprotección, los corticoides tópicos y los antipalúdicos siguen siendo el tratamiento principal del LEC. En casos refractarios, los antipalúdicos continúan siendo los fármacos de elección, y la combinación de estrategias de antimaláricos con otros agentes puede lograr resultados óptimos con mínima toxicidad. Es muy importante tener paciencia en cuanto a los resultados terapéuticos de los antipalúdicos, que pueden no observarse hasta transcurridos 2 a 3 meses de iniciado el tratamiento. Además, se debe considerar la utilización de HCQ o CQ junto con quinacrina (complementando con fotoprotección adecuada, dejar de fumar y el uso de vitamina D). Incluso los antipalúdicos podrían ser efectivos aun en aquellos pacientes que continúan fumando45.
Los retinoides, la dapsona, la talidomida y la lenalidomida son otras alternativas, pero con mayor riesgo de toxicidad. Los citotóxicos y los corticoides sistémicos se reservan para LES con compromiso de órganos internos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses