La aféresis terapéutica engloba un gran número de técnicas que tienen como principal fundamento procesar la sangre de un paciente a través de un dispositivo extracorpóreo con el objetivo de eliminar anticuerpos e inmunocomplejos preformados para evitar el daño tisular, eliminar mediadores de la inflamación como complemento y citocinas que podrían contribuir al daño, aportar factores deficitarios y estimular clonas linfocitarias para mejorar la respuesta a la terapia inmunosupresora.
Entre los diferentes tipos de aféresis, los más utilizados para el tratamiento de las enfermedades autoinmunes sistémicas son el recambio plasmático terapéutico y la inmunoadsorción.
Para una correcta utilización de estos procedimientos, la American Society for Apheresis ha establecido más de 65 indicaciones clasificadas en diferentes categorías según el nivel de evidencia. En esta revisión se analizan las indicaciones de estas terapéuticas en las diferentes enfermedades autoinmunes sistémicas.
De esta revisión se puede concluir que los recambios plasmáticos terapéuticos son una posibilidad terapéutica eficaz y segura en el tratamiento de afectaciones graves de las enfermedades autoinmunes y una opción válida en casos de enfermedad refractaria a los tratamientos convencionales.
Therapeutic apheresis encompasses a large number of techniques whose main purpose is to process patients’ blood through an extracorporeal device. The aim is to remove antibodies and preformed immune complex to avoid tissue damage, eliminate inflammatory mediators – such as complement and cytokines, which could contribute to further damage – restore deficiencies, and stimulate lymphocyte clones to improve the response to immunosuppressive therapy.
Among the different types of apheresis, the most commonly used for the treatment of autoimmune diseases are plasma exchange and immunoadsorption.
To aid the correct use of these procedures, the American Society for Apheresis has established more than 65 indications classified into different categories according to the level of evidence. In this review, we analyze the distinct therapeutic indications for the treatment of different autoimmune diseases.
This review indicates that plasma exchange is a safe and effective therapeutic option for treating the serious manifestations of systemic autoimmune diseases and is a valid option for those patients with diseases refractory to conventional treatments.
El término aféresis proviene de la palabra griega «aphairesis» que significa extraer parte de un todo. Esta técnica fue descrita originalmente por investigadores de la Universidad John Hopkins en el año 19141. Estos estudios establecieron las bases para las actuales aféresis terapéuticas, cuyo objetivo fundamental es eliminar del plasma aquellas sustancias o componentes humorales que están relacionados con la patogénesis de diversas enfermedades2. En la década de los sesenta, estos sistemas de depuración fueron utilizados por primera vez en pacientes con artritis reumatoide (AR) con el objetivo de disminuir los niveles circulantes de factor reumatoide3 y, posteriormente, en pacientes con lupus eritematoso sistémico (LES) para eliminar los anticuerpos anti-ADN circulantes4,5. En las últimas décadas, se han ampliado las indicaciones de la aféresis terapéutica de manera que actualmente desempeña un papel importante en el tratamiento de enfermedades de naturaleza autoinmune6.
DefiniciónLa aféresis terapéutica engloba un gran número de técnicas que tienen como principal fundamento procesar la sangre de un paciente a través de un dispositivo extracorpóreo con el objetivo de eliminar aquellas sustancias patogénicas capaces de generar o perpetuar una enfermedad. Entre los diferentes tipos de aféresis terapéuticas se encuentran la eritrocitoaféresis, la leucocitoaféresis, la plaquetoaféresis, recambios de hematíes y de plasma. Actualmente también es posible realizar un procedimiento para la eliminación específica de algún componente plasmático mediante el uso de columnas con sustancias, antígenos o anticuerpos, que se conoce como procedimientos de inmunoadsorción (IADS). Todos estos procedimientos son el resultado del paso de la sangre de un paciente a través de un dispositivo por el cual se separan del resto de los componentes de la sangre los eritrocitos, los leucocitos y las plaquetas del plasma para su posterior eliminación o retorno al paciente según se requiera.
El recambio plasmático terapéutico (RP) es una técnica de depuración de la sangre extracorpórea, mediante la cual se elimina el plasma. Se realiza la extracción de un volumen variable de plasma del paciente que es sustituido por soluciones de reposición que mantengan el volumen y la presión oncótica7.
El término «plasmaféresis» debe reservarse para las situaciones en las que solo se lleve a cabo la eliminación de plasma sin reposición, como es el caso de la donación de plasma por aféresis para uso transfusional o posterior fraccionamiento industrial del plasma. Este procedimiento extrae menos cantidad de plasma (en torno 600ml), sin solución de reposición, en menos tiempo y con técnicas de separación más simples que las utilizadas en el RP8 (tabla 1).
Diferencias entre recambio plasmático terapéutico y plasmaféresis
| Recambio plasmático | Plasmaféresis | |
| Volumen extraído (% respecto al volumen plasmático) | 120–130 | 20 |
| Volumen infundido (%) | 100 | 0 |
| Tiempo de procedimiento (minutos) | 120–180 | 50 |
| Separadores celulares | Flujo continuoFlujo discontinuoMembranas | Flujo discontinuo |
Cuando la aféresis está indicada por razones terapéuticas, la eficacia del procedimiento viene dada por la extracción de grandes volúmenes de plasma, aproximadamente 1,2 veces el volumen circulante de plasma (límites: 1,0-1,5), con una eliminación del 63 al 72% de los componentes originales del mismo. Por ello, el RP requiere generalmente un mayor tiempo, la sustitución del plasma eliminado y separadores celulares más complejos9.
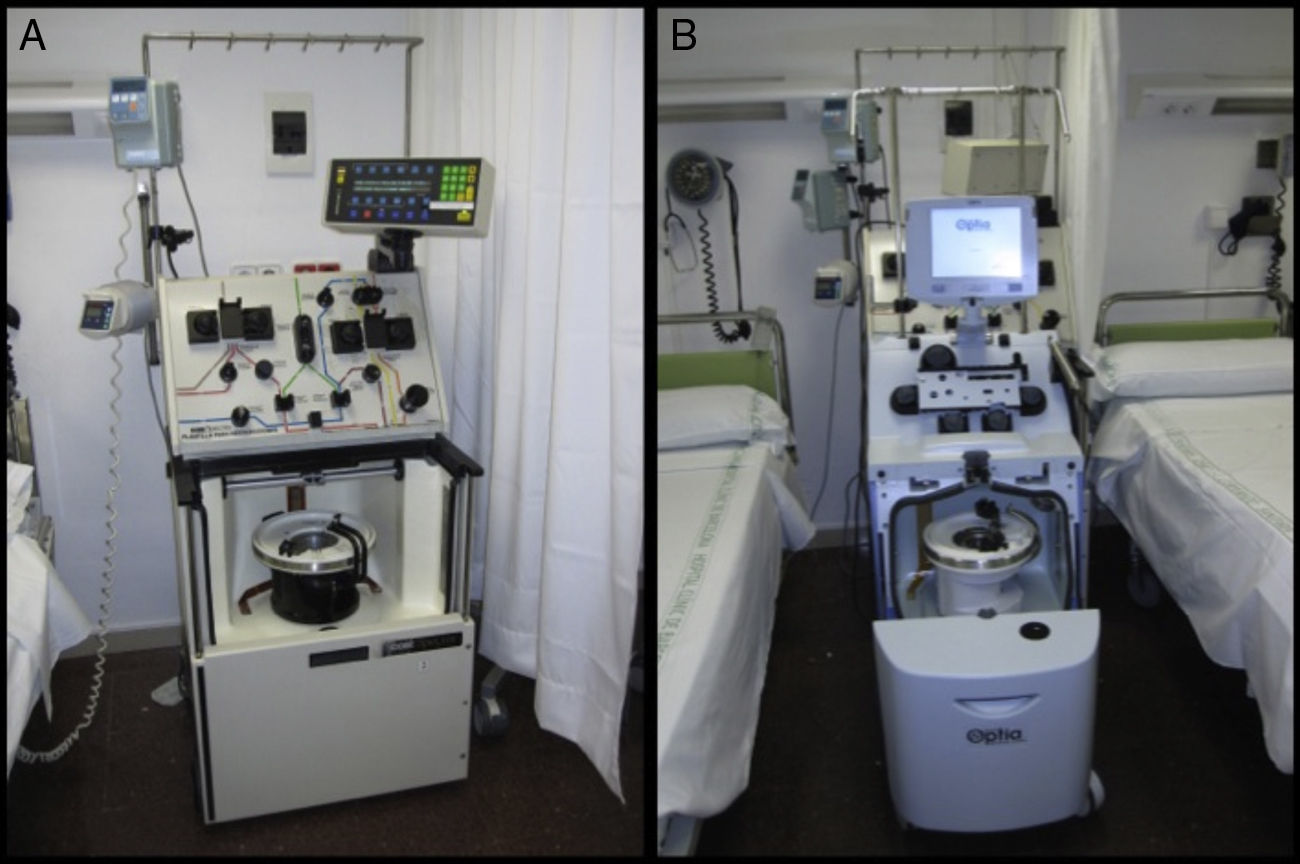
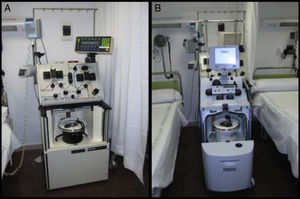
Consideraciones técnicasEl RP es una técnica compleja que debe llevarse a cabo por personal experimentado con un apoyo multidisciplinar, con el fin de optimizar la duración y la frecuencia del tratamiento, decidir la técnica más adecuada, determinar la reposición plasmática y minimizar los riesgos10. En la figura 1 se pueden observar separadores celulares utilizados por el Servicio de Hemoterapia y Hemostasia para la realización de los recambios plasmáticos en el Hospital Clínic de Barcelona11.
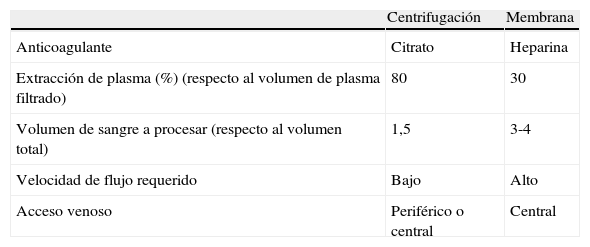
Los avances tecnológicos en los equipos de aféresis automatizados han hecho que estos procedimientos cada vez sean más seguros, rápidos y efectivos. Actualmente, las técnicas principales del RP son la separación por centrifugación y por filtración por membrana, las cuales permiten la separación exclusiva del componente deseado según la densidad, el tamaño y el peso molecular, por lo que se reduce la pérdida no deseada de otras proteínas y componentes del plasma9 (tabla 2).
Diferencias entre los principales sistemas de filtración
| Centrifugación | Membrana | |
| Anticoagulante | Citrato | Heparina |
| Extracción de plasma (%) (respecto al volumen de plasma filtrado) | 80 | 30 |
| Volumen de sangre a procesar (respecto al volumen total) | 1,5 | 3-4 |
| Velocidad de flujo requerido | Bajo | Alto |
| Acceso venoso | Periférico o central | Central |
Los sistemas por centrifugación separan los elementos celulares del plasma por medio de elementos giratorios que separan los distintos componentes según su peso molecular mediante fuerza centrífuga. Los separadores celulares más actuales son de flujo continuo, en los que la sangre del paciente penetra en la máquina, es centrifugada separando el componente deseado y el remanente se retorna a un flujo constante sin interrupción. Mediante 2 accesos venosos, se realiza de forma simultánea la salida y la entrada de la sangre. Las máquinas centrífugas pueden comprimir los glóbulos rojos a un hematocrito del 80%, por lo que pueden eliminar el 80% o más del plasma que reciben. Así, para eliminar 1,2 veces el volumen plasmático del paciente, necesitan procesar solo 1,5 veces el volumen de sangre, precisando un flujo bajo que, en ocasiones, se consigue con vías venosas periféricas9.
Posteriormente, se introdujo el sistema de filtración por membranas de alta permeabilidad, que permite la separación del plasma y sus componentes de los elementos celulares. En este caso, el procedimiento se realiza por un circuito extracorpóreo, a través de un sistema de filtros de fibra hueca similar al de hemodiálisis. A diferencia de las máquinas de centrifugación, los sistemas de filtración por membranas no pueden extraer plasma de forma tan eficiente, porque un hematocrito demasiado alto dentro del separador podría dañarlo. Por lo general, se suele extraer solo aproximadamente del 30 al 35% del plasma, de modo que se necesitan procesar 3-4 veces el volumen de sangre del paciente para conseguir una eliminación plasmática similar. Para lograr este objetivo en el mismo tiempo, se requiere mayor flujo de sangre, por lo que es necesario un acceso venoso central9. En la actualidad, están disponibles métodos de doble filtración e IADS que se pueden acoplar a las máquinas de aféresis10.
Con el fin de evitar la coagulación del circuito de aféresis, debe utilizarse una sustancia anticoagulante como primer paso en cualquiera de las técnicas. Generalmente en la separación por sistema de membrana se utiliza como anticoagulante la heparina sódica intravenosa al 1%, a dosis de 0,5 a 1mg/kg. En la centrifugación, el anticoagulante más usado es el citrato sódico con dextrosa (ACD-A). En este caso, es necesario vigilar de forma cuidadosa la aparición de síntomas de hipocalcemia, ya que el citrato se une al calcio y reduce el nivel de calcio ionizado tanto en el circuito extracorpóreo como en la circulación del paciente.
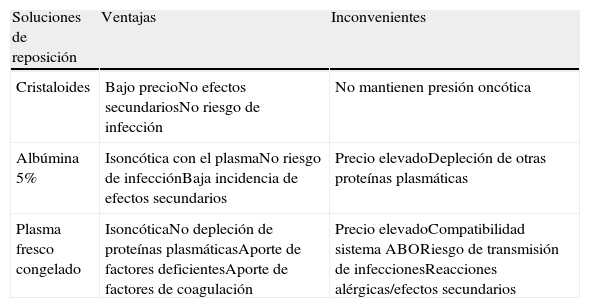
Soluciones de reposiciónTras la extracción de plasma, debe reemplazarse el volumen con sustancias de reposición con adecuada actividad coloide, como plasma fresco congelado (PFC), albúmina y otros cristaloides, así como suplementar electrólitos y otras deficiencias (tabla 3). Según la enfermedad a tratar y el estado del paciente, se debe seleccionar la sustancia más adecuada. Por lo general, la más utilizada es la albúmina a una concentración al 5%. Es una sustancia isoncótica y tiene pocas reacciones adversas, pero carece de factores de coagulación y otras proteínas plasmáticas, que se agotan durante el recambio plasmático. Ello obliga a controlar el tiempo de protrombina después de cada sesión, ya que puede incrementarse aproximadamente un 30% y duplicarse el tiempo de tromboplastina parcial activado.
Ventajas e inconvenientes en las soluciones de reposición
| Soluciones de reposición | Ventajas | Inconvenientes |
| Cristaloides | Bajo precioNo efectos secundariosNo riesgo de infección | No mantienen presión oncótica |
| Albúmina 5% | Isoncótica con el plasmaNo riesgo de infecciónBaja incidencia de efectos secundarios | Precio elevadoDepleción de otras proteínas plasmáticas |
| Plasma fresco congelado | IsoncóticaNo depleción de proteínas plasmáticasAporte de factores deficientesAporte de factores de coagulación | Precio elevadoCompatibilidad sistema ABORiesgo de transmisión de infeccionesReacciones alérgicas/efectos secundarios |
El PFC precisa de compatibilidad con el sistema ABO sanguíneo y presenta un mayor riesgo de complicaciones, como reacciones de hipersensibilidad, hipocalcemia e infecciones, por lo que solo debe utilizarse en situaciones concretas10. Dado que el PFC aporta factores de la coagulación, se utiliza en estados de coagulopatía, como en la púrpura trombocitopénica trombótica12.
El RP produce un agotamiento progresivo de las inmunoglobulinas, por lo que muchos autores recomiendan la administración sistemática de inmunoglobulinas intravenosas tras el tratamiento6.
Respecto al tratamiento farmacológico asociado, en general, se recomienda administrarlo tras la realización del RP, ya que este puede disminuir los niveles de algunos fármacos, en especial los intravasculares o los unidos a proteínas plasmáticas, como los anticuerpos monoclonales. Otros estudios farmacocinéticos han observado que los niveles de ciclosporina, tacrolimus, corticoides y antiepilépticos, como la fenitoína, fenobarbital, carbamazepina y ácido valproico, no se afectan tras el RP13,14.
Pauta terapéuticaEsta puede variar según la enfermedad a tratar. En general, el volumen tratado debe ser de una a 1,5 veces el volumen plasmático total, con reposición de albúmina o PFC según la indicación. En cuanto a la duración del tratamiento, por lo general, es suficiente un ciclo de 3 a 6 sesiones de RP para ver la respuesta clínica, aunque se han descrito tratamientos más prolongados con eficacia cuestionable12. Sin embargo, en el caso de la AR refractaria la pauta terapéutica propuesta es de 12 sesiones, una cada semana15.
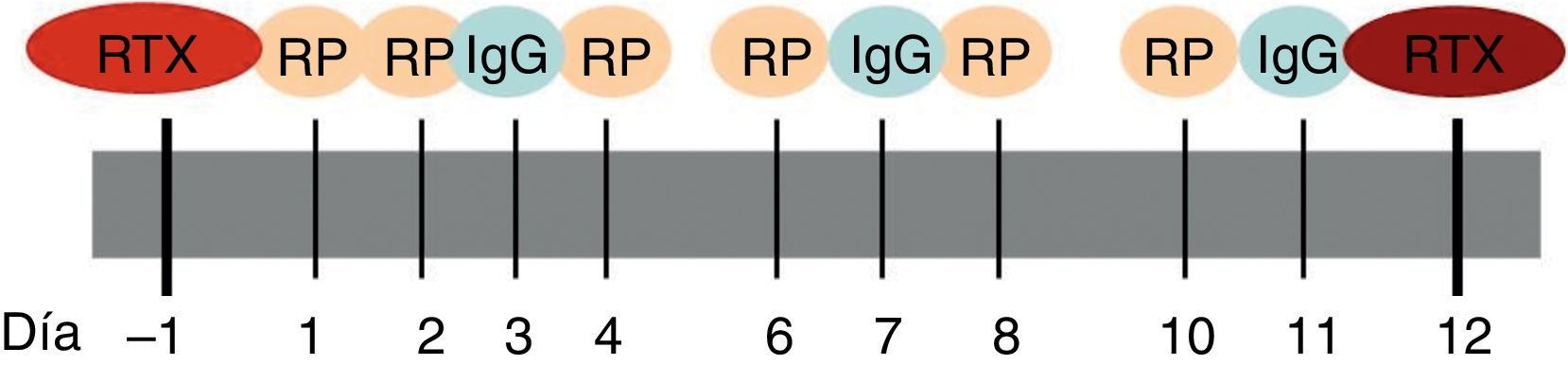
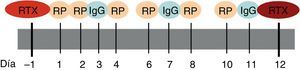
En nuestro caso y de acuerdo con el Servicio de Hemoterapia y Hemostasia, la pauta utilizada en el tratamiento de la mayoría de las enfermedades autoinmunes sistémicas consta de un total de 6 sesiones de RP. Las 2 primeras se realizan en días consecutivos seguidas por sesiones en días alternos. En los días de descanso se administran dosis sustitutivas de inmunoglobulinas intravenosas. Dependiendo de la gravedad del cuadro y de la enfermedad a tratar, se asocian 2 dosis de rituximab, al inicio y al finalizar el tratamiento respectivamente, con el fin de favorecer la depleción de linfocitos CD20 (fig. 2).
Limitaciones y complicacionesLa principal limitación del RP es su coste elevado derivado de la complejidad de la técnica, los requerimientos de personal especializado, la maquinaria, las sustancias de reposición y los tratamientos asociados9.
A pesar de realizarse por equipos experimentados, la aféresis no está exenta de riesgos. La frecuencia global de las complicaciones varía entre un 25 y un 60%, según las series, con diferencias según la enfermedad de base y la técnica empleada, aunque cuando se realiza con las medidas profilácticas adecuadas, la incidencia de reacciones adversas puede reducirse hasta el 3%, como es el caso de nuestra institución. Los efectos adversos inmediatos más frecuentes son síntomas vasovagales leves, como náuseas, vómitos y sudoración, aunque en ocasiones pueden aparecer complicaciones más graves como hipotensión intensa, arritmias e hipoxemia con complicaciones respiratorias16–18. Además, la colocación de los accesos venosos comporta un riesgo asociado en forma de hematomas, neumotórax, hemorragias, trombosis e infecciones de catéter19.
Otras complicaciones de este tratamiento son las secundarias a las sustancias añadidas. La infusión de citrato puede producir hipocalcemia, y como consecuencia de su metabolismo la generación de 2 moléculas de bicarbonato que provocan una alcalosis metabólica. La hipocalcemia también puede ser inducida por la reposición con albúmina y PFC, por lo que en cualquier procedimiento de aféresis los niveles de calcemia deben ser monitorizados de forma estricta y suplementados en caso de deficiencia20. La infusión de albúmina induce acidosis metabólica por el pH ácido de la solución, por lo que puede requerir suplementos de bicarbonato. En general, la probabilidad de complicaciones es mayor en pacientes que reciben hemoderivados (PFC, inmunoglobulinas, transfusiones) en forma de reacciones hemolíticas, febriles o alérgicas o situaciones de mayor gravedad como anafilaxia o lesión pulmonar aguda asociada a la transfusión. La infección es una de las complicaciones con mayor morbimortalidad. En el caso de pacientes lúpicos se ha de considerar la situación basal de inmunodepresión sumada a la pérdida de inmunoglobulinas (aunque la administración profiláctica de 200mg/kg cada 2 recambios la evitaría) y otros elementos plasmáticos, y al riesgo de infección por catéter21.
Fundamentos y objetivos terapéuticosEl valor terapéutico del RP se basa en la eliminación de determinadas sustancias patogénicas con el fin de evitar el daño tisular asociado y dar lugar a la resolución del proceso patológico22.
La molécula a eliminar debe cumplir al menos uno de los siguientes criterios:
- •
Poseer un tamaño molecular suficientemente grande como para no poder ser eliminada por otras técnicas de purificación menos costosas, como hemofiltración o hemodiálisis de alto flujo.
- •
Tener una vida media larga, de modo que la eliminación extracorpórea sea mucho más rápida que las vías de aclaramiento endógeno.
- •
Ser muy tóxica y resistente a la terapia convencional, de modo que la rápida eliminación inducida por el RP esté indicada2.
La utilidad del RP en patología autoinmune radica en la posibilidad de modular componentes humorales del sistema inmune así como reducir los niveles de autoanticuerpos o inmunocomplejos circulantes, mientras que la terapia inmunodepresora frena la producción de novo de anticuerpos. Además, se han propuesto otros efectos sobre la función inmune, tales como el agotamiento del complemento, fibrinógeno y otros factores trombóticos, mediadores tóxicos e inflamatorios, citocinas e inmunomoduladores del sistema mononuclear-fagocítico11.
Por tanto, los objetivos del RP en estas patologías serían disminuir y eliminar los anticuerpos e inmunocomplejos preformados para evitar el daño tisular, eliminar mediadores de la inflamación como complemento y citocinas que podrían contribuir al daño, aportar factores deficitarios y estimular clonas linfocitarias para mejorar la respuesta a la terapia inmunosupresora.
IndicacionesSon muchas las enfermedades en las que se ha usado la aféresis terapéutica y especialmente los RP y la IADS, pero en la práctica clínica se ha observado una gran variabilidad de resultados según las indicaciones23.
Con el objetivo de establecer una guía para la correcta utilización de estos procedimientos, la American Society for Apheresis (ASFA) ha establecido diferentes categorías de indicación (tabla 4). Para la confección de estas categorías se llevó a cabo una revisión sistemática de la literatura, se evaluó la calidad de la evidencia y se estableció el grado de recomendación según el sistema Grading of Recomendations Assessment, Development and Evaluation (GRADE)24,25. La última revisión de la guía se realizó en 2010 y en ella se establecieron más de 65 indicaciones12. En este artículo se detallan las diferentes indicaciones de la aféresis en las enfermedades autoinmunes sistémicas (tabla 5).
Categorías establecidas por la ASFA según niveles de evidencia, publicadas en las guías de las indicaciones de la aféresis terapéutica del 2010
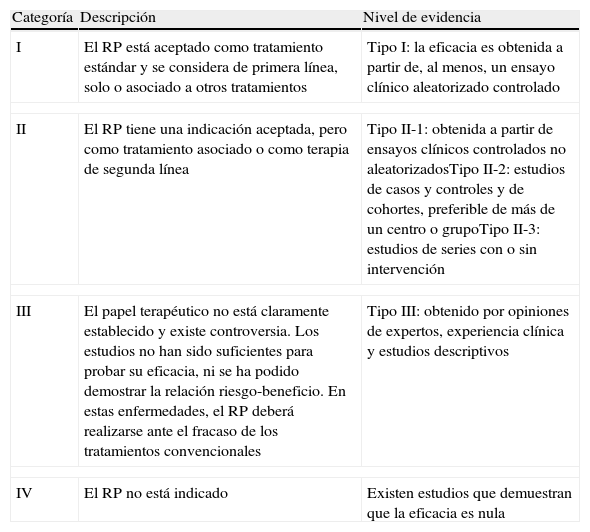
| Categoría | Descripción | Nivel de evidencia |
| I | El RP está aceptado como tratamiento estándar y se considera de primera línea, solo o asociado a otros tratamientos | Tipo I: la eficacia es obtenida a partir de, al menos, un ensayo clínico aleatorizado controlado |
| II | El RP tiene una indicación aceptada, pero como tratamiento asociado o como terapia de segunda línea | Tipo II-1: obtenida a partir de ensayos clínicos controlados no aleatorizadosTipo II-2: estudios de casos y controles y de cohortes, preferible de más de un centro o grupoTipo II-3: estudios de series con o sin intervención |
| III | El papel terapéutico no está claramente establecido y existe controversia. Los estudios no han sido suficientes para probar su eficacia, ni se ha podido demostrar la relación riesgo-beneficio. En estas enfermedades, el RP deberá realizarse ante el fracaso de los tratamientos convencionales | Tipo III: obtenido por opiniones de expertos, experiencia clínica y estudios descriptivos |
| IV | El RP no está indicado | Existen estudios que demuestran que la eficacia es nula |
ASFA: Sociedad Americana de Aféresis (American Society for Apheresis); RP: recambio plasmático terapéutico.
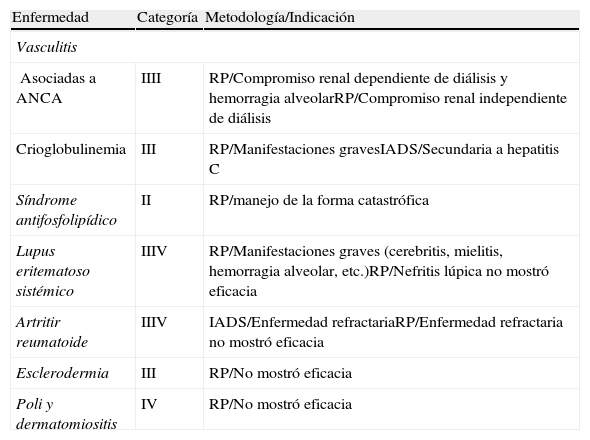
Indicaciones de los recambios plasmáticos en las enfermedades reumáticas según diferentes categorías de las guías 2010 de la Sociedad Americana de Aféresis
| Enfermedad | Categoría | Metodología/Indicación |
| Vasculitis | ||
| Asociadas a ANCA | IIII | RP/Compromiso renal dependiente de diálisis y hemorragia alveolarRP/Compromiso renal independiente de diálisis |
| Crioglobulinemia | III | RP/Manifestaciones gravesIADS/Secundaria a hepatitis C |
| Síndrome antifosfolipídico | II | RP/manejo de la forma catastrófica |
| Lupus eritematoso sistémico | IIIV | RP/Manifestaciones graves (cerebritis, mielitis, hemorragia alveolar, etc.)RP/Nefritis lúpica no mostró eficacia |
| Artritir reumatoide | IIIV | IADS/Enfermedad refractariaRP/Enfermedad refractaria no mostró eficacia |
| Esclerodermia | III | RP/No mostró eficacia |
| Poli y dermatomiositis | IV | RP/No mostró eficacia |
La mayoría de la información relativa a RP en las vasculitis proviene de estudios orientados a la identificación de reactantes inmunológicos circulantes como crioglobulinas y anticuerpos anticitoplasma de neutrófilo (ANCA) implicados en la patogénesis de la crioglobulinemia mixta (CM) y las vasculitis asociadas a ANCA, respectivamente26. Respecto a la CM, los primeros estudios realizados en los años ochenta demostraron la eficacia del RP en un pequeño grupo de pacientes. Geltner et al.27 describieron la mejora de las úlceras cutáneas, la función renal y la púrpura en 5 pacientes con CM tratados con RP asociados a esteroides y clorambucil. Ferri et al.28 usaron el RP sin otros agentes inmunosupresores en 16 pacientes con CM y afectación renal, hepática o compromiso neurológico, y objetivaron mejoría en los pacientes con insuficiencia renal rápidamente progresiva o lesiones activas y en aquellos con neuropatía periférica de inicio reciente. En 4 de los 6 pacientes con CM y hepatitis crónica activa, objetivaron normalización o reducción significativa de las enzimas hepáticas tras el RP. En todos los casos, la respuesta a la aféresis fue evidente tras las primeras 2-3 semanas de tratamiento. Solo existe un ensayo clínico aleatorizado con IADS en pacientes con CM secundaria a la infección por el virus de la hepatitis C (VHC) sin respuesta al tratamiento previo convencional29. El protocolo habitual de RP en la CM es el recambio de un volumen plasmático 3 veces por semana, durante 2-3 semanas. En la reposición de líquidos se puede usar albúmina al 5% que debe ser calentada previamente para prevenir la precipitación de crioglobulinas circulantes. El promedio de procedimientos para obtener una mejoría clínica es de 13 (rango de sesiones: 4-39)30. Las recientes recomendaciones del Grupo Italiano para el tratamiento de la CM asociada a VHC establecen el uso de la aféresis como tratamiento de elección de las manifestaciones graves como la insuficiencia renal o afectación neurológica y para el síndrome de hiperviscosidad31. La ASFA/AABB recomienda el RP como terapia adyuvante en el tratamiento de la CM con síntomas agudos graves, como úlceras cutáneas, glomerulonefritis o neuropatía con un nivel de evidencia IB. Para la CM secundaria a VHC se recomienda IADS con un grado de evidencia IIB12.
Respecto a la vasculitis asociada a ANCA, la evidencia del beneficio del RP en el tratamiento de la hemorragia alveolar es limitada32,33, por lo que en este caso los pacientes deben ser tratados con la asociación de ciclofosfamida y glucocorticoides. En el tratamiento de la afectación renal grave existe una mayor evidencia a partir del estudio MEPEX. En este, 137 pacientes con vasculitis renal grave (creatinina sérica >500mmol/l) fueron aleatorizados para recibir altas dosis de metilprednisolona intravenosa (n=67) o RP (n=70). El RP se asoció a una mayor recuperación renal, una reducción del riesgo de enfermedad renal terminal y una menor dependencia de hemodiálisis en comparación con metilprednisolona34. Otro estudio sugirió que la probabilidad de recuperación renal supera el riesgo de muerte relacionada con el tratamiento con RP35. Walsh et al.36 han publicado de forma reciente un metaanálisis con un total de 387 pacientes, en el que se ha analizado la utilidad de los RP en la vasculitis renal y la glomerulonefritis rápidamente progresiva idiopática. No hubo diferencias significativas en el efecto del RP respecto al espectro de afectación renal, pero se objetivó una tendencia a favor del RP en la prevención de muerte en aquellos ensayos clínicos que incluyeron pacientes con función renal conservada y en la prevención de enfermedad renal terminal en aquellos que incluyeron pacientes con función renal deprimida26–34. Las guías de la ASFA para vasculitis asociada a ANCA, que aparecieron antes de la publicación de este metaanálisis, recomiendan el RP en los casos dependientes de diálisis y en aquellos con hemorragia alveolar difusa, con un nivel de evidencia grado IA y IC, respectivamente. La evidencia en pacientes que no requieren diálisis es más débil (grado IIC)12.
Hasta el momento, solo existe un ensayo clínico aleatorizado que ha analizado el papel del RP (6 sesiones) como terapia de inducción en 32 pacientes con vasculitis asociada a ANCA. El grupo control recibió solo la terapia inmunosupresora estándar con prednisolona y ciclofosfamida, y el grupo de estudio recibió además los RP. Después de un mes del tratamiento, ninguno de los pacientes con RP se encontraba en hemodiálisis o en progresión renal, mientras en el grupo control 6 pacientes presentaron progresión renal y 5 estaban en hemodiálisis. La supervivencia renal después de uno, 3, 12 meses y 5 años fue significativamente mejor en el grupo de RP, sin diferencias en las tasas de recaídas, ni en la morbimortalidad37.
En la actualidad, el estudio PEXIVAS (ClinicalTrials.gov Identifier:NCT00987389) es un ensayo clínico en fase de reclutamiento diseñado para determinar si los RP son eficaces para reducir la muerte y la enfermedad renal terminal en comparación con la terapia inmunosupresora. Los resultados no se esperan hasta el 2018.
En nuestra experiencia, de los 10 pacientes con vasculitis asociada a ANCA, 5 fueron tratados por insuficiencia renal rápidamente progresiva obteniendo una respuesta óptima, con una muerte en el contexto de un shock séptico por neumonía intrahospitalaria.
El RP elimina rápidamente los inmunocomplejos responsables del desarrollo de la poliarteritis nodosa (PAN), por lo que el inicio agudo de este procedimiento sería adecuado para el control de esta enfermedad y además es la mejor estrategia terapéutica para las vasculitis inducidas por virus38. La combinación de agentes antivíricos y RP ha demostrado su eficacia39. En nuestra experiencia, el paciente tratado presentaba una PAN no asociada a virus y desarrolló 2 episodios de necrosis isquémica del intestino delgado que precisaron resección y terapia combinada «off-label» con ciclofosfamida, inmunoglobulina intravenosa, rituximab y RP con una buena respuesta inicial. Desafortunadamente, presentó un tercer brote con isquemia intestinal masiva y falleció. Pagnoux et al.40 revisaron una cohorte de 62 pacientes con afectación gastrointestinal debida a vasculitis necrotizante y detectaron 38 casos de PAN. De ellos, solo 2 fueron PAN no inducidas por virus tratados con RP con resultados discordantes.
Lupus eritematoso sistémicoEl RP fue utilizado inicialmente en el LES con el fin de reducir la concentración de autoanticuerpos y disminuir la tasa de progresión de la enfermedad. Sin embargo, este supuesto no se ha traducido en una clara respuesta clínica. A principios de la década de 1980 fueron publicados varios estudios con resultados favorables, mostrando mejorías clínicas y remisiones superiores al 50% de los pacientes tratados41. Sin embargo, un ensayo clínico aleatorizado en el que se aplicó el RP en pacientes con LES leve, mostró una mejoría de los parámetros serológicos y clínicos pero estos no presentaron una marcada mejoría clínica respecto al grupo control42. Posteriormente, en un estudio prospectivo en el que se trataron 28 pacientes en situación de brote con la combinación de ciclosporina y RP, se observó una remisión clínica más rápida y con menos requerimientos de inmunosupresión43.
Con relación al LES, las indicaciones han ido variando según las guías en los últimos años, y actualmente la recomendación de RP se limita a las manifestaciones graves del LES refractarias al tratamiento de primera línea con una categoría II. En cuanto a la nefropatía lúpica, la categoría de la recomendación continúa siendo la IV6,12,44,45, basada en la falta de eficacia de los RP obtenida en varios ensayos clínicos46–50.
Respecto a la afectación neurológica, se ha obtenido un beneficio potencial en aquellos pacientes refractarios a tratamientos de primera línea11,51–53 y, en general, la ASFA establece una categoría II en casos de afectación grave12. Esta indicación además se ve apoyada por la similitud con la encefalomielitis aguda diseminada, para la cual el tratamiento con RP tiene una recomendación con categoría II54–56.
Otras manifestaciones graves en el LES como la hemorragia alveolar57, la púrpura trombocitopénica trombótica58, la anemia hemolítica autoinmune, y otras situaciones asociadas, como el síndrome antifosfolipídico (SAF), la miastenia gravis, el síndrome de hiperviscosidad y la crioglobulinemia se han beneficiado del tratamiento con RP10.
Síndrome antifosfolipídicoEl RP, basado en la eliminación de anticuerpos antifosfolipídicos, citocinas, factor de necrosis tumoral-α y complemento, es un tratamiento de rescate de gran utilidad en algunas manifestaciones del SAF como la anemia hemolítica microangiopática, pérdidas fetales recurrentes, mielitis transversa y, sobre todo, el SAF catastrófico59,60. En una serie de 280 pacientes con esta variante de SAF, la mayor tasa de remisión se logró mediante la combinación de anticoagulación, corticoides y RP seguida de la asociación de anticoagulación, corticoides, RP y/o inmunoglobulinas intravenosas61. La disminución de la mortalidad se ha asociado al aumento de la utilización de estas terapias combinadas con RP62. Según la ASFA, el uso del RP en el SAF catastrófico se recomienda con un nivel de evidencia II-310.
No existe consenso respecto a la frecuencia de las sesiones y la duración del tratamiento con RP en el SAF. Tampoco hay uniformidad en la solución de reposición. La ASFA recomienda PFC10, pero otros grupos han obtenido resultados satisfactorios mediante la reposición con albúmina al 5%, utilizando solo PFC en casos de falta de respuesta63. Un grupo italiano sugiere el siguiente protocolo de RP en caso de SAF catastrófico: debe iniciarse durante las primeras 12h, las sesiones deben ser diarias durante los primeros 3 días con descenso posterior y realizar la reposición con solución de albúmina humana64. En este caso, el déficit de anticoagulantes naturales asociado a la infusión de albúmina debe monitorizarse y administrarse antitrombina al finalizar la sesión, ya que esta es esencial para mediar la anticoagulación por heparina durante el proceso.
La eficacia del RP en el SAF durante el embarazo también ha sido descrita por varios grupos65. El-Haieg et al.66 evaluaron, en un ensayo clínico abierto, la eficacia del RP asociado a bajas dosis de prednisona (10mg/día) en 18 pacientes con SAF (11 con SAF primario y 7 con SAF asociado a la LES). En los 48 embarazos previos al uso del RP, 39 finalizaron con pérdida fetal y 9 con partos prematuros y preeclampsia grave. El RP se inició una vez detectado el latido fetal (en torno a las 7 semanas de embarazo). Al principio se realizaron 3 sesiones por semana, con reducción gradual posterior, manteniendo una sesión al mes en la mayoría de los pacientes. Al final del estudio se obtuvieron muy buenos resultados, con una tasa de nacidos vivos del 100%, sin contar las defunciones neonatales relacionadas con la prematuridad. Ninguna de las 18 mujeres presentó preeclampsia grave. Todos los partos fueron después de las 32 semanas de la gestación y el 11% presentaron retraso del crecimiento intrauterino. Además, en los tratamientos combinados de RP y corticoides se obtuvo una reducción de la actividad del anticoagulante lúpico, una reducción significativa en la concentración de anticuerpos anticardiolipina y un aumento en el recuento de plaquetas. No se registraron efectos secundarios importantes y solo una paciente presentó hipotensión. Ruffatti et al.65 recomiendan iniciar el RP antes de que aparezcan las complicaciones del embarazo en el SAF. En caso de afecciones más graves, como trombocitopenia intensa, la combinación de RP con inmunoglobulinas intravenosas puede ser útil y puede prevenir las infecciones neonatales tempranas.
Artritis reumatoideEn estudios controlados, la linfoféresis y el RP han demostrado un escaso o nulo beneficio clínico67,68. Sin embargo en el tratamiento de la vasculitis reumatoide, el RP parece ser beneficioso como queda reflejado en 2 trabajos, los cuales describen una rápida mejoría en 5 pacientes con vasculitis necrotizante reumatoide grave, con resolución y curación de las ulceraciones en relación con el descenso del título de inmunocomplejos circulantes68,69. Diferentes publicaciones sugieren que el RP puede ser beneficioso para controlar otras complicaciones graves que acompañan a la AR tales como la hiperviscosidad y la neuropatía periférica70,71.
La IADS ha obtenido mejores resultados en el tratamiento de pacientes con AR15,70,72–74. En este caso, una columna de proteína A estafilocócica con una alta afinidad para la porción Fc de la IgG y los complejos de IgM, como el factor reumatoide, permite depurar estos autoanticuerpos y justifica el uso de este tratamiento. En 1999, Felson et al.15 llevaron a cabo un estudio aleatorizado en 99 pacientes con AR refractaria (52 tratados con IADS y 47 con placebo). El tratamiento con IADS fue semanal, durante 12 semanas, y se observó una respuesta óptima en un 42% en comparación con un 16% en brazo placebo. La misma tasa de respuesta fue observada en 40 pacientes que fueron nuevamente tratados tras completar las 12 semanas de tratamiento, tras la recidiva de la enfermedad o en aquellos pacientes que no respondieron en el primer estudio75.
MiopatíasEl uso de RP en la polimiositis y la dermatomiositis tiene una categoría III y IV de las recomendaciones, respectivamente6. En un estudio, 32 de 35 pacientes con miopatía inflamatoria tratados con RP presentaron una mejoría de la fuerza muscular sin efectos secundarios graves76. Sin embargo, estos pacientes recibieron tratamiento asociado con otros agentes inmunosupresores. En otros estudios de pacientes con miopatía inflamatoria refractaria los RP no fueron efectivos y se describieron algunos efectos adversos72,77. De acuerdo con estos y otros estudios73,74,78,79, se considera que el RP puede desempeñar un papel en el tratamiento de las miopatías inflamatorias graves o refractarias al tratamiento convencional, en especial en la fase aguda de la enfermedad. Sin embargo, no hay pruebas suficientes para recomendarla como tratamiento estándar.
Púrpura trombocitopénica trombóticaLas guías solo establecen la indicación para la forma idiopática, con categoría I de acuerdo con ensayos clínicos aleatorizados80,81. Aun falta por saber qué pacientes serían los que más se beneficiarían de esta técnica82. Desde que se emplea el RP, la mortalidad ha descendido a menos del 10%. Por ello, dada la gravedad de esta enfermedad y la alta mortalidad si no se realiza tratamiento, el RP se establece como tratamiento estandarizado incluso de primera línea12.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses