El «pie diabético» incluye una serie de síndromes en los que la interacción de la pérdida de la sensación protectora por la presencia de neuropatía sensitiva, el cambio en los puntos de presión a causa de la neuropatía motora, la disfunción autonómica y la disminución del flujo sanguíneo por enfermedad vascular periférica pueden dar lugar a la aparición de lesiones o úlceras inducidas por traumatismos menores que pasan «desapercibidos». Esta situación conlleva una importante morbilidad y un riesgo de amputación elevado. Se puede prevenir con la aplicación de programas de prevención, basados en la detección precoz de neuropatía, evaluación de factores de riesgo asociados, junto a aplicación de un programa estructurado de educación y tratamiento de los factores de riesgo. Incluyen el manejo óptimo de la lesión aguda, con antibioterapia específica y cuidados que favorecen un cicatrización correcta y temprana.
Diabetic foot includes a group of syndromes in which the interaction among loss of protective sensation due to sensory peripheral neuropathy, a change in pressure spots due to motor neuropathy, autonomic dysfunction, and decreased blood supply due to peripheral vascular disease can lead to the occurrence of wounds or ulcers usually related to minimal injuries that are usually unnoticed. Diabetic foot is associated with higher morbidity and a high risk of amputation of the foot or limb. These situations can be avoided with an appropriate prevention program, based on the early detection of diabetic neuropathy and assessment of the associated risk factors in addition to structured patient education. Also important are optimal treatment of the acute injury, with specific antibiotics and foot care measures that encourage early and effective healing.
Las lesiones en el pie constituyen una de las mayores causas de morbilidad e incapacidad en las personas con diabetes. Representan la causa más frecuente de ingreso hospitalario en dicho grupo; se trata de una estancia hospitalaria prolongada y recurrente, y en ocasiones se precisa la amputación del miembro. Este hecho origina un coste social y económico elevado y una disminución de la calidad de vida de los pacientes. Entre el 40 y el 70% de las amputaciones de miembros inferiores (AMI) ocurren en la población diabética, y hasta en el 85% de los casos el factor desencadenante es la úlcera, asociada a infección y gangrena. La incidencia de un nuevo episodio tras una amputación ronda en torno al 50% a los 5 años.
Según los datos obtenidos del registro de AMI del Área 7 de Madrid (1989 y 1993), las personas con diabetes tenían un riesgo 20 veces mayor que la población no diabética (18 para el varón y 30 para la mujer), y la AMI ocurría a una edad más temprana, entre 1 y 5 años. Los factores asociados a la AMI eran similares a los descritos en otras poblaciones e incluían la presencia de polineuropatía, enfermedad vascular periférica y alteraciones biomecánicas de las articulaciones del pie1-3. Este registro permitió desarrollar programas de prevención primaria (aparición de lesiones en los pies)4,5 y prevención secundaria (manejo de la lesión aguda, evitando que termine en una AMI).
En estudios posteriores se ha valorado la aplicación de dichos programas, objetivándose una reducción en la incidencia de AMI en pacientes diabéticos del 50% en las primeras amputaciones mayores y del 28-56% en las menores6,7.
EtiologíaLos factores de riesgo reconocidos para sufrir lesiones en los pies son:
- •
La neuropatía diabética, que se define como la presencia de síntomas o signos de disfunción del sistema nervioso periférico en el paciente diabético, una vez excluidas otras causas8. Es una de las complicaciones microvasculares más frecuentes en la población diabética, aumenta su prevalencia y gravedad conforme se incrementa el tiempo de evolución de la diabetes, la edad, la hiperglucemia y su duración9-11. Constituye el factor de riesgo más importante asociado a la presencia de úlceras en los pies.
Afecta a fibras nerviosas sensitivas, motoras y autonómicas del sistema nervioso periférico. De comienzo predominantemente distal y lento, es asintomática en más del 85% de los casos.
En cuanto a la afectación de las fibras sensitivas, la pérdida o la disminución de la sensibilidad térmica, algésica, vibratoria y propioceptiva propicia la aparición de lesiones inducidas por una manipulación inadecuada de los pies, por el uso de calzado inapropiado y por hábitos higiénicos peligrosos. Esta iatrogenia pasa desapercibida y se mantiene en el tiempo debido a la pérdida del reflejo defensivo doloroso. El primer síntoma suele ser una úlcera en la mayoría de los casos.
Por otro lado, las fibras motoras son las encargadas de mantener de forma correcta la posición de las articulaciones del pie, lo que permite una distribución adecuada de las presiones. Cuando estas se alteran, se puede producir una atrofia muscular que induce deformidad ósea y modifica la biomecánica de la marcha y la redistribución de las presiones. La formación de callos en los puntos anómalos de presión, junto con un adelgazamiento de la cabeza metatarsiana, incrementa la presión plantar y, por último, induce el desarrollo de la úlcera.
La pérdida de las fibras autonómicas produce una alteración en la regulación del flujo sanguíneo y una disminución de la sudoración; como consecuencia, la piel está seca y aparecen fisuras.
- •
La enfermedad vascular periférica (EVP), caracterizada por una afectación distal al territorio infrapoplíteo, en ocasiones bilateral y multisegmentaria. Si aparece calcificación de la media se asocia a la presencia de neuropatía. La EVP constituye un factor de riesgo determinante en la evolución de las lesiones del pie hacia la amputación12.
- •
Las alteraciones biomecánicas, caracterizadas por modificar los puntos de apoyo durante la marcha o en posición estática, lo que induce la aparición de callosidades y/o úlceras por presión.
- •
Otros factores de riesgo incluyen la edad (>40 años), el tiempo de evolución (>10 años), el hábito tabáquico, la falta de autosuficiencia visual y motriz, la baja situación socioeconómica y el hecho de vivir solo.
Aproximadamente el 16% de los pacientes diabéticos padecerá una úlcera a lo largo de su evolución1,2. La incidencia anual es del 2 al 3%, que se duplica en presencia de polineuropatía, superando el 20% si esta es de alto riesgo. La prevalencia ronda en torno al 2-3%.
Con respecto a la neuropatía diabética, se ha visto en varios estudios que el 50% de los pacientes diabéticos la desarrollará a lo largo de su evolución13. La prevalencia en España, utilizando los cuestionarios de signos y síntomas, se ha estimado en el 22,7%, y es mayor en los pacientes con diabetes mellitus tipo2 (24,1%) que en aquellos con diabetes mellitus tipo1 (12,9%)9.
Con respecto a la EVP, su prevalencia varía en función del método diagnóstico utilizado; empleando el índice tobillo-brazo (ITB), se ha descrito un porcentaje del 20 al 40%. El riesgo aumenta con la edad, el tiempo de duración de la diabetes y la presencia de neuropatía.
Manifestaciones clínicasNeuropatía diabéticaLa forma más frecuente de polineuropatía diabética (PND) es la polineuropatía distal simétrica o sensitivomotora crónica14,15, asintomática en aproximadamente un 85% de los pacientes. Puede iniciarse con la aparición de una úlcera en el pie, si no se diagnostica de forma temprana y se instauran medidas de prevención primaria.
La polineuropatía sintomática engloba síntomas positivos que no se asocian a la presencia de signos objetivos positivos ni a un incremento en el riesgo para padecer lesiones en los pies. Entre ellos se encuentran las parestesias (sensaciones anómalas como hormigueo, acorchamiento o adormecimiento de los pies), las disestesias (sensaciones anómalas dolorosas), la hiperalgesia (síntomas dolorosos ante estímulos de baja intensidad, como un pinchazo), la alodinia (percepción dolorosa ante estímulos no dolorosos) y el dolor quemante o urente. El dolor neuropático se caracteriza por empeorar durante la noche y se localiza con más frecuencia en los pies y en los miembros inferiores, aunque en ocasiones afecta a las manos. Los síntomas negativos, como hipoalgesia, hipoestesia y anestesia, se asocian a un aumento de riesgo para padecer lesiones16. Es frecuente que aparezcan al mismo tiempo varios síntomas y signos en el propio paciente, que pueden variar a lo largo del tiempo.
Alteraciones biomecánicasComo se ha explicado en el apartado de etiología, en ocasiones la neuropatía favorece la alteración de las articulaciones del pie mediante la afectación de la función motora, el sistema autónomo y la sensibilidad propioceptiva. Como consecuencia se afecta la estática del pie (con distribución anormal de las presiones plantares) y de la dinámica (alteraciones en la marcha y en los puntos de apoyo). Esta alteración se evidencia principalmente por la presencia de rozaduras, callosidades y deformidades plantares.
En casos extremos se puede originar la artropatía de Charcot, caracterizada por la aparición de fracturas y subluxaciones tras pequeños traumatismos (generalmente los ocasionados por la alteración de la marcha unida a la pérdida de sensibilidad de la PND), lo que ocasiona mayores deformidades, favoreciendo así la producción de nuevas fracturas y de ulceraciones en los pies. Se ha estimado una incidencia de ulceración de hasta el 17% anual.
Enfermedad vascular periféricaEs una manifestación del proceso aterosclerótico en el sistema arterial de los miembros inferiores que da lugar a una disminución del riego sanguíneo y, en el peor de los casos, a isquemia. Se asocia a la presencia de afectación macrovascular en otras localizaciones y a un mayor riesgo de desarrollar enfermedad cerebrovascular e infarto agudo de miocardio (20% a los 5 años).
Entre los síntomas clásicos de la EVP se encuentra, como síntoma principal, la claudicación intermitente (dolor que aparece con la deambulación, tras un tiempo determinado y variable, que cede con el reposo y aparece de nuevo al reiniciar la marcha). Otros son el dolor en reposo y en decúbito, la frialdad y la pérdida de vello de la piel.
A diferencia de la población sin diabetes, la EVP en los diabéticos tiene una mayor afectación difusa y distal, que suele asociarse a la calcificación de la media de forma extensa. Habitualmente se acompaña de presencia de PND (con alteración de la sensibilidad), por lo que con más frecuencia la EVP es asintomática o se presenta con síntomas no clásicos. La presencia de EVP aumenta significativamente el riesgo de amputación, ya que no se puede satisfacer la demanda sanguínea necesaria para el control de la infección y una correcta cicatrización.
PronósticoEl pronóstico de las lesiones en el pie de las personas con diabetes representa un reto de primera magnitud para el sistema sanitario, pues depende de las estrategias preventivas para detectar las personas en riesgo y establecer el diagnóstico precoz y el tratamiento intensivo de las úlceras, que representan todavía la causa más frecuente de hospitalización y que terminan con frecuencia en amputaciones de origen no traumático de la extremidad inferior.
TratamientoPrevención primariaIdentificación de los pacientes con riesgo de presentar lesiones de forma inadvertida en los pies y en su caso aplicación de las medidas preventivas oportunas. El primer paso es la anamnesis y una exploración específica mínima. En los antecedentes personales deben constar el tiempo de evolución de la diabetes y el grado de control metabólico, los factores de riesgo cardiovascular, la presencia de enfermedad microvascular (retinopatía, nefropatía y neuropatía) o de enfermedad macrovascular (síntomas de claudicación intermitente y dolor en reposo, enfermedad cardiovascular y cerebrovascular) y los antecedentes de úlcera o infección previa en los pies.
En la exploración se realiza una inspección del pie valorando su aspecto, la temperatura, la coloración, la presencia de callos, deformidades articulares y secuelas de úlceras o cirugías previas, con palpación de los pulsos distales, pedios y tibiales posteriores y la exploración de la sensibilidad térmica, algésica y vibratoria, junto a la obtención del reflejo aquíleo.
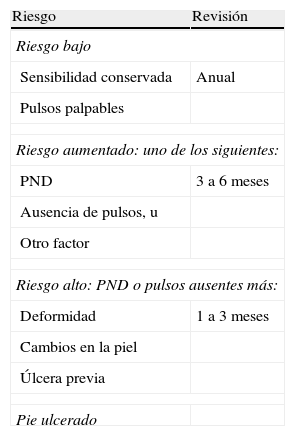
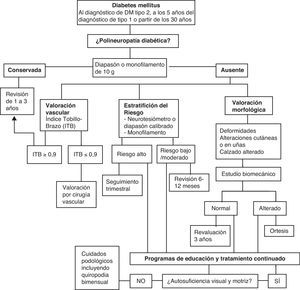
A partir de esta primera aproximación se puede establecer una clasificación clínica del riesgo para determinar la frecuencia mínima con la que deben hacerse las revisiones de los pies en cada paciente (tabla 1).
Clasificación clínica del riesgo de ulceración y periocidad de la revisión
| Riesgo | Revisión |
| Riesgo bajo | |
| Sensibilidad conservada | Anual |
| Pulsos palpables | |
| Riesgo aumentado: uno de los siguientes: | |
| PND | 3 a 6 meses |
| Ausencia de pulsos, u | |
| Otro factor | |
| Riesgo alto: PND o pulsos ausentes más: | |
| Deformidad | 1 a 3 meses |
| Cambios en la piel | |
| Úlcera previa | |
| Pie ulcerado | |
Se recomienda realizarlo al diagnóstico de los pacientes diabéticos tipo2, y a los 5 años del diagnóstico de los pacientes diabéticos tipo1, o a partir de los 30 años de edad, y posteriormente en todos los pacientes diabéticos, al menos anualmente si presentan un riesgo elevado (hemoglobina glucosilada>7%)17.
Entre los cuestionarios de signos y síntomas recomendados para el cribado de PND, el más empleado es el cuestionario de signos Neuropathy Disability Score (NDS), que tiene un valor predictivo sobre el riesgo de presentar úlceras en los pies. Como alternativa puede utilizarse únicamente el monofilamento de 10g de Semmes-Weinstein o el diapasón.
- •
El NDS valora la sensibilidad térmica, algésica y vibratoria, y el reflejo aquíleo en cada pie. Para su realización se precisa de un martillo de reflejos, diapasón de 128 ciclos por segundo, algodón y un palillo de punta roma y puntiaguda.
Metodología18:
- -
Sensibilidad algésica: usando el palillo puntiagudo, presionar en la raíz de la uña del dedo gordo. Preguntar al paciente si siente dolor, y no si siente que le tocan. Alternar la presión con un extremo romo para asegurar que diferencia la sensación de «tocar» de la de «pinchar».
- -
Sensibilidad táctil: usar el algodón.
- -
Sensibilidad térmica: utilizar el manguito del martillo o del diapasón y asegurarse de que percibe la sensación de frialdad.
- -
Reflejo aquíleo: percutir con el martillo el tendón de Aquiles. Se produce una contracción de los músculos de la pantorrilla.
- -
Sensibilidad vibratoria: hacer vibrar el diapasón golpeándolo contra una superficie y reposar su extremo sobre la punta del dedo gordo. El paciente debe decir si nota o no la vibración y en qué momento deja de notarla. Si el examinador es aún capaz de percibir la vibración cuando el paciente ha dejado de notarla, la sensibilidad vibratoria del paciente está disminuida.
Según el resultado de la exploración, se asigna una puntuación de 1 a 2 a cada signo y finalmente se suman los puntos (tabla 2). Una puntuación mayor o igual a 6 establece el diagnóstico de PND.
Tabla 2.Puntuación de los signos para el diagnóstico de polineuropatía basado en el cuestionario Neuropathy Disability Score (≥ 6 puntos)
Reflejo aquíleo Sí (0) No (2 por cada lado) Sensibilidad térmica Sí (0) No (uno por lado) Sensibilidad algésica Sí (0) No (uno por lado) Sensibilidad vibratoria Sí (0) No (uno por lado) - -
- •
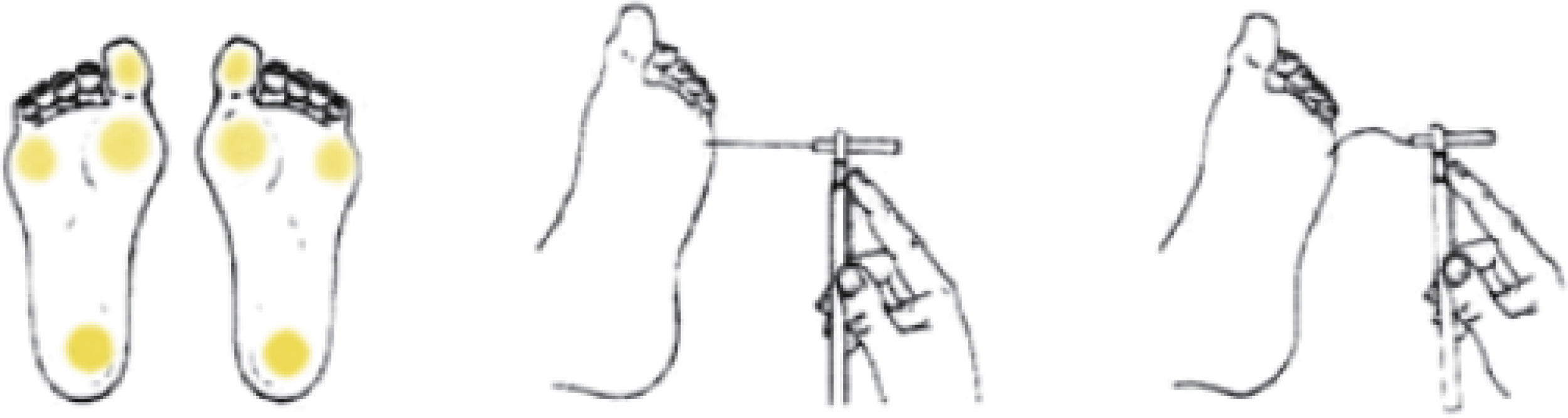
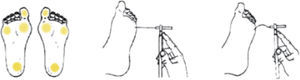
Monofilamento de 10g. Evaluación de la sensibilidad a la presión en 4 puntos (cara ventral del dedo gordo y cara plantar del talón, del primer y del quinto metatarsiano), en cada pie (fig. 1). Se aplica 3 veces en cada uno de los puntos señalados, debiendo acertar al menos 2 de cada 3. Es un método sencillo, rápido y reproducible que identifica hasta el 90% de los pacientes en riesgo detectados con otros test más complejos.
- •
Diapasón de 128Hz o diapasón calibrado en la escala de 8 (el nivel 4 corresponde a la sensación cualitativa sí/no del diapasón de 128Hz). Se ha demostrado que su utilización aislada tiene una sensibilidad, una especificidad y un valor predictivo semejantes al monofilamento, por lo que constituye una prueba de cribado eficaz de la PND, ya que acorta el tiempo de exploración en la consulta19.
El diagnóstico de PND, basado en el NDS, se debe confirmar con un segundo test diagnóstico, aunque no existe acuerdo en tal afirmación. Con respecto a la estratificación del riesgo de úlcera, se realiza mediante la evaluación del umbral de sensibilidad vibratoria con el neurotensiómetro y la exploración de la sensibilidad a la presión con el monofilamento de 10g (metodología anteriormente descrita).
El neurotensiómetro se aplica en 3 puntos: en el maléolo radial de la mano y en el primer y quinto dedos del pie, y se realiza la media de las 3 mediciones en cada localización. El paciente debe decir cuándo empieza a notar la vibración, y en ese momento el neurotensiómetro indica el valor en milivoltios. Los pacientes que presenta un umbral mayor de 25mV tienen un riesgo de presentar una úlcera en el pie superior al 20% anual. Alternativamente se puede utilizar el diapasón calibrado, considerando la pérdida de sensación en la escala de 2.
Clasificación del riesgo de úlcera:
- -
Riesgo bajo: el único dato diagnóstico de PND ha sido una puntuación del NDS mayor o igual a 6.
- -
Riego moderado: además de NDS mayor o igual a 6, umbral de percepción vibratoria >25mV con el neurotensiómetro o <2 en la escala del diapasón calibrado.
- -
Riesgo elevado: además presenta una pérdida de la sensación a la presión con el monofilamento (2 veces de cada 3 estímulos en al menos un lugar de los 4 explorados).
Independientemente de la clasificación previa, los pacientes con antecedentes de úlcera o de amputación constituyen el grupo de riesgo más importante para presentar nuevas lesiones.
Alteraciones biomecánicasUna primera aproximación para la detección de alteraciones podológicas por personal no adiestrado es la realización de la denominada «Exploración podológica de los 2min» (tabla 3), en la que mediante un sencillo cuestionario se recogen los aspectos básicos de la patología morfofuncional del pie.
Exploración podológica mínima de los 2min (si existe más de un dato positivo se recomienda estudio biomecánico completo)
| Deformidades | Estado cutáneo |
| Deformidades digitales, juanetes, prominencias óseas, cabezas metatarsales prominentes, falta de tejido adipososubmetatarsal, tendones marcados, pie caído y pie de Charcot | Callos, fisuras, lesiones preulcerosas, zonas de roce, zonas enrojecidas, zonas calientes, maceración, inflamción y sequedad |
| Alteraciones de la uña | Examen del calzado |
| Quebradizas, engrosadas, clavadas, bordes inflamados e infección fúngica | Desgastes excesivos en suelaCalzado deformado |
Las alteraciones dinámicas relacionadas con la movilidad anómala requieren un examen podológico más exhaustivo encaminado a la determinación del patrón mecánico. La inspección, la exploración funcional articular y la monitorización de los patrones mecánicos (podobarometría dinámica y análisis cualitativo de la marcha) permiten la detección de incrementos de presión y fuerzas lesivas que favorecen las complicaciones del pie diabético y que pueden ser prevenidas con la instauración de tratamientos ortésicos diseñados a medida. Las ortesis son dispositivos que se emplean para disminuir la presión, las fuerzas tangenciales y las fuerzas de torsión generadas por las alteraciones biomecánicas del pie.
Con respecto a la artropatía de Charcot, el diagnóstico se realiza con radiología convencional; en muchas ocasiones es preciso el diagnóstico diferencial con la osteomielitis recurriendo a la resonancia magnética nuclear o a la gammagrafía con leucocitos marcados.
Enfermedad vascular periféricaLos pacientes con PND deben evaluarse para descartar la presencia de EVP20. El cribado basado en la palpación de los pulsos pedios y tibiales posteriores y en la historia de claudicación intermitente estima una prevalencia de EVP entre el 8,4 y el 23,1%. Esta cifra se incrementa hasta en un 40% de los explorados si se utiliza el eco-doppler bidireccional con la estimación del ITB y la morfología de la onda del pulso arterial. Por ello es fundamental la realización del ITB para no infravalorar la prevalencia de EVP.
El ITB es el cociente entre la presión arterial sistólica (PAS) del tobillo y la PAS del brazo (se elige la más alta obtenida entre los 2 brazos). Se considera normal si tiene un valor entre 0,9 y 1,2; por debajo de 0,9 ya es diagnóstico de EVP (0,7-0,9: obstrucción leve; 0,4-0,7: obstrucción moderada, y <0,4: obstrucción severa). Si es superior a 1,2 no es valorable, ya que indica poca compresibilidad de las arterias por calcificación de la capa media arterial. Sin embargo, la morfología de la onda deja de ser trifásica, lo cual también es indicativo de EVP.
Estudios previos que han evaluado diferentes métodos de cribado de la EVP en diabéticos han demostrado que los métodos más sensibles en presencia de PND son el análisis simultáneo de la morfología de la onda del pulso, nomalmente trifásica, y el índice braquiotibial, como alternativa al braquiopedal21-23.
Los pacientes con EVP deben ser evaluados por el especialista de cirugía vascular para confirmar el diagnóstico y establecer su severidad con los métodos adecuados. Hay que valorar la posibilidad de revascularización percutánea o quirúrgica, ya que en estos pacientes supone un mayor beneficio que las actividades de los programas educativos.
Medidas preventivasConsisten en la actuación sobre los factores de riesgo previamente detectados. Las medidas a tomar son:
- 1.
Control metabólico estricto: buen control de la glucemia, junto al resto de factores de riesgo cardiovascular (hipertensión arterial, dislipidemia y abandono del hábito tabáquico). Una vez conseguido un control metabólico óptimo, una dieta con una proporción elevada de grasa monoinsaturada/saturada y de poliinsaturada/saturada podría desempeñar un papel añadido importante en la prevención de PND24-26.
- 2.
En caso de presencia de PND, el paciente debe ser incluido en un programa de educación específica en el autocuidado de los pies. El objetivo fundamental de estos programas es sustituir la pérdida del reflejo doloroso por la inspección diaria del pie y del calzado, para buscar lesiones que hayan pasado inadvertidas. Se instruyen sobre los cuidados básicos del pie, las uñas y la piel, y la selección de un calzado adecuado para la distribución uniforme de las presiones. Han de evaluarse periódicamente para comprobar si han sido capaces de modificar sus hábitos y para insistir en medidas preventivas. Cuando los pacientes no son autosuficientes en el cuidado de los pies o no disponen de apoyo familiar, se remiten a la consulta de podología para recibir cuidados podológicos. Dichos cuidados, realizados por personal especializado, disminuyen la prevalencia de callosidades y de uñas encarnadas, mejoran el conocimiento de los pacientes sobre el cuidado de los pies y evitan que ellos mismos manipulen de forma incorrecta sus uñas y sus lesiones. Varios estudios han evidenciado que los cuidados podológicos continuados, integrados en el abordaje multidisciplinario del pie diabético, tienen un papel fundamental en la prevención primaria de úlceras27. En un estudio aleatorizado se demostró una reducción significativa de la recurrencia de úlcera en pacientes diabéticos de alto riesgo que recibieron cuidados podológicos regulares (al menos una vez al mes) frente a un grupo de pacientes que no los recibieron. Las evidencias previas ponen de manifiesto la necesidad de un servicio eficaz de podología integrado en el equipo multidisciplinario de atención al paciente diabético.
- 3.
Con respecto a la presencia de EVP, se debe remitir al servicio de cirugía vascular para continuación del estudio diagnóstico (arteriografía…), seguimiento y tratamiento, si procede (revascularización). La eficacia y la seguridad de la cirugía reconstructora en diabéticos son similares a las de las personas sin diabetes28. Sin embargo, la presencia de PND y, en particular, de infección en el momento de la intervención pueden reducir las expectativas de éxito de la cirugía. Por ello, son fundamentales la detección y la intervención tempranas, preferiblemente antes de que se produzca la úlcera.
- 4.
Si se detectan o sospechan alteraciones en la biomecánica, deben recibir una valoración podológica exhaustiva para la determinación de un patrón mecánico y prescripción de tratamientos ortésicos diseñados a medida.
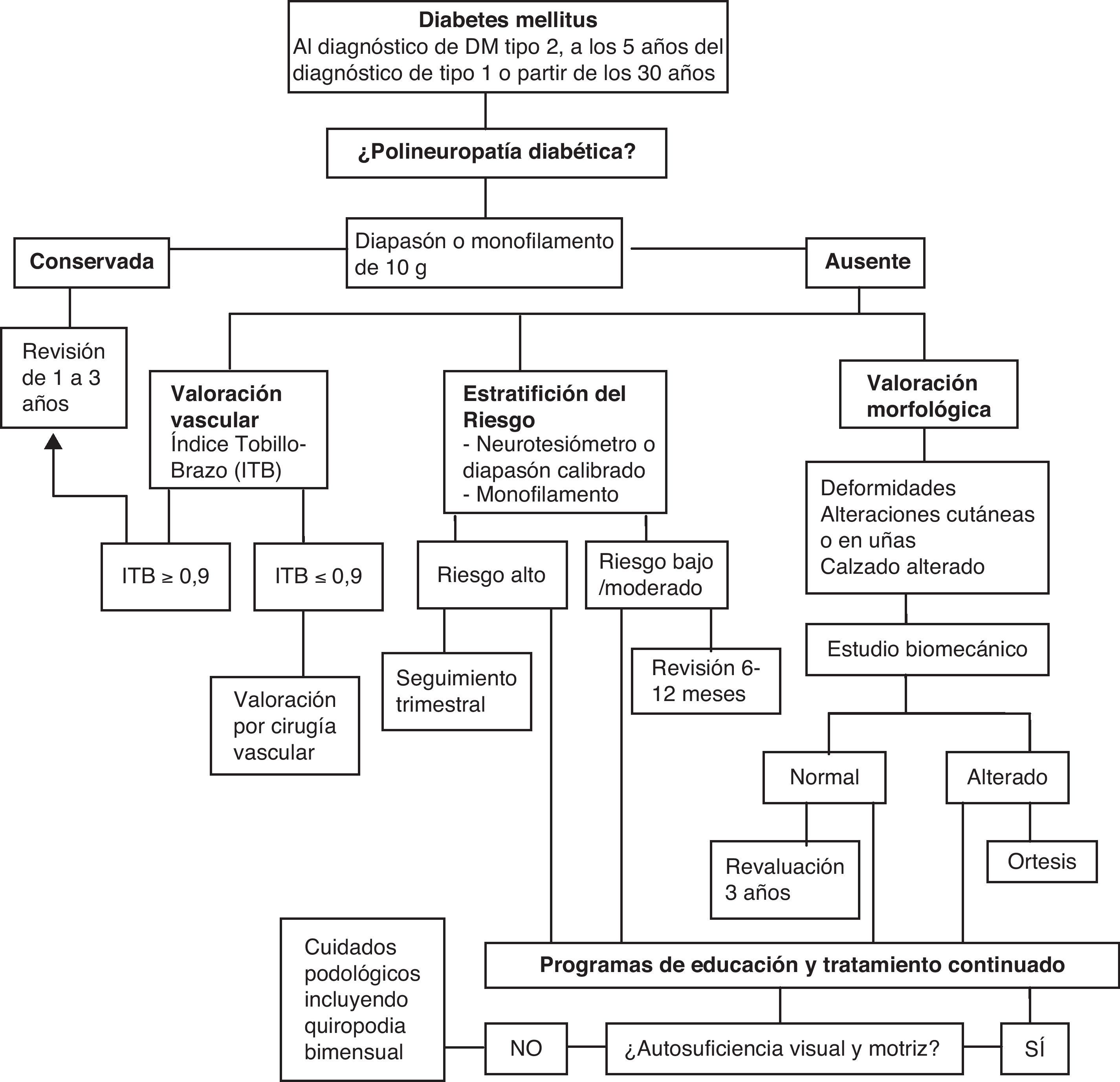
En la figura 2 se muestran las actividades a realizar en prevención primaria.
Prevención secundariaTratamiento de la úlcera en el pie diabético y prevención de la amputación.
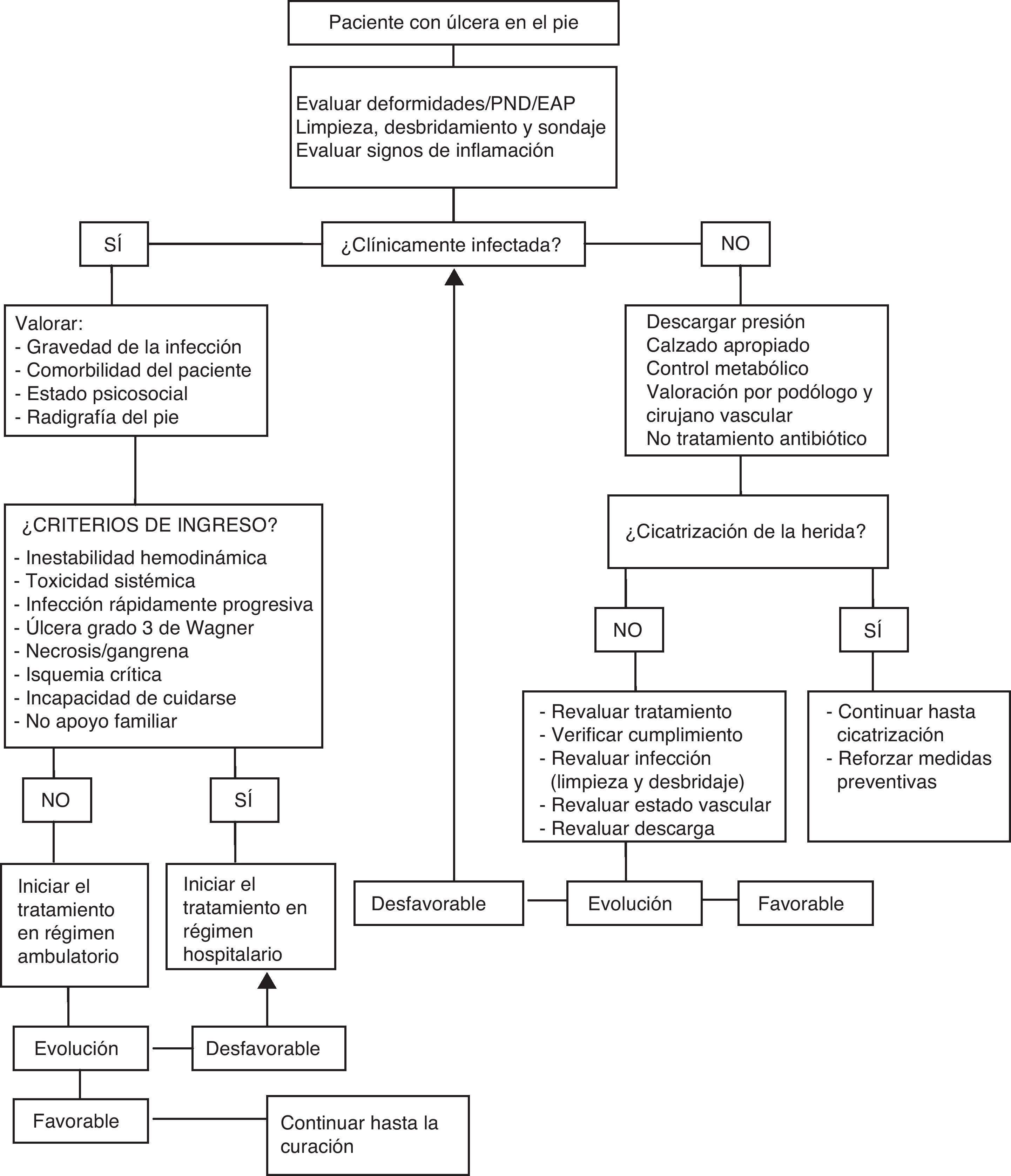
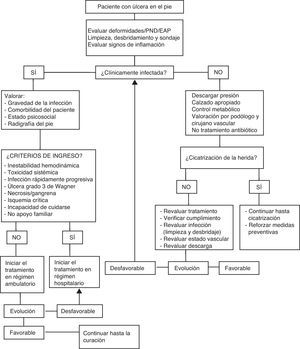
Para un manejo adecuado de la úlcera es necesario caracterizarla, descartar una respuesta sistémica (fiebre, hipotensión), valorar el grado de control metabólico (descompensación glucémica y cetoacidosis) y nutricional del paciente, la circulación arterial (existencia de signos de necrosis o gangrena, valoración de pulso, ITB y otras pruebas si es necesario), el estado vascular venoso (edema, estasis o signos de EVP) y la presencia de neuropatía y alteraciones biomecánicas (callos, deformidades, Charcot…). De esta forma se podrá establecer su gravedad y elaborar un plan de tratamiento multidisciplinar óptimo. Los algoritmos de decisión ante una úlcera se exponen en la figura 3.
Caracterización de la úlceraLa úlcera se define como cualquier discontinuidad de la piel. Hay que evaluar la extensión y la profundidad, la presencia de mal olor, crepitación, abscesos y celulitis perilesional, y valorar la afección de la articulación y de los huesos. En función de su localización, puede ser de origen vascular (dedos y talón) o neuropático (planta y laterales). Es importante monitorizar la lesión con documentación gráfica.
En cuanto a la clasificación de la úlcera, se han propuesto varias clasificaciones, aunque ninguna está universalmente aceptada. La más antigua es la clasificación de Wagner, basada en la profundidad de la lesión y la presencia de necrosis, que establece 5 grados:
- -
Grado 0: no hay lesión en la piel, pero sí deformidades, callosidades y alteración de la sensibilidad.
- -
Grado 1: úlcera superficial, con celulitis perilesional menor de 2cm.
- -
Grado 2: 2A (úlcera superficial con celulitis regional de más de 2cm de diámetro), 2B (úlcera profunda que alcanza tendones, pero sin afectación ósea).
- -
Grado 3: úlcera con artritis u osteomielitis.
- -
Grado 4: gangrena localizada en dedos, antepié o talón.
- -
Grado 5: gangrena de todo el pie.
Dicha clasificación, sin embargo, no diferencia el origen de la úlcera y tampoco sirve para establecer tratamientos. El grupo de trabajo internacional sobre el pie diabético estableció una clasificación (PEDIS)29 basada en la perfusión (enfermedad arterial), la extensión (área), la profundidad, la infección y la sensibilidad. La Sociedad Americana de Enfermedades Infecciosas reconoce 4 niveles en función del grado de infección y establece asociación con el nivel de PEDIS30:
- -
Nivel 1: no existe infección.
- -
Nivel 2 (infección leve): ulceración superficial sin afectar tendones ni estructura ósea. Más de 2 marcadores de inflamación: eritema, pus, dolor, induración, edema. Celulitis periulcerosa menor de 2cm.
- -
Nivel 3 (infección moderada): ulceración profunda pero localizada y que afecta a tendones pero no a estructuras óseas. Celulitis periulcerosa mayor de 2cm. Linfangitis, fascitis, abscesos, gangrena, artritis u osteomielitis.
- -
Nivel 4 (infección grave): ulceración con osteomielitis; infección más toxicidad sistémica o alteraciones metabólicas.
No todas las úlceras en los pies están infectadas, y algunos microorganismos, aunque virulentos, pueden colonizar la herida pero también contaminar. La infección no puede ser definida microbiológicamente, sino como la presencia de secreción purulenta junto al menos 2 signos de inflamación (rubor, tumefacción, calor…). No es fácil establecer el diagnóstico de infección ni determinar su extensión en pacientes con diabetes. Debe basarse en pruebas de laboratorio, obtención de muestras para cultivo y en pruebas de imagen. En ocasiones es necesario realizar otras pruebas accesorias.
Pruebas complementarias- •
Analítica básica. Aporta información sobre:
- -
El grado de control metabólico (hiperglucemia y cetoacidosis).
- -
El estado nutricional del paciente (albúmina, proteínas totales, lípidos y hemograma).
- -
Signos de infección/inflamación y afectación ósea: leucocitosis, con desviación izquierda, proteína C reactiva (para el diagnóstico y la monitorización de la respuesta), velocidad de sedimentación globular (si es mayor de 70mm/h es altamente sugestiva de osteomielitis), fosfatasa alcalina (si es mayor de 135UI/l es sugestiva de osteomielitis).
- -
- •
Microbiología: Cultivo y toma de muestras.
Consideraciones previas:
- -
El cultivo de las lesiones clínicamente no infectadas no es necesario.
- -
Los cultivos de heridas infectadas son útiles para dirigir la elección de antibióticos, aunque pueden ser innecesarios en una infección aguda leve en un paciente sin tratamiento antibiótico previo. Se obtendrán las muestras antes de iniciar la antibioterapia (si es posible) o después de interrumpirla en un paciente estable sin respuesta al tratamiento.
- -
Se tratará de obtener muestras tisulares de la base desbridada mediante legrado/biopsia, ya que aportan resultados más exactos que las muestras de frotis superficial. Se evitará la obtención de frotis de úlceras no desbridadas o supuración de heridas.
- -
Se obtendrán hemocultivos en pacientes con infección grave y afectación sistémica.
Método de obtención de muestras:
- -
Torunda estéril: es lo menos rentable y tiene escaso rendimiento en el aislamiento anaerobio.
- -
Aspirado con aguja estéril: resulta difícil obtener material suficiente, y solo es rentable en los abscesos. Escaso rendimiento en aislamiento anaerobio.
- -
Exudado tras curetaje: lo mejor y más rentable.
La muestra debe ser analizada para aerobios y anaerobios; por su rapidez, utilizar la tinción de Gram cuando sea posible.
- -
- •
Pruebas de imagen.
- -
Radiología simple: para identificar cuerpos extraños, gas en los tejidos, anomalías óseas, osteomielitis (erosión cortical, reacción perióstica, radiolucencia y esclerosis mixta).
- -
Resonancia magnética: es la mejor técnica para el diagnóstico de osteomielitis, ya que alcanza una sensibilidad del 90% y una especificidad del 80%.
- -
Medicina nuclear: sobre todo en el pie medio y retropié, para diferenciar la articulación neuropática con y sin infección; la técnica más útil es la gammagrafía (SPECT-TC) con leucocitos marcados con indio-111.
- -
Ecografía de alta resolución y TC: útiles para detectar abscesos en los tejidos blandos profundos o fístulas.
- -
- •
Otras pruebas accesorias.
- -
Índice tobillo-brazo: no solo para el cribado de la EVP, sino para determinar la posibilidad de curación y la necesidad de revascularización. Una presión arterial absoluta del miembro inferior para esperar la curación en el tobillo debe ser >50mmHg, y en los dedos del pie, >30mmHg. Con cifras inferiores a 40 y 20mmHg, respectivamente, la curación es poco probable.
- -
Arteriografía: se recomienda si el paciente presenta gangrena seca, dolor en reposo, ingurgitación venosa o úlcera de grado mayor o igual a 3 de Wagner y sin pulsos periféricos.
- -
Hay que considerar que en más del 80% de los casos la infección es polimicrobiana, y que existen más microorganismos implicados cuanto más profunda es la úlcera y cuando su curso es crónico. En las úlceras agudas, superficiales o más profundas sin afectar tendones, pero no tratadas previamente, están involucrados grampositivos como Staphylococcus aureus o Streptococcus betahemolítico grupo B (pyogenes). En las úlceras más profundas o tratadas previamente con antibióticos, de larga evolución y/u hospitalizados están involucrados habitualmente más de 2 microorganismos, entre los que se pueden encontrar, además de S. aureus, otros gérmenes como S. aureus resistente a meticilina (SARM), Staphylococcus coagulasa negativo, Streptococcus, Enterococcus, Pseudomonas aeruginosa y, en ocasiones, Candida y Corynebacterium. La existencia de anaerobios se incrementa en relación con la cronicidad de la úlcera. En la fascitis necrosante/mionecrosis participan cocos grampositivos aerobios, enterobacterias, bacilos gramnegativos no fermentadores, y anaerobios.
Manejo terapéuticoSe realizará en función de la valoración clínica del paciente, las características de la úlcera y los resultados de las pruebas complementarias. En la figura 3 se muestra el algoritmo de manejo de la úlcera en el pie diabético.
Ante la presencia de infección se deberá evaluar si es posible instaurar el tratamiento de forma ambulatoria o si es necesario el ingreso hospitalario. La existencia de un solo criterio de ingreso hospitalario puede ser suficiente para realizarlo. Incluso sin medios y ni recursos suficientes, se debe proceder a la hospitalización, para garantizar un seguimiento estrecho.
El tratamiento debe cubrir aspectos generales, pauta de antibiótico y manejo local.
- •
Aspectos generales.
Un óptimo control glucémico contribuye a mejorar la infección y la cicatrización de la herida y, conforme mejora la infección, resulta más fácil controlar la hiperglucemia. El empleo de suplementos calórico-proteicos en algunos pacientes favorece también la cicatrización de la herida.
- •
Tratamiento local.
El desbridamiento está indicado en todas las úlceras infectadas31; es importante su ayuda en la consecución de un adecuado tejido de granulación, y también permite obtener muestras adecuadas para cultivo. Con respecto a la aplicación de apósitos32, se recomienda mantener un ambiente húmedo para prevenir la pérdida tisular, facilitar la migración celular, promover la angiogénesis y la síntesis de tejido conjuntivo. El sistema clásico consiste en gasas húmedas con suero salino fisiológico. No hay ningún ensayo que evalúe la eficacia de los apósitos con plata ni evidencia suficiente que apoye la superioridad de cualquier tipo de apósito protector sobre otro. En cuanto a las medidas de descarga33, es esencial el reposo del pie para la resolución de la infección. Las férulas de descarga con contacto total son más eficaces a la hora de curar las úlceras no infectadas que los vendajes tradicionales, y son los dispositivos de elección para disminuir la presión plantar en los diabéticos con úlceras no infectadas y no isquémicas.
- •
Tratamiento antibiótico empírico34.
No es posible realizar recomendaciones basadas en la evidencia acerca del uso de antibióticos en las úlceras del pie diabético. La elección del antibiótico debe realizarse basándose en los microorganismos más probables y el patrón de resistencias locales, con antibióticos de amplio espectro que cubran aerobios y anaerobios.
En las infecciones superficiales (nivel 1 o 2) están involucrados con más probabilidad Staphyloccocus aureus y el Streptococcus pyogenes. De primera elección serían la cloxacilina, la amoxicilina-clavulánico o una cefalosporina de primera generación por vía oral. El tratamiento se mantendrá entre 1-2 semanas. Como segunda elección, en caso de ausencia de mejoría con el tratamiento previo, se sustituirán por clindamicina o levofloxacino por vía oral. La pauta se mantendrá durante un mínimo de 2 semanas.
En infecciones profundas que afectan a tendones pero respetando estructuras óseas (nivel 3), con frecuencia están involucrados, además de S. aureus y S. pyogenes, las enterobacterias. La primera elección sería la combinación de clindamicina y levofloxacino oral entre 2 y 4 semanas. De segunda línea, si hay ausencia de mejoría o presencia de síntomas sistémicos, se utilizarían estos mismos pero por vía intravenosa. Como alternativas, ertapenem o ceftriaxona y metronidazol intravenosos.
En infecciones extensas, de evolución tórpida, con antecedentes de manipulación quirúrgica u hospitalización y antibioterapia previa (nivel 4), cabe esperar encontrar una lesión polimicrobiana con la participación añadida de Pseudomonas aeruginosa, enterococos, SARM o anaerobios. La primera opción sería ciprofloxacino y clindamicina intravenoso, o ertapenem parenteral, o ceftriaxona y metronidazol intravenoso. Como alternativa o ante la ausencia de mejoría con el tratamiento previo se puede utilizar imipenem y metronidazol intravenoso, o linezolid y metronidazol intravenoso.
El ertapenem parece la primera opción por vía parenteral por su facilidad de uso en monoterapia y dosis única diaria. Presenta un espectro antimicrobiano que cubre enterobacterias productoras de betalactamasas, buena penetración en los tejidos blandos y aporta una experiencia clínica favorable35.
- •
Revascularización y amputación.
Ante una úlcera de evolución tórpida se debe reevaluar la posibilidad de revascularización percutánea o quirúrgica. En pacientes con un pie isquémico infectado resulta preferible practicar la revascularización necesaria 1-2 días después de iniciar el tratamiento antibiótico, en lugar de demorar estas intervenciones a favor de un tratamiento antibiótico prolongado y potencialmente ineficaz. En caso de no ser viable la revascularización, se debe plantear la amputación más económica.
La amputación está indicada en caso de necrosis de uno o varios dedos, gangrena digital o del antepié, dolor incontrolable con analgésicos, necrosis extensa e infección potencialmente mortal. El abordaje quirúrgico debe optimizar la probabilidad de cicatrización y tratar de conservar la integridad de la superficie de carga del pie para la deambulación.
- •
Tratamientos complementarios.
Oxígeno hiperbárico: para el tratamiento de las heridas graves de la extremidad que amenazan la vida y que no responden a otros tratamientos. Sobre todo, en la isquemia que no puede corregirse mediante intervenciones vasculares.
Factores de crecimiento: PDGF (platelet derived growth factor), VEGF (vascular endotelial growth factor), MMP (matriz metaloproteinasas). Los estudios son insuficientes para recomendar su uso por el momento.
- •
Osteomielitis.
No existen protocolos terapéuticos basados en la evidencia, por la carencia de estudios prospectivos y aleatorizados rigurosos.
La American Diabetes Association (ADA) recomienda que se reseque todo o la mayor parte del hueso infectado si no va a resultar afectada la funcionalidad del pie.
En todos los casos se debe asociar tratamiento antibiótico durante 2-4 semanas si se extirpó todo el hueso infectado, y 4-6 semanas si se adoptó una actitud más conservadora. La osteomielitis focal puede tratarse con antibioterapia prolongada, inicialmente intravenosa y luego por vía oral durante un mínimo de 2 meses y, habitualmente, entre 3 y 6 meses.
- •
Seguimiento.
La observación de la respuesta al tratamiento debe realizarse a diario en los pacientes ingresados y cada 2-5 días en los ambulatorios. Se recomienda:
- -
Seleccionar el régimen antibiótico definitivo en base a cultivos, estudio de imagen y respuesta clínica inicial. Se utilizarán durante un periodo de tiempo definido por la biología de la infección y el síndrome clínico.
- -
Reevaluar la herida para garantizar que está respondiendo y cicatrizando.
- -
Revisar los regímenes de descarga y el tratamiento de la herida. Se determinará la eficacia y el cumplimiento por parte del paciente.
- -
Evaluar el control glucémico.
- -
Frecuencia de las revisiones, preferentemente cada 1-2 meses de forma conjunta con el podólogo.
- -
El objetivo es aliviar los síntomas, evitar su interferencia con el sueño y mejorar la calidad de vida. El primer paso es conseguir un control glucémico estable y óptimo. Aunque no existen datos de estudios controlados, varios estudios observacionales sugieren que los síntomas de neuropatía mejoran no solo optimizando el control de la glucemia sino también evitando también las fluctuaciones extremas.
He aquí el manejo de los síntomas neuropáticos, según su patogenia36:
- •
Las parestesias se deben a la generación de potenciales evocados espontáneos en las fibras Aβ. El tratamiento consiste en la utilización de agentes estabilizadores de membrana y bloqueadores de los canales de sodio, principalmente carbamacepina y fenitoína.
- •
Las disestesias son consecuencia de la generación de potenciales evocados en las fibras Aβ y en las Aδ. La carbamacepina es el fármaco de primera elección, seguida por la lidocaína y el topiramato, y en tercer lugar, por los fármacos de acción central. Cuando el dolor es paroxístico, responde mejor a los inhibidores gabaminérgicos, como la pregabalina.
- •
El dolor urente o quemante se debe a una sensibilización periférica, a potenciales ectópicos de las fibras C y a la pérdida de control inhibitorio. Son de elección los fármacos de acción local, como la capsaicina tópica, y los inhibidores gabaminérgicos, como la pregabalina. De segunda línea son los fármacos que potencian las vías serotoninérgicas y noradrenérgicas, como los antidepresivos tricíclicos, la clonidina y los opiáceos como el tramadol.
- •
Las hiperalgesias se producen por un fenómeno de sensibilidad periférica, por lo que es de elección un fármaco tópico local.
- •
La alodinia se debe a varios fenómenos de sensibilización y reorganización central, así como a la pérdida de controles inhibitorios. La pregabalina es el fármaco de primera línea, seguido por el tramadol, el baclofeno y los derivados de la morfina.
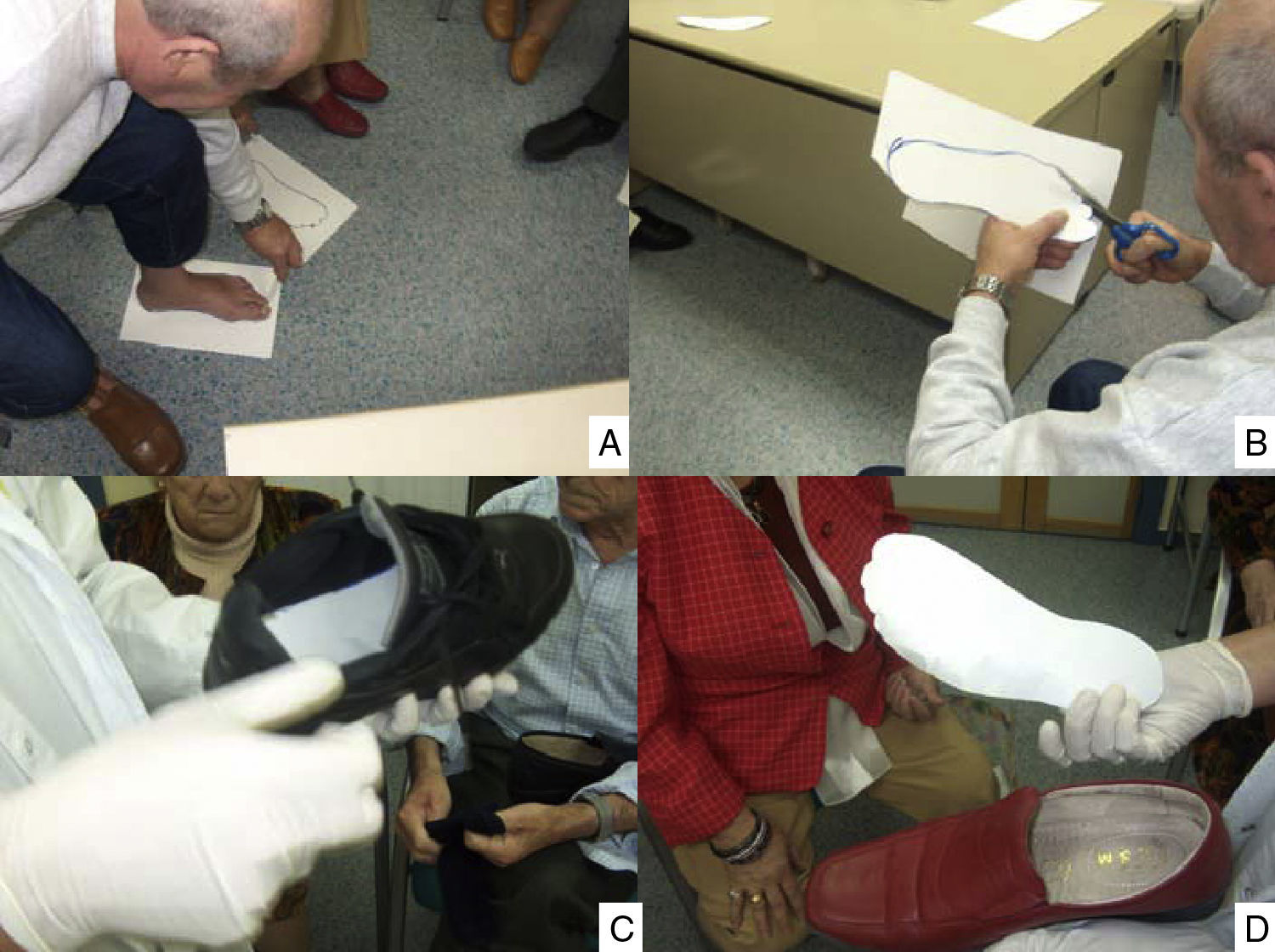
Las estrategias para la prevención de las lesiones en los pies en las personas con diabetes se pueden resumir en la figura 2. La pérdida o reducción del reflejo «doloroso», junto con la falta de autosuficiencia visual y motriz para examinarse el pie y detectar lesiones incipientes y verlas, hace que estas lesiones se detecten en fase avanzada. Las estrategias educativas son cruciales para establecer el reflejo del dolor ante «autoagresiones» (fig. 4). Convencer a un paciente en esta situación para que «invierta» dinero en la compra de un calzado adecuado es difícil de llevar a cabo. La figura 5 suministra una estrategia diseñada para alcanzarlo. Si aparece un «callo» —que significa un cambio de presión, antesala de la aparición de una úlcera en los pies—, el cuidado de estas lesiones debe basarse en la descarga y limpieza de las lesiones, como se refleja en la figura 6. Si queremos reducir las AMI en personas con diabetes, todas estas estrategias deben ser tenidas en cuenta, y han demostrado que son eficientes para lograr reducir su impacto.
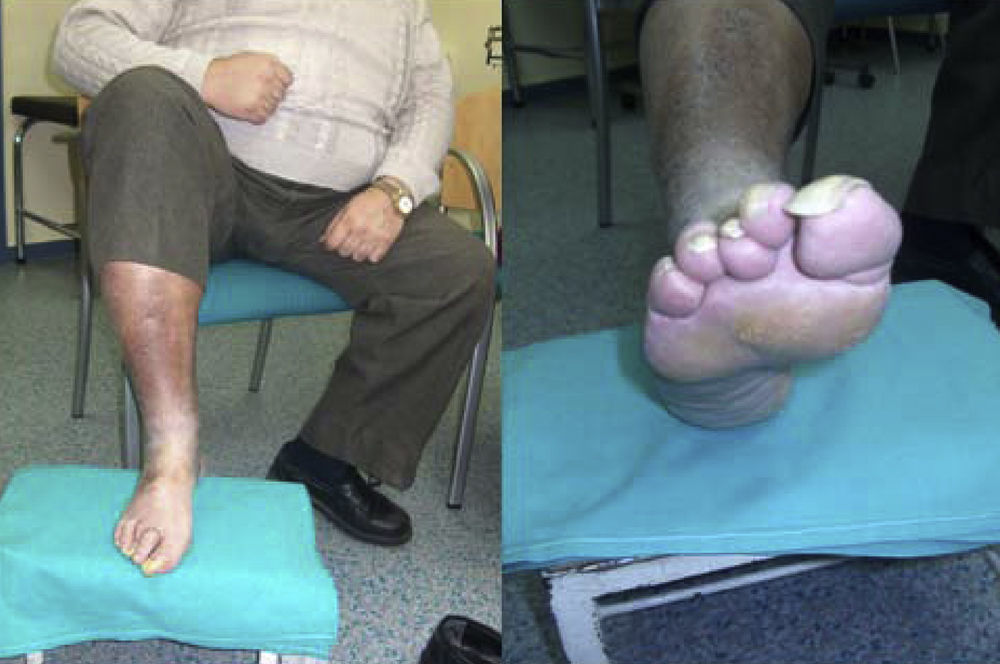
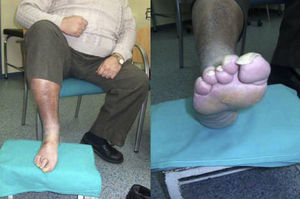
Magnitud del problema de los pies. El paciente tiene 56 años de edad, sin autosuficiencia visual ni motriz para observarse la planta del pie. Tiene polineuropatía con una disminución de la sensibilidad térmica y algésica. Se puede observar la callosidad producida por alteración de los puntos de apoyo, uñas hipertróficas y una piel fina con ausencia de vello, lo que demuestra una circulación insuficiente. Además, se corta él mismo las uñas del pie con un alicate. Vive solo, utiliza un calzado inadecuado «más barato» y no acude al podólogo por falta de suficiencia económica. Se cierra el círculo de los factores de riesgo para sufrir una lesión en los pies. (Fotografía del Dr. Calle Pascual.)
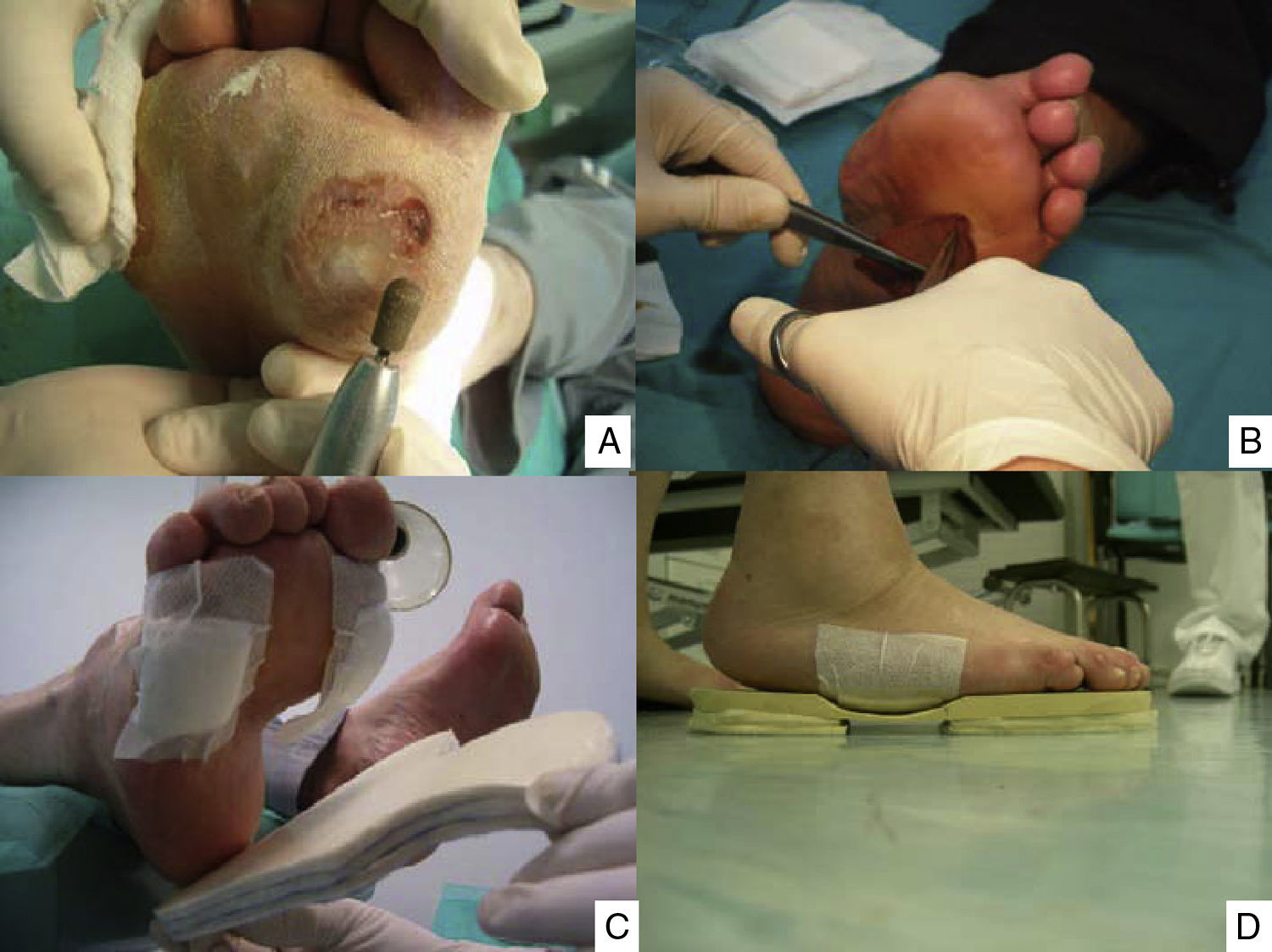
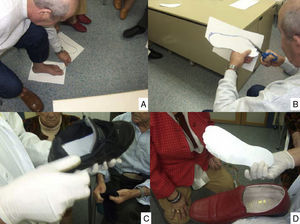
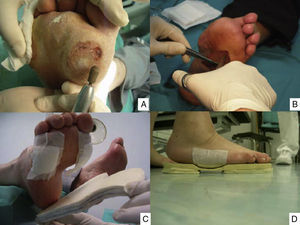
Puntos clave del tratamiento de las lesiones del pie: limpieza y curetaje de las callosidades y lesiones por presión (A), desbridar los bordes y el fondo de las úlceras hasta dejar los límites limpios y sin tejidos muertos (B), y disminuir la presión con colocación de fieltros de descarga (C) y plantillas (D). (Fotografía del Dr. Calle Pascual.)
Los autores declaran no tener ningún conflicto de intereses.