Evaluar la persistencia inicial al tratamiento con corticosteroides y beta-2 agonistas de larga duración (CSI/LABA) según el tipo de dispositivo inhalador (MDI o DPI) para el tratamiento del asma y la EPOC.
Material y métodosEstudio observacional multicéntrico. Se incluyeron sujetos en tratamiento inicial con CSI/LABA durante 2007-2011, y con un periodo de seguimiento de 3 años. Se confeccionaron 2 grupos de estudio (asma, EPOC) y 2 subgrupos según el tipo de dispositivo inhalador (MDI o DPI). Las principales medidas fueron: sociodemográficas, comorbilidad, adherencia (ratio de posesión del medicamento, RPM), medicación, exacerbaciones y uso de los recursos y sus costes (directos, indirectos). Se utilizaron modelos multivariantes para la corrección de las variables. Significación estadística: p < 0,05.
ResultadosSe seleccionó a 2.082 sujetos asmáticos (MDI: N = 566, 27,2%; DPI: N = 1.516, 72,8%). Los pacientes con dispositivos MDI mostraron un mayor grado de persistencia (32,5 vs. 27,8%; p = 0,037), adherencia al tratamiento (RPM: 83,1 vs. 80,5%; p < 0,001), menos exacerbaciones (17,7 vs. 24,9%; p = 0,001) y menor coste sanitario (2.583 vs. 2.938 EUR; p = 0,042). También se analizaron 1.418 pacientes con EPOC (MDI: N = 594, 41,9%; DPI: N = 824, 58,1%). Los pacientes con dispositivos MDI también mostraron un mayor grado de persistencia (31,5 vs. 24,8%; p = 0,005), adherencia al tratamiento (RPM: 83,3 vs. 80,1%; p = 0,001), menos exacerbaciones (40,1 vs. 48,2%; p = 0,002) y menor coste sanitario (3.922 vs. 4.588 EUR; p = 0,021).
ConclusionesLos dispositivos MDI (tratamiento inicial con CSI/LABA) pueden asociarse a un mayor grado de persistencia en el tratamiento, tanto en asma como en EPOC, con menores tasas de exacerbaciones y consumo de recursos sanitarios y costes.
To assess the initial treatment persistence with inhaled corticosteroids and long-acting beta-2 adrenergic bronchodilators (ICS/LABA) depending on the inhaler device used (pMDI or DPI), for the treatment of asthma and COPD.
Material and methodsAn multicenter observational study. Subjects in initial treatment with ICS/LABA during 2007-2011 were included, and a follow-up period of 3 years. 2 groups of study (asthma, COPD) and 2 subgroups were prepared according to the device type inhaler (pMDI or DPI). The main measurements were: sociodemographic, comorbidity, adherence (rate possession medication -RPM-), persistence, drugs, exacerbation rates, resources use, and their costs (direct and indirect costs). Multivariate methods were used for the variables correction, with significance level of P<.05.
ResultsThe study included 2,082 asthma patients (pMDI: N = 566, 27.2%; DPI = 1,516, 72.8%). Patients with MDI devices showed a higher degree of persistence (32.5 vs. 27.8%; P=.037), treatment adherence (RPM: 83.1 vs. 80.5%; P<.001), fewer exacerbations (17.7 vs. 24.9%; P=.001) and lower health care costs (2,583 vs. 2,938 EUR; P = 0.042). 1,418 patients with COPD also were analyzed (pMDI: N = 524, 41.9%; DPI: N = 824, 58.1%) were analyzed. Patients with MDI devices also showed a higher degree of persistence (31.5 vs. 24.8%; P=.005), treatment adherence (RPM: 83.3 vs. 80.1%; P= .001), less exacerbations (40.1 vs. 48.2%; P=.002) and lower health care costs (3,922 vs. 4,588 EUR; P=.021).
ConclusionspMDI devices (as ICS/LABA initial treatment) are associated with higher treatment persistence either in asthma or COPD, with lower exacerbation rates, and use of health resources and cost
Las enfermedades del aparato respiratorio representan un importante problema de salud pública, especialmente por su elevada morbimortalidad1. Las 2enfermedades más prevalentes y con mayores implicaciones sociosanitarias y económicas son el asma y la enfermedad pulmonar obstructiva crónica (EPOC)2. El proceso de la inflamación es una característica constante en la fisiopatología del asma y la EPOC, pero la respuesta inflamatoria de la EPOC es claramente diferente de la del asma3. La mayoría de los fármacos disponibles y recomendados para el tratamiento del asma y EPOC son inhalados4,5.
La persistencia en el tratamiento es un problema importante en el manejo de la enfermedad crónica y un indicador de la habilidad de los pacientes en el manejo de su condición y tratamiento6. Estudios sobre la persistencia del tratamiento han demostrado que son un problema importante en pacientes con enfermedades respiratorias crónicas, como el asma y la EPOC7–9. La causa más frecuente de suspensión del tratamiento suele ser la aparición de efectos secundarios, mejora de los síntomas o problemas de reducción del efecto del fármaco en el tiempo, que aconsejan su interrupción o inducen a su abandono espontáneo10.
La adherencia del paciente a la medicación inhalada es otro factor a tener en cuenta, puesto que las características del dispositivo pueden contribuir a un mejor control de la enfermedad9. Los aerosoles son una suspensión estable de partículas sólidas o líquidas en un medio gaseoso con fines terapéuticos, los cuales pueden ser generados por dispositivos como inhaladores presurizados de dosis medida (MDI), inhaladores de polvo seco (DPI) y nebulizadores11. Los inhaladores difieren en la eficiencia del suministro del fármaco a las vías respiratorias inferiores que depende de la forma del dispositivo, de su resistencia interna, de la formulación de la medicación, de la medida de la partícula, de la velocidad de la nube del aerosol emitida y de la facilidad con la que los pacientes pueden utilizarlo10,12. La falta de adherencia no solo repercute en una menor efectividad de los tratamientos sino que también supone un aumento de los costes sanitarios4,5.
Los estudios disponibles en cuanto a la comparación de los dispositivos para el tratamiento del asma o EPOC son limitados13, especialmente en nuestro país, por lo que la realización de este estudio puede ser relevante. En este sentido, la persistencia en el tratamiento constituye un factor clave en la progresión de la enfermedad y en el riesgo de complicaciones. El objetivo principal del estudio fue evaluar la persistencia en el tratamiento inicial con corticosteroides y beta-2 agonistas de larga duración (CSI/LABA) en combinación a dosis fija según el tipo de dispositivo inhalador (MDI o DPI) para el tratamiento del asma y de la EPOC en situación de práctica clínica habitual. Como objetivos secundarios se describieron las exacerbaciones, el cambio/interrupción del tratamiento y el uso de los recursos y sus costes asociados.
Pacientes y métodosDiseño y población de estudioSe efectuó un estudio observacional de carácter retrospectivo, realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos disociados). La población de estudio está formada por pacientes pertenecientes a 8 centros de atención primaria (AP) de 2áreas geográficas (Barcelona [La Roca del Vallés] y Gerona [subcomarca: Selva Interior]). Se incluyó en el estudio a los pacientes que demandaron atención y que iniciaron tratamiento con CSI/LABA (fecha índice) en combinación a dosis-fija durante los años 2007-2011 (periodo de selección: 4 años), y que reunieran las siguientes características: a) edad ≥ 18 años en asma y ≥40 en la EPOC, b) pacientes con diagnóstico de asma y EPOC un mínimo de 12 meses previos a la fecha índice, c) estar en el programa de prescripciones para la obtención de las recetas médicas (con registro constatado de la dosis diaria, el intervalo de tiempo y la duración de cada tratamiento administrado; ≥2 recetas durante el periodo de seguimiento) y d) que se pudiera garantizar el seguimiento regular de los pacientes (≥2 registros sanitarios en el sistema informático). Fueron excluidos a) los sujetos trasladados a otros centros, los desplazados o fuera de zona, b) los pacientes institucionalizados permanentemente, c) los que tenían antecedentes de enfisema pulmonar, bronquiectasias, fibrosis quística, neoplasia bronquial y d) los que tuvieran fenotipo mixto asma-EPOC.
Se diferenciaron 2grupos de estudio en función del tipo de dispositivo inhalador, a) MDI y b) DPI. Estos grupos fueron para pacientes con asma y EPOC. El periodo de seguimiento: 3 años a partir de la fecha de inclusión del fármaco.
Variables del estudioLos registros de los pacientes con asma o EPOC se obtuvieron de la Clasificación Internacional de la AP (CIAP-2), códigos R96 o R95, o de la Clasificación Internacional de Enfermedades (novena edición) Modificación Clínica (CIE-9-MC; códigos 493.x o 491.x para la enfermedad o las reagudizaciones). El procedimiento diagnóstico de asma y EPOC siempre fue a criterio del médico, con comprobación de los valores de la espirometría. En cuanto a la exacerbación, se siguió la normativa ALERTA-2, que define la exacerbación como un evento en el curso natural de la enfermedad caracterizado por la agudización de la enfermedad identificada por un aumento progresivo en la dificultad para respirar, sensación de falta de aire, sibilancias, tos y opresión torácica, o una combinación de todos estos síntomas ocasionada por la obstrucción intensa del flujo aéreo. Se seleccionó a todos los pacientes con EPOC con independencia de si fueron exacerbadores previos; los fenotipos mixtos fueron excluidos del estudio. Se obtuvo el registro (historias informatizadas) de cada episodio de exacerbación, y del tiempo desde el diagnóstico de la enfermedad (en años). Además, también se constató el índice de masa corporal (IMC, kg/m2), la gravedad del asma (intermitente, persistente leve, persistente moderado y persistente grave; criterios GINA)4, la gravedad de la EPOC (criterios GOLD)5 al inicio del estudio y los fallecimientos por todas las causas.
Como variables sociodemográficas y de comorbilidad fueron: edad (continua y por rangos) y sexo, así como los antecedentes personales obtenidos a partir de la CIAP-2 de hipertensión arterial (K86, K87), diabetes mellitus (T89,T90), dislipidemia (T93), obesidad (T82), tabaquismo activo (P17), alcoholismo (P15, P16), todos los tipos de fallos orgánicos (cardiaco, hepático y renal), cardiopatía isquémica (códigos: K74, K76, K75), accidente cerebro-vascular (K90, K91, K93), demencias o trastornos de memoria (P70, P20), enfermedades neurológicas: enfermedad de Parkinson (N87), epilepsia (N88), esclerosis múltiple (N86) y otras enfermedades neurológicas (N99), síndrome depresivo (P76) y neoplasias malignas (todos los tipos: A79, B72-75, D74-78, F75, H75, K72, L71, L97, N74-76, T71-73, U75-79, W72-73, X75-81, Y77-79). Como variable resumen de la comorbilidad general, para cada paciente atendido, se utilizó: a) el índice de comorbilidad de Charlson como una aproximación a la gravedad del paciente y b) el índice de casuística individual, obtenido a partir de los Adjusted Clinical Groups, que es un sistema de clasificación de pacientes por isoconsumo de recursos14. El aplicativo Adjusted Clinical Groups proporciona las bandas de utilización de recursos (BUR), con lo que cada paciente en función de su morbilidad general quedó agrupado en una de las 5 categorías mutuamente excluyentes (1: usuarios sanos o de morbilidad muy baja, 2: morbilidad baja, 3: morbilidad moderada, 4: morbilidad elevada y 5: morbilidad muy elevada).
Se obtuvieron los medicamentos (principios activos) indicados para el tratamiento según la clasificación Anatomical Therapeutic Chemical Classification System15: corticoides orales/sistémicos (OCS, H02AB), corticoides inhalados (GCI, R03BA), beta-2 agonistas de corta duración (SABA, R03AC), beta-2 agonistas de larga duración (LABA, R03AC), agonistas beta-2 sistémicos (xantinas, R03*) y antagonistas de los receptores de los leucotrienos (R03DC). La información se obtuvo de los registros procedentes de la dispensación farmacológica de medicamentos emitida por la aplicación del CatSalut. Se diferenciaron aquellos pacientes que recibieron tratamiento con OCS de larga duración (pautados), de los que lo recibieron únicamente para la estabilización de la reagudización/exacerbación. La elección del medicamento para un paciente en concreto fue a criterio del médico (práctica clínica). La persistencia se definió como el tiempo, medido en meses, sin abandono del tratamiento inicial o sin cambio a otra medicación al menos 60 días después de la prescripción inicial. La tasa de persistencia en el tratamiento se obtuvo a los 12, 24 y 36 meses del seguimiento. El porcentaje de cumplimiento terapéutico se definió según los criterios de la Sociedad Internacional de Farmacoeconomía y Resultados en Salud (ISPOR) y se calculó en función de la tasa/ratio de posesión del medicamento (RPM). Este se evaluó desde la primera hasta la última prescripción y representó el número de días de medicación suministrada entre el número de días en tratamiento (a partir de la fecha índice)16. Se valoró el motivo de la suspensión, ya fuera por interrupción del tratamiento o por cambio a otra medicación.
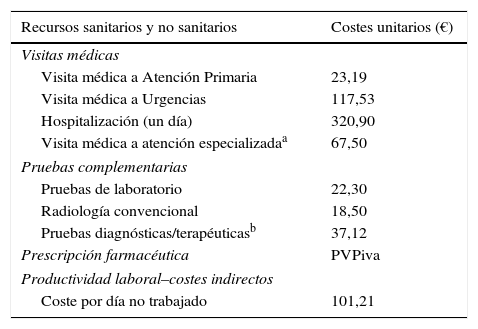
Uso de recursos y costesSe consideraron como costes sanitarios (costes directos) los relacionados con la actividad asistencial (visitas médicas, días de hospitalización, urgencias, solicitudes diagnósticas o terapéuticas, etc.), efectuada por los profesionales y como no sanitarios (indirectos) los relativos a las pérdidas de productividad laboral (días de incapacidad). El coste fue expresado en coste medio por paciente (promedio/unitario) durante todo el periodo estudio. Los diferentes conceptos de estudio y su valoración económica se detallan en la tabla 1 (correspondientes al año 2014). Las tarifas se obtuvieron a partir de la contabilidad analítica de los centros, excepto la medicación y los días de baja laboral. Las prescripciones (recetas médicas agudas, crónicas o a demanda) se cuantificaron según el precio de venta al público por envase en el momento de la prescripción. Los días de incapacidad laboral o pérdidas de productividad se consideraron como costes no sanitarios (costes indirectos; según el salario medio interprofesional, fuente: INE)17. El uso de los recursos y costes de los pacientes fueron únicamente por causas respiratorias.
Detalle de los costes/unitarios y de las pérdidas de productividad laboral (año 2014)
| Recursos sanitarios y no sanitarios | Costes unitarios (€) |
|---|---|
| Visitas médicas | |
| Visita médica a Atención Primaria | 23,19 |
| Visita médica a Urgencias | 117,53 |
| Hospitalización (un día) | 320,90 |
| Visita médica a atención especializadaa | 67,50 |
| Pruebas complementarias | |
| Pruebas de laboratorio | 22,30 |
| Radiología convencional | 18,50 |
| Pruebas diagnósticas/terapéuticasb | 37,12 |
| Prescripción farmacéutica | PVPiva |
| Productividad laboral–costes indirectos | |
| Coste por día no trabajado | 101,21 |
Fuente de los recursos sanitarios: contabilidad analítica propia e INE.
Valores expresados en euros.
PVP: precio de venta al público.
El estudio fue clasificado por la Agencia Española del Medicamento y Productos Sanitarios (EPA-OD) y posteriormente fue aprobado por el Comité de Ética de Investigación Clínica de la Unió Catalano-Balears de Hospitales de Barcelona.
Análisis estadísticoSe efectuó un análisis estadístico descriptivo-univariante con valores de media, desviación típica/estándar, intervalos de confianza (IC) del 95% y de amplitud intercuartílica (mediana y percentiles 25-75 de la distribución) y se comprobó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. Para la medida de la persistencia en el tratamiento se realizó un análisis de supervivencia de Kaplan-Meier (comparación: log-rang test). En el análisis bivariante se utilizaron las pruebas de ANOVA, chi al cuadrado y correlación lineal de Pearson. Los modelos multivariantes utilizados fueron los siguientes: a) análisis de la covarianza (ANCOVA; procedimiento: estimación de medias marginales; ajuste de Bonferroni), para la corrección del coste sanitario (variable dependiente, en función del tipo de dispositivo), b) modelo de riesgos proporcionales de Cox, para la corrección de la persistencia al tratamiento (variable dependiente) y c) regresión lineal múltiple, para el coste sanitario (variable dependiente). Las covariables incluidas fueron: el sexo, la edad, la comorbilidad general, el tiempo de duración de la enfermedad, la gravedad del asma/EPOC, el RPM y la presencia de exacerbaciones. Se utilizó el programa SPSSWIN versión 17, con una significación estadística para valores de p<0,05.
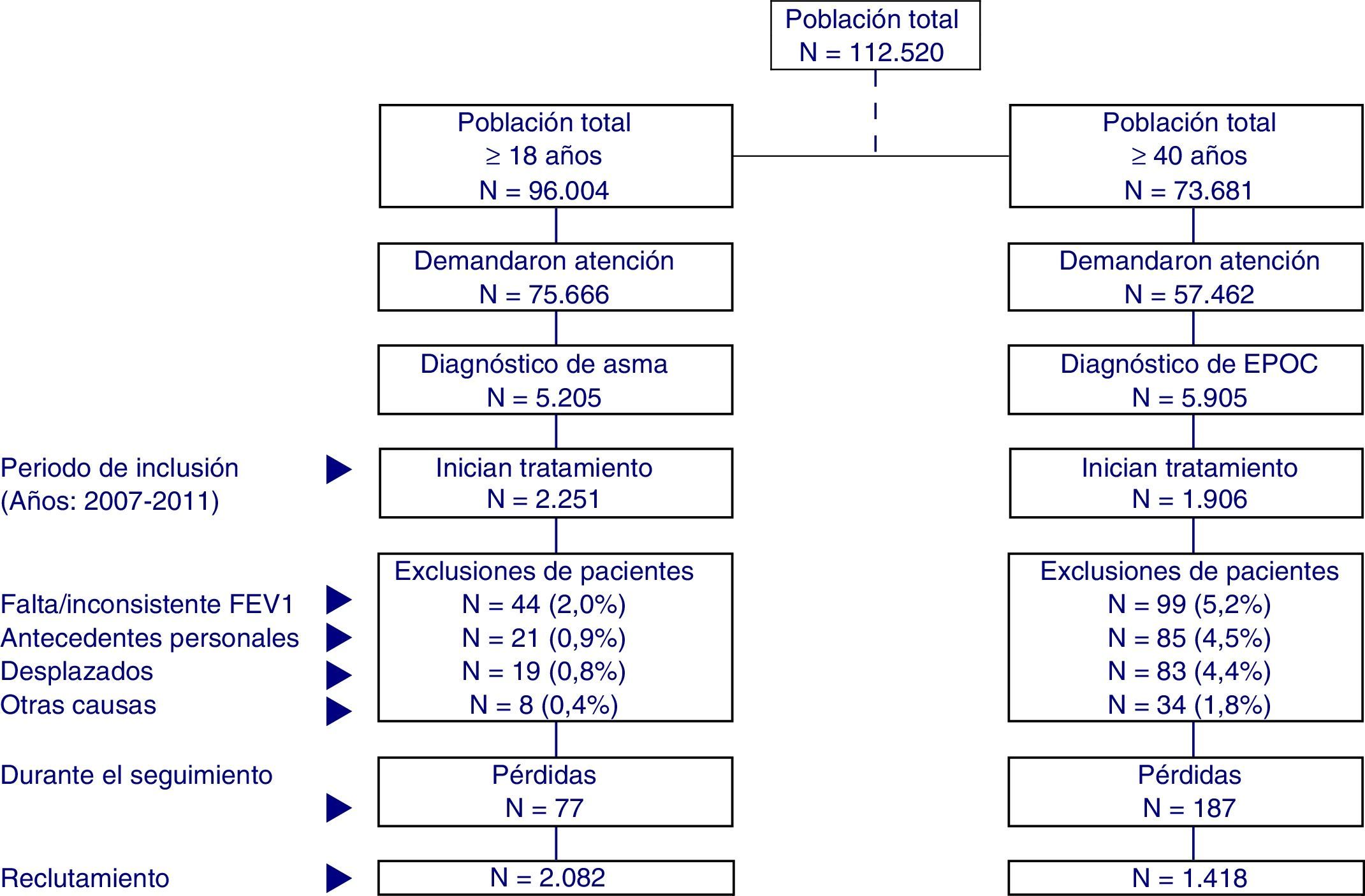
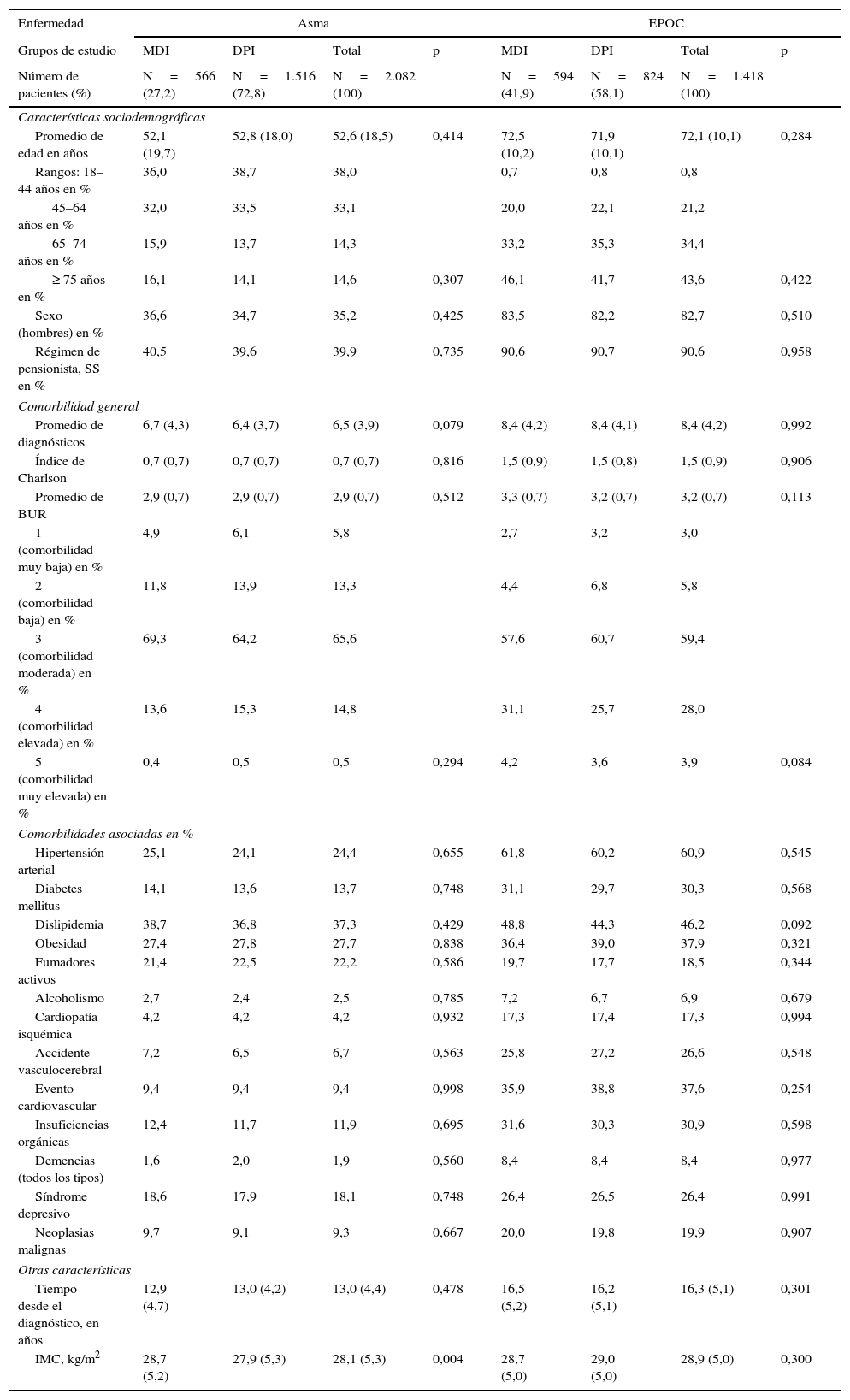
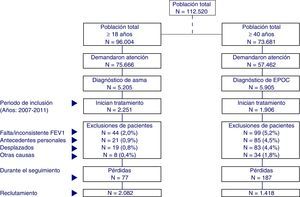
ResultadosSe incluyeron para análisis un total de 2.082 pacientes con asma y 1.418 pacientes con EPOC que cumplieron los criterios anteriormente descritos y que pudieron ser seguidos (fig. 1). En asma (tabla 2), iniciaron tratamiento con CSI/LABA el 27,2% con MDI y el 72,8% con DPI. La edad media fue de 52,6 años, un 64,8% fueron mujeres, las BUR fueron de 2,9 puntos y el promedio de diagnósticos crónicos fue de 6,5 por paciente. La dislipidemia (37,3%), la hipertensión arterial (24,4%) y la obesidad (27,7%) fueron las comorbilidades más frecuentes. En EPOC, iniciaron tratamiento con CSI/LABA el 41,9% con MDI y el 58,1% con DPI. La edad media fue de 72,1 años, un 82,7% fueron varones, las BUR fueron de 3,2 puntos y el promedio de diagnósticos crónicos fue de 8,4 por paciente. La hipertensión arterial (60,9%), la dislipidemia (46,2%) y la obesidad (37,6%) fueron las comorbilidades más frecuentes. Los grupos de estudio fueron aceptablemente comparables, tanto en asma como en EPOC.
Esquema general del estudio.
Se efectuó un diseño observacional, multicéntrico, longitudinal y de carácter retrospectivo, realizado a partir de la revisión de los registros médicos existentes (bases de datos informatizadas, con datos disociados).
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado (un segundo).
Características basales de la serie estudiada
| Enfermedad | Asma | EPOC | ||||||
|---|---|---|---|---|---|---|---|---|
| Grupos de estudio | MDI | DPI | Total | p | MDI | DPI | Total | p |
| Número de pacientes (%) | N=566 (27,2) | N=1.516 (72,8) | N=2.082 (100) | N=594 (41,9) | N=824 (58,1) | N=1.418 (100) | ||
| Características sociodemográficas | ||||||||
| Promedio de edad en años | 52,1 (19,7) | 52,8 (18,0) | 52,6 (18,5) | 0,414 | 72,5 (10,2) | 71,9 (10,1) | 72,1 (10,1) | 0,284 |
| Rangos: 18–44 años en % | 36,0 | 38,7 | 38,0 | 0,7 | 0,8 | 0,8 | ||
| 45–64 años en % | 32,0 | 33,5 | 33,1 | 20,0 | 22,1 | 21,2 | ||
| 65–74 años en % | 15,9 | 13,7 | 14,3 | 33,2 | 35,3 | 34,4 | ||
| ≥ 75 años en % | 16,1 | 14,1 | 14,6 | 0,307 | 46,1 | 41,7 | 43,6 | 0,422 |
| Sexo (hombres) en % | 36,6 | 34,7 | 35,2 | 0,425 | 83,5 | 82,2 | 82,7 | 0,510 |
| Régimen de pensionista, SS en % | 40,5 | 39,6 | 39,9 | 0,735 | 90,6 | 90,7 | 90,6 | 0,958 |
| Comorbilidad general | ||||||||
| Promedio de diagnósticos | 6,7 (4,3) | 6,4 (3,7) | 6,5 (3,9) | 0,079 | 8,4 (4,2) | 8,4 (4,1) | 8,4 (4,2) | 0,992 |
| Índice de Charlson | 0,7 (0,7) | 0,7 (0,7) | 0,7 (0,7) | 0,816 | 1,5 (0,9) | 1,5 (0,8) | 1,5 (0,9) | 0,906 |
| Promedio de BUR | 2,9 (0,7) | 2,9 (0,7) | 2,9 (0,7) | 0,512 | 3,3 (0,7) | 3,2 (0,7) | 3,2 (0,7) | 0,113 |
| 1 (comorbilidad muy baja) en % | 4,9 | 6,1 | 5,8 | 2,7 | 3,2 | 3,0 | ||
| 2 (comorbilidad baja) en % | 11,8 | 13,9 | 13,3 | 4,4 | 6,8 | 5,8 | ||
| 3 (comorbilidad moderada) en % | 69,3 | 64,2 | 65,6 | 57,6 | 60,7 | 59,4 | ||
| 4 (comorbilidad elevada) en % | 13,6 | 15,3 | 14,8 | 31,1 | 25,7 | 28,0 | ||
| 5 (comorbilidad muy elevada) en % | 0,4 | 0,5 | 0,5 | 0,294 | 4,2 | 3,6 | 3,9 | 0,084 |
| Comorbilidades asociadas en % | ||||||||
| Hipertensión arterial | 25,1 | 24,1 | 24,4 | 0,655 | 61,8 | 60,2 | 60,9 | 0,545 |
| Diabetes mellitus | 14,1 | 13,6 | 13,7 | 0,748 | 31,1 | 29,7 | 30,3 | 0,568 |
| Dislipidemia | 38,7 | 36,8 | 37,3 | 0,429 | 48,8 | 44,3 | 46,2 | 0,092 |
| Obesidad | 27,4 | 27,8 | 27,7 | 0,838 | 36,4 | 39,0 | 37,9 | 0,321 |
| Fumadores activos | 21,4 | 22,5 | 22,2 | 0,586 | 19,7 | 17,7 | 18,5 | 0,344 |
| Alcoholismo | 2,7 | 2,4 | 2,5 | 0,785 | 7,2 | 6,7 | 6,9 | 0,679 |
| Cardiopatía isquémica | 4,2 | 4,2 | 4,2 | 0,932 | 17,3 | 17,4 | 17,3 | 0,994 |
| Accidente vasculocerebral | 7,2 | 6,5 | 6,7 | 0,563 | 25,8 | 27,2 | 26,6 | 0,548 |
| Evento cardiovascular | 9,4 | 9,4 | 9,4 | 0,998 | 35,9 | 38,8 | 37,6 | 0,254 |
| Insuficiencias orgánicas | 12,4 | 11,7 | 11,9 | 0,695 | 31,6 | 30,3 | 30,9 | 0,598 |
| Demencias (todos los tipos) | 1,6 | 2,0 | 1,9 | 0,560 | 8,4 | 8,4 | 8,4 | 0,977 |
| Síndrome depresivo | 18,6 | 17,9 | 18,1 | 0,748 | 26,4 | 26,5 | 26,4 | 0,991 |
| Neoplasias malignas | 9,7 | 9,1 | 9,3 | 0,667 | 20,0 | 19,8 | 19,9 | 0,907 |
| Otras características | ||||||||
| Tiempo desde el diagnóstico, en años | 12,9 (4,7) | 13,0 (4,2) | 13,0 (4,4) | 0,478 | 16,5 (5,2) | 16,2 (5,1) | 16,3 (5,1) | 0,301 |
| IMC, kg/m2 | 28,7 (5,2) | 27,9 (5,3) | 28,1 (5,3) | 0,004 | 28,7 (5,0) | 29,0 (5,0) | 28,9 (5,0) | 0,300 |
Valores expresados en porcentaje o media (desviación estándar).
BUR: bandas de utilización de recursos; DPI: inhaladores de polvo seco; EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; MDI: inhaladores presurizados de dosis medida; p: significación estadística; SS: seguridad social.
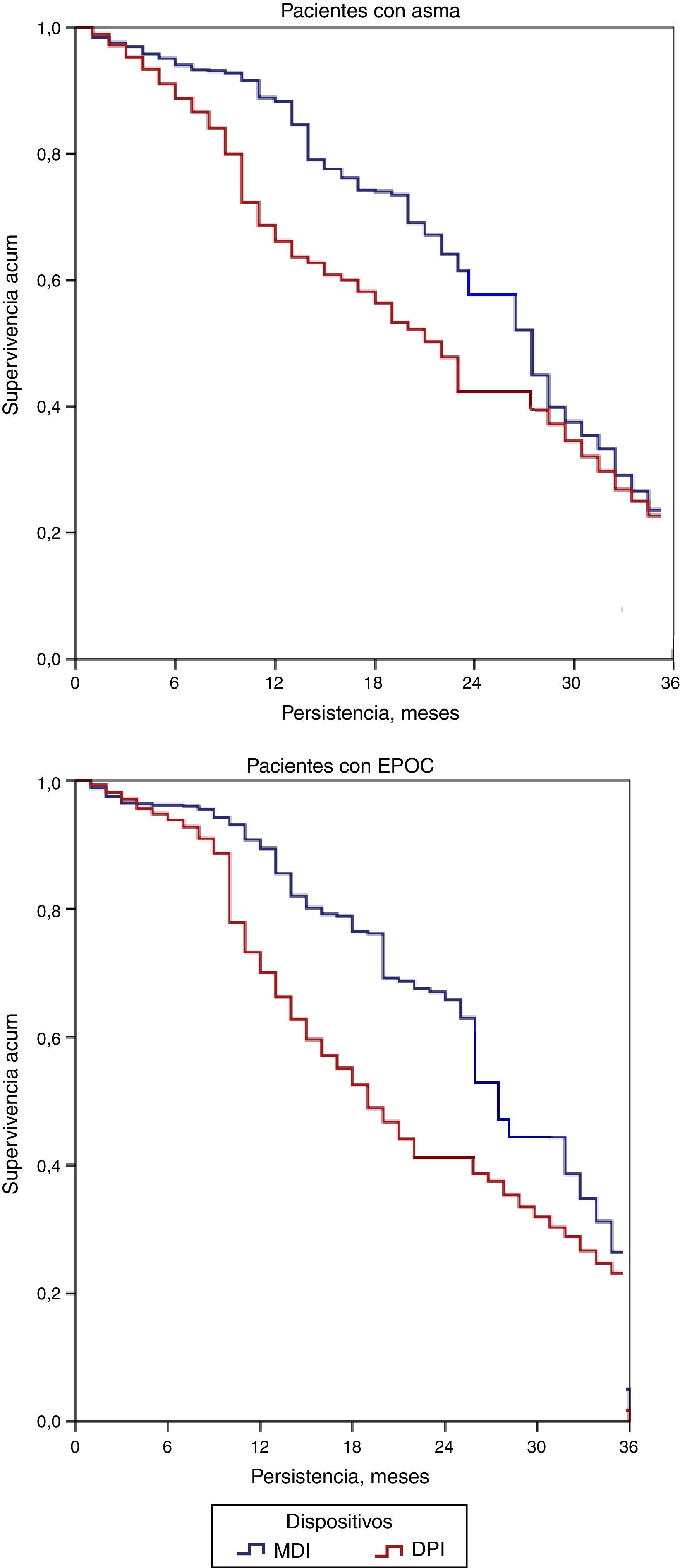
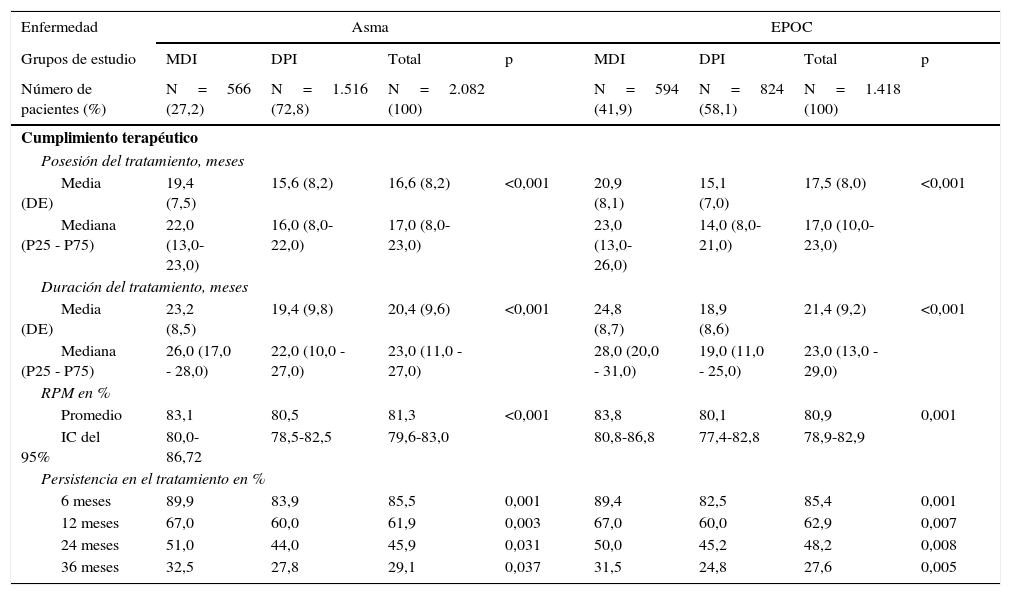
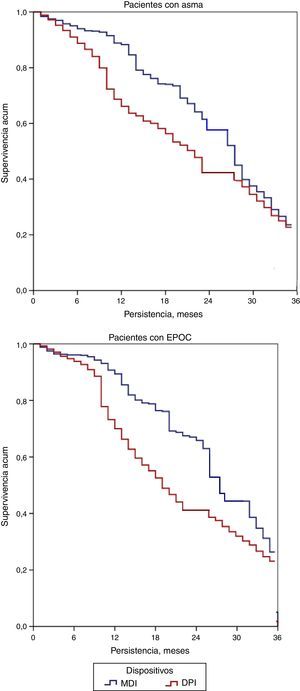
En el análisis de persistencia para pacientes asmáticos (tabla 3), la persistencia en el tratamiento a los 36 meses fue del 29,1%: significativamente superior con MDI (32,5 frente al 27,8%; p=0,037). La curva de supervivencia (mediana de tiempo) de la persistencia en el tratamiento se muestra en la figura 2. La adherencia/cumplimiento a los 36 meses fue del 81,3% (IC del 95%: 79,6-83,0%), también significativamente mayor con MDI (83,1 frente al 80,5%; p=0,001). En el análisis de persistencia para pacientes con EPOC (tabla 3), la persistencia en el tratamiento a los 36 meses fue del 27,6%, significativamente superior con MDI (31,5 frente al 24,8%; p=0,005). La adherencia/cumplimiento a los 36 meses fue del 80,9% (IC del 95%: 78,9-82,9%), ligeramente mayor con MDI (83,8 frente al 80,1%; p=0,001). El análisis de la supervivencia (riesgos proporcionales de Cox) mostró que la duración del tratamiento en asma se asoció al dispositivo MDI (HR=1,1; IC del 95%: 1,0–1,2) y a la edad (HR=1,2; IC del 95%: 1,1–1,4; p<0,05); mientras que en la EPOC se asoció con MDI (HR=1,9; IC del 95%: 1,7–2,1) y al tiempo de evolución de la enfermedad (HR=1,1; IC del 95%: 1,0–1,2; p<0,01) (fig. 2). En asma y EPOC, el cambio a otra medicación fue del 32,8 y 30,5% respectivamente; mientras que la suspensión fue del 35,6 y del 34,8%, respectivamente. No hubo diferencias significativas entre los tipos de dispositivos estudiados.
Persistencia al tratamiento por grupos de estudio
| Enfermedad | Asma | EPOC | ||||||
|---|---|---|---|---|---|---|---|---|
| Grupos de estudio | MDI | DPI | Total | p | MDI | DPI | Total | p |
| Número de pacientes (%) | N=566 (27,2) | N=1.516 (72,8) | N=2.082 (100) | N=594 (41,9) | N=824 (58,1) | N=1.418 (100) | ||
| Cumplimiento terapéutico | ||||||||
| Posesión del tratamiento, meses | ||||||||
| Media (DE) | 19,4 (7,5) | 15,6 (8,2) | 16,6 (8,2) | <0,001 | 20,9 (8,1) | 15,1 (7,0) | 17,5 (8,0) | <0,001 |
| Mediana (P25 - P75) | 22,0 (13,0-23,0) | 16,0 (8,0-22,0) | 17,0 (8,0-23,0) | 23,0 (13,0-26,0) | 14,0 (8,0-21,0) | 17,0 (10,0-23,0) | ||
| Duración del tratamiento, meses | ||||||||
| Media (DE) | 23,2 (8,5) | 19,4 (9,8) | 20,4 (9,6) | <0,001 | 24,8 (8,7) | 18,9 (8,6) | 21,4 (9,2) | <0,001 |
| Mediana (P25 - P75) | 26,0 (17,0 - 28,0) | 22,0 (10,0 - 27,0) | 23,0 (11,0 - 27,0) | 28,0 (20,0 - 31,0) | 19,0 (11,0 - 25,0) | 23,0 (13,0 - 29,0) | ||
| RPM en % | ||||||||
| Promedio | 83,1 | 80,5 | 81,3 | <0,001 | 83,8 | 80,1 | 80,9 | 0,001 |
| IC del 95% | 80,0-86,72 | 78,5-82,5 | 79,6-83,0 | 80,8-86,8 | 77,4-82,8 | 78,9-82,9 | ||
| Persistencia en el tratamiento en % | ||||||||
| 6 meses | 89,9 | 83,9 | 85,5 | 0,001 | 89,4 | 82,5 | 85,4 | 0,001 |
| 12 meses | 67,0 | 60,0 | 61,9 | 0,003 | 67,0 | 60,0 | 62,9 | 0,007 |
| 24 meses | 51,0 | 44,0 | 45,9 | 0,031 | 50,0 | 45,2 | 48,2 | 0,008 |
| 36 meses | 32,5 | 27,8 | 29,1 | 0,037 | 31,5 | 24,8 | 27,6 | 0,005 |
Valores expresados en media (DE: desviación estándar) o porcentaje.
DPI: inhaladores de polvo seco; EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; MDI: inhaladores presurizados de dosis medida; P: percentil; p: significación estadística; RPM: ratio de posesión del medicamento.
La persistencia se definió como el tiempo, medido en meses, sin abandono del tratamiento inicial o sin cambio a otra medicación al menos 60 días después de la prescripción inicial.
Persistencia en el tratamiento durante el periodo de estudio.
Curvas de Kaplan-Meier: estimación de la mediana de duración del tratamiento. Comparaciones entre grupos: prueba de Log Rank-Mantel-Cox; p<0,05 en todos los casos.
DPI: inhaladores de polvo seco; EPOC: enfermedad pulmonar obstructiva crónica; MDI: inhaladores presurizados de dosis medida.
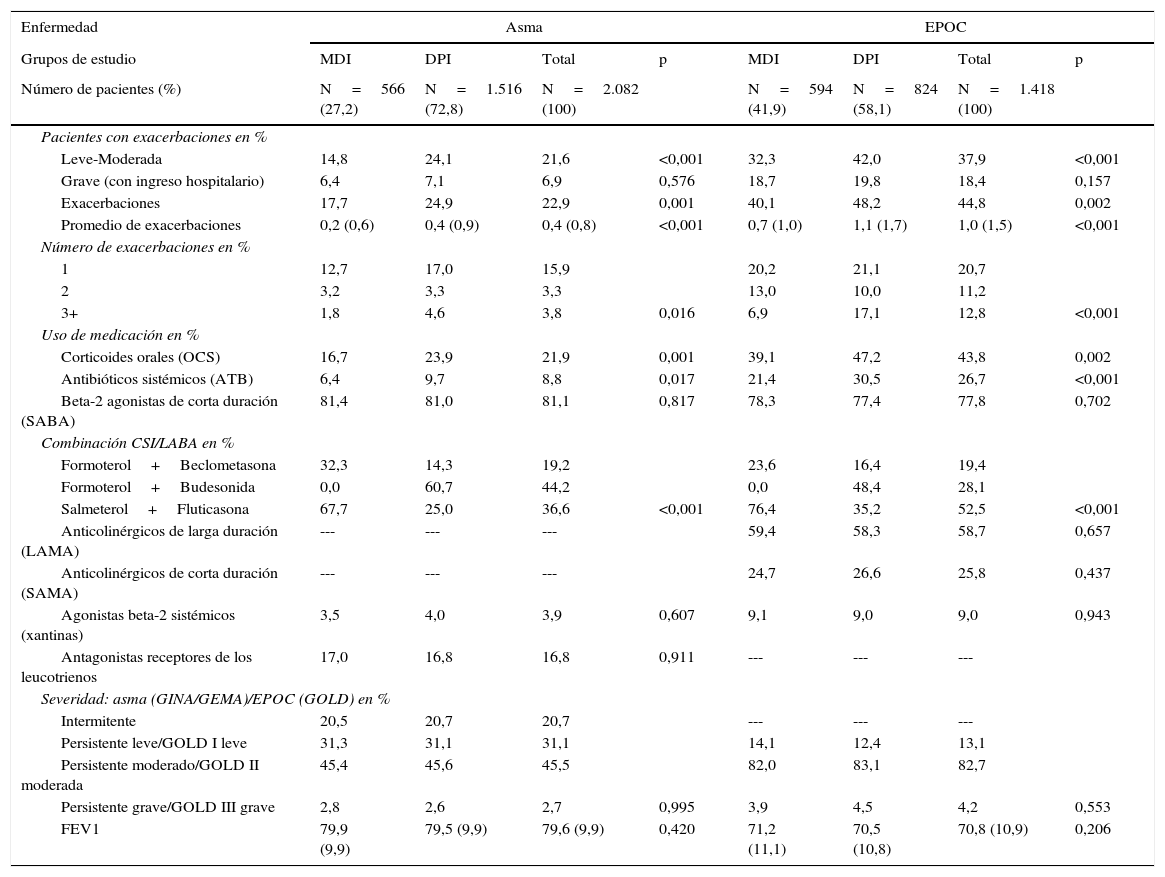
En el análisis de las exacerbaciones, la medicación administrada y la severidad (asma y EPOC, basal) se detallan en la tabla 4. En asma, el 22,9% de los pacientes mostraron algún tipo de exacerbación, mayor en los pacientes con uso de DPI (24,9 frente al 17,7%; p<0,001). El uso de SABA fue similar en los 2grupos (81,1%), y únicamente el 5,4% recibieron corticoides orales de larga duración (pautado). El 76,6% de los pacientes mostraron un grado de gravedad/severidad (GINA) persistente leve/moderado del asma. El porcentaje de fallecimientos fue del 5,1% (6,4 frente al 4,1%; p=0,673, respectivamente). En EPOC, el 44,8% de los pacientes mostraron algún tipo de exacerbación, mayor en los pacientes con uso de DPI (48,2 frente al 40,1%; p=0,002). El uso de SABA fue similar en los 2grupos (77,8%), y el 8,7% recibieron corticoides orales de larga duración pautados. El 95,8% de los pacientes mostraron un grado de gravedad/severidad (GOLD) leve/moderado del asma. El porcentaje de fallecimientos fue del 23,3% (26,6 frente al 19,5%; p=0,185, respectivamente). No se observaron diferencias según el tipo de dispositivo DPI (Accuhaler®, Turbuhaler®, Nexthaler®).
Descripción de las exacerbaciones, medicación administrada y severidad del asma y EPOC
| Enfermedad | Asma | EPOC | ||||||
|---|---|---|---|---|---|---|---|---|
| Grupos de estudio | MDI | DPI | Total | p | MDI | DPI | Total | p |
| Número de pacientes (%) | N=566 (27,2) | N=1.516 (72,8) | N=2.082 (100) | N=594 (41,9) | N=824 (58,1) | N=1.418 (100) | ||
| Pacientes con exacerbaciones en % | ||||||||
| Leve-Moderada | 14,8 | 24,1 | 21,6 | <0,001 | 32,3 | 42,0 | 37,9 | <0,001 |
| Grave (con ingreso hospitalario) | 6,4 | 7,1 | 6,9 | 0,576 | 18,7 | 19,8 | 18,4 | 0,157 |
| Exacerbaciones | 17,7 | 24,9 | 22,9 | 0,001 | 40,1 | 48,2 | 44,8 | 0,002 |
| Promedio de exacerbaciones | 0,2 (0,6) | 0,4 (0,9) | 0,4 (0,8) | <0,001 | 0,7 (1,0) | 1,1 (1,7) | 1,0 (1,5) | <0,001 |
| Número de exacerbaciones en % | ||||||||
| 1 | 12,7 | 17,0 | 15,9 | 20,2 | 21,1 | 20,7 | ||
| 2 | 3,2 | 3,3 | 3,3 | 13,0 | 10,0 | 11,2 | ||
| 3+ | 1,8 | 4,6 | 3,8 | 0,016 | 6,9 | 17,1 | 12,8 | <0,001 |
| Uso de medicación en % | ||||||||
| Corticoides orales (OCS) | 16,7 | 23,9 | 21,9 | 0,001 | 39,1 | 47,2 | 43,8 | 0,002 |
| Antibióticos sistémicos (ATB) | 6,4 | 9,7 | 8,8 | 0,017 | 21,4 | 30,5 | 26,7 | <0,001 |
| Beta-2 agonistas de corta duración (SABA) | 81,4 | 81,0 | 81,1 | 0,817 | 78,3 | 77,4 | 77,8 | 0,702 |
| Combinación CSI/LABA en % | ||||||||
| Formoterol+Beclometasona | 32,3 | 14,3 | 19,2 | 23,6 | 16,4 | 19,4 | ||
| Formoterol+Budesonida | 0,0 | 60,7 | 44,2 | 0,0 | 48,4 | 28,1 | ||
| Salmeterol+Fluticasona | 67,7 | 25,0 | 36,6 | <0,001 | 76,4 | 35,2 | 52,5 | <0,001 |
| Anticolinérgicos de larga duración (LAMA) | --- | --- | --- | 59,4 | 58,3 | 58,7 | 0,657 | |
| Anticolinérgicos de corta duración (SAMA) | --- | --- | --- | 24,7 | 26,6 | 25,8 | 0,437 | |
| Agonistas beta-2 sistémicos (xantinas) | 3,5 | 4,0 | 3,9 | 0,607 | 9,1 | 9,0 | 9,0 | 0,943 |
| Antagonistas receptores de los leucotrienos | 17,0 | 16,8 | 16,8 | 0,911 | --- | --- | --- | |
| Severidad: asma (GINA/GEMA)/EPOC (GOLD) en % | ||||||||
| Intermitente | 20,5 | 20,7 | 20,7 | --- | --- | --- | ||
| Persistente leve/GOLD I leve | 31,3 | 31,1 | 31,1 | 14,1 | 12,4 | 13,1 | ||
| Persistente moderado/GOLD II moderada | 45,4 | 45,6 | 45,5 | 82,0 | 83,1 | 82,7 | ||
| Persistente grave/GOLD III grave | 2,8 | 2,6 | 2,7 | 0,995 | 3,9 | 4,5 | 4,2 | 0,553 |
| FEV1 | 79,9 (9,9) | 79,5 (9,9) | 79,6 (9,9) | 0,420 | 71,2 (11,1) | 70,5 (10,8) | 70,8 (10,9) | 0,206 |
Valores expresados en porcentaje o media (desviación estándar).
DPI: inhaladores de polvo seco; EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado (un segundo); GEMA: Guía Española para el Manejo del Asma; GINA: Global Initiative for Asthma; MDI: inhaladores presurizados de dosis medida; p: significación estadística.
En asma, durante el periodo de seguimiento (36 meses), los pacientes con MDI utilizaron menos recursos sanitarios, especialmente en visitas médicas en AP (24,9 frente a 34,1; p<0,001), días de hospitalización (0,4 frente a 0,8; p=0,045), visitas en atención especializada (2,2 frente a 4,2; p<0,001) y urgencias hospitalarias (0,2 frente a 0,4; p<0,001) (tabla 5). Las diferencias en días de incapacidad laboral (costes indirectos) no fueron significativas (5,1 frente a 6,5; p=0,509, respectivamente). El coste total de los pacientes incluidos en el estudio ascendió a 6,1 millones de euros, de los cuales el 78,5% correspondieron a costes sanitarios directos y el 21,5% a costes no sanitarios (pérdidas de productividad), con un promedio/unitario total de 2.887 €. El 78,5% de los costes totales se produjeron en AP y el 18,0% en atención especializada. El promedio/unitario corregido por covariables (ANCOVA) del coste total de los sujetos con MDI fue de 2.583 frente a 2.938 €, (p=0,042), respectivamente. En EPOC, los pacientes con MDI utilizaron también menos recursos sanitarios, especialmente en visitas médicas en AP (37,0 frente a 43,9; p<0,001), días de hospitalización (2,1 frente a 3,3; p=0,009), visitas en atención especializada (4,9 frente a 7,1; p<0,001) y urgencias hospitalarias (0,3 frente a 0,6; p<0,001) (tabla 5). Las diferencias en días de incapacidad laboral (costes indirectos) tampoco fueron significativas (2,5 frente a 3,4; p=0,489), respectivamente. El coste total de los pacientes incluidos en el estudio ascendió a 6,4 millones de euros, de los cuales el 92,8% correspondieron a costes sanitarios directos y el 7,2% a costes no sanitarios (pérdidas de productividad), con un promedio/unitario total de 4.337 €. El promedio/unitario corregido por covariables (ANCOVA) del coste total de los sujetos con MDI fue de 3.922 frente a 4.588 € con DPI (p=0,021).
Uso de recursos y costes (en EUR) según los grupos de estudio (durante el seguimiento de los pacientes, 3 años)
| Enfermedad | Asma | EPOC | ||||||
|---|---|---|---|---|---|---|---|---|
| Grupos de estudio | MDI | DPI | Total | p | MDI | DPI | Total | p |
| Número de pacientes (%) | N=566 (27,2) | N=1.516 (72,8) | N=2.082 (100) | N=594 (41,9) | N=824 (58,1) | N=1.418 (100) | ||
| Uso de recursos | ||||||||
| Visitas médicas, Atención Primaria | 24,9 (22,6) | 34,1 (28,1) | 31,6 (27,1) | <0,001 | 37,0 (28,3) | 43,9 (33,0) | 41,0 (31,3) | <0,001 |
| Pruebas de laboratorio | 2,6 (1,1) | 3,0 (2,2) | 2,9 (1,9) | <0,001 | 2,8 (1,4) | 3,6 (2,8) | 3,2 (2,4) | <0,001 |
| Radiología convencional | 1,4 (1,9) | 1,7 (2,7) | 1,6 (2,5) | 0,015 | 1,4 (1,8) | 1,7 (2,2) | 1,5 (2,1) | 0,015 |
| Pruebas complementarias | 1,2 (1,2) | 1,5 (1,3) | 1,4 (1,3) | <0,001 | 1,5 (1,0) | 1,7 (1,6) | 1,6 (1,4) | 0,018 |
| Ingresos hospitalarios en % | 0,1 (0,4) | 0,1 (0,5) | 0,1 (0,5) | 0,235 | 0,4 (0,8) | 0,4 (0,8) | 0,4 (0,8) | 0,400 |
| Días de hospitalización | 0,4 (1,8) | 0,8 (5,2) | 0,7 (4,5) | 0,045 | 2,1 (5,3) | 3,3 (10,1) | 2,8 (8,4) | 0,009 |
| Visitas médicas, hospitalarias | 2,2 (5,2) | 4,2 (6,8) | 3,6 (6,5) | <0,001 | 4,9 (6,2) | 7,1 (12,7) | 6,2 (10,6) | <0,001 |
| Urgencias, hospitalarias | 0,2 (0,6) | 0,4 (1,0) | 0,4 (0,9) | <0,001 | 0,3 (0,7) | 0,6 (1,3) | 0,5 (1,1) | <0,001 |
| Días de incapacidad laboral | 5,1 (37,6) | 6,5 (44,9) | 6,1 (43,1) | 0,509 | 2,5 (28,2) | 3,4 (21,0) | 3,1 (24,3) | 0,489 |
| Costes brutos, en EUR | ||||||||
| Costes sanitarios | 2.014 (1.565) | 2.361 (2.268) | 2.266 (2.106) | 0,001 | 3.686 (2.526) | 4.273 (4.152) | 4.027 (3.573) | 0,002 |
| Costes en Atención Primaria | 1.720 (1.243) | 1.756 (1.126) | 1.746 (1.159) | 0,533 | 2.634 (1.387) | 2.656 (1.538) | 2.647 (1.477) | 0,780 |
| Visitas médicas | 578 (525) | 791 (652) | 733 (627) | <0,001 | 857 (656) | 1.018 (765) | 950 (725) | <0,001 |
| Pruebas de laboratorio | 58 (23) | 66 (48) | 64 (43) | <0,001 | 62 (32) | 80 (62) | 72 (53) | <0,001 |
| Radiología convencional | 25 (35) | 31 (50) | 29 (46) | 0,015 | 26 (33) | 31 (42) | 29 (38) | 0,015 |
| Pruebas complementarias | 45 (44) | 56 (49) | 53 (48) | <0,001 | 55 (39) | 62 (60) | 59 (52) | 0,018 |
| Medicamentos | 1.014 (1.034) | 812 (817) | 867 (886) | <0,001 | 1.634 (1.079) | 1.466 (1.226) | 1.536 (1.169) | 0,008 |
| Costes, atención especializada | 293 (783) | 605 (1.789) | 520 (1.586) | <0,001 | 1.052 (1.852) | 1.617 (3.630) | 1.380 (3.028) | 0,001 |
| Días de hospitalización | 125 (588) | 269 (1.665) | 230 (1.454) | 0,045 | 682 (1.714) | 1.066 (3.246) | 905 (2.718) | 0,009 |
| Visitas médicas | 146 (348) | 284 (460) | 246 (437) | <0,001 | 333 (418) | 477 (860) | 417 (713) | <0,001 |
| Urgencias | 22 (69) | 52 (120) | 44 (109) | <0,001 | 37 (86) | 74 (148) | 59 (127) | <0,001 |
| Costes no sanitariosa | 517 (3.805) | 659 (4.548) | 621 (4.358) | 0,509 | 257 (2.854) | 349 (2.121) | 310 (2.455) | 0,489 |
| Costes totales, en EUR | 2.531 (4.276) | 3.020 (5.155) | 2.887 (4.935) | 0,044 | 3.943 (3.898) | 4.622 (4.785) | 4.337 (4.446) | 0,005 |
| Costes corregidos (ANCOVA)b | Diferencia | Diferencia | ||||||
| Costes totales, en EUR | 2.583 | 2.938 | −355 | 0,042 | 3.922 | 4.588 | −666 | 0,021 |
| IC del 95% | 2.179-2.986 | 2.688-3.188 | 3.487-4.357 | 4.230-4.946 | ||||
DPI: inhaladores de polvo seco; EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; MDI: inhaladores presurizados de dosis medida; p: significación estadística.
Valores expresados en media (desviación estándar).
En el modelo de correlaciones binarias, la edad se asoció a las BUR (asma: r=0,415; EPOC: r=0,335), mientras que el coste sanitario se asoció con las exacerbaciones (asma: r=0,526; EPOC: r=0,509; p<0,01). Finalmente, en el modelo de regresión lineal múltiple (método: pasos consecutivos), el coste sanitario del asma se asoció al número de exacerbaciones (β=0,465), la severidad del asma (β=0,244), la edad (β=0,162), la falta de cumplimiento terapéutico (RPM: β=−0,101), baja persistencia (β=−0,093), la comorbilidad general (BUR: β=0,055) y al tipo de dispositivo (DPI: β=0,058), p<0,01 en todos los casos. Mientras que el coste sanitario de la EPOC se asoció al número de exacerbaciones (â=0,492), la severidad de la EPOC (â=0,244), la persistencia (â=−0,128) la edad (â=0,081), la falta de cumplimiento terapéutico (RPM: β=−0,098), la comorbilidad general (BUR: β=0,007) y al tipo de dispositivo (DPI: β=0,052), p<0,01 en todos los casos. El coeficiente de determinación de los modelos fue del 49,6 y 43,8%, respectivamente.
DiscusiónLos resultados del estudio ponen de manifiesto que los dispositivos MDI pueden asociarse a una mayor persistencia en el tratamiento y a menor proporción de exacerbaciones, circunstancia que repercute en un menor uso de los recursos y costes de enfermedades respiratorias como el asma y la EPOC para el sistema nacional de salud, en el contexto de la práctica clínica habitual. Los pocos estudios observacionales disponibles dificultan la comparación de los resultados, aunque en asma se han mostrado datos favorables al uso del dispositivo MDI para una misma combinación CSI/LABA (fluticasona propionato/salmeterol)13.
Al finalizar el periodo de seguimiento, la persistencia en el tratamiento fue del 31,5% (MDI) frente al 24,8% (DPI) en pacientes con asma y del 32,5 frente al 27,8%, respectivamente en EPOC, con menores tasas de exacerbaciones. En la bibliografía consultada, la persistencia en la medicación inhalada es baja, la asociación de CSI/LABA oscila entre el 18 y el 65%, con tasas aun inferiores si la medicación se utiliza en monoterapia18. A modo de ejemplo, la revisión efectuada por Bårnes19 sobre la base de 19 estudios muestra una adherencia al tratamiento que oscila entre el 22 y el 63%; el autor detalla que el 24% de las exacerbaciones y el 60% de las hospitalizaciones relacionadas con el asma podrían atribuirse a una mala adherencia. Nuestros resultados son similares o ligeramente superiores a los reportados (aunque siguen siendo bajos)8,9. Esta circunstancia se podría explicar por varias razones: a) el método de medida de la adherencia/persistencia, b) se consideró la dosis prescrita por el médico al inicio del estudio, c) es un estudio con datos más reciente, d) son pacientes que demandaron atención, es decir, acuden regularmente a los controles y están sujetos a un seguimiento específico (autocontrol: colectivo de enfermería).
La persistencia en el tratamiento farmacológico observada en nuestro estudio es significativamente más alta con dispositivos MDI frente a los DPI tanto en asma como en EPOC, aunque es importante tener presente otros factores (educación sanitaria, preferencias de los pacientes, etc.) que no fueron medidos en el estudio. La educación adecuada sobre el uso correcto no solo puede mejorar el control de los síntomas de la enfermedad, sino que también puede permitir la reducción de dosis a largo plazo20–22. En este sentido, las sociedades científicas ponen de manifiesto que cada tipo de dispositivo presenta características y limitaciones que deben ser evaluados y tenidos en cuenta antes de ser prescritos. Los MDI son los dispositivos más eficientes (coste-efectivos) y deberían considerarse como el inhalador de primera elección para el tratamiento de la EPOC y el asma estable23. La excelente revisión efectuada por Brocklebank24 muestra que los pacientes respiratorios pueden utilizar dispositivos MDI tan eficazmente como otros dispositivos inhaladores siempre y cuando la técnica de inhalación sea correcta9,11. Aunque serán necesarios más ensayos clínicos para demostrar las diferencias en la efectividad clínica y el coste-efectividad de los distintos tipos de dispositivos. Parece que nuestros resultados están en consonancia con estas recomendaciones, puesto que son pacientes que inician tratamiento con CSI/LABA y no son representativos de todos los pacientes con asma/EPOC tratados en las consultas.
Los episodios de exacerbación, en su mayoría leve, fueron mayores en aquellos pacientes con suspensión/falta de adherencia al tratamiento. El riesgo para presentarlos se relaciona con el nivel de gravedad clínica o funcional, insuficiente tratamiento preventivo y mal cumplimiento del tratamiento prescrito. Estos datos están en consonancia con la bibliografía consultada25,26. No obstante, con base en la demanda de asistencia médica influyen numerosos factores ajenos a la propia enfermedad, como el acceso a los recursos sanitarios, la comorbilidad o la naturaleza del paciente, que podrían ocasionar que los episodios de empeoramiento no sean comunicados por el interesado y, por tanto, que no sean tratados. En el modelo de regresión lineal múltiple, el coste sanitario se asoció mayoritariamente al tipo de dispositivo, al número de exacerbaciones, y a la falta de adherencia al tratamiento. En este aspecto, Bender27 obtiene un coste medio de 5.440 dólares en EE. UU., y concluye que la falta de adherencia al tratamiento compromete la efectividad clínica y hace aumentar el coste sanitario del asma y otras enfermedades crónicas. Mattke28 en un estudio observacional (N=41.234) demuestra que la falta de adherencia al tratamiento repercute en mayores tasas de visitas y hospitalizaciones. Piecoro29 en un estudio transversal realizado en beneficiarios de Medicaid detalla un coste medio para el asma de 616 dólares, así como que, la falta de adherencia al tratamiento fue notoria, y se asoció con un aumento de las exacerbaciones que repercute en mayores tasas de hospitalización. En todos ellos el coste de la medicación y los ingresos hospitalarios son relevantes, mientras que los que cuantificaron los costes no sanitarios fueron de poca magnitud6,13. En nuestro estudio cabe destacar un potencial ahorro del 10% en los dispositivos MDI frente a los DPI tanto en asma como en EPOC.
Las posibles limitaciones del estudio inciden en las propias de los estudios retrospectivos, como por ejemplo, el infrarregistro de la enfermedad, las posibles diferencias de los profesionales y de los pacientes, al ser un diseño observacional, o incluso el sistema de costes empleado o la posibilidad de la existencia de un sesgo de clasificación. La posible inexactitud de la codificación diagnóstica en cuanto al diagnóstico de la enfermedad y otras comorbilidades, en la propia definición de la exacerbación o bien la falta de alguna variable que pudiera influir en los resultados finales (nivel socioeconómico de los pacientes, exposición al trabajo, evolución de la dosis farmacológica prescrita, subtipos de dispositivos, motivos de suspensión, etc.) deben considerarse como una limitación del estudio. A nuestro entender, estas limitaciones seguramente inciden en los 2subgrupos analizados de forma similar, tanto en asma como en EPOC, por lo que no afectaría a las conclusiones del estudio. Las limitaciones más destacadas están en relación con la propia medida del RPM/persistencia, la falta de medida de algunas variables esenciales (educación) y la validez externa de los resultados (generalización de los datos). Es conocido que la eficacia del dispositivo solo podría demostrarse con un ensayo clínico; no obstante, en un diseño observacional (como este estudio), puede ser una buena aproximación a lo que sucede en situación de práctica clínica habitual, minimizando las posibles limitaciones del estudio.
En la mayoría de los centros de AP ya se están realizando programas educativos para enseñar a los pacientes a utilizar los dispositivos de inhalación, lo que puede redundar en un correcto uso de estos y en una mejora de su enfermedad4,5,30. Es importante revisar periódicamente las habilidades en el manejo, puesto que los pacientes tienden a olvidar con el tiempo la forma correcta de administración, al perder la costumbre. Las perspectivas futuras que nos ofrece este estudio se centran en replicarlo en otras instituciones sanitarias y en promover estrategias de intervención orientadas a fomentar el autocuidado de los pacientes (programas educativos estructurados e individualizados). Serán necesarios más estudios para establecer la asociación entre el tipo de dispositivo inhalador y la adherencia al tratamiento. En conclusión, con base en los datos aportados por nuestro estudio, los dispositivos MDI (tratamiento inicial con CSI/LABA) se asocian a mayor grado de persistencia y menos exacerbaciones, lo que se ha asociado a menor uso de los recursos y costes tanto en asma como EPOC.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría/colaboraciónLa concepción y el diseño del manuscrito fueron realizados por A. Sicras y J.M. Collar, la recogida de los datos y el análisis estadístico por A. Sicras y la interpretación de los datos, redacción, revisión y aprobación del manuscrito remitido por todos los autores.
Conflicto de interesesEl estudio fue patrocinado por Mundipharma. J.M. Collar es empleado de Mundipharma. A. Sicras es un consultor independiente en relación con el desarrollo de este manuscrito. Los demás autores declaran no tener conflicto de intereses.