La vía epidural constituye una opción terapéutica analgésica en la isquemia vascular periférica, que ha ido evolucionando en el tiempo con la aparición de nuevos fármacos administrables por vía epidural y con la aplicación de la neuroestimulación medular. La analgesia epidural presenta ciertas limitaciones en el tratamiento de la isquemia periférica, que vienen condicionadas por la situación clínica de los pacientes, el tipo de isquemia y el entorno sanitario. Algunas complicaciones secundarias a la isquemia, como el síndrome compartimental, las neuropatías motoras y los síndromes de reperfusión pueden verse potencialmente artefactados y enmascarados por la analgesia epidural. Por ello, se necesita conocer ciertos conceptos de la isquemia periférica y evaluar los balances entre beneficios, riesgos y costes para una adecuada aplicación de la analgesia epidural.
Material y métodosLas referencias bibliográficas de la presente revisión se obtuvieron a través de una búsqueda bibliográfica en la base de datos de MEDLINE®, usando los siguientes términos de búsqueda: “peripheral vascular disease; (critical) limb isch(a)emia and epidural; spinal cord stimulation; pain”; o bien: “epidural and phamtom limb; stump pain”. De esta búsqueda bibliográfica sólo se obtuvo acceso a un total de 48 publicaciones científicas de casos clínicos y 5 publicaciones de revisiones literarias científicas, que fueron sometidas a análisis crítico de acuerdo a los criterios de la medicina basada en la evidencia, sin limitaciones en cuanto al tamaño muestral (parte II). Adicionalmente, se consultaron otras referencias literarias fuera de los criterios de la búsqueda bibliográfica y fuera del análisis crítico, para realizar una revisión histórica acerca de las técnicas de analgesia epidural y el dolor por isquemia arterial periférica (parte I).
ResultadosIsquemia vascular periféricaAl hablar de tratamiento de dolor en los pacientes afectados de isquemia arterial periférica, se ha de tener en cuenta que el dolor es un síntoma principal por el que se acude al médico y a través del cual se realiza el diagnóstico.
La isquemia es la detención o falta de circulación en un tejido u órgano. Los vasos arteriales pueden ser de tamaño largo (aorta, carótida, troncos braquiocefálicos, etc.), de tamaño medio (ramas de las anteriores, fuera del tórax y abdomen) y de tamaño pequeño (microcirculación: con las arteriolas y capilares). La inervación de los vasos incluye fibras sensoriales aferentes (nociceptores) y fi bras eferentes simpáticas (vasoconstrictoras).
La enfermedad arterial isquémica aterooclusiva se asocia1 con unos factores de riesgo evidentes, como el tabaquismo, la diabetes, la hipertensión, la dislipemia y la hiperviscosidad sanguínea, entre otros. Suele afectar a las extremidades inferiores, pero también aparece en las superiores. Esta patología puede coexistir con enfermedad cerebral en un 20-60% de casos, con enfermedad renal en un 20-40% de casos y con la presencia de enfermedad corona-ria en un 10-30% de casos.
La isquemia vascular periférica es una de las manifestaciones de la enfermedad vascular periférica, la cual engloba un concepto más amplio de patologías vasculares de diferente etiología:
A. Patología arterial.
— Arterioesclerosis.
— Tromboangeítis obliterante o enfermedad de Buerger.
— Embolias.
— Trombosis.
— Traumatismos.
— Aneurismas arteriales.
— Síndrome compartimental.
— Colagenopatías.
— Aneurisma arteriovenosos congénitos.
— Enfermedades por el frío.
— Enfermedades vasoespásticas (Raynaud, acrocianosis, ergotismo, etc.).
— Eritromelalgia.
B. Patología venosa y linfática.
— Oclusión aguda venosa.
— Enfermedad venosa profunda.
— Oclusión venosa crónica.
— Síndrome postraumático y posflebítico.
— Síndrome varicoso.
— Linfedema, linfangitis.
C. Úlceras vasculares.
— Arteriales (por arteriosclerosis, tromboangeítis, hipertensión o diabetes).
— Venosas.
D. Secuelas posquirúrgicas.
— Dolor del muñón y del miembro fantasma.
— Síndrome de revascularización o compartimental.
— Neuropatía y cirugía de varices.
La presentación clínica de la isquemia arterial periférica puede ser:
— Asintomática. Con una prevalencia entre el 3 y el 20%, y en cuyo diagnóstico se deben emplear pruebas no invasivas.
— Sintomática. Cuya prevalencia se sitúa entre el 3 y el 6%.
En el diagnóstico es importante valorar los factores de riesgo cardiovascular, usar pruebas no invasivas como primera opción diagnóstica y, cuando sea necesario localizar el nivel de la lesión, se realizará angiografía y/o angiorresonancia. Siempre será necesario evaluar el riesgo de viabilidad de la extremidad.
La evolución puede ser hacia varias formas de presentación clínica:
A. Asintomática: 20-50% de los casos.
B. Isquemia aguda.
C. Isquemia crónica.
— Claudicación intermitente: 10-35% de los casos.
— Isquemia crítica: 1-3% de los casos.
D. Amputación.
En cuanto al tratamiento, puede ser médico conservador o realizarse un tratamiento de revascularización mediante técnicas endovasculares o cirugía abierta. Es importante controlar los factores de riesgo.
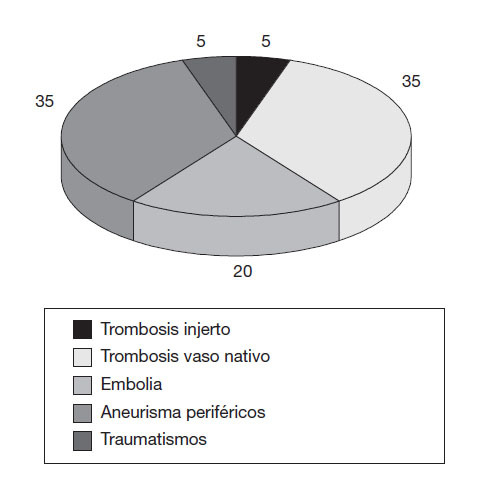
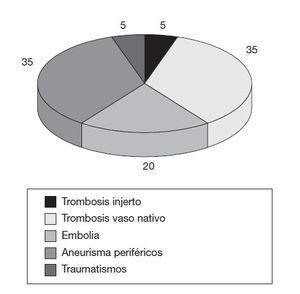
Isquemia arterial agudaEs la disminución brusca de la perfusión sanguínea en una extremidad que causa la posible amenaza de la viabilidad de ésta. Se acompaña de dolor, palidez, pérdida de pulso, parestesias y parálisis (5P). La etiología suele ser trombosis de vaso nativo o de reconstrucción de injerto, embolias, traumatismos o aneurismas (fig. 1). La clínica puede aparecer en unas 2 semanas tras el episodio de la alteración de la perfusión. La presencia de dolor puede ser variable. En el diagnóstico hay que realizar pruebas de laboratorio habituales, electrocardiograma, pruebas vasculares no invasivas (presión arterial, pletismografía, Doppler) y puebas invasivas, como la arteriografía y la angiorresonancia. Se precisa hacer diagnóstico diferencial con la isquemia crítica en pacientes afectados de patología arterial crónica, además de otros cuadros como el shock sistémico, arteriopatía por virus de la inmunodeficiencia humana, neuropatías agudas y síndrome compartimental.
Figura 1 Incidencias de la etiología de la isquemia aguda.
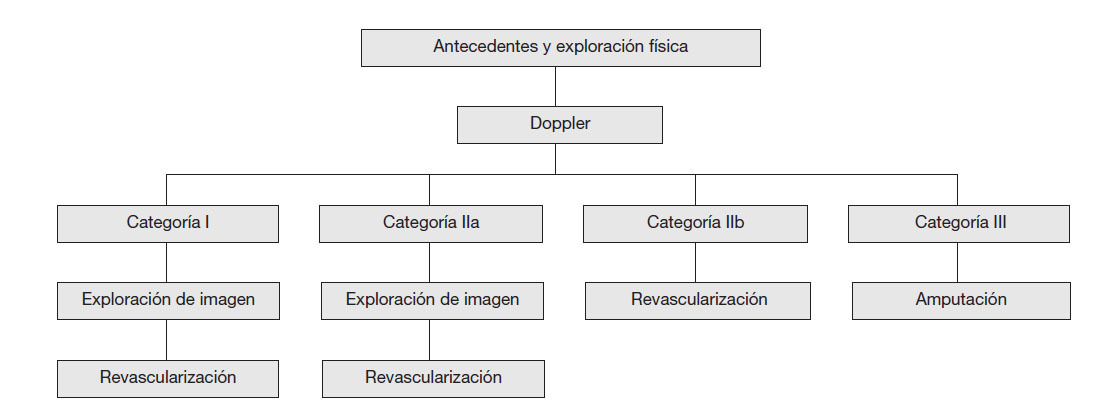
En la evaluación de la isquemia arterial aguda es importante determinar la categoría de la viabilidad de la extremidad (tabla 1) para aplicar el tratamiento adecuado (fig. 2).
Tabla 1 Categorías de distinción entre las extremidades amenazadas, viables e irreversibles en isquemia arterial aguda
Figura 2 Tratamiento angiológico de la isquemia arterial aguda según la categoría de isquemia.
En el tratamiento de la isquemia arterial aguda el objetivo fundamental es evitar la propagación de los trombos y el agravamiento de la isquemia, para lo cual puede precisarse:
— Anticoagulación inmediata con heparina.
— Trombólisis endovascular.
— Trombectomía percutánea.
— Embolectomía.
— Cirugía de revascularización: a) endovascular, preferentemente para lesiones infrainguinales, y b) cirugía abierta, para lesiones suprainguinales y traumatismos arteriales.
— Se ha de realizar una arteriografía de control al completar la intervención.
— Amputación: la amputación en la isquemia aguda se puede complicar con hemorragia debido a la prevalencia de anticoagulación, y esta complicación es más frecuente en la amputación supracondílea. Se realiza en un 25% de los casos.
La mortalidad por isquemia aguda varía entre un 15 y un 20% y se debe, sobre todo, a hemorragias, intervenciones de cirugía mayor e insufi ciencia renal.
En el seguimiento tras la reperfusión se ha de prestar atención a la aparición de complicaciones como el síndrome compartimental2 y la rabdomiólisis:
Síndrome compartimental. Ocurre por un aumento de la permeabilidad capilar que conlleva edema local e hipertensión compartimental, lo que conduce a una obstrucción de vénulas, disfunción de los nervios, obstrucción capilar y arteriolar e infarto muscular. Cursa con dolor desproporcionado, parestesias y edema. El diagnóstico es clínico, además de poder analizarse por el aumento de la presión intracompartimental (> 20 mmHg). El tratamiento consiste en realizar una fasciotomía.
Rabdomiólisis. Cursa con una destrucción muscular importante, con la presencia de mioglobinuria en un 20% y un aumento de la creatinfosfocinasa > 5.000 UI. Puede producir insufi ciencia renal.
Isquemia arterial crónicaEs la expresión clínica del deterioro progresivo del fl ujo arterial en las extremidades. Puede presentarse de varias formas:
— Asintomática: 20-50% de casos.
—Claudicación intermitente: 10-35% de casos.
—Isquemia crítica: 1-3% de casos.
Para su clasificación se utilizan los estadios de La Fontaine y de Rutherford (tabla 2).
Tabla 2 Clasificación de la enfermedad arterial periférica: estadíos de Fontaine y categorías de Rutherford
El mecanismo de producción del dolor en la isquemia crónica es por la inadecuada perfusión (isquemia), además de por los cambios secundarios debido a úlceras y gangrenas, espasmos arteriales y por la afectación del retorno venoso. En la claudicación intermitente el dolor aparece con el ejercicio, depende del nivel de la oclusión y puede producirse un síndrome compartimental crónico.
El diagnóstico diferencial del dolor de isquemia arterial crónica debe realizarse con los pacientes que presentan estenosis de canal, sobre todo a nivel lumbar, compresión nerviosa secundaria a hernia discal, con los síndromes venosos compartimentales, con el dolor por artritis de cadera o del pie, las ciáticas, neuropatías y el síndrome regional complejo tipo I. Es importante hacer un examen físico para detectar factores de riesgo y patología arterial en los grandes vasos, aorta y/o carótida, la palpación de los pulsos periféricos y hacer una valoración del estado de la piel y de los cambios tróficos. En el tratamiento de los pacientes con isquemia crónica es importante controlar los factores de riesgos asociados.
La isquemia crítica en la extremidad es una manifestación de la enfermedad arterial periférica crónica que describe a los pacientes con dolor de reposo isquémico crónico, ulceración o gangrena. Para asegurar que la isquemia crítica de una extremidad se debe a arteriosclerosis, debe observarse una presión arterial sistólica en tobillo < 50 mmHg o una presión arterial sistólica en el primer dedo del pie < 30 mmHg, o una presión transcutánea de oxígeno (Tcp O2) < 30 mmHg1. La isquemia crítica se produce cuando las lesiones arteriales deterioran el flujo sanguíneo, hasta el punto que no pueden satisfacer la nutrición de los tejidos. En las enfermedades arteriales oclusivas, la isquemia crítica puede presentarse en múltiples niveles arteriales. En la microcirculación aparece una disfunción endotelial y alteración hemorreológica con activación de los leucocitos e inflamación, que conlleva una mala distribución de la microcirculación de la piel además de la reducción del flujo sanguíneo. Hay una reducción de la Tcp O2. La baja presión de perfusión de los tejidos pone en marcha una serie de respuestas microcirculatorias complejas que contribuyen a producir dolor de reposo y alteraciones trófi cas. Cualquier paciente con dolor en la pierna o presencia de ulceraciones requiere una exploración para descartar isquemia crítica.
La presencia de úlceras y/o gangrenas atribuibles a una enfermedad arterial oclusiva y demostrada de modo objetivo, es más frecuente en pacientes diabéticos sedentarios y en presencia de neuropatía, lo cual conlleva un riesgo de perder la extremidad y un peor pronóstico. Se presenta con dolor intenso, que aumenta mucho por la noche, causado por la isquemia y por la neuropatía, con cambios tróficos frecuentes en la piel
El tratamiento de la isquemia crítica se basa en:
— Tratamiento médico (fármacos prostanoides, vasodilatadores, anticoagulación, oxígeno hiperbárico, analgésicos, tratamiento de las úlceras, modificación de los factores de riesgo).
— Cirugía de revascularización.
— Neuroestimulación de la médula espinal.
El dolor por isquemia arterial periférica puede presentarse de forma:
A.Aguda. En forma de reciente comienzo, con duración limitada y temporal, y en relación con la enfermedad. Su aparición conlleva la puesta en marcha de todos los cambios endocrinometabólicos al estrés, además de cambios psicológicos como ansiedad, insomnio, etc. Siempre conlleva una respuesta individual, multifactorial, influenciada por el nivel cultural y los acontecimientos previos vividos. Por sus características se puede presentar como neuropático agudo, con una incidencia del 1-3%, el cual aparece sobre todo en cirugía y tras el traumatismo3.
B. Crónica. Cuando persiste más de 3-6 meses. El tratamiento del dolor por isquemia periférica ha de ser rápido, eficaz y específico4, ya que si no se trata puede implicar el riesgo hacia formas de dolor de tipo crónico5. Se han descrito una serie de factores que se relacionan con evolución hacia la cronicidad del dolor. Estos factores pueden ser:
— Preoperatorios: dolor severo, cirugías repetidas.
— Intraoperatorios: daño nervioso en el abordaje quirúrgico.
— Postoperatorios: dolor severo, ansiedad, etc.
La etiopatogenia del dolor en la isquemia arterial ocurre por:
— Inadecuada perfusión de los tejidos.
— Cambios secundarios a las ulceraciones, gangrena y trastornos tróficos de la piel.
— Ruptura de vasos grandes.
— Empeoramiento del retorno venoso.
Los mecanismos del dolor pueden ser múltiples: por una parte se deben a la hipoxia, la acidosis, la acumulación de metabolitos y el daño tisular debido al déficit de irrigación y, posiblemente, a una disregulación del tono simpático. A ello se le puede sumar la presencia de neuropatía isquémica del miembro, que produce dolor neuropático, el cual puede exhibir signos de centralización en los pacientes con grados severos de isquemia6. Por tanto, se pueden distinguir 2 componentes en el dolor de la enfermedad arterial periférica:
— Dolor nociceptivo, que a su vez puede diferenciarse en: a) profundo, referido a tejidos musculares, exacerbado con el ejercicio y que puede considerarse como un equivalente anginoso. Es el principal componente de dolor en la claudicación intermitente, y b) superfi cial, generado en las úlceras y en los bordes de las zonas gangrenosas en los casos con trastornos trófi cos presentes.
Este componente de dolor puede aliviarse con opiáceos y analgesia convencional sistémica. Asimismo, también responde a la neuroestimulación eléctrica epidural, a diferencia del dolor nociceptivo puro generado por otras etiologías, que no suele responder, lo que ha llevado a hipotetizar que el tratamiento del componente neuropático del dolor y la mejoría en el trofismo vascular de miembros con isquemia periférica a través de la neuroestimulación epidural medular induce un alivio del componente nociceptivo7.
— Dolor neuropático: es un dolor de reposo, frecuentemente referido a zonas superficiales del miembro. En estudios recientes6 se ha evidenciado que los pacientes con isquemia crítica de extremidades puntúan más alto en cuestionarios de dolor neuropático, como el S-LANSS (Self-report version of the Leeds Assesment of Neuropathic Symtoms and Signs), el NPSI (Neuropathic Pain Symptom Inventory) o el SF-MPQ (Short-Form McGill Pain Questionnaire), en descriptores de dolor neuropático como las quejas álgicas de quemazón (dolor por neuropatía), hipersensibilidad superficial (hiperalgesia y alodinia), punzadas, puñaladas o pulsaciones, mientras que en los pacientes con claudicación intermitente predominan los descriptores de calambres y pesadez de miembros. El test sensorial cuantitativo (QST, Quantitative Sensory Testing) puede revelar la presencia de neuropatía sensitiva y signos de centralización del dolor neuropático. Con la neuroestimulación eléctrica epidural el dolor neuropático de otros orígenes puede obtener alivio evidente a los 10 min de iniciar la neuroestimulación, mientras que en los casos de dolor por enfermedad arterial periférica aterooclusiva el alivio puede tardar hasta 2 días. Este comportamiento del alivio del dolor podría relacionarse con la vasodilatación inducida por la neuroestimulación epidural medular, ya que en los casos de isquemia vasospástica el alivio es más rápido7.
Las crisis irruptivas de dolor, que fueron descritas por Portenoy y Hagen8, son frecuentes en los pacientes con isquemia arterial periférica. Estas crisis pueden estar provocadas por estímulos o independientes de éstos (continuas o episódicas). En el postoperatorio de cirugía vascular en pacientes con isquemia periférica, el dolor espontáneo irruptivo se puede precipitar por los movimientos, la tos, la respiración profunda, etc., pudiendo aparecer también fenómenos de hiperalgesia y alodinia9,10. El mecanismo del dolor neuropático irruptivo se debe a una lesión de los nervios que producirá una alteración en los canales del calcio, produciendo una hiperexcitabilidad de la neurona con aumento de la actividad ectópica de los terminales nerviosos y un descenso en el umbral del estímulo al dolor. Las descargas ectópicas se correlacionan con una redistribución de los canales del sodio, y también con la liberación de noradrenalina desde el terminal simpático de los nervios. Se produce una sensibilización central debida a las continuas descargas de las fibras C hacia la médula espinal, interviniendo en estos procesos los receptores N-metil D aspartato (NMDA). El descenso de esta inhibición segmentaria, después de ocurrir un daño nervioso, puede facilitar la transmisión del dolor. La activación del sistema inmunitario tras producirse la lesión nerviosa periférica, junto con la activación de las células de la glía, promueven la liberación de citocinas (interleucinas I y II y factor de necrosis tumoral), lo cual sugiere que estos mecanismos podrían estar implicados en la hiperexcitabilidad neuronal observada en el dolor irruptivo11.
El tratamiento del dolor en la isquemia aguda requiere una valoración clínica individual de cada paciente cuando se diagnostica, bien antes de realizar el tratamiento de revascularización o mientras se le realizan pruebas para confirmar el diagnóstico. En los casos de isquemia aguda se ha de tener presente la posible aparición del síndrome compartimental y la rabdomiólisis, que complican tanto el tratamiento como la evolución de la enfermedad. Se debe realizar la modalidad analgésica, más eficaz y más adecuada al estado clínico del paciente. La analgesia ideal debería ser multimodal. Al valorar el dolor por isquemia arterial periférica es importante determinar en él la localización, distribución, duración, su interferencia en la calidad del sueño y los factores que lo agravan o lo alivian, la necesidad de terapia coadyuvante, así como la presencia de terapias antiagregantes y/o anticoagulantes dentro del contexto global del paciente. El dolor por isquemia vascular periférica afecta con frecuencia a personas mayores con toda la patología médica y social que de ellas se deriva. Asimismo, también es importante valorar el beneficio de aplicar técnicas de rehabilitación en el paciente.
La vía epidural12,13 usada para analgesia se ha mostrado eficaz en el alivio del dolor por isquemia arterial, bien sea mediante bolos, perfusión continua o a través de sistemas de analgesia controlada por el paciente. Los fármacos más usados son los anestésicos locales, además de coadyuvantes.
La neuroestimulación epidural es un tratamiento intervencionista en los pacientes con enfermedad arterial periférica en los estadios grado III y IV de La Fontaine en los que no se puede realizar revascularización, que resulta eficaz en cuanto al alivio del dolor, mejorando la calidad de vida, la microcirculación y disminuyendo el consumo de analgésicos14-16.
Analgesia epidural para el dolor de isquemia periféricaLa administración de fármacos epidurales fue descrita en 1885 por Corning17 cuando inicialmente inyectó solución de cocaína en el espacio intervertebral T11-T12. Posteriormente, aparecieron referencias de su uso por parte de Sicard18, Cathelin19 y en España por Pagés20. La técnica de pérdida de resistencia fue descrita por Sicard, mientras que Heldt y Moloney21 describieron la presión negativa en el espacio epidural y la técnica de la “gota pendiente” la introdujo Gutiérrez en 193222. Con posterioridad a estos hallazgos, se desarrollaron los catéteres y los sistemas de perfusión23-25. En 1945 Tuohy desarrolló la aguja de punta Huber y describió su técnica de administración continua de fármacos epidurales a través de catéter. Benson en 1946 y Hingson y Southworth en 1947 publicaron el uso de la anestesia caudal continua para el alivio del vasospasmo en las enfermedades vasculares periféricas. Hingson y Southworth en 1947, Ruben en 1950 y Thistlethwaite et al en 1953 publicaron los resultados clínicos de la utilización del bloqueo simpático a través de perfusiones epidurales continuas en tromboflebitis y enfermedad arterial periférica. Bonica et al26 describieron, en 1957, sus experiencias con el uso de los bloqueos epidurales en dolor de diversas etiologías, entre ellas la enfermedad arterial periférica, y realizaron además una extensa revisión de 3.637 casos de bloqueos epidurales, enfatizando la importancia de su uso como medida diagnóstica, pronóstica y terapéutica. Con el descubrimiento de los receptores opiáceos en 197325, hubo un resurgimiento de la analgesia epidural. Actualmente, las técnicas de la anestesia combinada epidural-general son una práctica habitual, que se usa para analgesia y anestesia, pero esta idea fue propuesta por Crile27. El concepto de anestesia combinada espinal-epidural se introdujo en 193728. Uno de los recientes avances en la cateterización epidural es la introducción de los sistemas de estimulación epidural utilizados para la localización del espacio epidural, con potencial utilidad para minimizar riesgos derivados de la técnica, sobre todo en pediatría.
La analgesia epidural proporciona una analgesia de mayor calidad y permite realizar una terapia multimodal29.
En una revisión acerca de la morbilidad de bloqueo neuroaxial30 la incidencia de complicaciones adversas aparece en 1:1.000 procedimientos.
Las principales complicaciones son:
— Neuropatías: 10% de prevalencia.
— Hematoma epidural: < 0,05% de los casos.
— Absceso epidural: < 0,1% de los casos.
— Complicaciones neurológicas: entre un 0,004 y un 0,036% de los casos.
Los efectos adversos más frecuentes son:
— Hipotensión, náuseas y vómitos (7%).
— Sedación (10%).
— Prurito (2%).
— Depresión respiratoria (7%).
— Necesidad de intubación de la vía aérea (0,8%).
—Cefalea pospunción (0,4-24%).
Entre las complicaciones, el absceso epidural se sospechará en todo paciente que tenga un sistema de anal gesia epidural por la presencia de fiebre y dolor lumbar asociado o no a síntomas neurológicos. El germen más frecuente es Staphylococcus aureus. Su diagnóstico ha de ser precoz y se ha de realizar pruebas de imagen (resonancia magnética nuclear) para su confirmación. El tratamiento puede ser médico conservador con tratamiento antibiótico sis témico y oral, o bien necesitar de tratamiento neuroquirúrgico. La incidencia de infección en el sitio de punción aparece en un 2,8% en los catéteres torácicos y en un 0,8% en los catéteres lumbares. La duración de la analgesia y el tipo de intervención quirúrgica influyen en la aparición de estas infecciones: por cada día de postoperatorio el riesgo de infección aumenta un 40%, por lo que siempre se deben extremar las medidas de asepsia, tanto en su implantación como en su mantenimiento. En un estudio realizado en nuestro hospital de colonización e infección31 se encontró una incidencia de colonización epidural del 22%, una incidencia de infección local del 9% y una incidencia de infección profunda del 1,47% tras cateterización epidural temporal, dichas incidencias fueron similares a la de otros estudios.
El riesgo de hematoma se estima en 0,0005%32. Hay que tener presente la presencia de terapia anticoagulante en estos pacientes antes de proceder a la instauración o a la retirada de un sistema de analgesia epidural, y seguir las recomendaciones y guías clínicas sobre los fármacos inhibidores de la hemostasia y la anestesia/analgesia regional neuroaxial33-35. Pueden haber casos de migración accidental del catéter estando el paciente anticoagulado en un 9,9%, y esto es más frecuentes en los catéteres torácicos. Se ha de realizar un rápido diagnóstico y tratamiento bien conservador o bien con descompresión neuroquirúrgica (el 0,010,07% de los casos) según la afectación medular derivada.
La depresión respiratoria es una complicación grave que se ha de detectar y valorar con especial atención, y hay varios criterios para definirla, el más usado es la frecuencia respiratoria36.
La cefalea pospunción dural se produce con más frecuencia en pacientes jóvenes, mejora espontáneamente en un 90% de los casos en 10 días, y aunque generalmente no es grave, conlleva un alto grado de preocupación en los pacientes37.
Por último, pueden haber fallos en el tratamiento de la analgesia en un 22%38, que aparecen en las primeras 48 h de su instauración y las causas más frecuentes son:
— Descolocación del catéter: 10%.
— Analgesia inadecuada: 3,5%.
— Déficit sensorial o motor: 2,2%.
La forma ideal de administración de analgesia epidural es mediante perfusión continua y, siempre que se pueda y el paciente colabore, se ha de usar una analgesia controlada por el paciente. Inicialmente se precisa alcanzar un buen nivel analgésico, mediante una perfusión basal, para posteriormente realizar la programación de bolos de analgesia suplementaria a demanda, controlada por el paciente. Hay evidencias de que los opiáceos administrados mediante analgesia controlada por el paciente se acumulan menos39. La adicción de antieméticos a los opiáceos no ha demostrado un claro beneficio respecto a su administración única. La administración de la analgesia epidural precisa de un nivel de comprensión y colaboración por parte del paciente y una formación del personal sanitario2,40.
Entre los riesgos de esta modalidad analgésica se han descrito casos de errores en la programación de la perfusión2,40. Entre las medidas preventivas para evitar riesgos derivados se encuentran la incorporación de una válvula antirreflujo en los sistemas de perfusión por bomba y la protocolización de las concentraciones de la medicación.
Los fármacos más utilizados para la analgesia epidural son los opiáceo y los anestésicos locales:
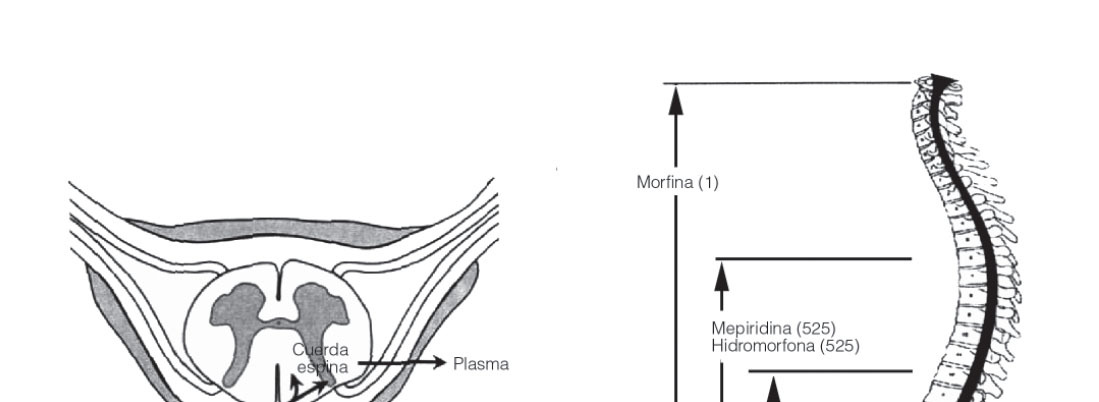
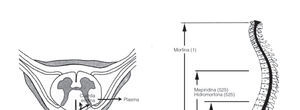
Opiáceos. Son analgésicos potentes que actúan mediante la unión a un receptor específico en la médula espinal. Producen una analgesia de alta calidad. Los fármacos lipofílicas tienen un comienzo de acción más rápido que las hidrofílicas, y su dispersión neuroaxial y riesgo de efectos secundarios es diferente (fig. 3). Entre ellos cabe destacar:
Figura 3 Dispersión y distribución de los opiáceos administrados por vía neuroaxial.
— Metadona: el enantiómero D de la metadona tiene además baja afinidad por los receptores NMDA41.
— Fentanilo: es lipofílico y de rápido comienzo de acción.
— Morfina: es hidrofílica y de acción más prolongada. Hay una formulación nueva de morfina encapsulada en liposomas (DEPODUR®) que produce una liberación más prolongada con una duración de 48 h.
El uso de opiáceos en pacientes afectados de isquemia (dolor crónico benigno) se ha de tener en cuenta a la hora de instaurar la analgesia epidural, ya que son pacientes en los que se puede desarrollar una mayor tolerancia, tanto asociativa o aprendida como no asociativa, que se debe a una desensibilización de los receptores o disminución del receptor y en cuya etiopatogenia intervienen los receptores NMDA. La sensibilidad anormal al dolor, con hiperalgesia y alodinia, también puede aparecer en pacientes tratados de forma crónica con opiáceos. Por todo ello, se debe actuar según unos protocolos en los se debe valorar la presencia de dosis techo de opiáceos, los descensos de la dosis y la rotación de opiáceos, y si es preciso se debe realizar una destoxificación de opiáceos42. Los opiáceos por vía epidural en pautas de analgesia controlada por el paciente se asocian con una mayor incidencia de prurito que en la analgesia intravenosa controlada por el paciente43.
Anestésicos locales. Bloquean los canales del sodio, lo que impide la transmisión del estímulo nervioso y la hiperexcitabilidad neuronal. Hay anestésicos locales de acción corta, larga e intermedia. Los valores plasmáticos de los anestésicos locales ascienden a las 48 h del comienzo de su perfusión epidural. Uno de los problemas más importantes que plantean durante su uso por vía epidural es la posibilidad de producción de bloqueo motor en las extremidades. La calidad de la analgesia mejora con la adicción de anestésicos locales44.
Adenosina. Produce analgesia a través de un receptor específico en la médula espinal. Estaría indicado en dolor neuropático e hiperalgesia.
Ketamina. Es un derivado de la fenciclidina sintetizada en 1962. Es un inductor con propiedades analgésicas amnésicas y sedativas, antagonista del receptor NMDA. Cuando es administrada de forma epidural asociada a opiáceos y/o anestésicos locales mejora el alivio del dolor y reduce los requerimientos de opiáceos, sin aumentar los efectos secundarios45-48. En el dolor isquémico que no responde a los opiáceos, la ketamina puede contribuir a su alivio.
Neostigmina. Es un inhibidor de la acetilcolinesterasa. Inhibe la transmisión endógena de acetilcolina. Produce un aumento de la liberación endógena de acetilcolina libre desde las neuronas simpáticas pregangliónicas. Su uso está limitado por los efectos secundarios de náuseas y vómitos. La neostigmina epidural combinada con opiáceos reduce la dosis de éstos42. Al combinarla con anestésicos locales mejora la calidad de la analgesia, intensifica y prolonga la duración del bloqueo motor.
Clonidina. Es un agonista específico del receptor alfa, presente dentro de las terminales presinápticas y postsinápticas de las fibras aferentes nociceptivas, reduce la transmisión del dolor por unión presináptica al nociceptor A delta y fibras C reduciendo la liberación de neurotransmisores y de forma postsináptica mediante hiperpolarización en las neuronas de segundo orden en el asta dorsal de la médula. Reduce el dolor nociceptivo y neuropático. Por vía epidural mejora el alivio del dolor. Prolonga el efecto analgésico de los anestésicos locales47.
Neuroestimulación epidural medular en isquemia arterial periféricaLa neuroestimulación epidural es una técnica intervencionista usada para el tratamiento crónico del dolor y, a diferencia de las técnicas de neuroablación, es reversible y mínimamente invasiva49. Consiste en la implantación subcutánea de un neuroestimulador, o generador de impulsos eléctricos, que estimula a nivel torácico bajo, en el caso de la isquemia de miembros inferiores, el cordón posterior de la médula espinal mediante un electrodo colocado en el espacio epidural, produciendo parestesias en el área del dolor. Su implantación se realiza en quirófano, con sedación intravenosa, asepsia y control fluoroscópico. Una vez obtenida la parestesia en el área con el dolor que hay que tratar, el electrodo generalmente se conecta a una batería externa temporal, con la cual se realiza un test de prueba de 1-2 semanas para asegurar una adecuada estimulación del área dolorosa que hay que tratar. Si la analgesia es adecuada, se colocará un generador interno definitivo en un segundo tiempo. Las indicaciones de neuroestimulación son50:
— Dolor radicular. Neuropatía periférica.
— Angina refractaria.
— Síndrome regional complejo.
— Congelación.
— Enfermedad vascular periférica (estadio III, IV Fontaine).
Hay varias teorías51 sobre el mecanismo de acción de la estimulación medular:
— La primera es la teoría de la puerta de entrada de Melzack y Wall, que afirma que los estímulos eléctricos inhiben la transmisión de impulsos nociceptivos del asta dorsal al cerebro a través del haz espinotalámico con inhibición segmentaria medular.
— Una segunda teoría propone que la estimulación antidrómica de la médula espinal provoca que las fi bras nerviosas liberen mediadores que causan vasodilatación, como la sustancia P, prostaciclina y el péptido relacionado con el gen de la calcitonina (CGRP).
— Una tercera teoría sugiere la participación de los neurotransmisores, como péptido intestinal vasoactivo, serotonina, sustancia P, CGRP, ácido gamma aminobutírico, prostaglandinas y óxido nítrico.
— Una cuarta teoría indica que la estimulación de la médula espinal afecta al sistema nervioso autónomo e inhibe la vasoconstricción conservada simpáticamente por medio de receptores ganglionares α-adrenérgicos 1 y nicotínicos.
— Estudios recientes52 sugieren que la estimulación medular induce vasodilatación mediante la vía del receptor vaniloide-1 (VR-1) que contienen las fi bras sensoriales.
Los primeros intentos de la neuroestimulación eléctrica cerebral datan de 1874, pero no se llegaron a realizar hasta 1948, para el tratamiento de alteraciones psiquiátricas. En 1967, Shealey et al53 introdujeron la técnica de neuroestimulación epidural medular, aunque las limitaciones técnicas de los sistemas de neuroestimulación utilizados y la escasez de publicaciones de los resultados clínicos obtenidos enlentecieron su posterior desarrollo49. En 1973 Cook et al54 trataron el dolor de las extremidades inferiores en pacientes con esclerosis múltiple y encontraron un aumento del fl ujo sanguíneo distal en las piernas después de usar estimulación medular. En 1998 se realizó un consenso en Bruselas para analizar las indicaciones de la estimulación epidural en la enfermedad vascular periférica, que son las siguientes:
— Isquemia vascular periférica lentamente progresiva debida a arteriosclerosis (estadio III y IV Fontaine).
— Pacientes con úlceras en los pies < 3 cm de diámetro.
— Alivio del dolor insuficiente con una medicación apropiada o cirugía realizada.
— Enfermedades vasospásticas (Raynaud, congelaciones por frío).
— Algunos casos de enfermedad de Buerger.
Las principales complicaciones de la neuroestimulación medular epidural son49:
— Fracaso de la neuroestimulación: malposisión de electrodos, rotura del cable de los electrodos, fallo en el generador de pulso, desconexión del dispositivo.
— Pueden requerir la revisión quirúrgica para su corrección.
— Migración de electrodos: es una malposición de electrodos previamente normoposicionados. Produce un descenso en la amplitud de estimulación en el caso de migración intratecal, con la posibilidad de producir lesión medular y fístula de líquido cefalorraquídeo.
— Hematoma e infección postimplantación del dispositivo.
Los cambios vasculares inducidos por la neuroestimulación epidural medular se pueden cuantificar a través de medidas de macroarticulación y microcirculación.
Entre las medidas de macrocirculación destacan:
— Ultrasonografía Doppler.
— Volumen de pulso.
— Índice tobillo/brazo: es la relación entre la presión arterial del brazo y la pierna. Un índice entre 0,3 y 0,9 es frecuente en los pacientes con claudicación intermitente.
— Distancia de la claudicación.
Las principales medidas de microcirculación evaluadas son:
— Capilaroscopia, basada en la visualización de los capilares en la raíz de las uñas de los dedos de manos y pies. Per-mite valorar la morfología dinámica, el flujo de sangre y la velocidad de los hematíes55,56.
— Medición de la Tcp O2. Analiza la presión de oxígeno en la piel mediante un análisis de la microcirculación y perfusión de los tejidos después de la difusión del oxígeno desde los vasos. La medición se hace en el dorso del pie mediante un electrodo. Se considera un rango normal entre 50 y 60 mmHg y un rango de isquemia media entre 10 y 30 mmHg. En los pacientes en los que persiste un Tcp O2 < 10 mmHg indica peor pronóstico, pudiendo llegar a precisar amputación en los 3 meses siguientes.
Se han usado 2 índices: el índice de perfusión regional (RPI) y el índice de vasodilatación (Tcp O2 42/Tcp O2 45). El índice RPI compara el Tcp O2 de la extremidad inferior con el del tórax, considerando que el Tcp O2 en el pie es la cuarta parte del torácico en los pacientes con isquemia.
El otro índice usado es el índice de la vasodilatación (Tcp O2 42/Tcp O2 45). Tcp O2 42 representa la vasodilatación submáxima y el Tcp O2 45 representa la máxima vasodilatación. El valor normal es 0,47, lo cual equivale a un tono vasomotor normal. Un índice bajo nos indica vasoconstricción. Los pacientes con claudicación intermitente tienen un índice de 0,37 y en los pacientes con isquemia severa disminuye a 0,29, mientras que en los pacientes con claudicación neurógena es de 0,61.
El Tcp O2 es una de las medidas microcirculatorias más utilizadas para valorar la estimulación de la médula espinal en la isquemia periférica, en donde se ha demostrado unos incrementos en sus mediciones en el pie después de la neuroestimulación55,57.
— Perfusión mediante Doppler láser: muestra un incremento de la velocidad de flujo con una tendencia a la normalización de ambos, la onda de pulso y la amplitud de la onda, después de usar la neuroestimulación. Se ha establecido que un flujo de sangre de 0,70 ml/100 g de tejido/min o mayor podría ser indicativo de realizar tratamiento con neuroestimulación.
En algunas publicaciones previas, se propuso que la combinación de alivio del dolor mayor del 75%, un incremento en el Tcp O2 de 10 mmHg sobre el valor de base, y un aumento en el pico del flujo de 10 cm/s sobre el nivel basal podrían ser valores para realizar una selección de los pacientes que se beneficiarían de la neuroestimulación55,57,58, aunque todavía no se ha llegado a confirmar su sensibilidad, especificidad y valores predictivos como parámetros predictores terapéuticos de preservación de miembros con isquemia crítica.
*Autor para correspondencia. Correo electrónico: mjog15@yahoo.es (M.J. Orduña Gónzález).
Recibido el 15 de enero de 2009; aceptado el 4 de febrero de 2009