Repercusiones biológicas del cemento óseo de polimetilmetacrilato
Biological effects of polymethacrylate bone cement
Hernández Cortés, P.
Ramírez Tabernero, V.
Acosta González, F. L.
Hospital Clínico Universitario San Cecilio. Granada.
Servicio de Traumatología y Cirugía Ortopédica.
(F. L. Acosta González.)
Correspondencia: Dr. Pedro Hernández Cortés.
Avenida de Andalucía, 9 - 2.º D. 18014 Granada.
En redacción: Diciembre 1998
N.° Código: 826-4223
RESUMEN
La popularidad de la fijación acrílica de los implantes ortopédicos se adscribe al trabajo pionero de 1960 de sir John Charnley. Jones y Hungerford proponen el término de enfermedad del cemento en 1987 como la condición patológica del aflojamiento de la prótesis total de cadera cementada y que para ellos es consecuencia de una reacción granulomatosa de cuerpo extraño. Este tejido produce una gran variedad de mediadores bioquímicos inductores de resorción ósea para explicar la osteolisis periprotésica.
Presentamos un estudio comparativo de las membranas de interfase en implantes cementados y no cementados. Discutimos la eventual relación del polimetilmetacrilato con la carcinogénesis y la adhesividad del s. aureus y epidermidis a los implantes ortopédicos. Definimos el «síndrome por implantación del cemento» y analizamos las teorías patogénicas, subrayando el papel de la histamina en la contribución al fenómeno.
La hipersensibilidad retardada a componentes del cemento óseo puede provocar enfermedad profesional y explicar el aflojamiento precoz de algunas prótesis cementadas.
ABSTRACT
The popularity of acrylic fixation of orthopedic implants is attributed to the pioneering work in 1960 by Sir John Charnley. In 1987 Jones and Hungerford proposed the term «cement disease» to describe the pathological condition of loosening of total hip arthroplasty. These authors consider this to be the consequence of a foreign-body granulomatous reaction. This tissue produces a variety of biochemical mediators that induce bone resorption, which explains periprosthetic osteolysis.
A comparative study was made of interfaces in cemented and uncemented implants. We discuss the relation between polymethylmethacrylate and carcinogenesis and the adhesion of Staphylococcus aureus and S. epidermidis to orthopedic implants. «Cement implantation syndrome» is defined and the pathogenic theories are analyzed, underlining the role of histamine in this phenomenon.
Delayed hypersensitivity to bone cement components can produce occupational disease and lead to early loosening of some cemented prostheses.
Palabras clave: Artroplastias. Cementos de fijación. Complicaciones.
Key words: Arthroplasty. Fixation cements. Complications.
INTRODUCCIÓN
El metil metacrilato es un plástico acrílico cuyo uso en medicina data de muchos años, en particular por dentistas y neurocirujanos, para el relleno de los defectos óseos del cráneo.
En el ámbito de la cirugía ortopédica, los hermanos Judet (1), en París, desarrollaron una endoprótesis femoral, inicialmente de material acrílico entre 1946 y 1953.
El primer estudio experimental sobre el uso del cemento acrílico en cirugía ortopédica fue llevado a cabo por Wiltse, Hall y Stenehjem. (1957) (2), los cuales asumieron su biocompatibilidad en el conejo o el mono.
En 1951 Sven Kiaer (publicado en 1953) (3) describe la unión de prótesis al hueso con plástico autopolimerizante como una técnica importada de la odontología.
Aunque Haboush, 1953 (4), acredita la primera artroplastia total de cadera (ATC) cementada, la popularidad de la fijación acrílica de los implantes se adscribe al trabajo pionero de 1960 de sir John Charnley (5).
ESTRUCTURA QUÍMICA
La fórmula del cemento óseo de polimetilmetacrilato (PMMA) que utilizamos en la actualidad no ha cambiado esencialmente del cemento desarrollado para Charnley por Denis Smith, un científico de materiales dentales de la Universidad de Manchester.
El cemento óseo tiene dos componentes, uno líquido y otro pulverizado, que deben ser mezclados durante la operación (7). Cerca del 88 por 100 del peso del componente pulverizado está constituido por partículas de PMMA o copolímeros aleatorios, en su mayor parte metilmetacrilato (MMA), junto con una pequeña cantidad de otros monómeros como el estireno. La mayoría de las partículas son esféricas y tienen un diámetro que oscila entre 30 y 150 mµ. El restante 10 por 100 del polvo es radioopaco (si es agregado) por la presencia de sulfato, de bario o de dióxido de zirconio (8). También se encuentra presente el peróxido de benzoilo (dos por 100), que es un iniciador (catalizador) de la polimerización.
El componente líquido es el monómero [MMA] (97 por 100) y también contiene N,N dimetil-p-toluidina (DMPT) --activador-- y una hidroquinona retardadora de la polimerización. La hidroquinona sirve para atrapar radicales libres y estabilizar el monómero para evitar la polimerización espontánea y aumentar el tiempo de caducidad.
Cuando se mezclan los componentes, se produce una rápida reacción del peróxido de benzoilo del polvo con el DMPT del líquido. Esta reacción libera radicales benzoilos que promueven la polimerización de los MMA. Esta polimerización alcanza un 90 por 100 entre los 5 y 15 minutos. Se trata de una reacción exotérmica, que conduce al cemento a una fase pastosa entre los tres y siete minutos.
Las variaciones de composición pueden afectar al tiempo de fraguado, propiedades mecánicas, reacción exotérmica y sumar la función propia de las sustancias añadidas. Las modificaciones químicas y adiciones surgen con el propósito de mejorar las propiedades físicas del PMMA, disminuir su toxicidad o diversificar sus aplicaciones.
Uno de los ejemplos mejor conocido es la adición de antibióticos al cemento propuesta por Buchholz, et al. (9), para disminuir el riesgo de infección perioperatoria y en la revisión de las artroplastias infectadas (10-17). En la misma filosofía, se han realizado ensayos clínicos con PMMA impregnado en adriamicina y drogas citotóxicas (18) en cirugía oncológica con resultados alentadores. Goodwin, et al. (19) añaden hormona de crecimiento (sustancia que estimula la formación osteoide en modelo experimental en conejos) al PMMA y comprueba una cinética de liberación adecuada. Para disminuir la toxicidad se defiende el uso de aminas terciarias que sustituyen al DMPT en la reacción del peróxido de benzoilo (20).
BIOCOMPATIBILIDAD
El concepto incluye los efectos que el ambiente biológico ejerce sobre las propiedades físicas del material (respuesta del material-biodegradación) y la respuesta biológica a los materiales (respuesta del huésped).
Respuesta del material
El PMMA es un material quebradizo a temperatura corporal que desarrolla una considerable sensibilidad a los surcos. Se fractura con cargas menores cuando hay surcos o defectos elevadores de tensión (21-23).
Los poros en su seno también empeoran su comportamiento frente a la fatiga (24). Existen evidencias de degradación enzimática del PMMA que determina de forma natural la aparición de productos catabólicos, pero no se ha establecido si este fenómeno puede ser capaz de determinar una degradación significativa (25).
Respuesta del huésped
Respuesta local: en torno a las prótesis cementadas se conforma una zona de hueso muerto de 0,5 mm de espesor como respuesta a la toxicidad química del monómero de metacrilato y a la liberación de calor durante el fraguado (26-28). Con el tiempo, esta zona se reemplaza por trabéculas óseas vivas que pueden persistir, pero con frecuencia casi todos los implantes se rodean de una cápsula fibrosa (29).
En 1923, Smith Petersen (30) desarrolla la artroplastia en cúpula en base a la observación de la pseudomembrana «sinovial» que cubría un cristal de la espalda de uno de sus pacientes, cuyo significado es la clásica respuesta a cuerpo extraño. En la interfase implante cementado-hueso, también podemos encontrar una membrana similar. A mediados de los años 70 se reconoce que la pérdida ósea periprotésica, que se manifestaba a veces como lesiones quísticas y otras como líneas radiolucentes en las radiografías, son el resultado de una reacción de cuerpo extraño (31).
Los resultados a largo plazo de las prótesis totales de cadera (PTC) cementadas son menos satisfactorios de lo que se auguraba, y al principio de los 70 y hasta la actualidad surgen artículos con tasas de aflojamiento que oscilan entre el 1 y el 56 por 100, dependiendo de las características de la serie y el concepto de «aflojamiento» considerado (32, 33).
Charnley (34) creía que el aflojamiento de los componentes femorales cementados se debía primariamente a factores mecánicos y que el cemento era bien tolerado por el esqueleto. Otros autores, por el contrario, mantienen que el tejido fibroso, que de manera invariable se forma en la interfase cemento-hueso es el resultado de la respuesta biológica al cuerpo extraño que suponen los materiales implantados y que este evento biológico conduciría al aflojamiento (31, 33, 35, 36).
Jones y Hungerford (36) proponen el término de enfermedad del cemento en 1987 como la condición patológica del aflojamiento de la PTC cementada y que para ellos es consecuencia de una respuesta biológica a las propiedades mecánicas del PMMA. Para ellos, la membrana de interfase en ausencia de PMMA es diferente de la membrana en. presencia de partículas de desgaste de MMA. El fallo de las prótesis no cementadas empleadas antes de la introducción del cemento para su fijación no se asociaba con osteolisis masivas como ocurre a menudo en las PTC cementadas.
La primera publicación de osteolisis periprotésicas en implantes no cementados no aflojados(37) desafió contundentemente a esta teoría. En la actualidad, el macrófago sigue siendo la llave del fenómeno, y por tanto el análisis de la membrana de interfase de creciente interés, pero los desencadenantes se amplían y ahora hablamos de la «enfermedad de las partículas» (37-39).
Las membranas de interfase de los implantes fijos y los afectados por aflojamiento aséptico difieren de manera sensible. El tejido de los implantes aflojados es más grueso, marcadamente celular y contiene grandes cantidades de partículas (40, 41).
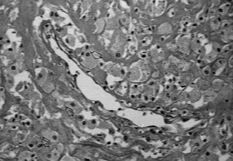
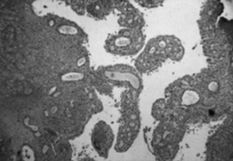
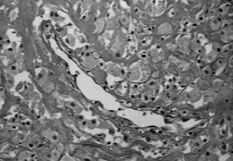
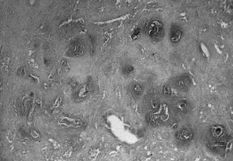
A este respecto, nosotros realizamos un estudio comparativo de la membrana de interfase de 25 muestras correspondientes a material de osteosíntesis movilizado y vástagos femorales aflojados, cementados y sin cementar, obtenidos en cirugía de revisión. El tejido fue analizado a doble ciego por dos patólogos de nuestro hospital: En los casos de placas movilizadas era evidente un tejido conjuntivo laxo con escasos histiocitos y ausencia de partículas de desgaste. La vascularización, muy variable y la celularidad nunca llamativa (Fig. 1).
Fig. 1.--Membrana de interfase de placa de osteosíntesis movilizada-hueso (100 x). Tejido conjuntivo laxo. Ausencia de partículas de desgaste. La vascularización muy variable y la celularidad nunca llamativa.
Fig. 1.--Interface between the mobilized osteosynthesis and bone (100x). Loose conjunctive tissue. Absence of wear particles. The vascularization varies and there is little cellularity.
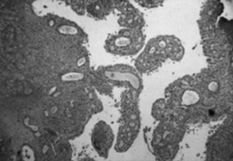
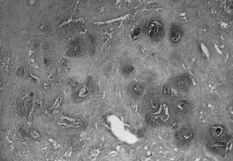
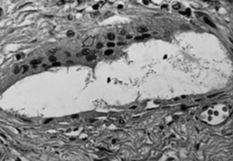
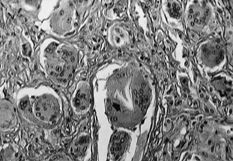
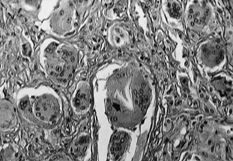
La membrana de interfase de las prótesis rescatadas respondía a un fenómeno histopatológico equivalente para los implantes cementados y no cementados, y que a veces nuestros patólogos no acertaban a distinguir, en controversia con las descripciones de Lennox (42). El análisis microscópico nos permitía distinguir tres estratos. Una primera capa de células poligonales con plegamientos y proyecciones vellosas que le dan una apariencia similar a la sinovial y que ya fue descrita por Goldring (43) (Fig. 2A). La capa intermedia es más celular y contiene macrófagos y células gigantes (Fig. 2B), áreas de fibrocartílago (Fig. 2C) y necrosis (Fig. 2D). El tercer estrato es fundamentalmente un estroma fibroso. Las partículas de PMMA, como principal hallazgo diferencial, se disuelve en el proceso de fijación y tinción. Las partículas pequeñas son difíciles de identificar y se sospechan cuando se ven los gránulos de bario pequeños y refractarios, utilizados para opacificar el cemento. Las partículas grandes de PMMA se ven como espacios claros en el tejido, delimitados por macrófagos y células gigantes y que a veces tienen gránulos de bario (Fig 3A). El «debris» del polietileno se puede reconocer como pequeñas partículas birrefringentes de localización intracelular (Fig. 3B).
ABCDFig. 2.--A: Membrana de interfase implante cementado-hueso (40 x). La capa superficial se compone de células poligonales con plegamientos y proyecciones vellosas, que le dan una apariencia similar a la sinovial. B: La capa intermedia es más celular y contiene macrófagos (flechas) y células gigantes (200 x). C: Areas de fibrocartílago en el estrato intermedio de la membrana de interfase (100 x). D: Areas de necrosis (100 x).
Fig. 2.--A: Interface between the cemented implant and bone (40x). The superficial layer consists of polygonal cells with folds and villous projections that give it a synovium-like appearance. B: The middle layer is more cellular and contains macrophages (arrows) and giant cells (200x). C: Areas of fibrocartilage in the middle layer of the interface (100x). D: Areas of necrosis (100x).
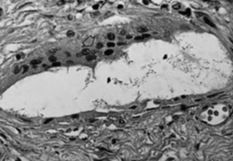
ABFig. 3.--A: Partícula de polimetilmetacrilato (400 x). Quedan disueltas en el proceso de fijación y tinción. Se identifican como espacios claros en el tejido, delimitados por macrófagos y células gigantes (flecha) y que a veces tienen gránulos de bario (flechas). B: Polietileno. Se puede reconocer como pequeñas partículas birrefringentes de locali- zación intracelular (flecha) (400 x).
Fig. 3.--A: Polymethylmethacrylate particle (400x). These particles are dissolved by fixation and staining. They are identified as clear tissue spaces delimited by macrophages and giant cells (arrow) that sometimes contain barium granules (arrows). B: Polyethylene. Recognizable as small intracellular birrefringent particles (arrows) (400x).
La ausencia de linfocitos en la membrana y la reproducción del fenómeno en ratones inmunocomprometidos descartan que el sistema inmune juega un papel importante (44).
La respuesta biológica al implante cementado parece desarrollarse a partir de la fragmentación del manto de cemento con la aparición de partículas de desgaste de PMMA. Esta teoría, corroborada por experiencias animales en las que se evidencia la biotolerancia del PMMA en bloque, y el desarrollo de una respuesta inflamatoria de cuerpo extraño ante el cemento óseo particulado (45), hace de nexo entre la tesis mecanicista y biológica del aflojamiento aséptico de la prótesis de cadera.
Estudios de cultivos celulares (43, 46, 47, 48, 49) avalan que el tejido de la interfase produce una gran variedad de mediadores bioquímicos (altos niveles de Pg E2, colagenasa, enzimas proteolíticos, LDH, interleuquina 1, interleuquina 6, TNF y gran variedad. de factores de crecimiento --factor de crecimiento plaquetario--), que no sólo estimulan la respuesta inflamatoria y fibrogénesis y se comportan como inductores de resorción ósea para explicar la osteolisis periprotésica.
Oncogenicidad
Se ha demostrado que las partículas de PMMA pueden estimular el desarrollo de tumores en roedores (50).
Aunque existe un significativo número de publicaciones vinculadas con tumores sobre implantes en perros y gatos (osteosarcomas y fibrosarcomas), los tumores relacionados con implantes en pacientes humanos son escasos y se asocian fundamentalmente con cromo, níquel y cobalto (51, 52, 53, 54).
A título anecdótico, Bell, en 1997 (55), describe un caso de sarcoma tipo histiocitoma fibroso maligno en la interfase del cemento-hueso, descubierto en la cirugía de revisión de una prótesis total de cadera.
Infección
Desde los trabajos de Gristina y Anwar (56, 57) se ha demostrado la adhesividad de S. aureus y S. epidermidis a casi todos los materiales constituyentes de los implantes ortopédicos, y también al PMMA.
Sin embargo, algunos autores postulan que el efecto citotóxico y térmico del cemento pudiera interferir en la colonización y desarrollo bacteriano (58, 59).
En esta tesis planteamos una experiencia, en la que un inóculo de S. aureus y S. epidermidis se aplicaba sobre una base de hueso liofilizado, que posteriormente se cubría con cemento CMW3 con y sin gentamicina. Las preparaciones de cemento con antibiótico recibían la suspensión de estafilococos de manera simultánea, a los cinco días y a los 10 para evaluar la duración de la liberación efectiva de la droga. Tras un período de incubación de 24 horas, se realizaba un pase en agar sangre y manitol. Los resultados de la lectura a las 24 horas mostraban un crecimiento sistemático en todas las preparaciones excepto en las de cemento con gentamicina.
En nuestro análisis, el efecto tóxico o térmico del PMMA es insuficiente para inhibir el crecimiento bacteriano; sin embargo, la liberación efectiva de gentamicina a partir del cemento óseo parece superar los 10 días.
Respuesta a distancia y sistémica
Se reconocen una serie de cambios cardiovasculares y pulmonares (hipotensión sistólica y diastólica, bradicardia y arritmias e hipoxemia) tras la inserción de las prótesis cementadas, que se han venido a llamar «síndrome por implantación del cemento» (60). Probablemente el efecto mejor conocido sea el de la hipotensión central, más constante en los vástagos que en el acetábulo y en pacientes con patología cardiocirculatoria.
Ocasionalmente se ha asociado el colapso cardiovascular o el paro cardiaco irreversible con este fenómeno (61).
Varias teorías han querido explicar estos fenómenos, incluyendo la embolización medular (62, 63) y la absorción sanguínea del monómero del cemento. De entre ellas, la más acreditada es la embólica, propuesta por Modig en 1975 (64). Keret y Reis (65) demuestran un 76 por 100 de embolias pulmonares grasas en 33 pacientes que fallecieron intraoperatoriamente durante una sustitución articular. Albúmina radioactiva colocada en el canal medular aparece en pulmón, de 10 a 120 segundos después del cementado y Lafont (66), con ecografía transesofágica, demuestra el paso de material ecogénico a aurícula y ventrículo derecho durante la inserción del vástago.
La hipotensión también se ha explicado por efecto directo del monómero. En experimentos animales, produce depresión circulatoria, vasodilatación periférica, disminución de la tensión arterial y bradicardia (67).
De estos efectos, pocos han sido confirmados en humanos. Modig, et al. (64), midieron la concentración de monómero en la arteria pulmonar y detectaron concentraciones bajas, que no diferían en la cementación del componente acetabular y el femoral. La relación entre la concentración de monómero y las caídas de tensión arterial y saturación de oxígeno era pobre.
Otros mecanismos hipotéticos son: el reflejo neurogénico, liberación de sustancias vasoactivas (histamina) y activación del complemento por el cemento y generación de trombina intravascular en los pulmones (68, 69).
El efecto vasoactivo directo y la liberación de histamina por el MMA son hipótesis interesantes. En este sentido quisimos comprobar la repercusión hemodinámica del bloqueo de los receptores de histamina H1 y H2 en la sustitución articular cementada. Realizamos un ensayo prospectivo con 45 pacientes (15 que iban a ser sometidos a PTC no cementadas, 15 cementadas con bloqueo histaminérgico y 15 cementadas sin antihistamínicos). La cementación en el grupo no tratado se acompaña de una hipotensión leve que afecta a la tensión sistólica y diastólica; sin embargo, los pacientes con bloqueo histaminérgico no sufren hipotensión en relación con la inserción del PMMA y su curva tensional se asemeja a las de las sustituciones no cementadas. A pesar de resultados contradictorios en la bibliografía (70) revisada, el hecho parece validar el papel de la histamina en el fenómeno y aconsejamos el empleo sistemático de antihistamínicos en la inducción de la anestesia para las artroplastias cementadas, dada la inocuidad de estos fármacos.
Respuesta inmune
Los individuos que trabajan con PMMA tienen varios efectos adversos: eczemas, cefaleas, dolor en extremidades, irritabilidad, pérdida de memoria, fatiga y trastornos del sueño. Wong(71) describe un caso de broncoespasmo agudo asociado al uso del cemento. Argumenta que el desencadenante al broncoespasmo pudo ser una reacción alérgica al MMA o en su defecto un efecto directo del MMA absorbido en sangre. No se conocen bien los efectos del MMA en pulmón. Hay algunos datos que sugieren que puede producir broncoconstricción. En algunos trabajadores expuestos a contacto inhalatorio se ha demostrado pequeñas y reversibles obstrucciones de la vía aérea y se ha implicado como detonante de asma ocupacional.
En un porcentaje reducido de artroplastias de cadera, el aflojamiento sucede de modo muy precoz y no puede, por tanto, ser explicado por el «debris» del polietileno. Haddad, et al. (72) estudian a 70 pacientes, 15 de ellos con aflojamiento aséptico de menos de dos años, 25 con PTC funcionantes y fijas y 25 en espera de operarse de una PTC, utilizando el «skin patch test» frente a los componentes del cemento. Encontró siete reacciones positivas a la DMPT, todas ellas en los pacientes con aflojamiento rápido. Las investigaciones sobre la incidencia de hipersensibilidad al monómero han sido limitadas. Monteny, et al. (73) describen un caso de respuesta alérgica en un paciente con una PTC derecha al implantarle la PTC izquierda. Waterman y Shrick (74) detectaron dos de 85 pacientes con alergia al MMA y propusieron la hipótesis de que la sensibilización se produjo al implantarles una PTC.
Más de cuarenta años después de que Wiltse, Hall y Stenehjem (2) declarasen la biocompatibilidad del PMMA, seguimos descubriendo nuevos y matizando los ya reconocidos efectos biológicos del cemento óseo acrílico. Sin embargo, su mérito trasciende de la mera descripción de la escasa reacción tisular, que el material produce en el conejo o el mono. Señalaron la «fragilidad» de este plástico a la tensión y el cizallamiento, y recelaron de la duración de su fijación al hueso. Precisamente estas limitaciones y no su repercusión biológica, son las que para muchos cirujanos, han desacreditado el uso del «cemento» en la fijación de implantes ortopédicos.
BIBLIOGRAFÍA
01.Judet J, Judet R. The use of an artificial femoral head for arthroplasty of the hip joint. J Bone Joint Surg 1950;32B:166-73.
02.Wiltse LL, Hall RH, Stenehjem JC. Experimental studies regarding the posible. Use of self curing acrylic in orthopaedic surgery. J Bone Joint Surg 1957;49A:961-72.
03.Maer Sven. Experimental investigation of the tissue reaction to acrylic plastics. Cinquiéme congrés international de Chirurgie orthopédique, Stockholm 1951. Bruxelles: Impremiere Lielens.
04.Haboush EJ. A new operation for arthroplaty of the hip. Bulletin of the Hospital for joint Diseases 1953;14:242.
05.Charnley J. Anchorage of the femoral head prostheses to the saft of thefemur. J Bone Joint Surg 1960;42B:28-30.
06.Charnley J. The bonding of prostheses to bone by cement. J Bone Joint Surg 1964;46-B:518-29.
07.Lautenschagler EP, Stupp BI, Keller JE. Structure and properties of acry1lic bone cement. En: Ducheyne P, Hastings GW, eds. Functional behavior of orthopedics biomaterials. Vol II. Boca Raton, FL, CRC Press; 1984.
08.Chan KH, Ahmed AM. Polymethylmethacrylate. En: Morrey BF, de Joint replacement arthroplasty. London: Churcill Livingstone; 1991. p. 23-279.
09.Buchholz HW, Engelbrecht H. Uber die depotwirkung einiger antibiotica bie Vermischung mit dem Kunztharz Palacos. Chirurgie 1970;41:511-7.
10.Schurman Dj, Trindade C, Hirschman HP. Antibiotic-acrylis bone cement composites. J Bone Joint Surg 1978;60A: 978-84.
11.Lautenschagler EP, Jacobs IJ, Marshall GW, Meyer PP. Mechanical propierties of bone cements containing large doses of antibiotics powders. J Biomed Mater Res 1976;10:929-38.
12.Holm NJ, Vejlsgaard R. The in vitro elution of gentamicin sulfate from methylmethacrylate bone cement. Acta Orthop Scand 1976;47:144-8.
13.Torholm C, Lidgren L, Lindberg , Hahlmeter G. Total hip Joint arthroplasty with gentamicin impregnated cement. Clin Orthop 1983;181:99-106.
14.Bohner M, Lemaitre J, Van Landuyt P, Zambelli PI, Merkle HP, Gander B. Gentamicin loaded hydraulic clacium phosphate bone cement as antibiotic delivery system. J Pharm Sci 1997;86(5):565-72.
15.Penner MJ, Masri BA, Duncan CP. Elution characteristics of vancomycin and tobramycin combined in acrylic bone-cement. J Arthroplasty 1996;11(8):939-44.
16.Murray WR. Use of antibiotic-containing bone cement. Clin Orthop 1984;190:89-95.
17.Espeaugh B, Engesaeter LB, Vollset SE, Havelin LI, Langeland N. Atitibiotic prophylaxis in total hip arthroplasty. Review of 10,905 primary cemented total hip replacements reported to the norwegian arthroplasty register, 1987 to 1995.
18.Katagari H, Sato K, Takahasi M, Sugiura H, Yamamura S, Iwata H. Use of Adriamycin-impregnated methylmethacrylate in the treatment of tumor metastases in the long bones. Arch Orthop Trauma Surg1997;116(6-7):329-33.
19.Goodwin CJ, Braden M, Downes S, Marshall NJ. Investigation into the release of bioactive recombinanat human growth hormone from normal and low viscosity polymethylmethacrylate bone cements. J Biomed Mater Res 1997;34(1): 7-55.
20.Vázquez B, Elvira C, Levenfeld B, Pascual B, Go-ni I, Gurruchaga M, Ginebra MP, Gil FX, Planell JA, Liso PA, Rebuelta M, San Roman J. Aplication of terliary amines with reduced toxicity to the curing process of acrylic bone cements. J Biomed Mater Res 1997;34(1):129-36.
21.Verdonschot N, Huiskes R. Cement debonding process of total hip arthroplasty stems. Clin Orthop 1997;336:297-307.
22.Flivick G. Yuan X, Ryd L, Jullusson R, Lidgren L. Effects of lamination on the strength of bone cement. Acta Orthop Scand 1997;68(1):55-8.
23.Lewis G. Properties of acrylic bone cement: state of the art review. J Biomed Mater Res 1997;38(2):155-82.
24.Burke DW, Gates El, Harris WH. Centrifugation as a method of improving tensile and fatigue properties of acrylic bone cement. J Bone Joint Surg (Am) 1984;66:1265-73.
25.Pantucek M. On the metabolic pathway of methylmethacrylate. Fed Eur Biochem Soc 1969;2:206-7.
26.Goodman SB, Schatzker J, Sumner Smith G. The effect of polymethylmethacrylate on bone: An experimental study. Arch Orthop Trauma Surg 1985 ;104:150-4.
27.Nelson DA, Barker ME, Hamlin BH. Thermal effects of acrylic cementation at bone tumour sites. Int Hypertermia 1997;13(3):287-306.
28.Stea S, Granchi D, Zolezzi C, Ciapetti G, Visentin M, Cavedagna D, Pizoferrato, A. High-performance liquid chromatography assay of N,N-dimetyl-p-toloudine released from bone cements: evidence for toxicity. Biomaterials 1997; 18(3):243-6.
29.Coleman DL, King RN, Andrade JD. The Foreing body reaction. A chronic inflamatory response. J Biomed Mater Res 1974;8:199-211.
30.Smith Petersen MN. Arthroplasty of the hip. J Bone Joint Surg 1939;21:269-88.
31.Fornasier VL, Cameron HU. The femoral stem/cement interface in total hip replacement. Clin Orthop 1976 ;116:248-56.
32.Stauffer RN. Ten year follow-up study of total hip replacement with particular reference to roentgenographic loosening of components. J Bone Joint Surg 1982 ;641A:983-90.
33.Sutherland CJ, Wilde AH, Borden LS, Marks KE. A ten year followupof one hundreed consecutive Müller curved-stem total hip replacement arthroplasties. J Bone Joint Surg 1982;64A:970-82.
34.Charnley J. Risks of total hip replacement. Br Med J 1975;4:101-9.
35.Jasty MJ, Floyd WE, Schiller AL, Goldring SR, Harris WH: Localized osteolysis in stable, non septic total hip replacement. J Bone Joint Surgery 1986;68A:912-9.
36.Jones LC, Hungerford DS. Cement disease. Clin Orthop 1987;225:192-206.
37.Maloney WJ, Jasty M, Rosenberg A, Harris WH. Bone lysis in wellfixed cemented femoral components. J Bone Joint Surg 1990;72-B:966-70.
38.Brown IW, Ring PA. Osteolytic changes in the upper femoral shaft following porous-coated hip replacement. J Bone Joint Surg 1985;67:A:218-21.
39.Mohanty M. Cellular basis for failure of joint prosthesis. Biomed Mater Eng 1996;6(3):65-72.
40.Freeman MAR, Bradley GW, Reveil PA. Observations upon the interface between bone and polymethylmethacrylate cement. J Bone Joint Surg 1975;64B:489-94.
41.Ishiguro N, Kojima T, Ito T, Saga S, Anma H, Kurokouchi K, Iwahori Y, Iwase T, Iwata H. Macrophage activation andmigration in interface tissue around loosening total hip arthroplasty components. J Biomed Mater Res 1997;35(3): 399-406.
42.Lennox DW, Schofield BH, Mc Donald DF, Riley LH. A histologic comparison of aseptic loosening of cemented, press-fit and biologic ingrowth prostheses. Clin Orthop 1987;225:171.
43.Goldring SR, Schiller AL, Roelke M, Fourke CM, O''Neill DA, Harris WH. The synovial like membrane at the bone cement interface in loose total hip replacements and its proposed role in bone lysis. J Bone Joint Surg 1983;65A:575-84.
44.Jasty M, Jiranek W, Harris WH. Acrylic fragmentation in total hip replacements and its biological consequences. Clin Orthop 1992;285:116-28.
45.Goodman SB, Fornasier VL, Kei J. The effects of bulk versus particulate polymethylmethacrylate on bone. Clin Orthop 1988;232:255-62.
46.Goldring SR, Jasty M, Roelke MS. Formation of a synovial-like membrane at the bone cement interface: Its role in bone resorption and implant loosening after total hip replacement. Arthritis Rheum1986;29:836-42.
47.Kim KJ, Rubash HE, Wilson SC. A histologic and biochemical comparison of the interface tissues in cementless and cemented hip prostheses. Clin Orthop 1993;287:142-52.
48.Dorr LD, Bloebaum R, Emmanual J. Histologic, biochemical, and ion analysis of tissue and fluids retrieved during total hip arthroplasty. Clin Orthop 1990;261:82-95.
49.Horowitz SM, Gautsch TL, Frondoza CG. Macrophage exposure topolymethylmethacrylate leads to mediator release and, injury. J Orthop Res 1991;9:406-13.
50.IARC Monographs on the evaluation of the carcinogenic risk of chemicals to human: Some monomers, plastics and synthetic elastomers and acrolein. Lyons. International agency on research in cancer. 1979. Weber PC. Epithelioid sarcoma in association with total knee replacement : A case report. J Bone Joint Surg (Br) 1986;68(5):824-6.
51.Eckstein FC, Vogel U, Mohr W. Fibrosarcoma in association with a total Knee Joint prosthesis. Virchows Archiv A Pathol Anat, 1992. 421:175-8.
52.Heath JC, Freeman MAR, Swanson SAV. Carcinogenic projections of wear particles from prosthesis made in cobalt-chromium alloy. Lancet; 1971. p. 564-6.
53.Gillespie WJ, Frampton CMA, Henderson RJ, Ryan PM. The incidence of cancer following total hip replacement. J Bone Joint Surg 1988;70B(4):539-42.
54.Visuri T, Koskenvuo M. Cancer risk after McKee-Farrar total hip replacement. Acta Orthop Scand 1989;60(supl): 231-25.
55.Bell RS, Hopyan S, Davis AM, Kandel R, Gross AE. Sarcoma of bone cerrient membrane: a case report and review of the literature. Can J Surg 1997;40(1):51-5.
56.Anwar H, Strap JL, Costerton JW. Kinetic interaction of biofilm cells of Staphylococcus, aureus with cephalexin and Tobramycin in a chemostat system. Antimicrob Agents Chemoter 1992;36:890-3.
57.Gristina A, Barth E, Webb L. Orthopaedic infection: Diagnosis and treatment. En: Gustilo, RB (De): Phyladelphia. Saunders Company; 1989. p. 3-36.
58.Lindberg L. Infection and antibiotics in relation to bone cement. In Willianis, DF (Ed) : Biocompatibility of orthopaedic implants, vol. 2. Boca Raton, CRC Press; 1982. p. 25.
59.Yamaura A, Makino H. Air bubble cavities in the methylmethacrylate plate of cranioplasty acting as site of focci for persistance infection case report. Neurol Med Chir 1979;19:35.
60.Eretth MH, Weber JG, Abel MD, Lennor RL, Lewallen DG, Ilstrup DM, Rehder K. Cemented versus noncemented total hip arthroplasty embolism, hemodinamics and intrapulmonary shunting. Mayo Clin Proc 1992;67:1066-74.
61.Patterson BM, Healy JH, Cornell CN, Shanok EN. Cardiac arrest during hip arthroplasty with a cemented long stem component. A report of seven cases. J Bone Joint Surg 1991;73A:271-7.
62.Figueira A, Núñez M, Reguelio C, Carregal A, Rey M, González G. Colapso cardiovascular tras prótesis cementada: ¿cemento óseo o embolismo masivo? Rev Esp Anestesiol Reanim 1996;43(9):339-40.
63.Fabbri G, Perin S, Coli A, Lari S. Pulmonary embolism associated with use of bone cement during hip arthroplasty. Chir Organi Mov 1996;81(4):347-9.
64.Modig J, Busch C, Olerud S, Saldeen T, Waernbaum G. Arterial hypotension and hypoxaemia during total hip replacement: The importance of thromboplastic products, fat embolism and acrylic monomers. Acta Anaesth Scandinavica 1975;19:28-43.
65.Keret, David, Reis DR. Intraoperative cardiac arrest and mortality in hipsurgery. Posible relationship to Acrylic bone cement. Orthop Rev 1980;9:51-6.
66.Lafont ND, Kalonji MK, Barre J, Guillaume C, Boogaerts JG. Clinical features and echocardiography of embolism during cemented hip arthroplasty. Cain J Anaetsh. 1997;44(2):112-7.
67.Weissman BN, Sosman JL, Braunstein EM, Dadkhahipoor H, Kandarpa K, Thornhill TS, Lowell JD, Sledge CB. Intravenous methylmethacrylate after total hip replacment. J Bone Joint Surg 1984;66A(3):443-50.
68.Dahl OE. The role of the pulmonary circulation in the regulation of coagulation and fibrinolysis in relation to major surgery. J Cardiothorac Vasc Anesth 1997;11(3):322-8.
69.Planes A, Vochelle N. Bone cement and deep-vein thrombosis. J Bone Joint Surg 1996;78(1):166.
70.Lamade WR, Friedl W, Schmid B, Meeder PJ. Bone cement implantation syndrome. A prospective randomized trial for use of antihistamine blockade. Arch Orthop Trauma Surg 1995;14:335-9.
71.Wong HY, Vidovich MI. Acute bronchospasm associated with polymetylmethacrylate cement Anesthesiology 1997;87(3):696-8.
72.Haddad FS, Cobb AG, Bentley G, Levell NJ, Dowd PM. Hipersensivity in aseptic loosening of total hip replacements. The role of constituents of bone cement. J Bone Joint Surg (Br) 1996;78(49:546-9.
73.Monteny E, Delespesse G, Screyer H, Spiette M. Methylmethacrylate hipersensivity in orthopaedic surgery. Acta Orthop Scand 1978;49:186-9.
74. Waterman AH, Schrick JJ. Allergy in hip arthroplasty. Contact dermatitis 1985;13:294-8.
Ripercussioni biologiche del cemento osseo in polimetilmetacrilato
RIASSUNTO
La popolarità della cementazione acrilica degli impianti ortopedici è da attribuire al lavoro precursore di Sir John Charnley. Jones e Hungerford propongono il termine «malattia del cemento» nel 1987 per definire condizione patologica del cedimento della protesi totale cementata dell''anca, conseguenza a loro giudizio di una reazione granulomatosa provocata da un corpo estraneo. Questo tessuto produce una grande varietà di mediatori biochimici induttori del riassorbimento osseo che spiegano l''osteolisi periprotetica.
Presentiamo uno studio comparativo delle membrane dell''interfaccia in impianti cementati e non cementati. Discutiamo l''eventuale rapporto del polimetilmetacrilato con la carcinogenesi e l''adesività dello Stafilococco aureus ed epidermidis agli impianti ortopedici. Definiamo la «sindrome da impianto di protesi cementata» e analizziamo le teorie patogenetiche, sottolineando il ruolo dell''istamina nella contribuzione al suddetto fenomeno.
L''ipersensibilità ritardata ai componenti del cemento osseo può provocare una malattia professionale e può spiegare il cedimento precoce di alcune protesi cementate.
Répercussions biologiques du ciment osseux en polyméthylméthacrylate
RÉSUMÉ
L''engouement pour la fixation acrylique des prothèses orthopédiques découle des travaux pionniers de sir John Charnley, datés de 1960. Jones et Hungerford ont proposé le terme de maladie du ciment en 1987 pour définir le relâchement pathologique d''une prothèse totale de la hanche cimentée, qui est le fait à leur avis d''une réaction granulomateuse face à un corps étranger. Ce tissu produit une grande variété de médiateurs biochimiques inducteurs d''une résorption osseuse susceptible d''expliquer l''ostéolyse périprothésique.
Les auteurs présentent une étude comparative des membranes d''interface dans le cas des prothèses cimentées et non cimentées. Ils discutent la relation éventuelle de polyméthacrylate avec la carcinogenèse et l''adhérence de S. aureus et de S. epidermidis sur les prothèses orthopédiques. Ils définissent le «syndrome de mise en place du ciment» et analysent les différentes théories pathogéniques, tout en soulignant le rôle que joue l''histamine dans le développement de ce phénomène.
Une hypersensibilité retardée aux composants du ciment osseux est susceptible de provoquer une maladie professionnelle et d''expliquer le relâchement précoce d''un certain nombre de prothèses cimentées.
Biologische Auswirkungen bei Knochenzement aus Polymethylmetaacrylat
ZUSAMMENFASSUNG
Die Popularität, orthopädische Transplantate mit Acryl zu befestigen, schreibt man der Pionierarbeit Sir John Charnleys aus dem Jahre 1960 zu. Jones und Hungerford schlagen 1987 Zement als Krankheitsbegriff vor, als pathologische Voraussetzung der Lockerung der Hüftvollprothese und der daraus folgenden Konsequenz einer körnigen Fremdkörperreaktion. Dieses Gewebe produziert eine große Anzahl von biochemischen Mittlerstoffen, welche eine Knochenresorption auslösen; dies, um die periprothesische Knochengewebsauflösung zu erklären
Wir stellen eine vergleichende Studie von Membranen in der Zwischenphase bei zementierten und nichtzementierten Implantaten vor. Wir diskutieren die eventuell bestehende Beziehung zwischen Polymethylmetaacrylat und der Krebsentstehung sowie die Haftfähigkeit des s. aureus und der Epidermis an den orthopädischen Implantaten. Wir definieren das «Syndrom durch die Implantation von Zement» und wir analysieren die pathogenen Theorien, wobei die Rolle von Histaminen beim Auftreten dieses Phänomenes unterstrichen wird.
Die verzögerte Hypersensibilität in bezug auf Knochenzementkomponenten kann eine Berufskrankheit hervorrufen und erklärt die vorzeitige Lockerung von einigen Zementprothesen.