Estudiar el perfil de las pacientes con cáncer de mama y mutación BRCA1 o BRCA2.
Material y métodosSe realizó un estudio retrospectivo entre 2010 y 2016 de 28 pacientes con cáncer de mama, que presentó mutación BRCA1 o BRCA2. Se excluyeron aquellos resultados considerados negativos, no informativos o variantes de significado incierto. Se diseñó una base de datos para recogida de los mismos al presentarse en el comité de tumores del Servicio de Ginecología. Se analizaron diferentes variables epidemiológicas, del tumor, del tratamiento, seguimiento y de medidas preventivas. Se han valorado también los diferentes subtipos moleculares basándose en los marcadores inmunohistoquímicos.
ResultadosSe estudió a 28 pacientes, 11 BRCA1, 17 BRCA2. Se clasificaron en los diferentes subtipos (11 luminal B, 9 triple negativo [TN], 7 luminal A, 1 HER2). La edad media ± desviación estándar al diagnóstico fue de 41,50±2,26 (24-65) años, con una mediana de 38,50 años. Las cirugías reductoras de riesgo fueron solicitadas en 22 (78,57%) pacientes; en 10 (35,71%) casos optaron por cirugía de la mama contralateral mediante mastectomía profiláctica, en 5 (17,85%) casos solo demandaron cirugía profiláctica de los ovarios, realizándose mediante laparoscopia salpingooforectomía bilateral y en las restantes 7 (25%) se realizaron ambas técnicas.
ConclusiónLas mutaciones BRCA representan un bajo pero importante número dentro de los cánceres de mama por su alta penetrancia. Los subtipos más frecuentemente asociados a dichas mutaciones han sido los clasificados como luminal B en primer lugar, seguidos de TN. La realización de cirugías reductoras de riesgo ha sido demandada por un elevado porcentaje de nuestras pacientes.
to study patients with breast cancer and BRCA 1 and / or 2 mutations.
Material and methodsWe performed a retrospective study of 28 patients with breast cancer and BRCA 1 and/or 2 mutations between 2010 and 2016. Patients were excluded if their results were negative, non-informative or variants of uncertain significance. A database was designed to gather information on patients appearing in the Tumour Committee of the Gynaecology Service. Distinct epidemiological variables, tumour characteristics, treatment and preventive measures were analysed. The different molecular subtypes were also evaluated, based on immunohistochemical biomarkers.
ResultsWe studied 28 patients, 11 with BRCA1 and 17 with BRCA2. Tumours were classified into subtypes (11 luminal B, 9 triple negative (TN), 7 luminal A, 1 HER2). The mean age at diagnosis was 41.50+2.26 (24-65) years, with a median age of 38.50 years. Risk-reducing surgeries were requested in 22 (78.57%) patients: 10 patients (35.71%) opted for prophylactic contralateral mastectomy, 5 patients (17.85%) required prophylactic ovarian surgery performed through bilateral salpingo-oophorectomy by laparoscopy, and in the remaining 7 (25%) both techniques were performed.
ConclusionBRCA mutations represent a small but important number of tumours within breast cancers because of their high penetrance. The subtypes most frequently associated with these mutations were firstly luminal B followed by TN. Risk-reducing surgery was requested by a high percentage of our patients.
El cáncer de mama es el tumor más frecuente en las mujeres occidentales. En España se diagnostican alrededor de 25.000 nuevos cánceres de mama y se estima que una de cada 8 mujeres tendrá cáncer de mama a lo largo de su vida. Así mismo, es la primera causa de fallecimiento por cáncer en la mujer1,2.
Se considera en la actualidad una entidad multifactorial, donde herencia, ambiente y hábitos de vida interaccionan sobre individuos con grados variables de susceptibilidad3,4. La mayoría, en torno al 70%, son esporádicos, el 15-20% corresponden a casos de agregación familiar y un 5-10% de todos los cánceres de mama son hereditarios2,3. Las mutaciones responsables de los síndromes de cáncer hereditarios son denominadas «germinales». Se encuentran en el individuo desde el momento de su concepción y pueden ser identificadas en personas sin cáncer a partir de un análisis de sangre en la mayoría de los casos. Dentro de ellas las mutaciones de los genes BRCA1 y BRCA2, aunque poco frecuentes, son consideradas de alta penetrancia y aumentan el riesgo de presentar, entre otros, cáncer de mama (el riesgo en la mujer portadora para desarrollar cáncer de mama se estima hasta del 65% en BRCA1 y el 45% para BRCA2, y el riesgo de presentar cáncer de ovario es del 39% en portadoras del BRCA1 y hasta del 11% en portadoras del BRCA2)2. Se estima que la tasa de portadores de dichas mutaciones en la población general es en torno al 0,1-0,2%, elevándose esta cifra hasta 5-7% cuando valoramos a pacientes que han presentado cáncer de mama2,3.
En el momento actual, existen unidades de consejo genético que, basándose en la información de antecedentes familiares, personales y utilizando modelos de cálculo empírico de riesgo caracterizan a los individuos/familia en un riesgo determinado4. A aquellos que presentan una susceptibilidad considerada de riesgo alto se les ofrece la determinación de estudios moleculares. Los resultados deben ser valorados en un equipo multidisciplinar que explique a las pacientes con mutación las posibles estrategias, desde la vigilancia estricta con pruebas radiológicas hasta las cirugías de reducción de riesgo o a la fármaco prevención4.
El objetivo de nuestro trabajo fue analizar el perfil de las pacientes que, tras el diagnóstico de cáncer de mama, realizaron estudio genético, siendo este positivo para la mutación BRCA1 o BRCA2. Valorar sus particularidades epidemiológicas, características del tumor, los diferentes subtipos moleculares del cáncer de mama5, tratamientos realizados, medidas preventivas (seguimientos estrictos, cirugías reductoras de riesgo tras diagnóstico de la mutación BRCA) y, por último, hemos querido estudiar la supervivencia intentando valorar las eventuales diferencias entre los diferentes subtipos.
Material y métodosEntre enero del 2010 y diciembre del 2016 se diagnosticó a 993 pacientes con cáncer de mama en nuestra área. Hemos realizado un estudio descriptivo retrospectivo de las 28 pacientes con estudio genético positivo para mutación BRCA1 o BRCA2 en dicho periodo. Los casos fueron presentados en nuestro comité de tumores y recogidos en una base de datos.
Las pacientes fueron consideradas de alto riesgo y remitidas a estudio genético, cuando cumplían los siguientes criterios:
- 1.
Tres cánceres de mama o 2 de mama y uno de ovario.
- 2.
Dos cánceres de mama:
- a.
En 1.er grado si ambos se diagnostican entre 51-60 años.
- b.
En 1.er grado si uno antes de los 50 años.
- c.
En 1.er grado si uno de ellos bilateral.
- 3.
Un cáncer de mama:
- a.
Un cáncer de mama antes de los 40 años.
- b.
Uno de mama menor de 50 años y otro de ovario en familiar 1.er grado.
- c.
Uno de mama en varón+un caso mama/ovario.
- 4.
Dos cánceres de ovario.
Aquellas cuyas características impliquen una sospecha de aumento de la susceptibilidad (edad temprana, bilateralidad, triple negativas [TN]) se derivaron a la unidad de Consejo Genético.
En nuestro centro, las solicitudes de las determinaciones moleculares de DNA para el diagnóstico de la eventual mutación se canalizan a través del Servicio de Genética y se tramitan en un laboratorio externo. Las mutaciones fueron clasificadas en negativas, positivas, no informativas o de significado incierto. Solo hemos considerado en este trabajo las positivas para mutación BRCA1 o BRCA2, ya que las variantes de significado incierto o los resultados no informativos no definen claramente el riesgo y este debe estimarse por la historia familiar.
Desde el 2016 se realiza un protocolo rápido para inclusión a pacientes que incluye las tipo TN, los cánceres de mama bilaterales en paciente menor a 40 años, las pacientes jóvenes (< 35 años) y las recidivas de cáncer de ovario sensible a platino cuyos resultados se obtienen en unas semanas (los resultados por vía no preferente precisan hasta 6 meses), permitiendo en los casos indicados un cambio de estrategia de tratamiento.
Se estudiaron diferentes variables, agrupadas en datos epidemiológicos (edad al diagnóstico, antecedentes personales, antecedentes familiares, paridad, lactancia, menopausia); de diagnóstico (estudio IHQ, localización del tumor, tamaño, tipo y características histológicas del mismo, número de ganglios y afectación de los mismos); de tratamiento (tipo de cirugía, terapia adyuvante y neoadyuvante); medidas preventivas (cirugías reductoras de riesgo encaminadas a reducir riesgo de nuevos cánceres o recaídas), y de evolución (meses de seguimiento, recidiva y fallecimientos debidos al cáncer).
Respecto al análisis estadístico, en primer lugar se realizó estudio descriptivo: se estudiaron las variables cualitativas mediante cálculo de frecuencias absolutas y relativas. En las variables cuantitativas se calcularon las medidas de tendencia central (media, mediana y moda), así como de dispersión (desviación típica, varianza y recorrido intercuartílico). Se han estudiado y comparado las diferentes variables a través de contrastes. El análisis de supervivencia ha sido estudiado mediante el estimador de Kaplan-Meier. La significación estadística fue definida para p<0,05.
ResultadosHemos estudiado a 28 pacientes con cáncer de mama, presentadas en el comité de tumores entre 2010 y 2016 con mutación para BRCA1 o BRCA2.
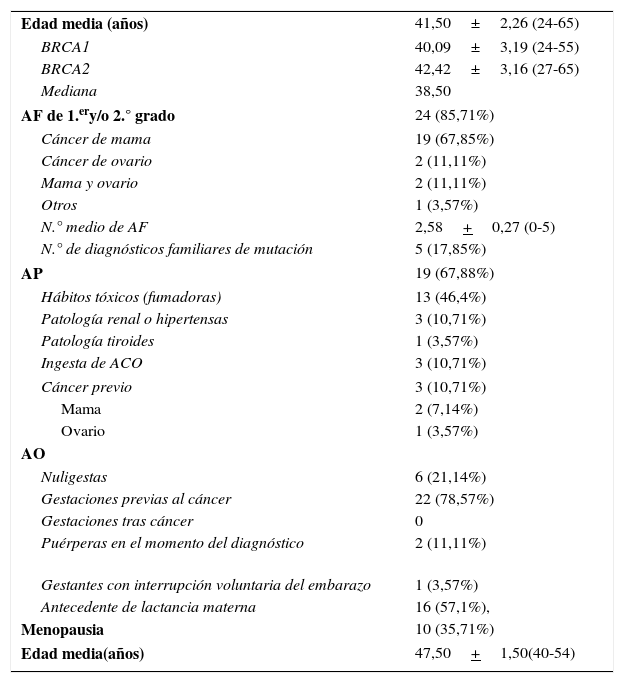
Datos epidemiológicosSe muestran en la tabla 1.
Datos epidemiológicos
| Edad media (años) | 41,50±2,26 (24-65) |
| BRCA1 | 40,09±3,19 (24-55) |
| BRCA2 | 42,42±3,16 (27-65) |
| Mediana | 38,50 |
| AF de 1.ery/o 2.° grado | 24 (85,71%) |
| Cáncer de mama | 19 (67,85%) |
| Cáncer de ovario | 2 (11,11%) |
| Mama y ovario | 2 (11,11%) |
| Otros | 1 (3,57%) |
| N.° medio de AF | 2,58+0,27 (0-5) |
| N.° de diagnósticos familiares de mutación | 5 (17,85%) |
| AP | 19 (67,88%) |
| Hábitos tóxicos (fumadoras) | 13 (46,4%) |
| Patología renal o hipertensas | 3 (10,71%) |
| Patología tiroides | 1 (3,57%) |
| Ingesta de ACO | 3 (10,71%) |
| Cáncer previo | 3 (10,71%) |
| Mama | 2 (7,14%) |
| Ovario | 1 (3,57%) |
| AO | |
| Nuligestas | 6 (21,14%) |
| Gestaciones previas al cáncer | 22 (78,57%) |
| Gestaciones tras cáncer | 0 |
| Puérperas en el momento del diagnóstico | 2 (11,11%) |
| Gestantes con interrupción voluntaria del embarazo | 1 (3,57%) |
| Antecedente de lactancia materna | 16 (57,1%), |
| Menopausia | 10 (35,71%) |
| Edad media(años) | 47,50+1,50(40-54) |
ACO: anticonceptivos orales; AF: antecedentes familiares; AO: antecedentes obstétricos; AP: antecedentes personales.
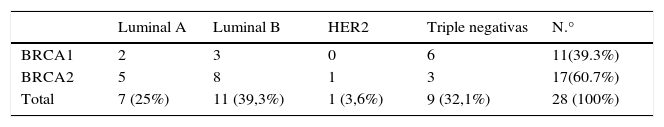
Tipos IHQ: se presentan en la tabla 2.
Localización: bilaterales en 5 (17.85%), localizados en mama derecha 9 (32,14%) y en la izquierda 14 (50%). Se describieron cánceres multicéntricos en 5 (17,85%) pacientes.
El tipo histológico fue, en orden de frecuencia: 21 (75%) ductal infiltrante, 4 (14,28%) lobulillar infiltrante, uno (3,57%) carcinoma ductal in situ, uno indiferenciado y uno inflamatorio.
Los grados de diferenciación fueron, de menor a mayor indiferenciación: 4G1 (14,28%), 18 G2 (64,28%) y 6 G3 (21,42%).
El tamaño del tumor en milímetros (mm): 33,91+6,04 (5-105).
Las pacientes con BRCA1 presentaron tumores mayores al diagnóstico, sin llegar a alcanzar significación estadística (p=0,095). BRCA1 47,75+12,14 (12-105) mm y BRCA2 26,53+6,13 (5-100) mm.
Ganglios axilaresNúmero de ganglios obtenido fue: 10,19+1,11 (2-19).
Número de ganglios positivos: 1,52+0,72 (1-12).
Número de pacientes con metástasis axilares (aquellas con diagnóstico prequirúrgico de afectación axilar positiva mediante punción-aspiración con aguja fina o con ganglio centinela positivo): 19 pacientes (67,85%).
Datos de tratamientoSe muestran en la tabla 3.
Tipos de cirugías realizadas
| No cirugía (estadio IV inicial) | 2 (11,11%) |
| Cirugía conservadora inicial | 9 (32,14%) |
| Mastectomía tras BRCA con cirugía inicial conservadora | 4 (14,28%) |
| Mastectomía inicial | 17 (60,71%) |
| Reconstrucción inmediata | 4 (14,28%) |
| Expansor | 3 (10,71%) |
| Prótesis | 1 (3,57%) |
| Reconstrucción diferida | 7 (25%) |
| Expansor | 3 (10,71%) |
| Colgajo perforante epigástrica inferior profunda | 1 (3,57%) |
| Colgajo dorsal ancho | 3 (10,71%) |
| Sin reconstrucción | 10 (8,92%) |
| BSGC | 10 |
| Negativos | 9 |
| Positivos | 1 |
| LA | 18 |
| BSGC+LA | 1 |
BSGC: biopsia selectiva del ganglio centinela; LA: linfadenectomía axilar.
Los tratamientos indicados tras la cirugía fueron: radioterapia en 17 (60,71%), hormonoterapia en 15 (53,57%) y quimioterapia en 9 (32.14%).
Las 2(7,14%) pacientes que iniciaron en estadios avanzados (metastásicas al diagnóstico) solo recibieron quimioterapia.
Se indicó tratamiento neoadyuvante previo a la cirugía (con quimioterapia) en 10 (35,71%) pacientes.
Cirugías reductoras de riesgo tras diagnóstico de BRCALas cirugías reductoras de riesgo fueron solicitadas en 22 (78,57%) pacientes; en 10 (35,71%) casos optaron por cirugía de la mama contralateral mediante mastectomía profiláctica, en 5 (17,85%) casos solo demandaron cirugía profiláctica de los ovarios (realizándose mediante laparoscopia salpingooforectomía bilateral (SOB) y en las restantes 7 (25%) se realizaron ambas técnicas.
Cuatro (14,28%) pacientes optaron por no realizar ninguna cirugía profiláctica y solicitaron seguimiento.
Se realizaron 2 (7,14%) castraciones quirúrgicas (SOB) en estadios avanzados.
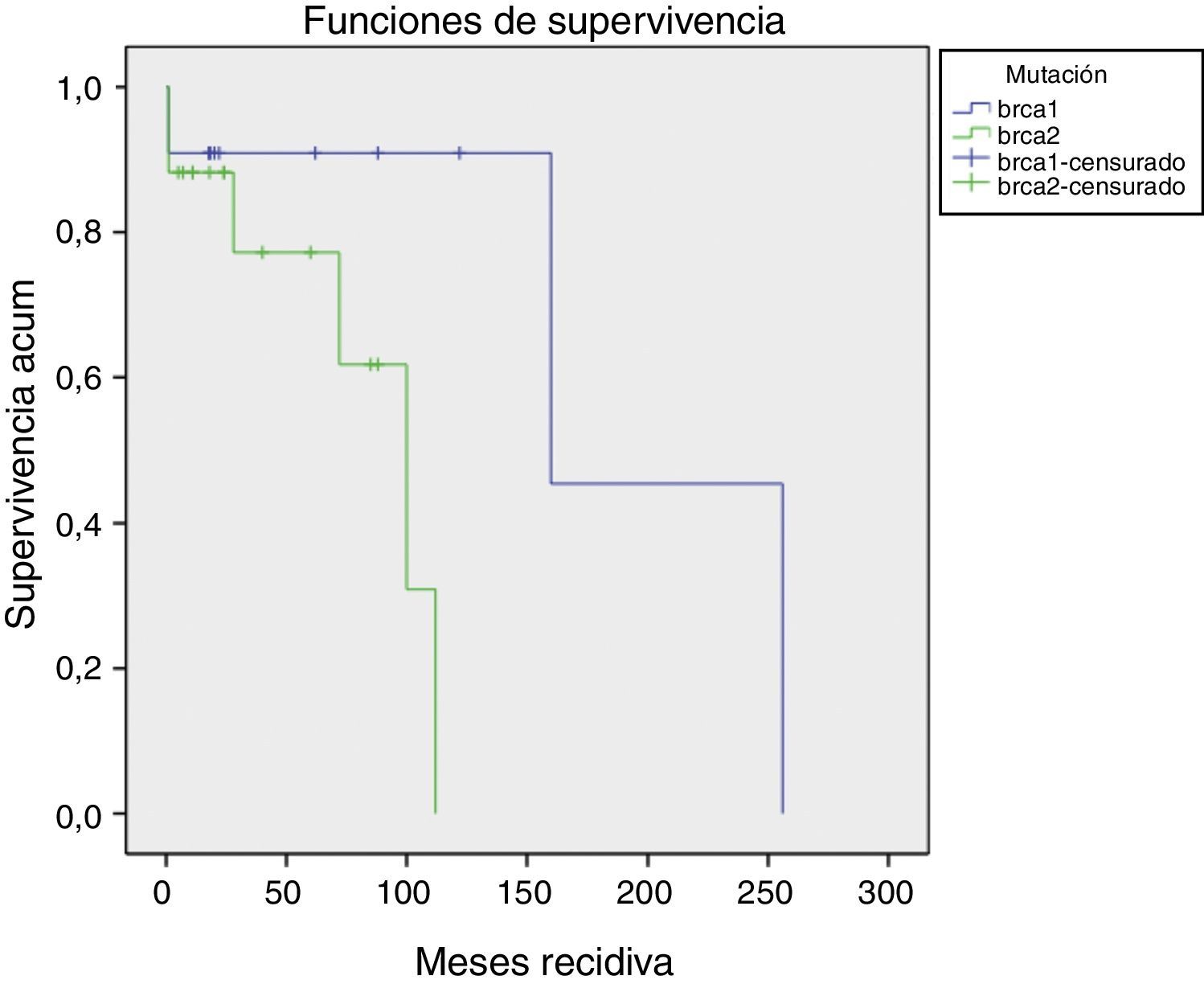
Seguimiento y supervivenciaLa media de seguimiento fue de 63,46±12,24 (5-288) meses:
- –
BRCA1 76,27±26,34(13-288) meses.
- –
BRCA2 55,18±11,19(5-144) meses.
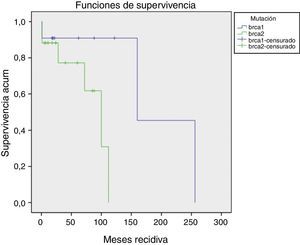
La aparición de recidivas/nuevos cánceres o metástasis ocurrió 52,57±11,64 (1-256) meses. No han existido diferencias (p=0,57) en el tiempo de aparición de recidivas. Las BRCA1 han presentado un periodo más largo de seguimiento (fig. 1).
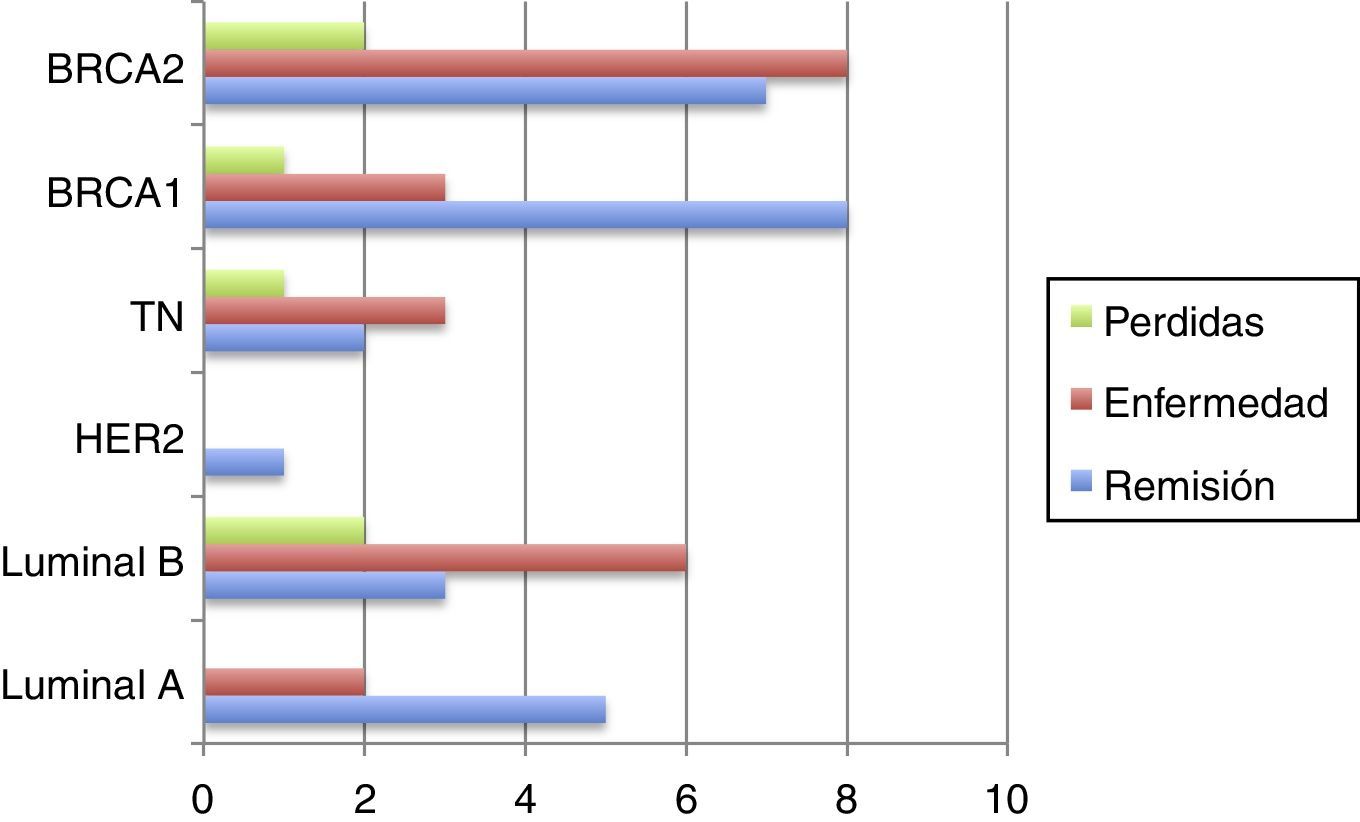
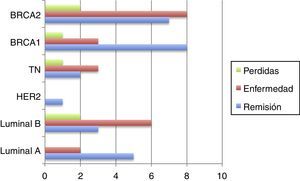
Tipos de recidivasHan existido 4 (14,22%) casos de recidivas en la mama homolateral; 2 (7,14%) casos que han desarrollado metástasis y fallecimientos (los estadios iv iniciales); 4 (14,22%) casos con nuevos cánceres (2 mama contralateral, uno renal, uno de ovario); 3 (10,71%) pacientes han dejado de realizar seguimiento (sin recidiva en última revisión).
El resto (15 [53,57%]) de las pacientes permanecen en remisión (fig. 2).
DiscusiónLa posibilidad de conocer de manera precoz la existencia de una eventual mutación en la población permite seleccionar a aquellas personas de riesgo elevado y ofertar las diferentes medidas preventivas tales como seguimiento estricto, toma de medidas profilácticas, como cirugías reductoras de riesgo, o a la posibilidad de realizar fármaco prevención. En las pacientes con un cáncer de mama, el conocimiento de la mutación BRCA permite también aconsejar sobre las posibles cirugías reductoras de riesgo para evitar nuevos cánceres.
En nuestro trabajo, observamos un perfil de pacientes de alto riesgo; mujeres jóvenes, con frecuentes antecedentes de exposición a tóxicos como tabaco, con tumores no siempre pequeños, con subtipos asociados a peor pronóstico (luminal B, TN), con importante tasa de agregación familiar, con afectación axilar en el momento del diagnóstico alta, y con una cifra no despreciable de recidivas o nuevos tumores.
La edad de aparición de los cánceres es temprana, siendo en nuestro trabajo algo menor en las pacientes BRCA1, coincidiendo con lo publicado en la literatura2,3. El estado menopáusico fue descrito en pocas pacientes.
La paridad y lactancia materna son factores protectores históricamente6-10 del cáncer de mama. En nuestra serie, hemos observado que la mayoría de las pacientes habían tenido alguna gestación y optado por la lactancia.
Los antecedentes familiares son comunes en muchas pacientes y en nuestro trabajo esta asociación fue también alta. Coincidimos con las guías clínicas y diferentes autores10-16 que la existencia de varios antecedentes familiares de cáncer de mama con edad menor a 50 años en el momento del diagnóstico es uno de los factores determinantes para la realización de test genéticos.
Respecto a los datos histológicos, siguen la tendencia de la población con cáncer de mama sin mutación BRCA. El tamaño ha sido algo mayor para los BRCA1, sin llegar a obtener significación tampoco en el número de ganglios ni en la afectación de los mismos.
Las mutaciones BRCA1 suelen darse en gente más joven y con un perfil de tumor más agresivo10. Se suelen asociar al subtipo TN. Parece que son algo más frecuentes que las BRCA2. Las pacientes con mutación BRCA2 presentan tumores que suelen aparecer a edades un poco más mayores, con receptores positivos y sensibles a hormonoterapia, y tienen una prevalencia algo menor que las BRCA1. En nuestro estudio la mutación BRCA2ha sido encontrada en un mayor número de pacientes, aunque el número de casos es pequeño este dato no coincide con lo referido por otros autores2,3,10.
Respecto a los diferentes subtipos, el luminal B ha sido descrito en un mayor número de casos, seguido de los TN. La tendencia descrita por otros autores17,18 de asociación de TN a BRCA1 la observamos sin hallar diferencias significativas.
La necesidad de tratamientos adyuvantes ha sido elevada, la administración de quimioterapia prequirúrgica es una opción19 que va en ascenso en esta población de pacientes jóvenes con perfiles IHQ en muchos casos de baja respuesta a la hormonoterapia.
Coincidimos con otros autores20,21 en la asociación de cáncer de mama previo, mutación BRCA y desarrollo de cáncer de mama contralateral. La tasa de recidivas y de nuevos tumores ha sido alta en la población estudiada con BRCA+.
Las medidas preventivas21-28 encaminadas a evitar nuevos tumores abarcan seguimiento estricto (para un diagnóstico precoz de eventuales nuevas neoplasias), la cirugía sobre ovarios y trompas, y la hormonoterapia en los casos con RH+. En nuestra experiencia, las pacientes con cáncer de mama, al conocer la mutación BRCA, solicitan cirugías radicales en la mama afectada y profilácticas contralaterales en un elevado porcentaje. También ha ocurrido así en el caso de cirugía reductora de riesgo de cáncer de ovario. Los casos que solo solicitaron seguimiento han correspondido con un perfil de pacientes con diagnóstico de mutación más tardío y que son algo más mayores y han presentado buena evolución de sus cánceres.
Aunque el manejo quirúrgico27-29 no difiere de los cánceres esporádicos, la posibilidad de mastectomía en pacientes con cáncer de mama y mutación BRCA es una opción válida28,30,31. Debe individualizarse y ofertarse a la paciente siempre que se pueda junto con la reconstrucción inmediata (RI) para evitar un mayor impacto psicológico que suele tener la toma de estas decisiones. Para ello, es importante tener el resultado de la eventual mutación en un tiempo que permita el cambio de opción quirúrgica (de conservadora a mastectomía) si así lo requiere y evitar radiaciones innecesarias. Si no se puede realizarse la RI, se debe valorar la reconstrucción diferida aprovechando la realización de otras cirugías reductoras de riesgo, como la anexectomía bilateral.
La cirugía profiláctica contralateral de mama no parece aumentar la supervivencia23,24 de estas pacientes, pero sí la disminución de dichos tumores.
El tratamiento con tamoxifeno o inhibidores de la aromatasa (posmenopáusicas) ha sido también estudiado por diferentes autores26,27, mejorando la supervivencia con el empleo de estos. En nuestro medio, fue indicado en aquellas pacientes con RH+susceptibles de respuesta al tratamiento hormonoterápico.
Las recomendaciones de modificación de hábitos y estilo de vida deben también considerarse32-35 como factores que pueden influir en la mejora del pronóstico de estas pacientes.
El seguimiento en estas pacientes debe ser estricto33 para evitar la aparición de los denominados cáncer de intervalo, en muchos casos se alterna mamografías y ecografías anuales con resonancia magnética a intervalos de 6 meses. La supervivencia de dichas pacientes suele asociarse a la edad precoz de aparición del primer cáncer, el desarrollo de nuevos tumores y la afectación axilar de inicio, así como la respuesta a la quimioterapia.
El impacto psicológico del cáncer cuando se tienen varios familiares afectados parece influir en la toma de estas decisiones36,37 no ha sido objeto de nuestro estudio pero pensamos que el número y la cercanía de familiares afectados tienen importancia en la actitud de las pacientes a la hora de decidir tratamientos más radicales.
Aunque nuestro trabajo es limitado por su pequeño número de pacientes, y por ser un estudio retrospectivo, consideramos que los datos obtenidos son útiles y se corresponden con la bibliografía actual. En espera de publicaciones prospectivas que aporten más información sobre este tema, ofertar cirugías no conservadoras y de reducción de riesgo en estas pacientes parece la opción más adecuada.
Concluimos que las mutaciones BRCA representan una cifra baja pero importante en pacientes con cáncer de mama. Se aconseja individualizar y solicitar estudio genético siguiendo los criterios ya expuestos. El manejo de estas pacientes consideradas de alto riesgo de recaída y de desarrollo de nuevos cánceres debe realizarse a través de unidades multidisciplinares. Los subtipos más frecuentemente asociados a las mutaciones BRCA han sido luminal B seguidos de los TN.
Las cirugías reductoras de riesgo han sido demandadas por un elevado porcentaje de nuestras pacientes; el impacto en la supervivencia no ha sido probado pero consideramos que disminuyen la aparición de nuevos tumores y seguramente podrían mejorar el pronóstico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.