REV. SENOLOGÍA Y PATOL. MAM., 12, 1 (12-18), 1999
ORIGINALES
Utilidad del CA 15.3 como factor pronóstico independiente en el cáncer de mama
Utility of CA 15,3 as a independent prognostic factor in breast cancer
F. Arnanz, P. Valenzuela, J. M. Rodríguez, C. Sánchez, M. Alonso, J. Cortés
Servicio de Ginecología y Obstetricia.
Hospital Universitario Príncipe de Asturias.
Alcalá de Henares (Madrid).
Correspondencia:
F. Arnanz.
Servicio de Obstetricia y Ginecología.
Hospital Universitario Príncipe de Asturias.
Carretera a Meco, s/n.
Alcalá de Henares (Madrid).
SUMMARY
Introduction: The aim of our study was to investigate the utility of the pre-treatment measurement of CA 15,3 as a prognostic factor in breast cancer.
Material and methods: We reviewed retrospectively the clinical records of 125 patients with breast cancer in which a pre-treatment determination of CA 15,3 was available. The probability of disease-free survival and absolute survival was calculated by the Kaplan-Meier method and the differences between groups with the log-rank test. The association of a pre-treatment CA 15,3 > 20 U/ml with classic prognostic factors such as tumoral size, lymph node status and hormonal status was calculated with the Fisher''s exact test.
Results: A pre-treatment CA 15,3 > 20 U/ml is associated with shorter disease-free survival (p = 0.000005) and absolute survival (p = 0.0205) periods. A pre-treatment CA 15,3 > 20 U/ml did not correlate with tumoral size (p = 0.328), with positive axillary lymph nodes (p = 0.085), or with a poor histologic differentiation (p = 0.208). A pre-treatment CA 15,3 > 20 U/ml correlated with lymphatic-vascular infiltration (p = 0.022), with the lack of estrogen receptor (p = 0.032) and with disseminated disease previous to treatment (p = 0.00018). Excluding from the analysis those women with disseminated disease prior to treatment, a pre-treatment CA 15,3 > 20 U/ml reduced disease-free survival (p = 0.014) but did not reduce the absolute survival (p = 0.158).
Conclusions: Our data suggest that pre-treatment measurement CA 15,3 could have prognostic implications in breast cancer.
Palabras clave
Cáncer de mama, CA 15.3, Factor pronóstico.
Key words
Breast cancer, CA 15,3, Prognostic factor.
INTRODUCCIÓN
La identificación de factores de mal pronóstico en el cáncer de mama es fundamental para la delimitación de subgrupos de pacientes subsidiarios de un tratamiento más agresivo que prolongue la supervivencia de las enfermas. Un indicador pronóstico ideal en el cáncer de mama debería ser la expresión de un fenómeno biológico relacionado con el crecimiento tumoral, con la invasión tumoral de tejidos circundantes y con el desarrollo de metástasis, ser sensible, sencillo de determinar y reproductible, ser altamente predictivo del pronóstico, ser independiente de otros factores pronósticos clinicopatológicos ya conocidos, ser de fácil interpretación, demostrarse en estudios prospectivos que mejora la supervivencia absoluta cuando se utiliza para seleccionar un subgrupo de pacientes que recibirán una terapia concreta y ser reproducidos estos hallazgos en estudios múltiples, desarrollados en diferentes centros y sobre diferentes bases de pacientes. El CA 15.3 es un carbohidrato asociado a tumor que se desprende de las células tumorales y puede ser detectado en la circulación periférica..1 Es utilizado rutinariamente como un indicador de masa tumoral y aparece elevado en aproximadamente un 65% de las pacientes con cáncer de mama metastásico. Se desconoce su utilidad como factor pronóstico, aunque recientemente se ha sugerido que posee valor predictivo de respuesta a quimioterapia a 3 y 6 meses de seguimiento tras su determinación..2
El propósito de este estudio es investigar si la determinación pretratamiento del antígeno tumoral CA 15.3 puede proporcionar información pronóstica en pacientes diagnosticadas de cáncer de mama.
PACIENTES Y MÉTODOS
Se estudiaron retrospectivamente los historiales clínicos de 160 mujeres diagnosticadas consecutivamente de cáncer de mama en nuestro Servicio. En 125 mujeres se disponía de una determinación basal de CA 15.3 y fueron reclutadas para el estudio.
La concentración de CA 15.3 se midió mediante radioinmunoanálisis y se consideraron como pacientes CA 15.3 positivas aquellas que presentaban unos niveles pretratamiento superiores a 20 unidades/ml.
Asimismo se determinaron de forma rutinaria los indicadores pronósticos clásicos como el tamaño tumoral, el estado de los ganglios linfáticos axilares, el tipo histológico, el grado de diferenciación, la presencia de infiltración linfaticovascular y el estado de los receptores hormonales.
Las pacientes fueron seguidas según un protocolo preestablecido que contemplaba al menos una visita cada 6 meses durante las cuales se realizaban una anamnesis y exploración física completa, determinación de series hemáticas, velocidad de sedimentación globular, así como una bioquímica sérica que incluía fosfatasa alcalina, GGT, ALT y AST. Se recogieron el tiempo libre de enfermedad y la supervivencia absoluta de cada paciente.
Se calculó la probabilidad de supervivencia libre de enfermedad y absoluta para los grupos con CA 15.3 pretratamiento positivo y negativo mediante la prueba de Kaplan y Meier. La significación estadística de las diferencias entre grupos se determinó mediante la prueba log-rank. Para la comparación de proporciones en variables cualitativas se utilizó la prueba exacta de Fisher. Se consideró estadísticamente significativa una p igual o menor a 0,05.
RESULTADOS
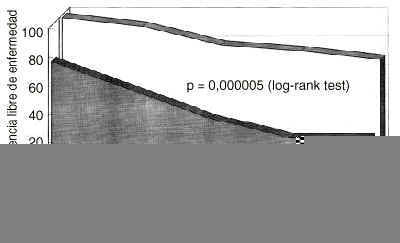
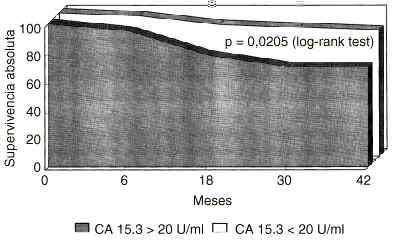
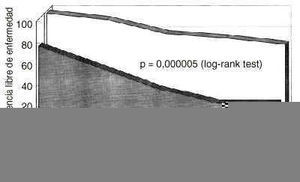
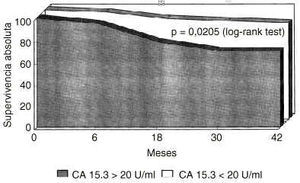
Sobre un total de 125 pacientes, la determinación pretratamiento de CA 15.3 mostró unos niveles superiores a 20 U/ml en 45 pacientes e iguales o inferiores a 20 U/ml en 80 mujeres. Se calculó la probabilidad de supervivencia libre de enfermedad en las mujeres con CA 15.3 basal positivo en comparación al grupo CA 15.3 negativo (Fig. 1). Un CA 15.3 basal elevado determinaba una supervivencia libre de enfermedad significativamente reducida con una p = 0,000005. La presencia de CA 15.3 también ensombrecía el pronóstico de las pacientes cuando era la supervivencia absoluta la variable de desenlace utilizada (Fig. 2), con una p = 0,0205.
Fig. 1. Probabilidad de supervivencia libre de enfermedad en mujeres diagnosticadas de cáncer de mama segregadas según la positividad basal del antígeno CA 15.3. La presencia de CA 15.3 determina una supervivencia libre de enfermedad significativamente reducida (p = 0,000005, log rank test).
Fig. 2. Probabilidad de supervivencia absoluta en mujeres diagnosticadas de cáncer de mama segregadas según la positividad basal del antígeno CA 15.3. La presencia de CA 15.3 determina una supervivencia absoluta significativamente reducida (p = 0,0205, log rank test).
Para estudiar la posibilidad de que CA 15.3 fuera un indicador de riesgo dependiente, asociado a un factor pronóstico clásico, se calculó la correlación de la positividad basal de CA 15.3 con los demás factores pronósticos estudiados. Un CA 15.3 basal elevado no mostraba correlación con el tamaño tumoral (p = 0,328) ni con la positividad de los ganglios linfáticos axilares (p = 0,085) ni con una pobre diferenciación histológica del tumor (p = 0,208). Una positividad basal de CA 15.3 correlacionaba débilmente con la presencia de infiltración linfaticovascular (p = 0,022) y con la ausencia de receptor estrogénico (p = 0,032). Como era previsible, la positividad basal de CA 15.3 se correlacionaba fuertemente (p = 0,00018) con la presencia de enfermedad diseminada inicial.
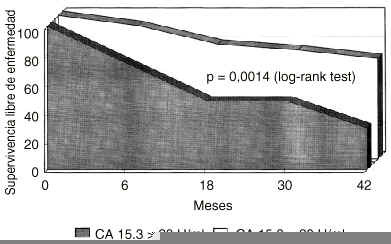
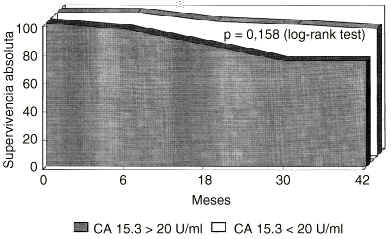
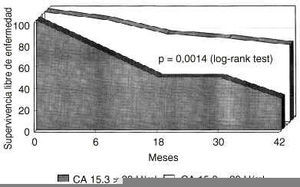
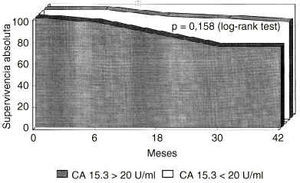
Se procedió a una reevaluación de los datos, excluyendo esta vez del análisis a las pacientes con enfermedad diseminada inicial. Sobre 125 pacientes estudiadas, en 111 mujeres no existía evidencia de enfermedad metastásica durante la evaluación clinicoanalítica basal. De estas 111 pacientes, 33 presentaban niveles basales elevados de CA 15.3 y 78 tenían unos niveles normales. Unos niveles elevados de CA 15.3 en la evaluación basal reducían significativamente la supervivencia libre de enfermedad, incluso en mujeres sin enfermedad diseminada evidenciada durante la evaluación inicial. En la figura 3 se muestra la disminución significativa en la probabilidad de supervivencia libre de enfermedad (p = 0,0014, log rank test). Con respecto a la probabilidad de super-vivencia absoluta, aunque era menor en el grupo CA 15.3 positivo, no alcanzaba significación estadística (p = 0,158, log rank test) como se expone en la figura 4.
Fig. 3. Probabilidad de supervivencia libre de enfermedad en mujeres diagnosticadas de cáncer de mama y sin enfermedad diseminada en el momento del diagnóstico, segregadas según la positividad basal del antígeno CA 15.3. La presencia de CA 15.3 determina una supervivencia libre de enfermedad significativamente reducida (p = 0,0014, log rank test).
Fig. 4. Probabilidad de supervivencia absoluta en mujeres diagnosticadas de cáncer de mama y sin enfermedad diseminada en el momento del diagnóstico, segregadas según la positividad basal del antígeno CA 15.3. Las pacientes con positividad basal del CA 15.3 presentan una menor supervivencia absoluta, aunque sin alcanzar significación estadística (p = 0,158, log rank test).
DISCUSIÓN
Nuestros datos sugieren que el marcador de masa tumoral CA 15.3 podría ser, asimismo, usado como un indicador de mal pronóstico en el cáncer de mama. Su positividad en la determinación inicial define un subgrupo de enfermas con una supervivencia absoluta y libre de enfermedad significativamente reducida. Este papel como indicador de mal pronóstico no puede ser completamente explicado por la positividad del CA 15.3 asociada a una enfermedad ya diseminada en el estudio inicial, puesto que, excluidas del análisis las pacientes con enfermedad diseminada, el CA 15.3 mantiene su capacidad discriminativa de mal pronóstico en cuanto a la supervivencia libre de enfermedad, aunque no respecto a la supervivencia absoluta.
El ensayo CA 15.3 determina la presencia en el suero de una glucoproteína de 400 kDa presente en la membrana celular..1 Dada su alta especificidad para la detección de masa tumoral en el cáncer de mama, se ha preconizado su uso como un marcador de masa tumoral en dicha patología. La determinación seriada de CA 15.3 sería de utilidad en el tratamiento de la enfermedad diseminada..5-9 De hecho, la elevación en los valores de CA 15.3 precede en unos 7 meses a la evidencia clínica de diseminación..10
En la actualidad su verdadera utilidad clínica es objeto de polémica. Una conferencia consenso de oncólogos alemanes celebrada en febrero de 1995 determinó que en ausencia de datos clínicos en la anamnesis y exploración sugestivos de metástasis la determinación seriada de CA 15.3 u otros marcadores tumorales no era de utilidad en el manejo post-operatorio de las pacientes con cáncer de mama ni ayudaba en la toma de decisiones terapéuticas..11 Sólo la mamografía de entre las técnicas de imagen estaba recomendada en el seguimiento de las pacientes, siendo inútiles la ecografía, otras técnicas radiológicas y la gammagrafía ósea, en ausencia de datos clínicos para modificar actitudes terapéuticas futuras. Incluso recientemente se ha sugerido que la presencia de unos valores normales de CA 15.3 no descarta la presencia de metástasis óseas, siendo la gammagrafía con difosfonatos una técnica más sensible..12En cambio, otros autores llegan a afirmar que unos niveles normales de CA 15.3 excluyen enfermedad metastásica en el cáncer de mama, como conclusión de un pequeño estudio sobre 78 pacientes..13 Las guías de práctica clínica redactadas por la American Society of Clinical Oncology en mayo de 1996 concluyen que no existen datos suficientes para recomendar el uso rutinario del índice de ADN, análisis de proliferación mediante estudio con citometría de flujo del ADN, CA 15.3, CEA, c-erb-B2, p53 o catepsina D en el estudio diagnóstico del cáncer de mama, aunque en ausencia de enfermedad medible los niveles de CA 15.3 y CEA pueden ser utilizados para documentar un fracaso terapéutico..14
La determinación de CA 15.3 no es suficientemente específica del cáncer de mama y está bien contrastada su inutilidad como una herramienta diagnóstica en la evaluación de la naturaleza de una lesión mamaria..15-18
Recientemente ha suscitado un gran interés la posible utilización de la determinación de CA 15.3 como factor pronóstico en el cáncer de mama. La principal limitación de esta teórica herramienta pronóstica reside en la asociación bien contrastada de unos niveles elevados de CA 15.3 con factores pronósticos ya consolidados y de utilidad en la toma de decisiones terapéuticas. Se ha demostrado que distintos marcadores tumorales como el CA 15.3, el CA 549 o el MSA muestran una correlación estadísticamente significativa con factores pronósticos como el estadio tumoral, el tamaño tumoral o la presencia de metástasis,.19, 20 aunque no con el tipo histológico, el estado de los receptores hormonales o la positividad de los ganglios linfáticos axilares..21 De entre diversos marcadores tumorales como CEA, AFP, CA 15.3, TPS o la oncoproteína Neu, solamente CA 15.3 muestra una asociación estadísticamente significativa con el estadio tumoral..17 Aunque es posible que nos encontremos ante un mero marcador pronóstico dependiente de algunos factores pronósticos clásicos, algunos datos recientes sugieren un auténtico valor pronóstico de unos niveles elevados de CA 15.3. Laffaioli et al encuentran asociación entre unos niveles elevados preoperatorios de CA 15.3 y la aparición más temprana de recurrencias, pero probablemente no como un factor pronóstico independiente, ya que los niveles elevados de CA 15.3 se correlacionaban, asimismo, con el tamaño tumoral y el estado de los ganglios linfáticos axilares..22 Horobin et al estudian 41 pacientes con cáncer de mama estadios I o II y demuestran cómo unos niveles basales de CA 15.3 superiores a 20 U/ml condicionan una supervivencia absoluta y libre de enfermedad significativamente más reducidas que las de 56 pacientes con menos de 20 U/ml. Aunque los autores no investigan la correlación con factores pronósticos clásicos, sugieren que se debería considerar terapia neoadyuvante en las pacientes con un CA 15.3 elevado..23 Cohen et al comunican que unos niveles basales de CA 15.3 normales determinan una supervivencia a los 2 años del 80%, mientras que un CA 15.3 mayor de 20 U/ml reduce la supervivencia al 31%. Desafortunadamente, los autores no controlan la asociación con factores pronósticos clásicos..24 Skrzydlewski et al hallan que la probabilidad de supervivencia libre de enfermedad para un seguimiento medio de 34 meses fue del 53% en los pacientes con un CA 15.3 preoperatorio elevado frente a un 88% en las pacientes con niveles normales. Durante el seguimiento una elevación de CA 15.3 muestra un valor predictivo para recurrencia tumoral del 80%. Los autores concluyen que CA 15.3 posee valor como factor pronóstico, aunque las conclusiones del estudio se ven limitadas porque no determinan su independencia con respecto a factores pronósticos clásicos..25 Bottini et al aportan datos similares,.26 relacionándose significativamente unos niveles basales elevados de CA 15.3 en pacientes con cáncer de mama T 2-4 N 0-1 M0 con una incidencia de recidivas más elevada. De nuevo no se examina formalmente con adecuados métodos estadísticos su independencia con respecto al tamaño tumoral o la positividad de los ganglios linfáticos. Tampellini et al examinan el valor pronóstico de CA 15.3 en la paciente que acaba de ser diagnosticada de enfermedad metastásica. Los niveles más elevados se observan en las mujeres con metástasis viscerales o derrame pleural. El análisis de supervivencia univariante demostraba que unos valores normales de CA 15.3 ensombrecía el pronóstico. En cambio, cuando se intentaba establecer la independencia de CA 15.3 con respecto a la extensión de la enfermedad se observó que la supervivencia venía determinada por la extensión de la enfermedad en hígado, pulmón, hueso y partes blandas como variables independientes, pero no así por unos niveles elevados de CA 15.3..27 Pectasides et al comunican que unos valores elevados de CA 15.3 en una determinación realizada justo tras la primera cirugía acortan significativamente la supervivencia, aunque desafortunadamente no evalúan la independencia con factores pronósticos clásicos..28Wojtacki et al corroboran recientemente que unos niveles basales elevados se asocian significativamente con un estadio más avanzado, con la presencia de metástasis, con la positividad de cuatro o más ganglios axilares, con un bajo contenido en receptores estrogénicos y progestagénicos, así como con el grado histológico del tumor. Los autores concluyen que los niveles basales de CA 15.3 representan la extensión tumoral y son un reflejo del grado de diferenciación y agresividad del tumor..29
Cuando se evalúa formalmente en 500 mujeres con cáncer de mama la posible dependencia de CA 15.3 con factores pronósticos clásicos,.30 los niveles basales de CA 15.3 se correlacionan significativamente con el estadio, el tamaño tumoral, el estado de los ganglios linfáticos, la presencia de metástasis y la infiltración linfocítica del tumor. Los autores de este estudio concluían que unos niveles elevados de CA 15.3 no son un factor pronóstico independiente, aunque unos niveles séricos superiores a 40 U/ml poseen un valor predictivo del 83% para la presencia de enfermedad avanzada.
Ante la evidencia clínica de una primera recurrencia de la enfermedad, tanto CA 15.3 como CA 125, como la presencia de metástasis viscerales son factores pronósticos independientes de supervivencia absoluta, determinado por un análisis multivariante..31 Otro estudio en cambio no consigue demostrar una utilidad pronóstica de los niveles de CA 15.3 previos al tratamiento en mujeres a las que se les acaba de diagnosticar una enfermedad diseminada..32
En resumen, nuestro estudio sugiere que la determinación basal de CA 15.3 en mujeres diagnosticadas de cáncer de mama es un factor pronóstico de supervivencia libre de enfermedad incluso en mujeres sin enfermedad diseminada en el momento del diagnóstico. Estos datos necesitan ser corroborados mediante los adecuados estudios prospectivos enrolando un adecuado número de pacientes. La independencia de CA 15.3 respecto a otros factores pronóticos clásicos necesita ser demostrada antes de considerar la posibilidad de una actuación terapéutica distinta según los niveles de CA 15.3 se encuentren elevados o no durante el proceso diagnóstico inicial del cáncer de mama.
AGRADECIMIENTOS
Agradecemos al doctor José L. Andreu su inestimable colaboración en la realización de los cálculos estadísticos y en la preparación del manuscrito.
RESUMEN
Introducción: El propósito de nuestro estudio era investigar la utilidad pronóstica de la determinación basal de CA 15.3 en el cáncer de mama.
Material y métodos: Se revisaron retrospectivamente los historiales clínicos de 125 pacientes diagnosticadas de cáncer de mama y en las que se disponía de una determinación basal de CA 15.3. Se calculó la probabilidad de supervivencia libre de enfermedad y absoluta mediante el método de Kaplan y Meier, así como la significación estadística de la diferencia entre grupos mediante la prueba log-rank. La asociación entre los niveles elevados de CA 15.3 y factores pronósticos clásicos como el tamaño tumoral, el estado de los ganglios linfáticos axilares o la presencia de receptores hormonales se calculó mediante la prueba exacta de Fisher.
Resultados: Un CA 15.3 basal > 20 U/ml se asocia a una reducción en la supervivencia libre de enfermedad (p = 0,000005) y en la supervivencia absoluta (p = 0,0205). Un CA 15.3 basal > 20 U/ml no mostraba correlación con el tamaño tumoral (p = 0,328), ni con la positividad de los ganglios linfáticos axilares (p = 0,085) ni con una pobre diferenciación histológica del tumor (p = 0,208). Unos niveles basales > 20 U/ml de CA 15.3 correlacionan con la presencia de infiltración linfaticovascular (p = 0,022), con la ausencia de receptor estrogénico (p = 0,032) y con la presencia de enfermedad diseminada inicial (p = 0,00018). Excluyendo del análisis a las pacientes con enfermedad basal diseminada, un CA 15.3 basal > 20 U/ml reducía significativamente la supervivencia libre de enfermedad (p = 0,0014), pero no la supervivencia absoluta (p = 0,158).
Conclusiones: Nuestros datos sugieren que los niveles basales de CA 15.3 podrían tener implicaciones pronósticas en el cáncer de mama.
BIBLIOGRAFÍA
1. Martínez de la Ossa, Barrena Gordon J. Marcadores tumorales en el cáncer de mama. Rev Senología Patol Mam 1996;9:78-85.
2. Dixon AR, Jonrup I, Jackson L, Chan SY, Badley RA, Blamey RW. Serological monitoring of advanced breast cancer treated by systemic cytotoxic using a combination of ESR, CEA and CA 15,3: fact or fiction? Dis Markers 1991;9:167-74.
3. Safi F, Kohler I, Rottinger E, Suhr P, Beger HG. Comparison of CA 15,3 and CEA in diagnosis and monitoring of breast cancer. Int J Biol Markers 1989;4:207-14.
4. Coveney EC, Geraghty JG, Sherry F, McDermott EW, Fennelly JJ, O''Higgins NJ, et al. The clinical value of CEA and CA 15.3 in breast cancer management. Int J Biol Markers 1995;10:35-41.
5. Robertson JF, Pearson D, Price MR, Selby C, Blamey RW, Howell A. Objective measurement of therapeutic response in breast cancer using tumour markers. Br J Cancer 1991; 64:757-63.
6. Dnistrian AM, Schwartz MK, Greenberg EJ, Smith CA, Schwartz DC. CA 15,3 and carcinoembryonic antigen in the clinical evaluation of breast cancer. Clin Chim Acta 1991;200:81-93.
7. Geraghty JG, Coveney EC, Sherry F, O''Higgins NJ, Duffy MJ. CA 15,3 in patients with locoregional and metastatic breast carcinoma. Cancer 1992;15(70): 2831-4.
8. Repetto L, Onetto M, Gardin G, Costanzi B, Giudici S, Vitiello E, et al. Serum CEA, CA 15,3 and MCA in breast cancer patients: a clinical evaluation. Cancer Detect Prev 1993; 17:411-5.
9. Blijlevens NM, Oosterhuis WP, Oosten HR, Mulder NH. Clinical value of TPS, CEA and CA 15,3 in breast cancer patients. Anticancer Res 1995;15:2711-6.
10. Jezersek B, Cervek J, Rudolf Z, Novakovic S. Clinical evaluation of potential usefulness of CEA, CA 15,3 and MCA in follow-up of breast cancer patients. Cancer Lett 1996;110:137-44.
11. Sauer H. Significance of tumor markers during the follow-up of women without symptoms after treatment of primary breast cancer. Anticancer Res 1997;17:3059-61.
12. Montravers F, Younsi N, Rousseau C, Philippe C, Seddiki M, Uzan S, et al. Comparison of bone scanning and CA 15,3 serum concentration in the follow-up breast cancer. Anticancer Res 1997;17:1683-6.
13. Buamah PK, Bent DJ, Bodger WA, Skillen AW. A profile of serum CA 15,3, carcinoembryonic antigen, alkaline phosphatase, and gamma-glutamyl transferase levels in patients with breast cancer. J Surg Oncol 1993; 53:84-7.
14. Anónimo. Clinical practice guidelines for the use of tumor markers in breast and colorectal cancer. Adopted on May 17, 1996 by the American Society of Clinical Oncology. J Clin Oncol 1996;14:2843-77.
15. Safi F, Kohler I, Rottinger E, Beger H. The value of the tumor marker CA 15,3 in diagnosing and monitoring breast cancer. A comparative study with carcinoembryonic antigen. Cancer 1991;68:574-82.
16. Eskelinen M, Hippelainen M, Salmela E, Paajanen H, Carlsson L, Jonsson P, et al. Comparison of tumour markers TAG 12 with CA 15,3 and MCA in breast cancer diagnosis. Anticancer Res 1992;12:39-42.
17. Eskelinen M, Kataja V, Hamalainen E, Kosma VM, Penttila I, Alhava E. Serum tumour markers CEA, AFP, CA 15,3, TPS and Neu in diagnosis of breast cancer. Anticancer Res 1997;17(2B):1231-4.
18. Eskelinen M, Hippelainen M, Kettunen J, Salmela E, Penttila I, Alhava E. Clinical value of serum tumour markers TPA, TPS, TAG 12, CA 15,3 and MCA in breast cancer diagnosis; results from a prospective study. Anticancer Res 1994;14:699-703.
19. Caponigro F, Iaffaioli RV, Pagliarulo C, De Placido S, Frasci G, Ungaro B, et al. CA 15,3 in human breast cancer. Comparison with tissue polypeptide antigen (TPA) and carcinoembryonic antigen (CEA). Int J Biol Markers 1990;5:73-6.
20. Kallioniemi OP, Oksa H, Aaran RK, Hietanen T, Lehtinen M, Koivula T. Serum CA 15,3 assay in the diagnosis and follow-up of breast cancer. Br J Cancer 1988; 58:213-5.
21. Heinze T, Schurenkamper P, Minguillon C, Lichtenegger W. Mammary serum antigen (MSA), Ca 549, CA 15,3 and CEA in breast cancer preoperative sensitivity and correlation to prognostic factors. Anticancer Res 1997;17:2953-4.
22. Iaffaioli RV, Caponigro F, Esposito G, Pagliarulo C, Deplacido S, Ungaro B, et al. Impact of preoperative CA 15,3 levels in operable breast cancer. Comparison with tissue polypeptide antigen (TPA) and carcinoembryonic antigen (CEA). Int J Biol Markers 1991; 6:21-4.
23. Horobin JM, Browning MC, McFarlane NP, Smith G, Preece PE, Wood RA, et al. Potential use of tumour marker CA 15,3 in the staging and prognosis of patients with breast cancer. J R Coll Surg Edinb 1991;36: 219-21.
24. Cohen AD, Gopas J, Karplus G, Cohen Y. CA 15,3, mucin-like carcinoma-associated antigen and tissue polypeptide-specific antigen: correlation to disease state and prognosis in breast cancer patients. Isr J Med Sci 1995;31:155-9.
25. Skrzydlewski Z, Niklinski J, Kiluk S, Kiluk M, Musiatowicz B, Zaremba E, et al. Evaluation of CA 15,3 serum levels in breast cancer patients. Minerva Chir 1997;52: 251-4.
26. Bottini A, Berruti A, Tampellini M, Morrica B, Brunelli A, Gnocchi E, et al. Influence of neoadjuvant chemotherapy on serum tumor markers CA 15,3, MCA, CEA, TPS and TPA in breast cancer patients with operable disease. Tumour Biol 1997;18:301-10.
27. Tampellini M, Berruti A, Gerbino A, Buniva T, Torta M, Gorzegno G, et al. Relationship between CA 15,3 serum levels and disease extent in predicting overall survival of breast cancer patients with newly diagnosed metastatic disease. Br J Cancer 1997;75:698-702.
28. Pectasides D, Pavlidis N, Gogou L, Antoniou F, Nicolaides C, Tsikalakis D. Clinical value of CA 15,3, mucin-like carcinoma-associated antigen, tumor polypeptide antigen, and carcinoembryonic antigen in monitoring early breast cancer patients. Am J Clin Oncol 1996;19:459-64.
29. Wojtacki J, Dziewulska-Bokiniec A, Kowalski DM, Zoltowska A, Ciesielski D, Suszko M. Pretreatment values of serum CA 15,3 antigen related to prognostic factors in breast cancer patients. Neoplasma 1996;43: 225-9.
30. O''Hanlon DM, Kerin MJ, Kent P, Maher D, Grimes H, Given HF. An evaluation of preoperative CA 15,3 measurement in primary breast carcinoma. Br J Cancer 1995;71:1288-91.
31. Berruti A, Tampellini M, Torta M, Buniva T, Gorzegno G, Dogliotti L. Prognostic value in predicting overall survival of two mucinous markers: CA 15,3 and CA 125 in breast cancer patients at first relapse of disease. Eur J Cancer 1994;30A:2082-4.
32. Albuquerque KV, Price MR, Badley RA, Jonrup I, Pearson D, Blamey RW, et al. Pretreatment serum levels of tumour markers in metastatic breast cancer: a prospective assessment of their role in predicting response to therapy and survival. Eur J Surg Oncol 1995;21: 504-9.