El tumor fibroso solitario, previamente denominado hemangiopericitoma, es un tumor mesenquimal benigno compuesto por células fusiformes con forma ovoide dentro de las fibras de colágeno. Su presentación en mama es poco frecuente; se han reportado alrededor de 50 casos en la literatura. Presentamos el caso de una mujer de 36 años con lesión en la mama derecha con características fenotípicas e inmunohistoquímicas de tumor fibroso solitario. Además, realizamos una revisión de la literatura de los casos publicados.
Solitary fibrous tumor, previously called hemangiopericytoma, is a benign mesenchymal tumor composed of ovoid spindle cells within collagen fibers. Its presentation in the breast is rare, with around 50 cases reported in the medical literature. We present the case of a 36-year-old woman with a right breast mass with phenotypic and immunohistochemical features of solitary fibrous tumor. In addition, we provide a review of published cases in the literature.
El tumor fibroso solitario (TFS) es una neoplasia mesenquimal benigna poco frecuente conformada por células fusiformes con forma ovoide dispuestas de manera aleatoria dentro de las fibras de colágeno1. La presencia de TFS es más frecuente en la pleura, pero también se han reportado casos en cavidad nasal, órbita, piel y tracto gastrointestinal, entre otros2–5. La localización en la mama es poco frecuente. Presentamos un caso de una paciente de 36 años y, adicionalmente, realizamos una revisión de la literatura.
Caso clínicoPaciente de 36 años que consulta por presentar una masa en la mama derecha de 10 años de evolución, con crecimiento progresivo en los últimos 6 meses asociado a mastalgia. Se le realizó ecografía mamaria, en la que se observa una lesión heterogénea de 39×16×33mm en el cuadrante inferior interno de la mama derecha, BI-RADS 4B. En el examen físico se palpaba lesión móvil, no adherida a planos profundos, de 3cm. Se realizó tru-cut de la lesión, con posterior tumorectomía. A nivel macroscópico se observó una masa redonda bien circunscrita, firme y de superficie externa lisa.
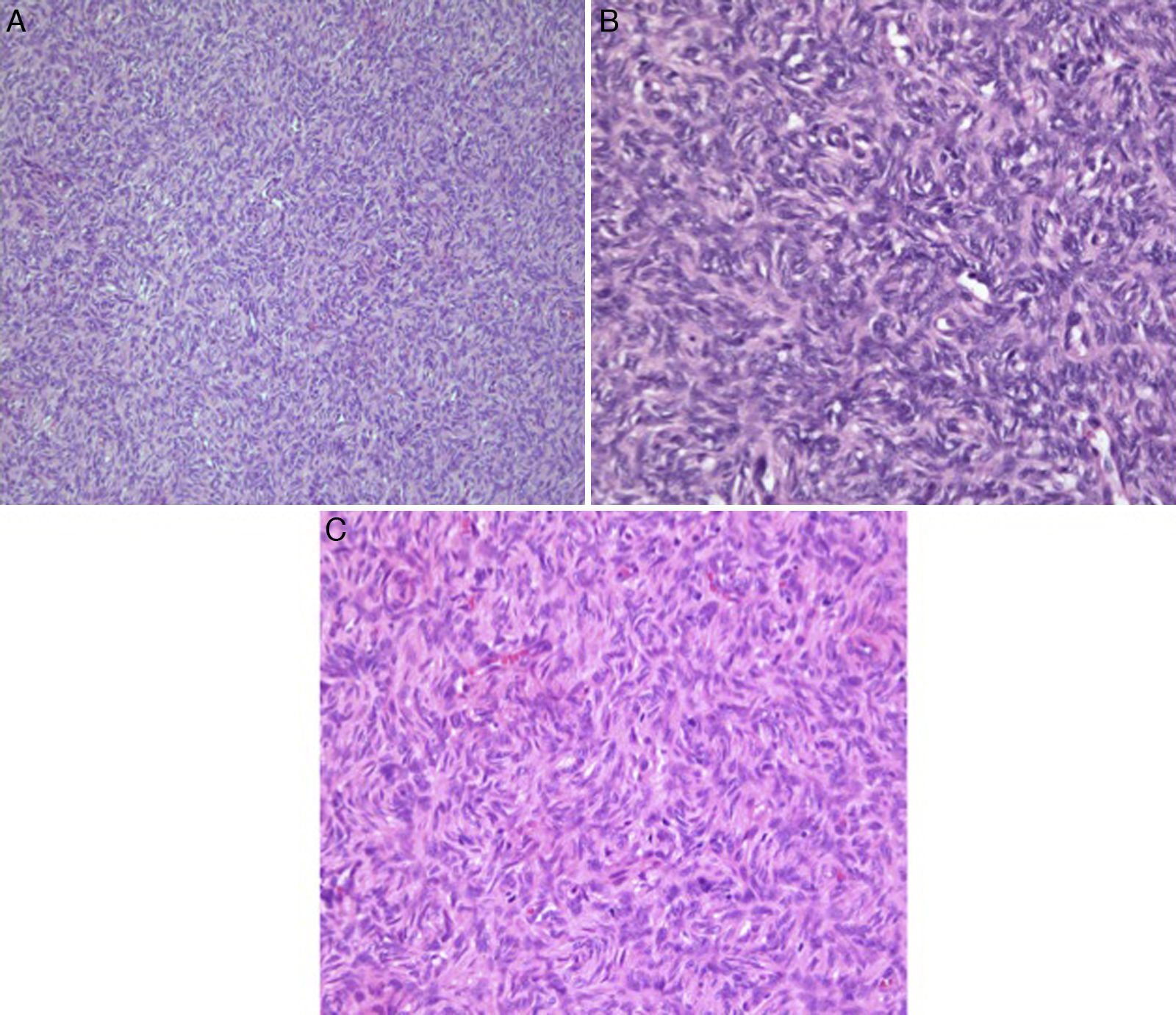
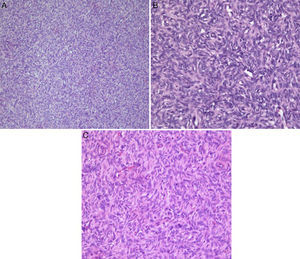
En el estudio histopatológico se observó una lesión mesenquimal formada por células redondas, fusocelulares, uniformes, con nucléolos elongados y escasamente atípicos, que se encuentran separadas por bandas gruesas de tejido colágeno hialinizado, acompañadas de frecuentes vasos sanguíneos ramificados con hialinización perivascular, que se disponen en un patrón de crecimiento discretamente estoriforme, conservando los espacios perivasculares y en patrón hemangiopericitoma-like. No se evidenció actividad mitótica significativa ni áreas de necrosis. No se observó tejido mamario residual (fig. 1A-C).
Tumor fibroso solitario. A. Se observa proliferacion difusa y homogénea de células fusocelulares con núcleos elongados (HyE, ×10). B y C. Patrón de crecimiento estoriforme, con frecuentes vasos sanguíneos ramificación con hialinización perivascular y conservación de los espacios vasculares (HyE, ×40).
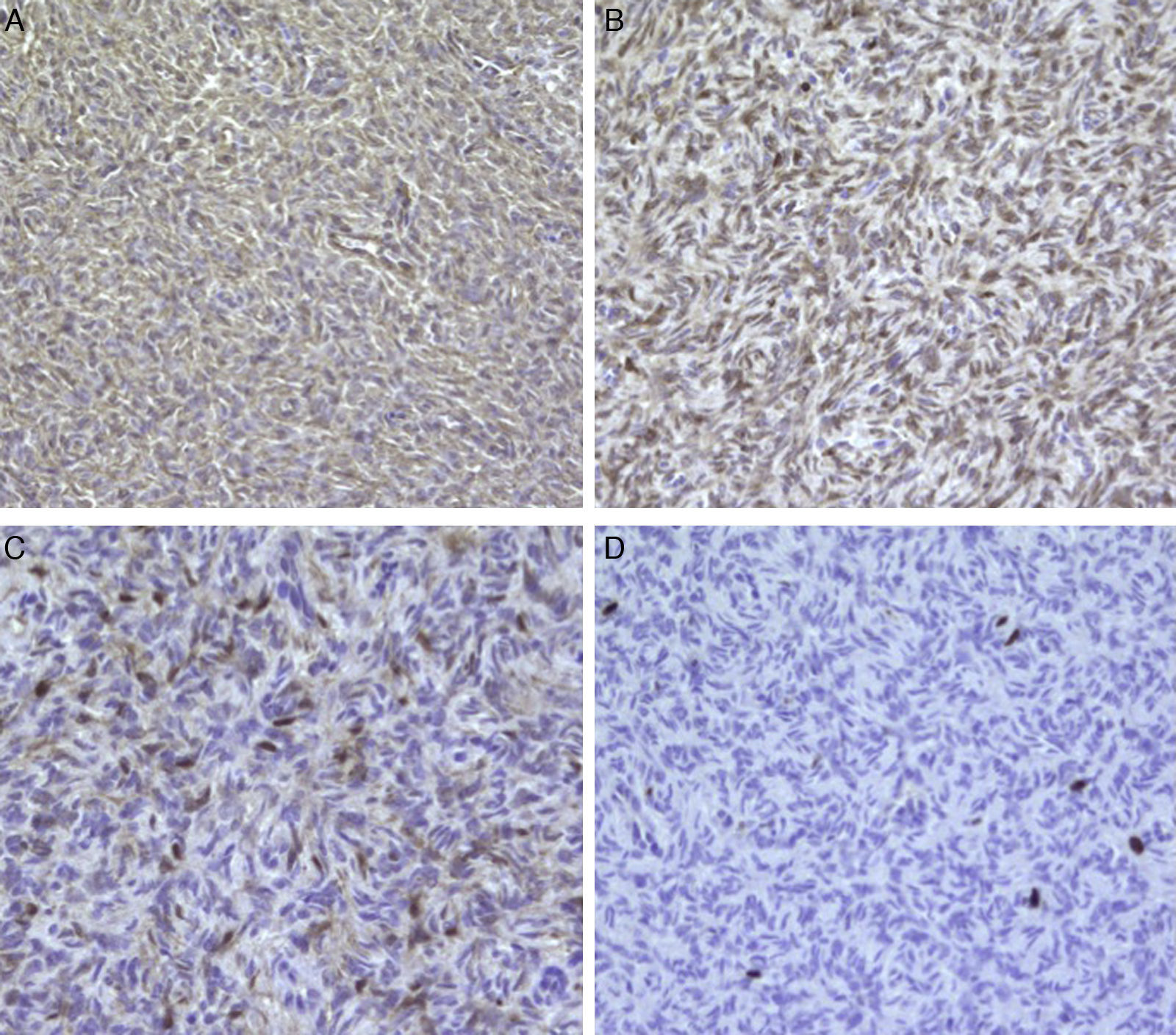
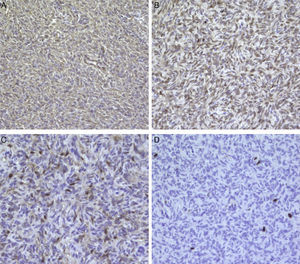
El estudio de inmunohistoquímica demostró positividad difusa e intensa para CD34, así como positividad focal y débil para BCL-2 y proteína S-100; los marcadores con citoqueratina AE1/AE3, actina, alfa-actina, miosina, EMA, CD117, CD99 y beta-catenina resultaron negativos, con un índice de proliferación celular Ki-67 del 2% (fig. 2A-D).
Con los hallazgos morfológicos en conjunto con el inmunoperfil se realizó un diagnóstico de TFS/hemangiopericitoma.
Un año después del diagnóstico la paciente ha sido valorada en múltiples ocasiones sin que se hayan evidenciado nuevas lesiones ni otras alteraciones en el examen físico ni en el estudio ecográfico.
DiscusiónEl TFS es una neoplasia mesenquimal derivada de los pericitos de los vasos sanguíneos; fue caracterizado en 1942 por Stout y Murray. Pertenece al grupo de tumores estromales fusocelulares benignos de la mama, que representan menos del 1% de los tumores mamarios6. Además del TFS, el grupo de los tumores estromales está conformado por el miofibroblastoma, la fascitis nodular, la hiperplasia estromal seudoangiomatosa y la fibromatosis mamaria6.
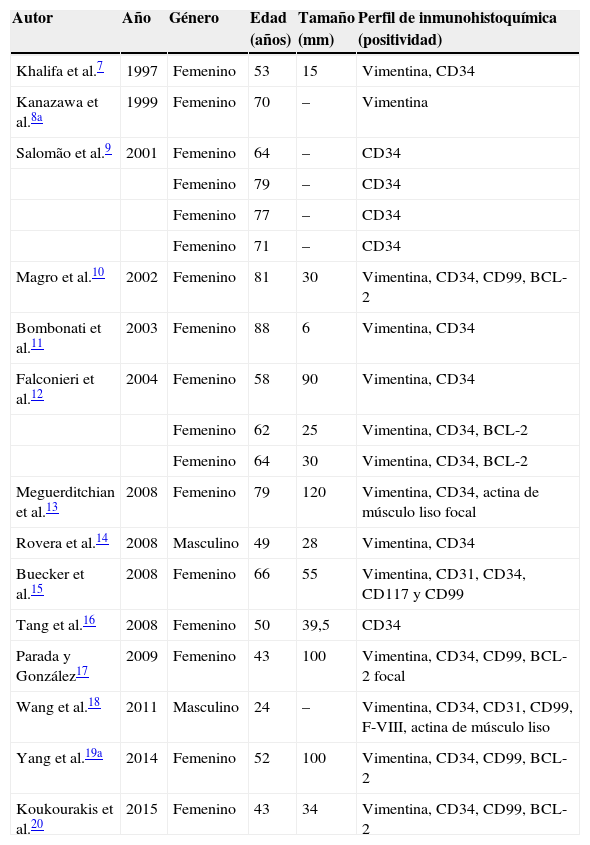
Previamente, el TFS se ha denominado, asimismo, hemangiopericitoma, por lo tanto, también utilizamos este término para realizar una búsqueda en la literatura médica en bases de datos con términos tanto en inglés como en español. En total, se han descrito alrededor de 50 casos con el diagnóstico histopatológico y/o inmuhistoquímico de TFS y/o hemangiopericitoma6–21. En la tabla 1 mostramos los casos publicados, excluyendo aquellos en donde el diagnóstico no fue realizado con inmuhistoquímica o el inmunoperfil no favorecía el diagnóstico, y aquellos que tenían características de TFS-like.
Casos publicados de tumor fibroso solitario
| Autor | Año | Género | Edad (años) | Tamaño (mm) | Perfil de inmunohistoquímica (positividad) |
|---|---|---|---|---|---|
| Khalifa et al.7 | 1997 | Femenino | 53 | 15 | Vimentina, CD34 |
| Kanazawa et al.8a | 1999 | Femenino | 70 | – | Vimentina |
| Salomão et al.9 | 2001 | Femenino | 64 | – | CD34 |
| Femenino | 79 | – | CD34 | ||
| Femenino | 77 | – | CD34 | ||
| Femenino | 71 | – | CD34 | ||
| Magro et al.10 | 2002 | Femenino | 81 | 30 | Vimentina, CD34, CD99, BCL-2 |
| Bombonati et al.11 | 2003 | Femenino | 88 | 6 | Vimentina, CD34 |
| Falconieri et al.12 | 2004 | Femenino | 58 | 90 | Vimentina, CD34 |
| Femenino | 62 | 25 | Vimentina, CD34, BCL-2 | ||
| Femenino | 64 | 30 | Vimentina, CD34, BCL-2 | ||
| Meguerditchian et al.13 | 2008 | Femenino | 79 | 120 | Vimentina, CD34, actina de músculo liso focal |
| Rovera et al.14 | 2008 | Masculino | 49 | 28 | Vimentina, CD34 |
| Buecker et al.15 | 2008 | Femenino | 66 | 55 | Vimentina, CD31, CD34, CD117 y CD99 |
| Tang et al.16 | 2008 | Femenino | 50 | 39,5 | CD34 |
| Parada y González17 | 2009 | Femenino | 43 | 100 | Vimentina, CD34, CD99, BCL-2 focal |
| Wang et al.18 | 2011 | Masculino | 24 | – | Vimentina, CD34, CD31, CD99, F-VIII, actina de músculo liso |
| Yang et al.19a | 2014 | Femenino | 52 | 100 | Vimentina, CD34, CD99, BCL-2 |
| Koukourakis et al.20 | 2015 | Femenino | 43 | 34 | Vimentina, CD34, CD99, BCL-2 |
Esta entidad afecta principalmente a pacientes adultos mayores 50 años, y el tamaño de la lesión puede ser variable. Es más frecuente en mujeres; sin embargo, se han reportado 2 casos en hombres14,18. Clínicamente las pacientes pueden presentar mastalgia; no se han observado cambios en la piel ni en el pezón, ni retracciones. En la mamografía se puede observar una masa densa bien circunscrita, sin calcificaciones. Sonográficamente se observa una masa sólida hipoecogénica con ecos internos heterogéneos y reforzamiento posterior.
Macroscópicamente se puede observar una masa redonda a oval bien circunscrita, firme, y de superficie externa lisa. Al corte, la superficie es arremolinada, con espacios vasculares dilatados. Por el bajo número de casos publicados aún no está clara la etiología ni las características epidemiológicas.
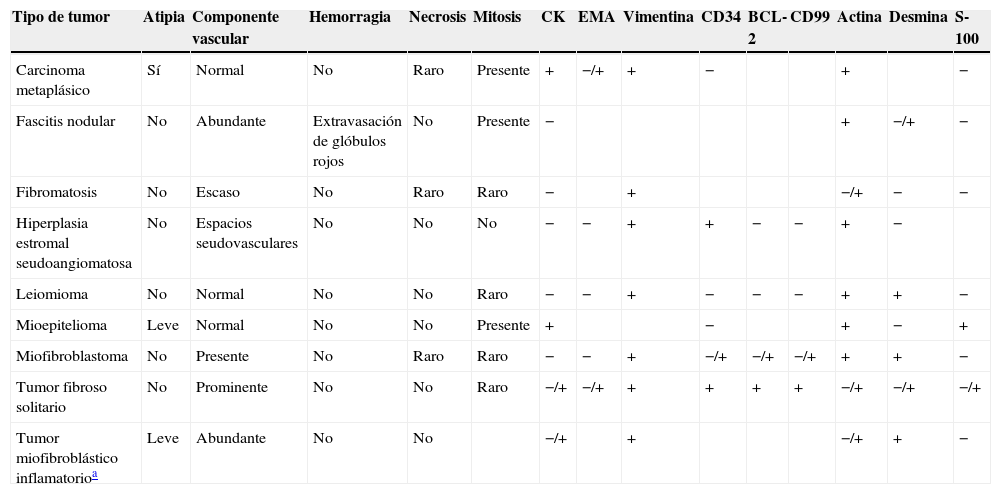
Al igual que las otras neoplasias mamarias, el diagnóstico definitivo debe ser realizado con la resección completa de la lesión. Histológicamente, el TFS se compone de células fusiformes con forma ovoide dispuestas de manera aleatoria dentro de las fibras de colágeno, con áreas hipercelulares e hipocelulares con ramificaciones vasculares prominentes de tipo hemangiopericitoma. Por su dificultad para distinguirlo de otras lesiones mesenquimales (tabla 2) es necesaria la ayuda diagnóstica con inmuhistoquímica. El TFS se caracteriza por tener inmunorreactividad para vimentina, CD34, CD99 y BCL-2, y en algunos casos para queratinas y marcadores neurales10. El principal diagnóstico diferencial es con el miofibroblastoma, que muestra características morfológicas similares, pero siempre con positividad para desmina y actina13. Se han descrito casos con positividad tanto para marcadores de TFS como de miofibroblastoma22. En biopsias pequeñas el diagnóstico diferencial incluye fibroadenoma celular, tumor filoides y carcinoma metaplásico17.
Características histológicas de tumores mesenquimales de seno
| Tipo de tumor | Atipia | Componente vascular | Hemorragia | Necrosis | Mitosis | CK | EMA | Vimentina | CD34 | BCL-2 | CD99 | Actina | Desmina | S-100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Carcinoma metaplásico | Sí | Normal | No | Raro | Presente | + | −/+ | + | − | + | − | |||
| Fascitis nodular | No | Abundante | Extravasación de glóbulos rojos | No | Presente | − | + | −/+ | − | |||||
| Fibromatosis | No | Escaso | No | Raro | Raro | − | + | −/+ | − | − | ||||
| Hiperplasia estromal seudoangiomatosa | No | Espacios seudovasculares | No | No | No | − | − | + | + | − | − | + | − | |
| Leiomioma | No | Normal | No | No | Raro | − | − | + | − | − | − | + | + | − |
| Mioepitelioma | Leve | Normal | No | No | Presente | + | − | + | − | + | ||||
| Miofibroblastoma | No | Presente | No | Raro | Raro | − | − | + | −/+ | −/+ | −/+ | + | + | − |
| Tumor fibroso solitario | No | Prominente | No | No | Raro | −/+ | −/+ | + | + | + | + | −/+ | −/+ | −/+ |
| Tumor miofibroblástico inflamatorioa | Leve | Abundante | No | No | −/+ | + | −/+ | + | − |
CK: citoqueratinas; EMA: antígeno de membrana epitelial.
Tabla modificada de Rovera et al.14
Recientemente se ha observado que la reactividad nuclear del marcador STAT6 estudiado por inmuhistoquímica tiene una alta sensibilidad y especificidad para el diagnóstico de TFS comparado con sus homólogos morfológicos. Esta reactividad podría ser explicada por la fusión somática recurrente de 2 genes, NAB2 y STAT6, localizados en la región del cromosoma 12q13; esta alteración genética ha sido observada en la gran mayoría de los TFS23–25.
El pronóstico de esta neoplasia es favorable. El comportamiento maligno es incierto. Únicamente se han reportado 2 casos con características histológicas de malignidad dadas por áreas hipercelulares, con atipia citológica moderada, necrosis tumoral, numerosas mitosis (≥4 mitosis por 10 campos de alta potencia) y/o márgenes infiltrativos8,19. De estos casos, uno de ellos tenía metástasis pulmonar8.
La mayoría de casos reportados han sido tratados con resección local amplia o mastectomía. No se detectaron metástasis en el vaciamiento ganglionar axilar y tampoco recurrencia local en ninguno de los grupos, con un seguimiento promedio de 5 años y hasta 23 años, de tal manera que se recomienda el manejo quirúrgico conservador con resección local amplia antes que la mastectomía6. La recurrencia local o aparición de metástasis depende principalmente de los parámetros histológicos. Aunque la mayoría de los casos publicados se caracterizan por un curso clínico no agresivo, se recomienda seguimiento a largo plazo principalmente para las formas atípicas. Hasta ahora no hay evidencia de que la quimioterapia y la radiación tengan relevancia clínica14. Es necesario reportar más casos como estos para conocer el comportamiento biológico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores expresan su agradecimiento al Dr. Pedro Luis Fernandez Ruiz, consultor del Departamento de Anatomía Patológica del Hospital Clínic de Barcelona, por la contribución en este caso.