Valorar la validez diagnóstica de una segunda biopsia del ganglio centinela (GC) en pacientes con cáncer de mama operable y axila negativa al diagnóstico, con GC metastásico, tratadas con quimioterapia neoadyuvante (QTN).
Pacientes y métodosEstudio prospectivo realizado en 52 mujeres con cáncer de mama infiltrante (2 bilateral); estadio II-A (cT2N0M0): 50, II-B (cT3N0M0): 4. El estatus axilar se estableció por exploración física, ecografía y punción ecoguiada de los ganglios sospechosos. Pauta QTN: epirrubicina/ciclofosfamida×4, y docetaxel×4. El día antes de la cirugía se inyectó periareolarmente 74-111MBq de nanocoloide de albúmina. El GC se analizó por amplificación de ácido nucleico de un solo paso. Se realizó linfadenectomía axilar en las pacientes con GC positivo al diagnóstico.
ResultadosEl GC axilar pre-QTN se identificó en el 96,3% de los casos; GC extirpados 1,8±0,8 (rango 1-4). En el 55,8% el resultado del GC fue positivo. Actualmente, 44 pacientes (2 bilateral) han completado el tratamiento. Se ha realizado una segunda biopsia del GC posneoadyuvancia en 22 pacientes: 20 con GC pre-QTN positivo, 2 sin migración axilar preneoadyuvancia. Solo se identificó el GC en el 54,5% de las pacientes; GC resecados 1,5±0,8 (rango 1-3). En 9 de las 10 mujeres sin migración la linfadenectomía axilar fue negativa. En 7 pacientes el GC fue un verdadero positivo, y en 4 de ellas los GC eran los únicos afectados de la axila. En 2 casos el resultado fue falso negativo (22,2%).
ConclusionesLos resultados de una segunda biopsia del GC post-QTN no son adecuados para su aplicación en la práctica clínica.
To evaluate the accuracy of a second sentinel lymph node (SLN) biopsy in patients with operable breast cancer and clinically negative axilla, with metastatic SLN at diagnosis, treated with neoadjuvant chemotherapy (NAC).
Patients and methodsA prospective study was performed in 52 women with invasive ductal carcinoma (2 bilateral); stage IIA (cT2N0M0): 50, IIB (cT3N0M0): 4. Axillary evaluation included physical examination and axillary ultrasound, with ultrasound-guided core needle biopsy of any suspicious lymph node. The NAC scheme consisted of epirubicin/cyclophosphamide×4, and docetaxel×4. The day before surgery, 74-111MBq albumin nanocolloid was injected periareolarly. The SLN was analyzed by one-step nucleic acid amplification. Axillary lymph node dissection was performed in patients with positive SLN at presentation.
ResultsPre-NAC axillary SLN was identified in 96.3% of the patients. The mean number of extirpated SLN was 1.8±0.8 (range 1-4). In 55.8% of the patients, the SLN was positive. Currently, 44 patients (2 bilateral) have completed NAC and surgical treatment. A second SLN biopsy was performed post-NAC in 22 patients: 20 with positive pre-NAC SLN and 2 without pre-NAC SLN identification. SLN was only identified in 54.5% of cases. The mean number of extirpated SLN was 1.5±0.8 (range 1-3). Non migration occurred in 10 patients, 9 patients without axillary lymph node dissection involvement. In 7 patients, the post-NAC SLN was a true positive and was the only axillary lymph node affected in 4. The false negative rate was 22.2%.
ConclusionsA second SLN biopsy after NAC in women with a positive SLN at diagnosis is not a useful option.
La quimioterapia neoadyuvante (QTN) es el tratamiento estándar en el cáncer de mama localmente avanzado e inflamatorio, existiendo evidencias que apoyan su uso en pacientes con enfermedad en estadios iniciales. Entre los principales objetivos de la QTN están: el inicio precoz del tratamiento sistémico, la conversión en operable de un cáncer de mama inicialmente no quirúrgico, el aumento en el número de cirugías conservadoras y la valoración de la quimiosensibilidad del tumor in vivo1–3.
La biopsia selectiva del ganglio centinela (BGC) es el procedimiento más adecuado para la estadificación regional del cáncer de mama. En la actualización del consenso sobre la BGC en el cáncer de mama del año 2010 se considera recomendable la realización de la BGC previa al tratamiento sistémico primario en pacientes con axila clínica/ecográficamente negativa de inicio, y es aceptable su realización posterior al tratamiento sistémico primario en el contexto de ensayos clínicos4, aunque estudios recientes evidencian que la BGC puede estar indicada después de QTN5,6.
En la actualidad, se discute en la literatura la posibilidad de realizar la BGC antes o después de la QTN, en función del estatus axilar al diagnóstico, y de las ventajas e inconvenientes de uno u otro momento7–13. El principal argumento para la realización de la BGC antes de comenzar la QTN (BGC preneoadyuvancia) es que permite una más precisa estadificación axilar inicial, con un mayor porcentaje de identificación del GC y una menor tasa de falsos negativos (FN). Entre sus inconvenientes está el someter a la paciente a 2 intervenciones quirúrgicas, una para localizar el GC y otra para la cirugía definitiva de la mama y axila, y que puede asociarse a retrasos en el comienzo de la QTN9,10,13–15.
Por otro lado, hasta el 50-60% de las pacientes con tumores T2 mayores de 3cm (posibles candidatas a QTN) presentan metástasis en el GC16, lo que actualmente implicaría la práctica de linfadenectomía axilar (LA) al finalizar la quimioterapia, en el caso de realizar BGC preneoadyuvancia4. Así, el principal inconveniente de la BGC preneoadyuvancia es que no permite valorar la respuesta ganglionar axilar al tratamiento, al no poderse establecer si la enfermedad metastásica inicial estaba limitada a el/los GC extirpados (el GC es el único ganglio axilar afectado en el 40-60% de los casos), o si se ha producido una respuesta al tratamiento (la QTN consigue una respuesta axilar completa patológica en el 20-40% de las pacientes)10,13. En estos casos, la realización de una segunda BGC al finalizar la QTN podría permitir la identificación de aquellas pacientes con axila negativa, evitando la realización de LA innecesarias. Actualmente, se considera que en pacientes con cirugía conservadora con BGC previa por carcinoma no hay evidencia para contraindicar una nueva BGC, aunque es aconsejable la valoración individual de cada caso4,17,18.
El objetivo de este estudio fue evaluar la validez diagnóstica de una segunda BGC después de QTN en pacientes con cáncer de mama operable y axila clínicamente negativa, con GC metastásico al diagnóstico inicial.
MétodosPacientesEstudio prospectivo en mujeres con cáncer de mama infiltrante y axila clínica/ecográficamente negativa al diagnóstico candidatas a QTN, que cumplían los siguientes criterios de inclusión: cáncer de mama operable confirmado histológicamente mediante punción biopsia con aguja gruesa o de vacío, tratamiento preoperatorio con QTN, BGC al diagnóstico inicial, cirugía de la mama y BGC con LA inmediata al finalizar el tratamiento sistémico. Se excluyeron las mujeres con carcinoma inflamatorio de mama, cirugía y/o radioterapia mamaria o axilar previa, tumores multicéntricos, enfermedad metastásica sistémica o segunda neoplasia, progresión de la enfermedad durante el tratamiento, gestantes o en periodo de lactancia, menores de 18 años, con antecedentes de alergia a la albúmina humana o que retiraron el consentimiento en cualquier momento del estudio. En todas las pacientes se obtuvo el consentimiento informado por escrito.
El estudio de la mama y axila al diagnóstico constaba de exploración física, mamografía, ecografía y resonancia magnética. El estatus axilar se estableció mediante exploración física, ecografía axilar y punción ecoguiada de los ganglios sospechosos. Al finalizar la quimioterapia, el estatus axilar se evaluó con exploración física y técnicas de imagen (ecografía y/o resonancia magnética). La evaluación del grado de respuesta clínica a la QTN se realizó a partir de los cambios que se producen en el tamaño tumoral a través de la exploración física y las técnicas de imagen, clasificándose según criterios RECIST en: respuesta completa, respuesta parcial o ausencia de respuesta.
Las enfermas recibieron el siguiente esquema secuencial de quimioterapia: 4 ciclos de epirrubicina (90mg/m2) y ciclofosfamida (600mg/m2) cada 21 días, seguido de 4 ciclos de docetaxel (100mg/m2) combinado con trastuzumab (8mg/Kg dosis de carga, 6mg/Kg cada 21 días) en pacientes con sobreexpresión de HER-2. Al finalizar la QTN se realizó LA de los niveles axilares i y ii en aquellas pacientes con resultado anatomopatológico positivo del GC al diagnóstico inicial.
Detección gammagráfica e intraoperatoria del ganglio centinelaEl día antes de la cirugía se administró el radiofármaco, 99mTc-nanocoloides de albúmina (Nanocoll®, GE HealthCare) mediante 4 inyecciones por vía intradérmica/subdérmica en las posiciones horarias 3, 6, 9 y 12 alrededor de la aréola de la mama afecta. El volumen de cada inyección fue de 0,2-0,3ml. La actividad administrada preneoadyuvancia fue de 74MBq (2mCi), y posneoadyuvancia, de 111MBq (3mCi). Inmediatamente después de la inyección del radiofármaco se practicó una linfogammagrafía, con adquisición planar de imágenes estáticas de forma seriada en al menos 2 proyecciones (anterior, y lateral u oblicua anterior a 45°), hasta visualizar el GC, con los siguientes parámetros técnicos de adquisición: colimador de baja energía y propósito general, ventana de energía: 140±10%KeV, matriz 256×256, 180s por imagen (gammacámaras Picker Axis® y Siemens Symbia T®). Se consideró como GC el/los ganglio/s visualizado/s, especialmente si están conectados a un canal linfático. Una vez identificado el GC, se marcó su localización con un rotulador de tinta indeleble sobre la piel de la paciente, colocada en una posición similar a la de la intervención quirúrgica. El día de la cirugía se consideró como GC el ganglio identificado en el territorio determinado por la linfogammagrafía que presentaba mayor actividad con la sonda detectora gamma (Europrobe®) en el lecho quirúrgico.
Estudio anatomopatológicoEl GC se analizó intraoperatoriamente con la técnica de amplificación de ácido nucleico de un solo paso (Sysmex®) clasificándose en: negativo (menos de 250copias/μL de ARNm-CK19), micrometástasis (entre 250 y 5.000copias/μL de ARNm-CK19) y macrometástasis (más de 5.000copias/μL de ARNm-CK19). Los ganglios de la LA se analizaron con tinción de hematoxilina-eosina e inmunohistoquímica con anticuerpos anticitoqueratina clon AE1/AE3 (Dako®). En la pieza de la mama se evaluó la respuesta patológica del tumor primario a la QTN, clasificándose en: respuesta completa patológica o persistencia de enfermedad residual infiltrante.
Análisis estadísticoEn el análisis descriptivo se expresaron las variables de naturaleza cuantitativa como media, desviación típica, mínimo y máximo. Y para la descripción de las variables cualitativas se calculó su frecuencia y porcentaje relativo en la población. Se diseñaron tablas de contingencia (2×2) para calcular la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión diagnóstica de la técnica, acompañados de la estimación del intervalo de confianza del 95% (IC 95%). Los programas informáticos usados fueron EpiDat® 3.1 y SPSS® 13.0.
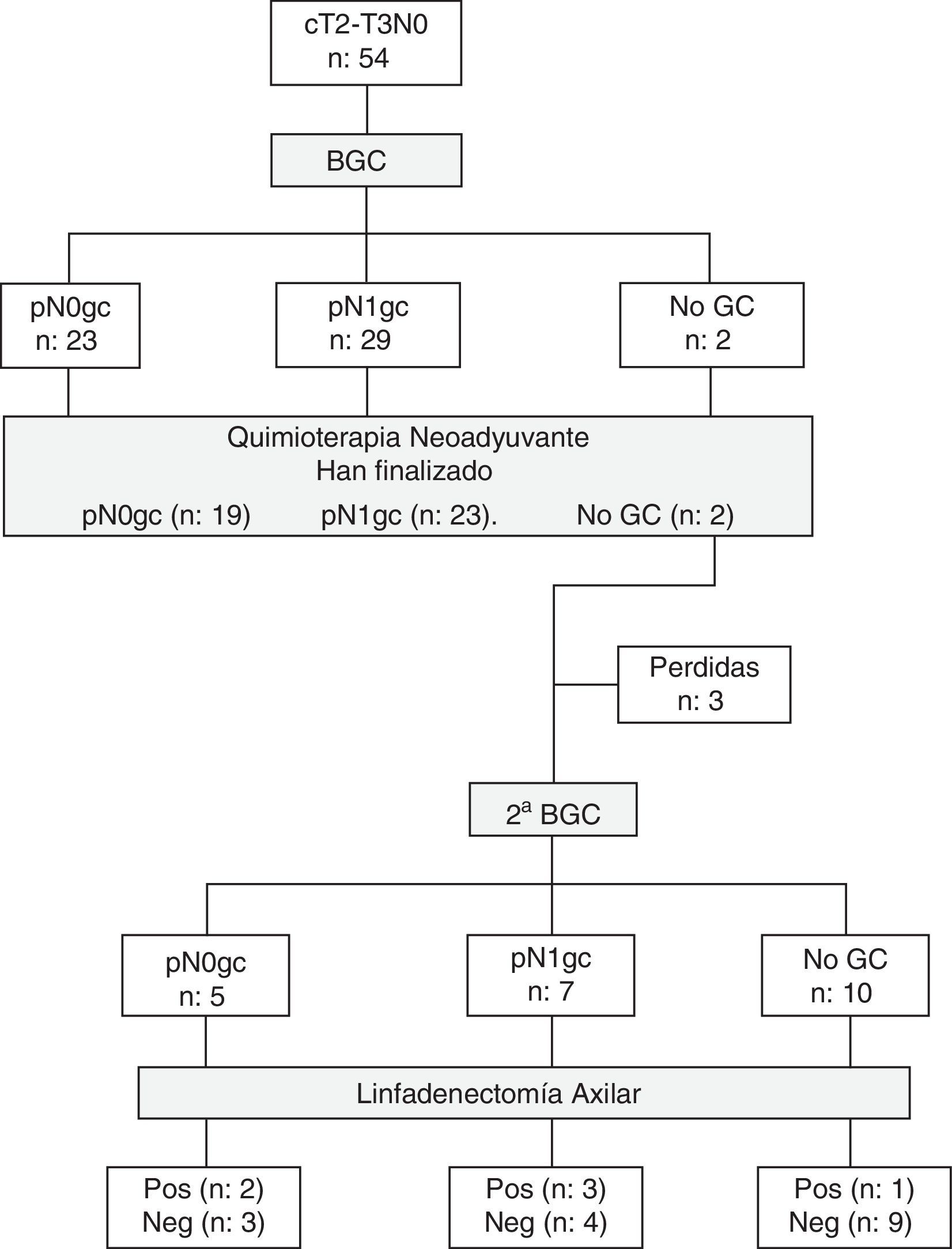
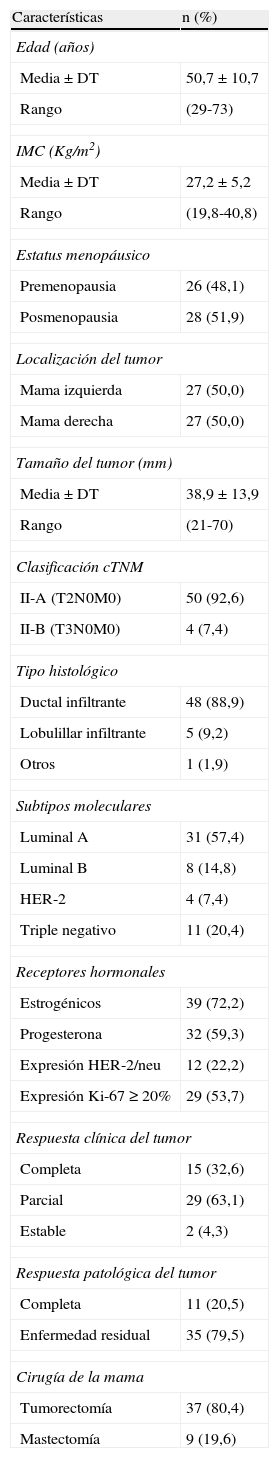
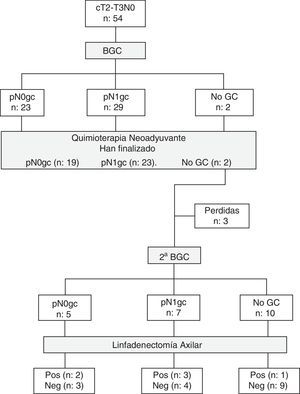
ResultadosEntre septiembre de 2011 y marzo de 2013 se han estudiado 52 mujeres con cáncer de mama (2 bilateral). La figura 1 representa el flujo de participantes en las diferentes etapas del estudio. Las principales características clínicas y patológicas de las pacientes incluidas en el estudio se resumen en la tabla 1.
Características clinicopatológicas de las pacientes
| Características | n (%) |
| Edad (años) | |
| Media±DT | 50,7±10,7 |
| Rango | (29-73) |
| IMC (Kg/m2) | |
| Media±DT | 27,2±5,2 |
| Rango | (19,8-40,8) |
| Estatus menopáusico | |
| Premenopausia | 26 (48,1) |
| Posmenopausia | 28 (51,9) |
| Localización del tumor | |
| Mama izquierda | 27 (50,0) |
| Mama derecha | 27 (50,0) |
| Tamaño del tumor (mm) | |
| Media±DT | 38,9±13,9 |
| Rango | (21-70) |
| Clasificación cTNM | |
| II-A (T2N0M0) | 50 (92,6) |
| II-B (T3N0M0) | 4 (7,4) |
| Tipo histológico | |
| Ductal infiltrante | 48 (88,9) |
| Lobulillar infiltrante | 5 (9,2) |
| Otros | 1 (1,9) |
| Subtipos moleculares | |
| Luminal A | 31 (57,4) |
| Luminal B | 8 (14,8) |
| HER-2 | 4 (7,4) |
| Triple negativo | 11 (20,4) |
| Receptores hormonales | |
| Estrogénicos | 39 (72,2) |
| Progesterona | 32 (59,3) |
| Expresión HER-2/neu | 12 (22,2) |
| Expresión Ki-67≥20% | 29 (53,7) |
| Respuesta clínica del tumor | |
| Completa | 15 (32,6) |
| Parcial | 29 (63,1) |
| Estable | 2 (4,3) |
| Respuesta patológica del tumor | |
| Completa | 11 (20,5) |
| Enfermedad residual | 35 (79,5) |
| Cirugía de la mama | |
| Tumorectomía | 37 (80,4) |
| Mastectomía | 9 (19,6) |
DT: desviación típica; GC: ganglio centinela; IMC: índice de masa corporal.
En la BGC preneoadyuvancia se identificó el GC axilar en el 96,3% (52/54) de los casos, y el número medio de GC extirpados fue de 1,8±0,8 (rango 1-4). En el 55,8% (29/52) de las pacientes el resultado del GC fue positivo. La relación entre el número de GC metastásicos y GC totales identificados fue la siguiente: 19 con macrometástasis (1/1: 7 casos; 1/2: 4 casos; 1/4: un caso; 2/2: 5 casos y 3/3: 2 casos), 3 con macro/micrometástasis (2/2: 3 casos) y 7 con micrometástasis (1/1: 4 casos; 1/2: 2 casos y 2/4: un caso). Actualmente, 44 pacientes (2 bilateral) han completado el tratamiento quimioterápico y la cirugía de la mama (37 tumorectomías, 9 mastectomías), 23 de ellas con GC pre-QTN positivo (15 macrometástasis, 2 macro/micrometástasis, 6 micrometástasis).
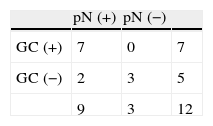
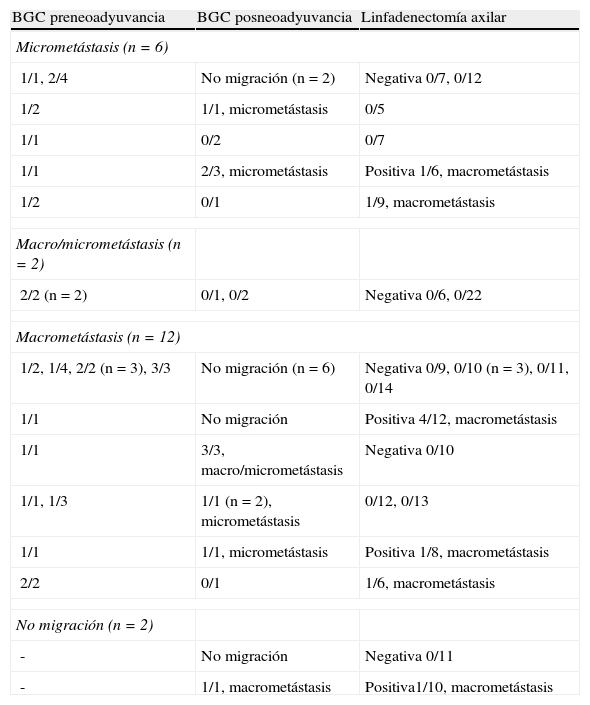
Biopsia selectiva del ganglio centinela y linfadenectomía axilar posneoadyuvanciaEn la linfogammagrafía posneoadyuvancia 11 pacientes presentaban un patrón de drenaje axilar homolateral, una a axila ipsilateral y cadena mamaria interna, otra hacia cadena mamaria interna, y una última a axila contralateral. En ninguno de los casos se intentó la detección intraoperatoria de los ganglios con drenaje a cadena mamaria interna. Se ha realizado una segunda BGC axilar posneoadyuvancia y LA en 22 pacientes: 20 con GC pre-QTN positivo y 2 sin migración axilar preneoadyuvancia. Solo se identificó el GC axilar en el 54,5% (12/22) de las pacientes, y el número medio de GC resecados fue de 1,5±0,8 (rango 1-3). En 9 de las 10 mujeres sin migración axilar la LA fue negativa. En 7 pacientes el GC fue un verdadero positivo (5 micrometástasis, una macro/micrometástasis, una macrometástasis), y en 4 (57,1%) de ellas el/los GC eran los únicos afectados de la axila. En los 2 casos FN solo se identificó un GC axilar y la LA era positiva para macrometástasis. En el 45% (9/20) de las enfermas con GC preneoadyuvancia positivo, el resto de los ganglios axilares extirpados (GC posneoadyuvancia y/o LA) eran negativos. El número medio de ganglios axilares totales extirpados en las cirugías (GC preneoadyuvancia y posneoadyuvancia, y LA) era de 12,5±4,9 (rango 6-25). En las tablas 2 y 3 se recogen los resultados de la segunda BGC y su correlación con el estatus patológico axilar después de la QTN.
Relación entre la segunda biopsia del ganglio centinela posneoadyuvancia y el estatus patológico axilar
| pN (+) | pN (−) | ||
| GC (+) | 7 | 0 | 7 |
| GC (−) | 2 | 3 | 5 |
| 9 | 3 | 12 |
GC: ganglio centinela.
Identificación: 54,5% (12/22). Falsos negativos: 22,2% (2/9). Valor predictivo negativo: 60,0% (3/5). Precisión: 83,3% (10/12).
Resultados de la biopsia selectiva del ganglio centinela posneoadyuvancia y la linfadenectomía axilar
| BGC preneoadyuvancia | BGC posneoadyuvancia | Linfadenectomía axilar |
| Micrometástasis (n=6) | ||
| 1/1, 2/4 | No migración (n=2) | Negativa 0/7, 0/12 |
| 1/2 | 1/1, micrometástasis | 0/5 |
| 1/1 | 0/2 | 0/7 |
| 1/1 | 2/3, micrometástasis | Positiva 1/6, macrometástasis |
| 1/2 | 0/1 | 1/9, macrometástasis |
| Macro/micrometástasis (n=2) | ||
| 2/2 (n=2) | 0/1, 0/2 | Negativa 0/6, 0/22 |
| Macrometástasis (n=12) | ||
| 1/2, 1/4, 2/2 (n=3), 3/3 | No migración (n=6) | Negativa 0/9, 0/10 (n=3), 0/11, 0/14 |
| 1/1 | No migración | Positiva 4/12, macrometástasis |
| 1/1 | 3/3, macro/micrometástasis | Negativa 0/10 |
| 1/1, 1/3 | 1/1 (n=2), micrometástasis | 0/12, 0/13 |
| 1/1 | 1/1, micrometástasis | Positiva 1/8, macrometástasis |
| 2/2 | 0/1 | 1/6, macrometástasis |
| No migración (n=2) | ||
| - | No migración | Negativa 0/11 |
| - | 1/1, macrometástasis | Positiva1/10, macrometástasis |
BGC: biopsia selectiva del ganglio centinela.
En nuestra población, la repetición de la BGC posneoadyuvancia identificó el GC en el 54,5% de los casos, frente a un 96,3% en el estudio pretratamiento. Este bajo porcentaje de localización intraoperatoria puede deberse al efecto combinado de la distorsión del drenaje linfático ocasionada por la quimioterapia y la interrupción de los canales linfáticos causada por la cirugía. En mujeres con recidiva de cáncer de mama y antecedente de cirugía axilar, tanto BGC como LA, el porcentaje de identificación en una segunda BGC se sitúa entre el 51 y el 100%17,18; y en la BGC post-QTN en pacientes con axila negativa al diagnóstico, entre el 83,3 y el 100%6,19–22. Por lo tanto, parece que el daño provocado por la cirugía axilar reciente en el drenaje linfático primario tiene más relevancia que los cambios secundarios a la QTN, en la disminución del porcentaje de identificación en la segunda BGC después de neoadyuvancia. No obstante, la repetición de la BGC después de QTN o en la recidiva del cáncer de mama no son situaciones similares, ya que en esta última pueden generarse nuevos linfáticos a partir de la lesión de novo, o regenerarse los previamente afectados si el tiempo transcurrido desde los tratamientos local y sistémico ha sido suficiente23,24. En cuanto a la elevada tasa de FN del 22,2% de la segunda BGC posneoadyuvancia en nuestras pacientes, está por encima de los valores aceptados del 5-10%, tanto en pacientes con cáncer de mama en estadios precoces25, como en enfermas tratadas con QTN19–22.
En mujeres con antecedente de cirugía de la axila y recidiva de cáncer de mama es más frecuente la aparición de drenajes extraaxilares o aberrantes en una segunda linfogammagrafía17,18. En los casos con BGC previa el porcentaje de drenajes aberrantes es del 25,7% (IC 95% 18,9-33,8)18; en nuestra serie, el 21,4% de las pacientes presentaron drenajes extraaxilares ipsilaterales, siendo en 2 de ellas el único drenaje linfático evidenciado. La aparición de drenajes aberrantes únicos o asociados a migración axilar homolateral puede tener influencia tanto en la cirugía como en la posibilidad de administración posterior de radioterapia o terapia sistémica adyuvante.
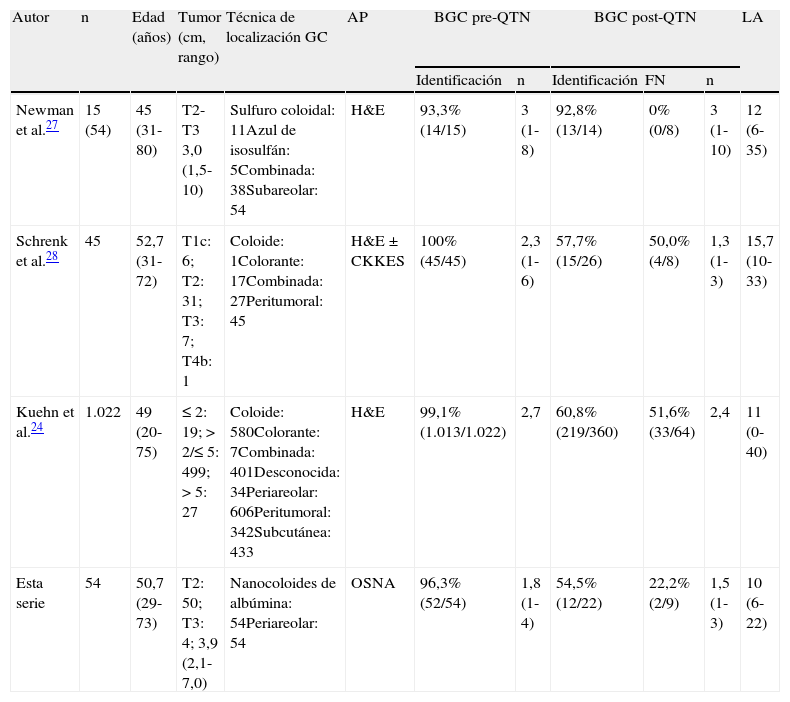
Son pocos los estudios que analizan la repetición de la BGC posquimioterapia en pacientes con cáncer de mama y axila clínica/ecográficamente negativa, y GC metastásico al diagnóstico (tabla 4). El Breast Oncology Program de la Universidad de Michigan26,27 estudia a 54 mujeres con cáncer de mama y axila positiva con confirmación patológica candidatas a QTN, de las que en 15 el estatus axilar se estableció mediante BGC al diagnóstico; en esta serie, la repetición de la BGC posneoadyuvancia permite la identificación de las pacientes que presentan una negativización de su estatus axilar, lo que evitaría la realización de LA en el 32% de los casos. Schrenk et al.28 realizan BGC después de QTN en 26 mujeres con cáncer de mama T1c-T4b, axila clínica/ecográficamente negativa y GC positivo al diagnóstico. En las 6 pacientes con micrometástasis al diagnóstico se identificó el GC y todas presentaban una axila negativa en el estudio patológico definitivo. Entre las 20 enfermas con macrometástasis solo se identificó el GC en el 45% de los casos, con una tasa de FN del 50%. El estudio multicéntrico alemán SENTInel NeoAdjuvant24 considera inaceptable un porcentaje de identificación del GC del 60,8% (IC 95% 55,6-65,9) con una tasa de FN del 51,6% (IC 95% 38,7-64,2), y en el 70,3% de los casos el/los GC eran los únicos afectados de la axila. Por lo tanto, concluye que una segunda BGC al finalizar la QTN en las pacientes pN1 (gc) al diagnóstico no es una opción útil en esta situación clínica.
Estudios de la segunda biopsia del ganglio centinela posneoadyuvancia en pacientes con cáncer de mama, axila negativa y ganglio centinela positivo al diagnóstico
| Autor | n | Edad (años) | Tumor (cm, rango) | Técnica de localización GC | AP | BGC pre-QTN | BGC post-QTN | LA | |||
| Identificación | n | Identificación | FN | n | |||||||
| Newman et al.27 | 15 (54) | 45 (31-80) | T2-T3 3,0 (1,5-10) | Sulfuro coloidal: 11Azul de isosulfán: 5Combinada: 38Subareolar: 54 | H&E | 93,3% (14/15) | 3 (1-8) | 92,8% (13/14) | 0% (0/8) | 3 (1-10) | 12 (6-35) |
| Schrenk et al.28 | 45 | 52,7 (31-72) | T1c: 6; T2: 31; T3: 7; T4b: 1 | Coloide: 1Colorante: 17Combinada: 27Peritumoral: 45 | H&E±CKKES | 100% (45/45) | 2,3 (1-6) | 57,7% (15/26) | 50,0% (4/8) | 1,3 (1-3) | 15,7 (10-33) |
| Kuehn et al.24 | 1.022 | 49 (20-75) | ≤2: 19; >2/≤5: 499; >5: 27 | Coloide: 580Colorante: 7Combinada: 401Desconocida: 34Periareolar: 606Peritumoral: 342Subcutánea: 433 | H&E | 99,1% (1.013/1.022) | 2,7 | 60,8% (219/360) | 51,6% (33/64) | 2,4 | 11 (0-40) |
| Esta serie | 54 | 50,7 (29-73) | T2: 50; T3: 4; 3,9 (2,1-7,0) | Nanocoloides de albúmina: 54Periareolar: 54 | OSNA | 96,3% (52/54) | 1,8 (1-4) | 54,5% (12/22) | 22,2% (2/9) | 1,5 (1-3) | 10 (6-22) |
AP: estudio anatomopatológico del ganglio centinela; BGC: biopsia selectiva del ganglio centinela; CKKES: inmunohistoquímica con citoqueratinas; FN: tasa de falsos negativos; H&E: hematoxilina-eosina; LA: linfadenectomía axilar; OSNA: amplificación de ácido nucleico de un solo paso; QTN: quimioterapia neoadyuvante.
Este estudio presenta varias limitaciones metodológicas. En primer lugar, no se ha realizado BGC de la cadena mamaria interna. Actualmente, no hay acuerdo en la extirpación de estos ganglios de forma rutinaria, tanto por la morbilidad que el procedimiento conlleva como por su limitada repercusión en el tratamiento de las pacientes29,30. En segundo lugar, solo hemos utilizado un radiocoloide para la localización del GC, y se demuestra que la utilización de una técnica combinada (coloide y colorante) puede mejorar el porcentaje de identificación23,24. Nuestra menor tasa de FN en comparación con otros estudios similares24,27 puede deberse a la mayor sensibilidad de la técnica de amplificación de ácido nucleico de un solo paso para la detección de metástasis en el GC31,32. Por último, el limitado número de pacientes estudiadas no permite establecer conclusiones definitivas.
Actualmente, en pacientes con cáncer de mama y axila negativa al diagnóstico tratadas con QTN es posible practicar la BGC antes o después del tratamiento6,33, aunque existe una tendencia hacia la realización post-QTN evitando LA innecesarias34–36. La evaluación axilar debe incluir una ecografía con punción de los ganglios sospechosos tanto en la estadificación inicial como al finalizar el tratamiento, para una correcta selección de las pacientes candidatas a BGC24,37–39.
En nuestra experiencia, en pacientes con cáncer de mama y axila negativa con GC metastásico al diagnóstico, los resultados de una segunda BGC post-QTN no son adecuados para su aplicación en la práctica clínica, con un bajo porcentaje de identificación del GC y una elevada tasa de FN, relacionados con el antecedente de cirugía axilar reciente y terapia sistémica primaria.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría- 1.
Participación en la concepción y diseño, la adquisición de los datos, el análisis e interpretación de los datos del trabajo que ha dado como resultado el artículo en cuestión: Ángel C. Rebollo-Aguirre, Rocío Sánchez-Sánchez, Tarik Aroui-Luquin, Juan García-García, Elena Pastor-Pons, Clara E. Chamorro-Santos y Salomón Menjón-Beltrán.
- 2.
Participación en la redacción del texto y en las posibles revisiones del mismo: Ángel C. Rebollo-Aguirre, Rocío Sánchez-Sánchez y Salomón Menjón-Beltrán.
- 3.
Aprobación de la versión que finalmente va a ser publicada: Ángel C. Rebollo-Aguirre, Rocío Sánchez-Sánchez, Tarik Aroui-Luquin, Juan García-García, Elena Pastor-Pons, Clara E. Chamorro-Santos y Salomón Menjón-Beltrán.
Los autores declaran no tener ningún conflicto de intereses.