Actualmente la irradiación de toda la mama después de una intervención quirúrgica conservadora sigue siendo un procedimiento estándar en el cáncer de mama, en la que clásicamente se administra una dosis de 50 Gy con fraccionamiento de 2 Gy. Sin embargo, diferentes dosis y fraccionamiento han demostrado al menos la misma eficacia. El objetivo principal del estudio fue determinar la tasa de recidiva local en pacientes sometidas a cirugía conservadora y radioterapia postoperatoria hipofraccionada. Los objetivos secundarios fueron la incidencia y el grado de toxicidad aguda y tardía.
Pacientes y métodosDesde enero de 2004 a diciembre de 2006, se seleccionó a 122 pacientes para radioterapia hipofraccionada con las características siguientes: edad ≥ 50 años, estadio temprano, margen de resección libre de tumor y espesor de la mama < 23cm. La dosis administrada fue 42,5 Gy con fraccionamiento de 2,66 Gy por sesión.
ResultadosCon una mediana de seguimiento de 58,29 meses, 116 (95,08%) pacientes están vivas: 114 libres de enfermedad y 2 con metástasis óseas. La recidiva local a 5 años fue 1,64% y sólo un caso (0,81%) presentó recidiva regional. Hubo un 2,46% de pacientes con segundo tumor primario y un 4,91% con metástasis. La toxicidad, tanto aguda como tardía, ha sido leve.
ConclusionesLa radioterapia hipofraccionada en pacientes de riesgo bajo proporciona los mismos beneficios que el tratamiento clásico con una baja toxicidad aguda y tardía.
Whole breast irradiation, typically administered at a dose of 50 Gy in 2 Gy fractions after conservative surgery, continues to be a standard procedure in breast cancer. However, different doses and fractionation have shown to be at least as effective. The main objective of this study was to determine the rate of local recurrence in patients undergoing conservative surgery and hypofractionated postoperative radiotherapy. The secondary objectives were to determine the incidence and grade of both acute and delayed toxicity.
Patients and methodsFrom January 2004 to December 2006, 122 patients who had the following characteristics were selected to receive hypofractionated radiotherapy to the whole breast: age ≥ 50 years, early stage, tumour free resection margins ≥ 10mm, thickness of the breast ≤ than 23cm. The total dose was 42.5 Gy with fractionation of 2.66.
ResultsWith a median follow up of 58.29 months, 116 (95.08%) patients were alive: 114 were free of disease and 2 had metastases. The 5 year local recurrence rate was 1.64%, and only in one case (0.81%) there was a regional recurrence. Only 2.46% of the patients developed a second primary tumour. Distant metastases were present in 4.91%. Toxicity, both acute and late, was mild (grade 1-2).
ConclusionsHypofractionated radiotherapy, in patients with low risk breast cancer after conservative surgery, provides the same benefits as the classical treatment with a low acute, as well as and delayed, toxicity.
El carcinoma de mama es el tumor maligno más frecuente en las mujeres occidentales y la primera causa de muerte entre los 35 y los 55 años1. La incidencia de esta enfermedad se ha incrementado más de un 3% cada año en la década de 1980, con tendencia a la estabilización en la década de 1990. No obstante, la mortalidad ha permanecido invariable e incluso parece haber disminuido, al menos en las mujeres de raza blanca2. La mejora en la detección temprana y los avances terapéuticos son, sin duda, la causa de esta modesta ganancia en la supervivencia, pero, sobre todo, de un significativo incremento en la calidad de vida de las pacientes.
La radioterapia en el tratamiento del cáncer de mama tiene un papel bien establecido, tanto en términos de control local, como de beneficio en la supervivencia. Después de 30 años de ensayos aleatorizados en cáncer de mama, sabemos que el tratamiento con cirugía conservadora más radioterapia ofrece la misma supervivencia que con mastectomía, pero con una calidad de vida muy superior en las pacientes sometidas a tratamiento conservador3.
Actualmente, la irradiación de toda la mama después de una cirugía conservadora sigue siendo un procedimiento estándar en el cáncer de mama, independientemente del estado de los ganglios axilares. Hasta fechas muy recientes, el esquema considerado estándar consiste en la administración de una dosis total de 45-50 Gy a toda la mama en 25 fracciones de 1,8-2 Gy por día durante 5 semanas4,5, y se considera que fracciones superiores a 2 Gy podrían incrementar la probabilidad de toxicidad tardía y derivar en un peor resultado estético6. No obstante, desde hace bastantes años, en países como Canadá y el Reino Unido es común el uso de fraccionamientos superiores a 2 Gy, basándose en modelos radiobiológicos que proponen que un incremento de la dosis por fracción —que reduce la dosis total y el tiempo de tratamiento (hipofraccionamiento)— es tan efectivo como los esquemas tradicionales. Tanto los tejidos normales, como los tumores varían en su capacidad de respuesta al tamaño de la fracción de radioterapia. Esta respuesta puede determinarse mediante un modelo en el que la sensibilidad (medida por el grado de daño a los tejidos normales y por las tasas de recidiva en los tumores) al tamaño de la fracción es representada por un cociente entre dos constantes α y β. Cuanto más bajo es el cociente α/β en los tejidos normales o tumorales, mayor es su respuesta a los cambios en el tamaño de la fracción7.
La sensibilidad del cáncer de mama a la dosis por fracción se ha estimado de manera experimental en 4 Gy y el α/β de la respuesta tardía del tejido normal mamario, en 3 Gy. Esto significa que administrar tratamientos con una dosis mayor por fracción puede suponer una ventaja en el control tumoral8. Sin embargo, había la incertidumbre acerca del impacto mayor en la respuesta tardía de los tejidos sanos a nivel de la mama, las costillas y el corazón, además de los potenciales efectos adversos en los resultados estéticos9.
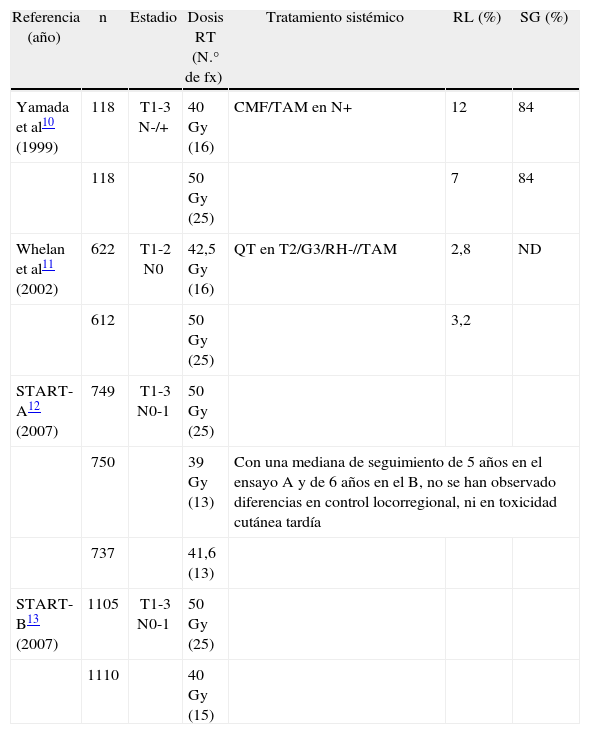
A partir de esta hipótesis, en la última década se han llevado a cabo varios estudios aleatorizados en los que se ha comparado el hipofraccionamiento con el esquema clásico en pacientes sometidas a cirugía conservadora por cáncer de mama, lo cual ha puesto de manifiesto la equivalencia de ambos en cuanto a control local, supervivencia, toxicidad aguda y tardía y resultados estéticos10-13. En la tabla 1 se muestra un resumen de estos ensayos.
Esquemas de tratamiento de radioterapia en cáncer de mama.
| Referencia (año) | n | Estadio | Dosis RT (N.° de fx) | Tratamiento sistémico | RL (%) | SG (%) |
| Yamada et al10 (1999) | 118 | T1-3 N-/+ | 40 Gy (16) | CMF/TAM en N+ | 12 | 84 |
| 118 | 50 Gy (25) | 7 | 84 | |||
| Whelan et al11 (2002) | 622 | T1-2 N0 | 42,5 Gy (16) | QT en T2/G3/RH-//TAM | 2,8 | ND |
| 612 | 50 Gy (25) | 3,2 | ||||
| START-A12 (2007) | 749 | T1-3 N0-1 | 50 Gy (25) | |||
| 750 | 39 Gy (13) | Con una mediana de seguimiento de 5 años en el ensayo A y de 6 años en el B, no se han observado diferencias en control locorregional, ni en toxicidad cutánea tardía | ||||
| 737 | 41,6 (13) | |||||
| START-B13 (2007) | 1105 | T1-3 N0-1 | 50 Gy (25) | |||
| 1110 | 40 Gy (15) | |||||
N.° de fx: número de fracciones; ND: no diferencias; QT: quimioterapia; RH: receptores hormonales; RL: recidiva local; RT: radioterapia; SG: supervivencia global; TAM: tamoxifeno.
Por otro lado, el empleo de un esquema hipofraccionado, que reduce a 3 semanas el tiempo total de tratamiento, supone una ventaja importante para la calidad de vida de las pacientes y, sin duda, una reducción considerable de los costes del tratamiento14-16.
El objetivo principal de este estudio ha sido determinar la tasa de recidiva en pacientes sometidas a cirugía conservadora que recibieron radioterapia postoperatoria hipofraccionada. Los objetivos secundarios fueron determinar la incidencia y el grado de toxicidad, tanto aguda, como tardía.
1Material y métodosDesde enero de 2004 a diciembre de 2006, en el Hospital Juan Ramón Jiménez de Huelva, se estableció como protocolo institucional la radioterapia hipofraccionada para todas las pacientes con carcinoma infiltrante de mama, sometidas a cirugía conservadora, que reunían las características siguientes: edad ≥ 50 años, tumor menor de 5cm, N0-1, margen de resección libre de tumor ≥ 10mm y espesor máximo de la mama menor de 23cm, medido a nivel de la base de ésta. La dosis administrada fue de 42,5 Gy, con fraccionamiento de 2,66 Gy por sesión, en 16 sesiones durante 21 días. La técnica de tratamiento consistió en 2 o 4 campos tangenciales con cuñas y un campo perpendicular a ellos para homogeneizar la dosis y mejorar su distribución en pulmón. En todos los casos se realizó una simulación virtual y planificación tridimensional de tratamiento. Para evaluar la planificación, se analizaron los histogramas dosis volumen con los criterios de calidad siguientes: el 95% del PTV debía recibir, al menos, el 95% de la dosis prescrita; menos del 10% del PTV podría sobrepasar el 105% de la dosis prescrita, y menos del 5% del PTV podría sobrepasar el 110% de la dosis prescrita. Los límites de dosis establecidos para los órganos de riesgo fueron: pulmón ipsilateral V20 < 25%, corazón V25 < 8% y mama contralateral V10 < 5%. Se utilizó un plano inclinado para el posicionamiento y la inmovilización de las pacientes.
Se ha realizado un estudio retrospectivo de estas pacientes, con el objetivo de determinar la tasa de recidiva locorregional y la incidencia de toxicidad, tanto aguda, como tardía. Después de finalizar la radioterapia, se controló a las mujeres cada 6 meses durante 5 años y, posteriormente, una vez al año. En cada visita se realizó una anamnesis, una exploración física general y exploración de ambas mamas. La primera mamografía de control se realizó 6 meses después de la radioterapia y, posteriormente, con periodicidad anual, salvo criterio del radiólogo. También a criterio del radiólogo se realizaron ecografía, resonancia magnética y/o biopsia de lesiones sospechosas. Se solicitaron otros estudios complementarios en función de la clínica de la paciente.
Para el análisis de las variables definidas en el estudio se tomaron medidas centrales y proporciones. Todos los datos se incorporaron a una base de datos y se trataron estadísticamente con el programa SPSS 14.
Se incluyó a un total de 122 pacientes cuyas características se muestran en la tabla 2.
Características de las pacientes.
| N = 122 (%) | |
| Edad | |
| Mediana | 64,50 |
| Media | 65,04 |
| IVL | |
| Sí | 9 (7,4) |
| No | 56 (45,96) |
| No especificado | 57 (46,7) |
| Menopausia | |
| Sí | 109 (89,3) |
| No | 13 (10,7) |
| RE | |
| Sí | 95 (77,9) |
| No | 27 (22,1) |
| Histología | |
| CDI | 86 (70,5) |
| CLI | 9 (7,4) |
| CDis | 15 (12,3) |
| Otro | 12 (9,8) |
| RP | |
| Sí | 84 (68,9) |
| No | 38 (31,1) |
| Grado | |
| G1 | 31 (25,8) |
| G2 | 49 (40,8) |
| G3 | 14 (11,7) |
| No especificado | 26 (21,3) |
| HER2 | |
| Positivo | 2 (1,6) |
| Negativo | 51 (41,8) |
| No especificado | 69 (56,6) |
| T | |
| T1 | 99 (81,2) |
| T2 | 20 (16,4) |
| Tx | 2 (1,6) |
| Tis | 1 (0,8) |
| QT | |
| Sí | 33 (27) |
| No | 89 (73) |
| N | |
| N0 | 109 (89,3) |
| N1mic | 3 (2,5) |
| N1 | 10 (8,2) |
| HT | |
| Sí | 96 (78,7) |
| No | 26 (21,3) |
| Margen | |
| > 10mm | 114 (93,4) |
| > 5mm | 4 (3,3) |
| > 1mm | 4 (3,3) |
| IT | |
| Sí | 1 (0,8) |
| No | 121 (99,2) |
| ECI | |
| Sí | 7 (5,7) |
| No | 57 (46,7) |
| No especificado | 58 (47,5) |
ECI: extenso componente intraductal, IVL: invasión vascular linfática, RE: receptores estrogénicos; RP: receptores progesterona, QT: quimioterapia, HT: hormonoterapia, IT: inmunoterapia.
Destacamos que se trata de un grupo bastante homogéneo de pacientes en lo que se refiere a factores de riesgo de recidiva local. Así, la edad media ± desviación estándar de las pacientes fue de 65,04 ± 9,2 años. El porcentaje de mujeres posmenopáusicas fue del 89,3%. Entre los diferentes tipos histológicos, el más frecuente fue el carcinoma ductal infiltrante, con un 70,5%; un 40,8% tuvo grado de diferenciación histológico tipo 2 y el patrón inmunohistoquímico estrogénico positivo (receptores estrogénicos [RE] positivos 77,9%) fue el más representativo. En relación con el TNM, la mayoría de las pacientes presentaron un tumor menor de 2cm de diámetro (T1 81,2%) y ausencia de afectación ganglionar (N0 89,3%). Tener un margen de resección patológico negativo, igual o superior a 10mm, era una condición para la inclusión en el protocolo de tratamiento; no obstante, esto se cumplió sólo en el 93,4% de las pacientes. Los 8 casos restantes presentaron márgenes libres entre 1 y 10mm. No hubo ningún caso de margen afectado.
Un 27% de las pacientes recibió quimioterapia, en cuyo caso la radioterapia se inició aproximadamente un mes después de finalizada ésta. El tratamiento hormonal se administró a un 78,7% de las pacientes, siendo en general concomitante con radioterapia. Cuando el tratamiento hormonal fue tamoxifeno, éste no se suspendió para administrar radioterapia; no obstante, en 6 pacientes que aún no habían iniciado tamoxifeno se esperó a finalizar la irradiación para administrarlo.
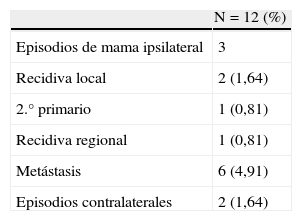
En la tabla 3 se muestra el patrón de recaídas, tanto locales, como a distancia. Con una mediana de seguimiento de 58,29 meses (rango 38-69), 116 (95,08%) pacientes están vivas, de las cuales 114 viven libres de enfermedad y 2, con metástasis óseas. La tasa de recidiva local a los 5 años ha sido del 1,64% y sólo en un caso (0,81%) se presentó una recidiva regional. En el 2,46% de las pacientes se ha presentado un segundo tumor primario: 1 caso en la mama ipsilateral y 2 casos en la mama contralateral. El porcentaje de metástasis a distancia ha sido del 4,91%, fundamentalmente en huesos y pulmón.
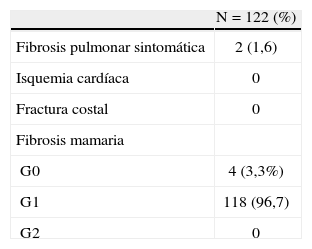
La toxicidad aguda cutánea fue mayoritariamente de grado 0-1 (90,16%), con sólo 1 caso (0,82%) de dermatitis de grado 3 (tabla 4). En cuanto a toxicidad tardía, 2 pacientes presentaron fibrosis pulmonar radiológicamente documentada, precedida de cuadro de tos no productiva. No hemos detectado ningún caso de fractura costal y ninguna paciente desarrolló cardiopatía durante el seguimiento. La fibrosis mamaria fue en todos los casos de grado 0-1 (tabla 5).
Actualmente, hay suficiente evidencia en la bibliografía científica, tanto ensayos aleatorizados10-13, como series de casos17-19, para afirmar que la radioterapia hipofraccionada, después de cirugía conservadora, en cáncer de mama temprano proporciona, al menos, los mismos resultados en términos de control local, supervivencia y toxicidad que los esquemas clásicos.
En el estudio canadiense de Whelan et al11,20, se incluyó a 1.234 pacientes a las que se aleatorizó a recibir radioterapia a dosis 42,5 Gy en 16 fracciones frente a tratamiento convencional con 50 Gy en 25 fracciones. Las tasas de recidiva a 5 y 10 años fueron del 3,2 y el 6,7%, respectivamente, en las pacientes asignadas a tratamiento estándar, frente al 2,8 y al 6,2% en las pacientes asignadas al brazo de tratamiento hipofraccionado. Los resultados estéticos valorados por las pacientes como excelente o buenos, tras 10 años de seguimiento, fueron del 71,3% en el grupo de tratamiento estándar y del 69,8% en el brazo de tratamiento hipofraccionado.
A raíz de la primera publicación de este ensayo, con resultados de no inferioridad para las mujeres sometidas a radioterapia hipofraccionada, adoptamos esta técnica como protocolo institucional en pacientes de riesgo bajo de recidiva local: mujeres mayores de 50 años, con tumores T1-2, N0-1 y amplio margen de resección negativo. Tanto la tasa de recidiva local (1,64%) a 5 años, como la regional (0,81%) han sido muy bajas, como corresponde al grupo de pacientes consideradas, y semejante a la publicada por Whelan et al en su ensayo.
El supuesto incremento de complicaciones pulmonares, cardíacas, óseas o cutáneas, así como un peor resultado estético a largo plazo, han sido argumentos habitualmente utilizados para rechazar el hipofraccionamiento. Sin embargo, en ninguno de los estudios mencionados que específicamente han analizado estos aspectos, se ha podido demostrar peores resultados con los esquemas más cortos. La toxicidad aguda y tardía ha sido baja en nuestro estudio, e igualmente superponible a la publicada en los ensayos que han comparado hipofraccionamiento con fraccionamiento convencional12,13. Así, en el ensayo START A12, realizado entre 1998 y 2002, se aleatorizó a 2.236 pacientes a recibir 39 o 41,6 Gy, en 13 fracciones, durante 5 semanas, frente al tratamiento estándar de 50 Gy en 25 fracciones, durante 5 semanas. Después de 5,1 años de seguimiento, la tasa de recaída locorregional fue del 3,6% en el grupo de 50 Gy; del 3,5% en el de 41,6 Gy, y del 5,2% en el de 39 Gy. La tasa de efectos adversos por radioterapia fue menor en las pacientes que recibieron 39 Gy, frente a las que recibieron 50 Gy, y fue similar entre las irradiadas con 41,6 Gy y las irradiadas con 50 Gy. Los cambios adversos en la piel resultaron ser significativamente menores en las pacientes con 39 Gy, comparado con las de 50 Gy (hazard ratio [HR] = 0,63; intervalo de confianza [IC] del 95%, 0,47-0, 84) y no se observaron diferencias significativas con las pacientes que recibieron 41,6 Gy (HR = 0,83; IC del 95%, 0,63-1, 08).
Igualmente, en el estudio aleatorizado START B13, se asignó a 2.215 mujeres a recibir 40 Gy en 15 fracciones, durante 3 semanas, frente a 50 Gy en 25 fracciones, durante 5 semanas. Con un seguimiento medio de 6 años, la tasa de recaída locorregional a 5 años fue del 2,2% en el brazo de 40 Gy, y del 3,3% en el brazo de 50 Gy. La tasa de efectos adversos por radioterapia fue menor en las pacientes que recibieron 40 Gy, frente a las que recibieron 50 Gy. Los cambios adversos en la piel fueron significativamente menores en las pacientes que recibieron 40 Gy, comparado con las que recibieron 50 Gy (HR = 0,76; IC del 95%, 0,60-0, 97).
A pesar de toda la evidencia clínica, aún hay cierta reticencia por parte de los profesionales para implementar los esquemas de tratamiento hipofraccionado, y es frecuente encontrar opiniones en la bibliografía que consideran que es demasiado pronto para estandarizar este tratamiento. Sin embargo, recientemente se han publicado las recomendaciones del National Institute for Health and Clinical Excellence21 en relación con los esquemas de tratamiento postoperatorio en cáncer de mama y la conclusión es que: “El uso de radioterapia externa a dosis 40 Gy en 15 sesiones puede aceptarse como tratamiento estándar para pacientes con cáncer de mama invasivo después de cirugía conservadora o mastectomía”.
En conclusión, nuestro estudio confirma que en nuestro medio, y en condiciones de práctica clínica habitual, el tratamiento hipofraccionado de las pacientes con cáncer de mama de riesgo bajo, después de una intervención quirúrgica conservadora, proporciona los mismos beneficios que el tratamiento clásico, así como una toxicidad baja, tanto aguda, como tardía. La reducción del tiempo total de tratamiento es, sin duda, uno de los objetivos primordiales del hipofraccionamiento. Con esta técnica, la duración de la radioterapia se reduce de 5 a 3 semanas, lo que supone una mejoría de la calidad de vida de las pacientes y una reducción importante del coste total del tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.