El cáncer de mama localmente avanzado es una forma evolucionada de enfermedad, con presentación variable. Aproximadamente, supone el 15% de las pacientes que tratamos con cáncer de mama. El manejo de estas pacientes es multidisciplinario.
ObjetivoExponer nuestra experiencia y el protocolo en el manejo del cáncer de mama localmente avanzado. Valoramos la tolerancia y la toxicidad del tratamiento neoadyuvante, así como también la respuesta clínica y patológica. Igualmente, se describen las complicaciones quirúrgicas y el resultado estético final.
Pacientes y métodoRealizamos un estudio retrospectivo en 20 mujeres con cáncer de mama localmente avanzado, tratadas en nuestra unidad durante un período de 2 años. Actualmente, seguimos un protocolo de quimioterapia neoadyuvante según el esquema TEC × 6 (docetaxel + epirrubicina + ciclofosfamida) asociado a filgastrim, seguido de cirugía y radioterapia.
ResultadosLos efectos secundarios más frecuentes fueron las náuseas (80%) y la astenia (50%). La respuesta patológica fue completa (tejido de mama y axila) en 6 pacientes (30%); parcial en 10 (50%), y presencia masiva de enfermedad (R0/R1) en 4 (20%). En todas las pacientes se realizó cirugía radical, con reconstrucción inmediata en 16 de ellas.
ConclusiónEl esquema TEC × 6 neoadyuvante presenta una alta tasa de eficacia y una tolerancia aceptable. Los resultados obtenidos con la técnica de mastectomía radical y reconstrucción inmediata fueron muy favorables.
Locally advanced breast cancer is a progressive form of the disease with variable presentation. It affects around 15% of patients who suffer from breast cancer. The management of these patients is multidisciplinary.
ObjectiveTo describe our experience in using a management protocol for locally advanced breast cancer. The tolerance and toxicity of neoadjuvant therapy, and clinical and pathological response to it are assessed. Surgical complications and the final aesthetic results are also discussed.
Patients and methodA retrospective study was conducted on 20 women with locally advanced breast cancer treated in our unit over a period of 2 years. A protocol is currently followed that includes neoadjuvant chemotherapy according to the scheme TEC × 6 (docetaxel + epirubicin + cyclophosphamide) combined with filgrastim followed by surgery and radiotherapy.
ResultsThe most common side effects were nausea (80%) and asthenia (50%). The pathological response was complete (breast and axillary tissue) in 6 patients (30%), partial in 10 (50%), and massive presence of disease (R0/R1) in 4 (20%). All patients underwent radical surgery with 16 patients having immediate reconstruction.
ConclusionThe neoadjuvant TEC × 6 scheme has a high rate of efficacy and an acceptable tolerance. The results obtained with radical mastectomy followed by immediate reconstruction were very favourable.
El cáncer de mama localmente avanzado (CMLA) es una forma evolucionada de la enfermedad, que incluye numerosas presentaciones: tumores T3, T4, N2/N3, así como cáncer inflamatorio1,2.
A pesar de la implantación del programa de detección temprana de cáncer de mama, en nuestro medio, el CMLA supone aproximadamente un 15% de las pacientes intervenidas con cáncer de mama. El mejor conocimiento de la biología del cáncer de mama, así como los avances farmacológicos y en radioterapia conseguidos en los últimos años, han permitido cambiar el tratamiento terapéutico de este tipo de tumores3.
Las complicaciones postoperatorias en las pacientes con CMLA —especialmente las que interesan a la herida quirúrgica y a las secuelas de la cirugía— son significativamente más frecuentes que en aquellos con tumores menos evolucionados y sometidos a una cirugía menos agresiva4. Por otra parte, los decepcionantes resultados obtenidos en series históricas en pacientes con cáncer de mama LMA tratados con cirugía y/o radioterapia no hacen más que confirmar la dificultad de controlar la enfermedad a nivel sistémico con un tratamiento exclusivamente local.
Actualmente, por tanto, el manejo de estas pacientes es multidisciplinario, y puede integrar quimioterapia (neoadyuvante o adyuvante), hormonoterapia, anticuerpos monoclonales, radioterapia y tratamiento quirúrgico. El objetivo final es doble: en primer lugar, mejorar el control sistémico de la enfermedad con tratamiento farmacológico, y así aumentar la supervivencia, y, en segundo lugar, conseguir el control local mediante cirugía y/o radioterapia.
Numerosos autores consideran la quimioterapia neoadyuvante como el tratamiento estándar de pacientes con CMLA, aunque no se ha demostrado superior a la quimioterapia adyuvante en cuanto a términos de supervivencia5.
Disponemos de pocos estudios que traten específicamente sobre las indicaciones de la cirugía conservadora después de quimioterapia neoadyuvante en el CMLA. No obstante, parece confirmarse que la quimioterapia neoadyuvante, en algunos casos, posibilita la cirugía de tumores que, inicialmente por su extensión local, se consideraban inoperables y, en otros, aumenta la probabilidad de cirugía conservadora. En 2008 en el estudio GEPAR se analizó la respuesta patológica ante la quimioterapia neoadyuvante mediante la comparación de los resultados de administrar 6 u 8 ciclos de esquema TEC (docetaxel, adriamicina, ciclofosfamida), siendo similares las respuestas patológicas completas y con menor toxicidad a favor del esquema corto6,7.
Nuestro objetivo es presentar los resultados del protocolo seguido en nuestro hospital durante el período 2008–2009 para el tratamiento de pacientes con CMLA mediante el esquema TEC × 6 neoadyuvante (docetaxel + epirrubicina + ciclofosfamida) asociado a filgastrim y seguido de cirugía radical con reconstrucción inmediata y radioterapia posterior.
Hemos analizado la tolerancia y la respuesta clínica y patológica al tratamiento neoadyuvante, así como el resultado estético después de la cirugía.
Material y métodoSe trata de un estudio retrospectivo en el que se recogen los datos pertenecientes a 20 mujeres con CMLA, tratadas en la Unidad de Mama del Hospital Juan Ramón Jiménez de Huelva, durante los años 2008 y 2009.
Según el protocolo, todas las pacientes recibieron tratamiento neoadyuvante a partir del esquema TEC × 6 (docetaxel: 75mg/m2 por vía intravenosa [IV]; epirrubicina 75mg/m2 IV; ciclofosfamida 500mg/m2 IV) en 6 ciclos de 21 días, y posteriormente sometidas a mastectomía radical modificada +/- reconstrucción inmediata y radioterapia.
Para la reconstrucción mediante implante, hay dos opciones posibles. En los casos en los que la piel ofrece una cobertura adecuada al implante elegido —y permite conseguir una aceptable simetría con la mama contralateral—, en el plano subpectoral colocamos una prótesis de silicona. Si la extirpación de piel mamaria realizada no permite cubrir la prótesis con el volumen adecuado, optamos por la colocación de un expansor con válvula incorporada que se sustituirá por un implante definitivo una vez realizada la expansión tisular necesaria. En ambos casos, ofrecemos la posibilidad de reconstrucción posterior del complejo aréola pezón mediante injerto libre de piel de la región inguinal o mediante tatuaje.
Se analizaron los parámetros siguientes: edad; estado hormonal; tamaño del tumor y estadio clínico; histología tumoral (tipo de tumor, grado de diferenciación, receptores hormonales, sobreexpresión del oncogén HER2/neu); toxicidad del tratamiento; respuesta clínica y patológica tras la quimioterapia; tipo de cirugía realizada, y clasificación pTNM.
La respuesta clínica al tratamiento neoadyuvante se determinó en función de la exploración física de la mama y de la axila, según los criterios siguientes: respuesta completa, como una remisión total del tumor y de las adenopatías si eran palpables previamente; respuesta parcial, como una reducción del tamaño tumoral; progresión, como aumento del tamaño tumoral o extensión a otros sitios; estable, sin cambios respecto a la exploración inicial.
El análisis patológico incluyó el tipo y el grado histológico, la infiltración linfática y vascular, la afectación tumoral de los ganglios axilares, los receptores hormonales y HER2/neu, así como las lesiones asociadas en el resto de la glándula.
Se valoró la respuesta patológica, que se clasificó como: a) completa, cuando no se halló tumor en la mama ni en los ganglios; b) parcial, si se apreció tumor residual o microscópico, y c) falta de respuesta ante la presencia masiva de enfermedad en la pieza extirpada.
ResultadosEn la tabla 1 se muestran los datos referidos a edad, estado hormonal, tipo y estadio tumoral, receptores hormonales y oncogén Her2/neu.
Edad, estado hormonal, tipo y estadio tumoral, receptores hormonales/oncogén Her2/neu
| Edad (años) | Rango 25–63/mediana 46 |
| Estado hormonal | Premenopáusicas 16 |
| Posmenopáusicas 4 | |
| Tipo | Carcinoma ductal 20 |
| Estadio | IIB 8 |
| IIIA 4 | |
| IIIB 8 | |
| Grado de diferenciación | Grado × (indeterminado) 2 |
| Grado I (bien diferenciado) 1 | |
| Grado II (moderadamente diferenciado) 12 | |
| Grado III (poco diferenciado) 5 | |
| Receptores hormonales | RE+: 11 |
| RP+: 11 | |
| RE+/RP+: 10 | |
| RE–/RP–: 8 | |
| Her2/neu | Positivo: 8 |
| Negativo: 12 | |
| pN | Positivo: 10 |
| Negativo:10 |
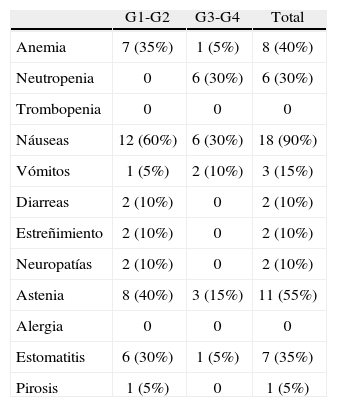
Se valoró la toxicidad del tratamiento neoadyuvante según el grado máximo (G1-G4) alcanzado en cualquier ciclo (tabla 2). Los efectos secundarios más frecuentes fueron náuseas (85%) y astenia (50%). La alopecia apareció en el 100% de las pacientes tratadas, que se consideró inherente al tratamiento. No se produjo ningún caso de neutropenia febril.
Toxicidad
| G1-G2 | G3-G4 | Total | |
| Anemia | 7 (35%) | 1 (5%) | 8 (40%) |
| Neutropenia | 0 | 6 (30%) | 6 (30%) |
| Trombopenia | 0 | 0 | 0 |
| Náuseas | 12 (60%) | 6 (30%) | 18 (90%) |
| Vómitos | 1 (5%) | 2 (10%) | 3 (15%) |
| Diarreas | 2 (10%) | 0 | 2 (10%) |
| Estreñimiento | 2 (10%) | 0 | 2 (10%) |
| Neuropatías | 2 (10%) | 0 | 2 (10%) |
| Astenia | 8 (40%) | 3 (15%) | 11 (55%) |
| Alergia | 0 | 0 | 0 |
| Estomatitis | 6 (30%) | 1 (5%) | 7 (35%) |
| Pirosis | 1 (5%) | 0 | 1 (5%) |
Se apreció respuesta completa con la quimioterapia neoadyuvante en 9 pacientes (45%), y respuesta parcial en 11 pacientes (55%). Ningún paciente se clasificó como “enfermedad estable” o “progresión”, por lo que la tasa de respuesta clínica en nuestra serie fue del 100%.
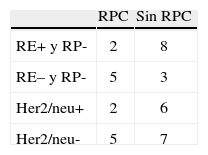
Respuesta patológicaDespués del estudio histológico de la pieza, se consideró que tuvieron una respuesta completa (pT0N0) al tratamiento adyuvante 6 pacientes (30%). En 10 pacientes (50%), la respuesta histológica fue parcial. En 4 pacientes (20%) se apreció falta de respuesta patológica, con persistencia masiva de la enfermedad y, por tanto, enfermedad estable a nivel patológico. En la tabla 3 se muestra la relación entre receptores hormonales y Her2/neu y la respuesta patológica completa.
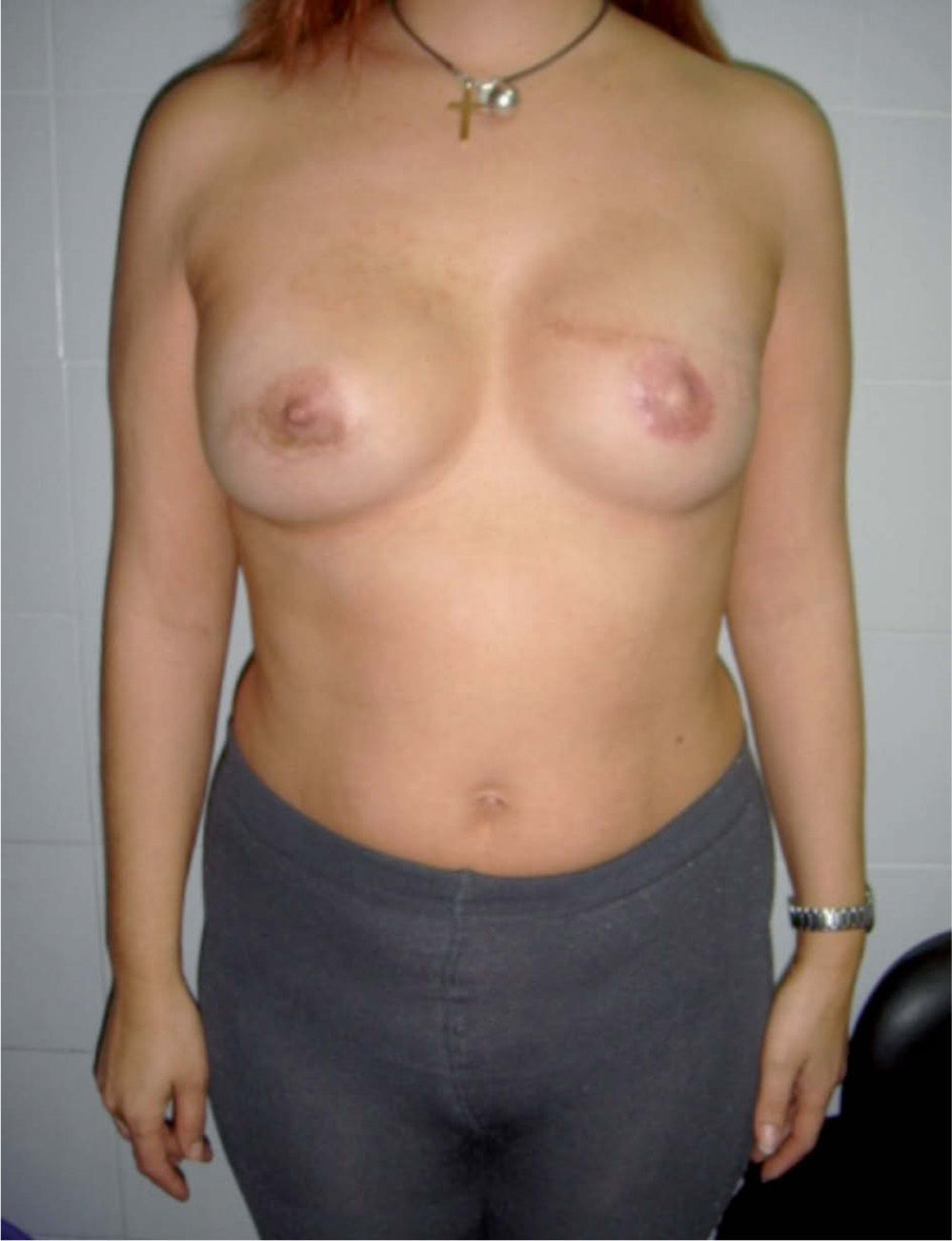
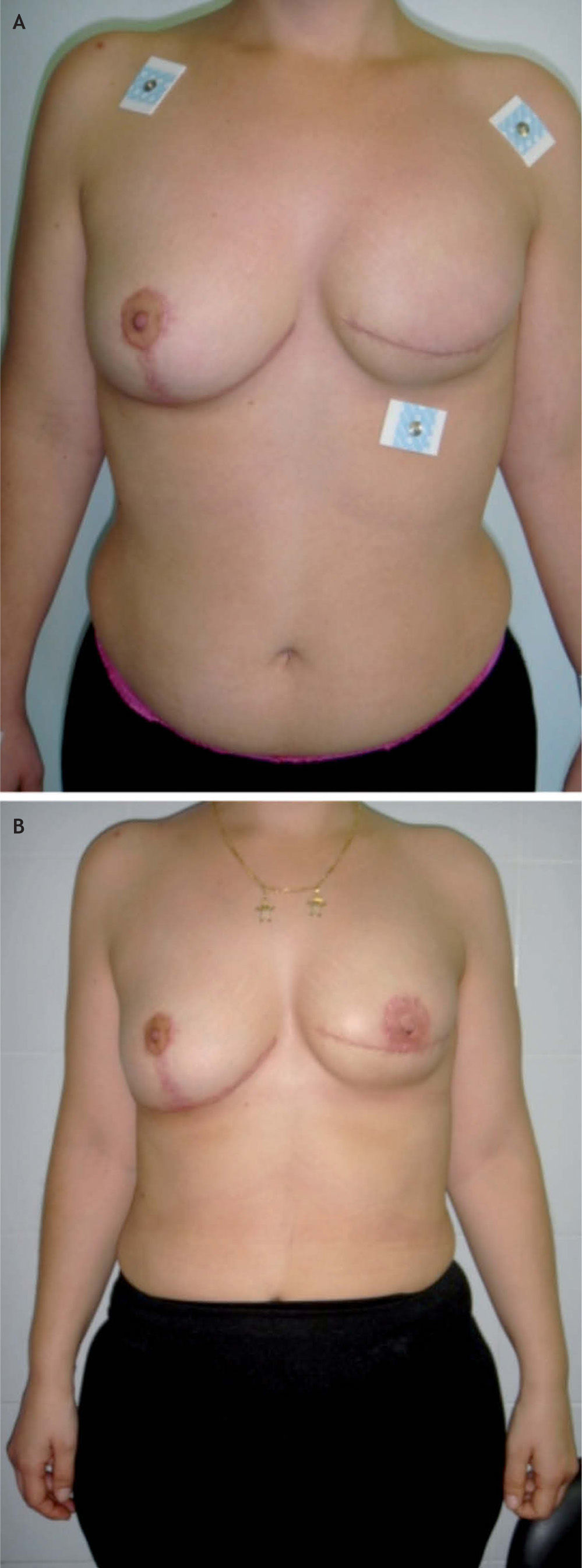
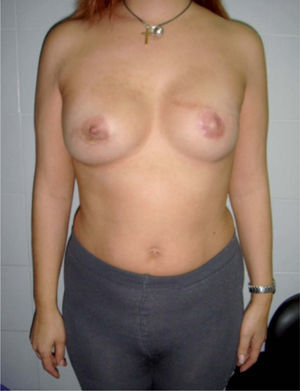
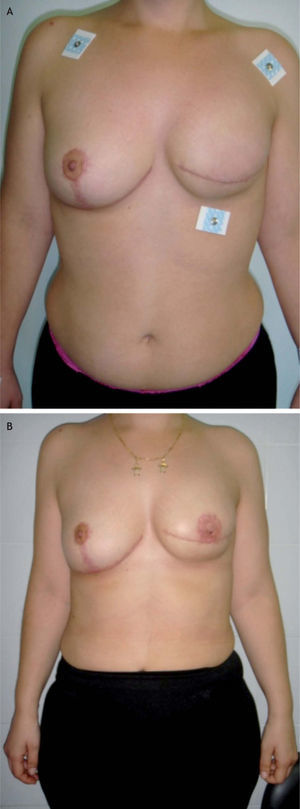
Tipo de cirugía y estadificación posquirúrgicaA todas las pacientes se les practicó una mastectomía radical modificada. En 16 (80%) de las 20 pacientes incluidas en este estudio, se reconstruyeron en la misma intervención quirúrgica mediante un implante protésico. En 5 pacientes se realizó alguna actuación sobre la mama contralateral: 1 mamoplastia reductora y 3 mastectomías subcutáneas con implante protésico (figs. 1 y 2).
Complicaciones postoperatoriasLas complicaciones postoperatorias observadas fueron las siguientes: 4 seromas; 1 caso de linforragia, que precisó mantenimiento del drenaje durante 12 días; 1 hematoma de la herida quirúrgica; 7 casos de parestesias en cara interna del brazo, y necrosis del CAP en una de las pacientes a la que se le practicó una mastectomía subcutánea de la otra mama.
Valoración estéticaEl cirujano y las pacientes valoraron el resultado estético, calificándose de bueno o muy bueno en el 65% de los casos (13 pacientes), según el cirujano, y en el 55% (11 pacientes), según las pacientes. El cirujano consideró un resultado aceptable en el 15% de los casos (3 pacientes), y las pacientes, en el 20% (4 pacientes). Las 4 pacientes no reconstruidas se calificaron como resultado malo o muy malo por el cirujano. Cinco pacientes (25%) valoraron el resultado estético como malo o muy malo.
Tratamiento adyuvanteEn 12 pacientes se inició posteriormente quimioterapia adyuvante con esquema paclitaxel semanal. Las pacientes Her2 positivas recibieron trastuzumab adyuvante, y todas las pacientes con receptores hormonales positivos fueron tratadas con hormonoterapia complementaria. La totalidad de ellas recibieron radioterapia adyuvante.
DiscusiónEl manejo idóneo del CMLA continúa siendo un reto para la mastología actual, y, probablemente, es aquí donde el tratamiento multidisciplinario alcance su mayor protagonismo.
El análisis de los trabajos que comparan la eficacia de esquemas de neoadyuvancia frente a adyuvancia concluyen que no hay diferencias estadísticamente significativas en la supervivencia libre de enfermedad, ni en la supervivencia global al recibir quimioterapia antes o después de la intervención quirúrgica. No obstante, en algunos casos, la quimioterapia neoadyuvante puede rescatar para la cirugía algunos tumores que inicialmente se consideraban inoperables y, en otros, facilitar o permitir una cirugía conservadora8–12.
Hay diferentes sistemas de valoración de la respuesta patológica a la quimioterapia13. La variabilidad en los esquemas de quimioterapia neoadyuvante, en la evaluación de la respuesta y en los objetivos planteados en los diversos estudios realizados, hacen que los resultados sean difícilmente comparables. No obstante, la tasa de respuesta clínica y patológica completa obtenidas en nuestro estudio pueden considerarse equiparables a la de otros grupos que utilizan esquemas de neoadyuvancia similares14.
En los trabajos de Tardivon et al15 se concluye que los parámetros más relevantes para predecir la respuesta tumoral a la quimioterapia son los cambios morfológicos durante el tratamiento, en los que el volumen tumoral es el más importante, el cual también es predictor de la supervivencia libre de recidiva. Posiblemente, la resonancia magnética (RM) es la prueba de elección para valorar la respuesta a la quimioterapia neoadyuvante, y es de cumplimiento obligado en los casos que se contemple la posibilidad de realizar una cirugía conservadora. En nuestras pacientes, se valoró la respuesta a la quimioterapia neoadyuvante mediante exploración física. La RM no hubiese cambiado el tratamiento de estas pacientes, ya que en ningún caso se consideró realizar una cirugía conservadora. Por otra parte, una respuesta completa observada en la RM no significa la desaparición del tumor en todos los casos, por lo que la resección del lecho tumoral y el estudio histológico posterior sigue siendo obligado en estas pacientes16.
Al final, el estudio anatomopatológico de la pieza es el que dictamina el grado de respuesta tumoral a la quimioterapia. La valoración clínica del tamaño tumoral, basada en la exploración17 y en pruebas de imagen, es una aproximación del grado de respuesta a la quimioterapia. Sin embargo, es necesario el estudio anatomopatológico de la pieza quirúrgica para conocer con seguridad esta respuesta. Se ha constatado que el subgrupo de pacientes que alcanza una respuesta patológica completa tras el tratamiento neoadyuvante tiene un riesgo menor de muerte o recurrencia de la enfermedad18. Este hecho ha conducido a que determinados cirujanos extiendan el tratamiento quirúrgico conservador a estas pacientes que obtuvieron una respuesta clínica favorable a la quimioterapia. Según Singletary et al19, aproximadamente un 15–20% de las pacientes con CMLA que reciben quimioterapia neoadyuvante pueden someterse a cirugía conservadora. Sin embargo, hay controversia en cuanto al control locorregional de la enfermedad con cirugía conservadora, entre otras causas, por la frecuente asociación de lesiones in situ o multifocalidad tumoral. Precisamente, estas dudas sobre el control locorregional de la cirugía conservadora y el hecho de asociar una técnica reconstructiva a la mayoría de nuestras pacientes es lo que nos hace seguir decantándonos por la mastectomía. No obstante, consideramos la posibilidad de mastectomía conservadora en algunas pacientes, lo cual obligaría a realizar de forma sistemática una RM previa a la cirugía.
Aunque observamos una proporción mayor de respuestas en pacientes con tumores con receptores hormonales positivos, no hemos encontrado relación estadísticamente significativa entre la respuesta patológica completa al tratamiento neoadyuvante y la expresión de receptores hormonales o del Her2/neu, aunque hay que señalar el limitado tamaño muestral de nuestra serie. Sin embargo, otros autores con similares esquemas de neoadyuvancia sí han detectado mejores respuestas en aquellos casos con receptores hormonales negativos20.
Otro punto controvertido en el manejo del CMLA es la linfadenectomía axilar. Existe consenso sobre la necesidad de conocer la afectación ganglionar en pacientes con cáncer de mama, con la doble finalidad de decidir el tratamiento a seguir y mejorar el control local de la enfermedad. Hasta hace unos años, la linfadenectomía era el único método posible, pero la generalización de la biopsia selectiva del ganglio centinela ha permitido disminuir el número de linfadenectomías axilares y sus complicaciones. Según el protocolo establecido, todas las pacientes del presente estudio se sometieron a linfadenectomía axilar. El debate sobre la realización de la técnica del ganglio centinela en pacientes con CMLA no está cerrado. Varios estudios han analizado las ventajas y los inconvenientes de realizar la técnica del ganglio centinela antes o después de la quimioterapia neoadyuvante21–23. Los argumentos en contra de realizar la biopsia del ganglio centinela después de quimioterapia neoadyuvante se basan en que puede producir alteraciones en la red linfática, así como provocar una posible alteración en la difusión del trazador y, por otro lado, que el tratamiento neoadyuvante podría actuar de manera diferente en el ganglio centinela que en otros ganglios. Nuestro grupo se posiciona a favor de la linfadenectomía en estas pacientes, pero habrá que esperar nuevos estudios con los que se pueda establecer claramente qué pacientes son candidatas a la biopsia selectiva del ganglio centinela.
Por último, un aspecto muy valorado por las pacientes intervenidas por cáncer de mama es el resultado estético final. Actualmente, la reconstrucción mamaria es un acto integrado en el tratamiento quirúrgico de las pacientes con cáncer de mama. Un estadio avanzado de la enfermedad en el diagnóstico inicial no supone una contraindicación para la reconstrucción, por tanto, nosotros ofrecemos esta posibilidad a nuestras pacientes. La reconstrucción mamaria atenúa en gran medida los efectos psicológicos que conlleva una amputación mamaria en la mujer y, por tanto, mejora su calidad de vida.
Concluimos que el esquema TEC × 6 neoadyuvante presenta una alta tasa de eficacia y una tolerancia aceptable. El número limitado de pacientes de nuestra serie no permite relacionar de forma significativa la respuesta patológica completa y la expresión de receptores hormonales o Her2/neu. Hasta el momento, nuestro grupo prefiere realizar una mastectomía radical modificada. La incorporación al tratamiento quirúrgico de técnicas de reconstrucción inmediata tiene un efecto psicológico positivo para las pacientes y consigue unos resultados estéticos favorables. Valoraremos la inclusión en nuestro protocolo de la cirugía conservadora y la técnica del ganglio centinela en casos seleccionados de pacientes con CMLA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.