INTRODUCCION
El 5-10 % delos carcinomas mamarios son hereditarios, es decir, presentanantecedentes familiares múltiples de primero y segundo gradocon un patrón de herencia autosómico dominante. En laúltima década se han descrito dos genes cuyamutación está relacionada con el desarrollo de unalto porcentaje de los casos hereditarios de cáncer mamario,los genes BRCA-1 y BRCA-2.Se encuentran en 17q21 y 13q12-q13, codificando proteínas de1.863 y 3.418 aminoácidos respectivamente, ambasrelacionadas con la regulación del ciclo celular y lareparación de ADN1-4.
En lasfamilias portadoras de mutación en BRCA-1 se ha descrito carcinoma demama en edades más jóvenes y con frecuenciabilateral, así como tumores de ovario y próstata. Lamutación en BRCA-2 lleva asociada un mayor riesgo de carcinoma de mama enhombres4-6.
Elconocimiento de las características morfológicas einmunohistoquímicas de las variantes tumorales en losportadores de ambas mutaciones podría establecer unpatrón morfoclínico de identificación. Lasreferencias de la literatura a este respecto coinciden en que setrata de carcinomas ductales infiltrantes (CDI) poco diferenciados,con alta proliferación, variando la incidencia del subtipomedular en la mutación BRCA-1 y de lobulillar enla BRCA-25,7-10. En algunas series se comenta que elpronóstico y evolución de estos pacientes es mejorque el de aquellos sin mutación, aunque compartan datosclínicos y gradohistológico5,6,11.
Elpropósito de este trabajo es la revisión de un grupode pacientes de ambos sexos, con tumores de mama y ovario,portadores de ambas mutaciones, con el fin de establecer elpatrón morfológico e inmunohistoquímico (IHQ).Se definirán los tipos histológicos de lasneoplasias, el grado de malignidad óptico y lacorrelación inmunohistoquímica con un panel deestudio que incluye anticuerpos mono y policlonales relacionadoscon receptores hormonales, agresividad, expresión deloncogén c-erb-2 en mama, y BRCA-1,añadiendo otros marcadores en los casos de carcinoma deovario (CEA, Ca 125 y Ca 19.9).
MATERIAL YMÉTODOS
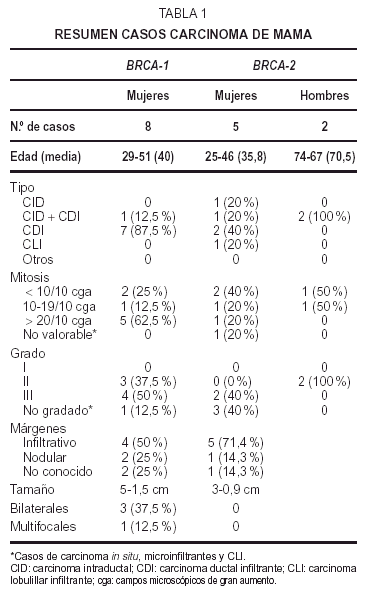
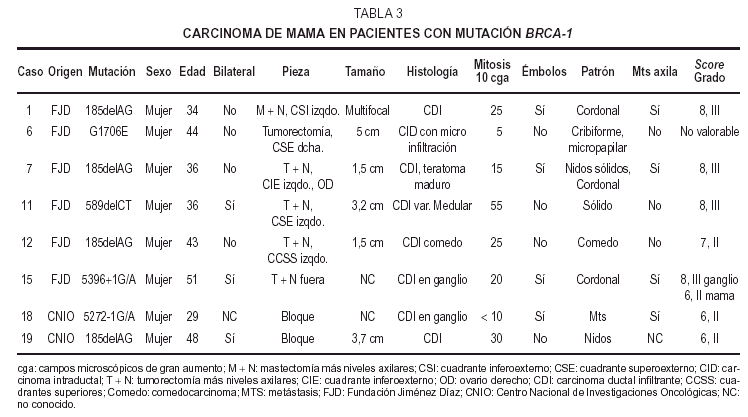
Se estudian19 casos familiares de carcinoma de mama y ovario de pacientesportadores de mutación en BRCA-1 (11 casos) o BRCA-2 (8 casos) trasanálisis genético. Quince de las enfermas fuerondiagnosticadas, intervenidas y tratadas en la FundaciónJiménez Díaz (FJD). Otros 4 casos se remitieron deotros hospitales de la Comunidad de Madrid, tras su estudiomolecular en el Centro Nacional de InvestigacionesOncológicas (CNIO)12.
De los casospropios (FJD) se reconsidera el estudio histopatológicocompleto (tamaño tumoral, nódulos únicos omúltiples, uni o bilateralidad de la neoplasia ylinfadenopatías axilares; así mismo uni obilateralidad y extensión de los tumores ováricos).De los casos de consulta (CNIO) con estudio molecular positivo,sólo se dispone de bloque de parafina y algunos datosclínicos. De cada caso se revisaron los cortesteñidos con hematoxilina-eosina (HE), eligiendo para estudioIHQ el bloque de parafina más representativo de lalesión tumoral. El diagnóstico morfológico fuerevisado por dos o más patólogos. El grado dediferenciación se valora según la escala deBloom-Richardson13 utilizada en la prácticadiaria, para los CDI de mama, que considera la formación detubos, atipias y mitosis (estas se cuantifican ópticamenteen diez campos microscópicos de gran aumento[cga]).
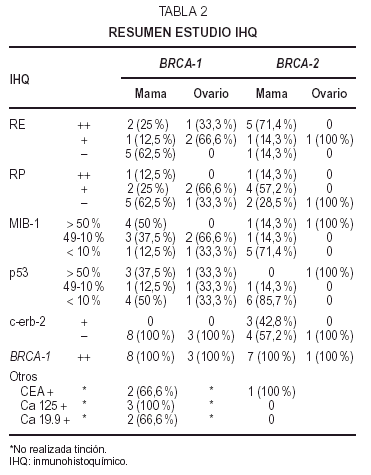
El estudioIHQ incluye tinción con anticuerpos monoclonales parareceptores estrogénicos (Novocastra, dilución 1:30,nuclear), receptores de progesterona (Novocastra, 1:30, nuclear),MIB-1 (DAKO, 1:30, nuclear), BRCA-1 (Oncogene Res. Product,1:50, nuclear) y el anticuerpo policlonal antioncogénc-erb-2 (DAKO, 1:2000,membrana). Se añade la proteína del gensupresor p53 (Novocastra-DAKO, 1:50, nuclear) para valorar una mayor agresividadsi la positividad es alta y la bcl-2 relacionada (DAKO, 1:80,citoplasma) para confirmar la positividad para receptoreshormonales. En los tumores ováricos se suman otrosmarcadores: CEA (DAKO, 1:10000, citoplasma), Ca 19.9 (Novocastra,1:100, membrana) y Ca 125 (Novocastra, 1:100, membrana).
Se utiliza latécnica de Estreptavidina-biotina, según varianteENVISION con el autoteñidor TECH-MATE (Dako), obteniendoresultados fidedignos tanto de los marcadores nucleares como demembrana. La cuantificación de MIB-1 y p53 se realiza trascontaje de 10 campos ópticos de gran aumento,considerándose tres grupos, los que muestran positividad enmás del 50 % del tumor, los que están entre 49 y 10 %y aquellos que son positivos en menos de un 10 % del tumor. Tantoen los marcadores nucleares como de membrana, se considera laintensidad de la tinción, siendo negativa (),débil (+) o fuerte(++), correlacionándoseademás con el porcentaje de células teñidas.C-erb-2 sólo se considera positivo si tiñe másde un 70 % de las células con expresión completa enmembrana.
RESULTADOS
Casos con mutaciónen BRCA-1
Los 11 casoscon mutación en BRCA-1, pertenecían a mujeres, ocho presentaroncarcinomas de mama y tres carcinoma de mama y ovario (tablas 1 y2).
Tumores de mama(tabla3)
Las edades deestas pacientes estaban comprendidas entre los 29 y los 51años, con una media de 40 años, apareciendo lostumores de mayor grado en mujeres jóvenes de 34 y 36años; no obstante, la paciente más joven, de 29años, mostró un CDI grado II. Cinco casos eranunilaterales y tres bilaterales. La localización fuevariable, cuatro derechos, dos izquierdos, y uno bilateralsimultáneo; predominando en el cuadrante superoexterno. Eltamaño tumoral osciló entre 5 y 1,5 cm. Todos loscasos fueron tumores únicos a excepción de un CDIgrado III multifocal unilateral, midiendo el foco mayor másde 1,5 cm de diámetro. Cuatro mostraron bordes estrelladosinfiltrativos y dos buena delimitación. Aparecieronmetástasis axilares en cuatro CDI de grados II yIII.
Una de laspacientes con CDI grado III presentó simultáneamenteal diagnóstico una masa en ovario izquierdo, diagnosticadade teratoma quístico maduro y no incluida en este estudiopor tratarse de una neoplasia benigna de estirpe germinal, enprincipio no relacionada con el síndrome de carcinoma demama-ovario hereditario.
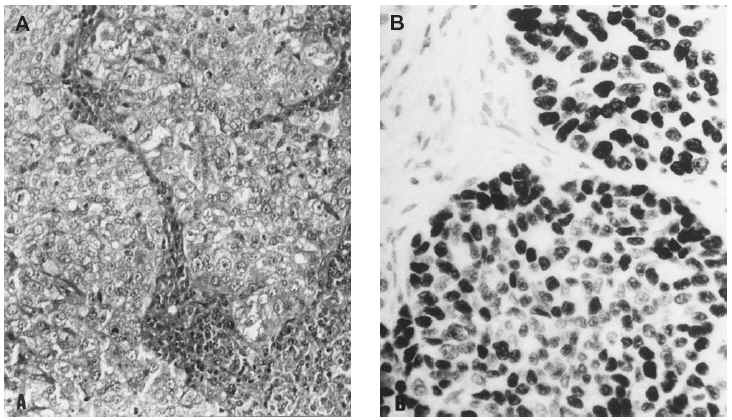
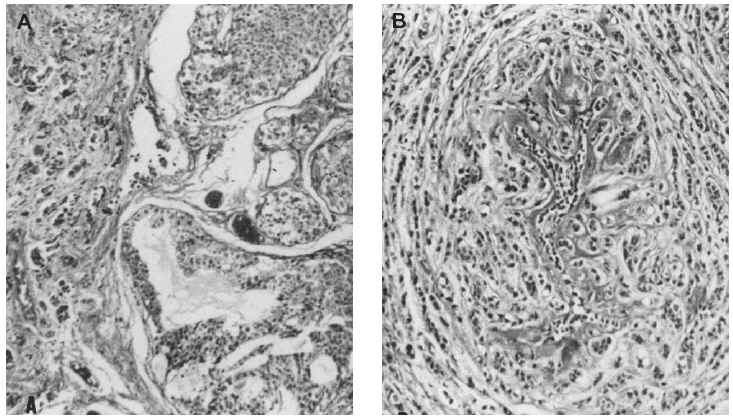
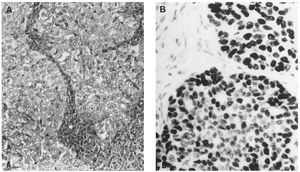
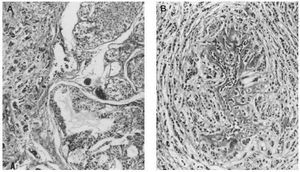
Microscopiaóptica. Siete de los casos fueron CDI: cuatro de grado III conalto número de mitosis (más de 20/10 cga) uno deellos subtipo medular, tres grado II de los que dos mostrarontambién alto índice mitótico (entre 10-26c.g.a.) El patrón es cordonal y en nidos sólidos(fig. 1A); cuatro presentaron émbolos tumoraleslinfáticos.
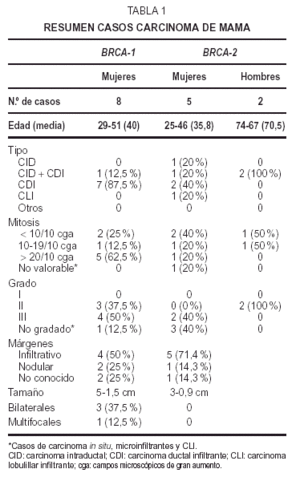
Fig 1A yB. Carcinoma de mama-ovario BRCA-1. A) Carcinoma ductal infiltrante (HE, x 40); B) carcinoma de ovariopoco diferenciado (tinción para p53, x 40).
El restantecorrespondió a un carcinoma intraductal (CID) con un foco demicroinfiltración, de patrón cribiforme ymicropapilar con microcalcificaciones, de bajo grado nuclear conescasas mitosis.
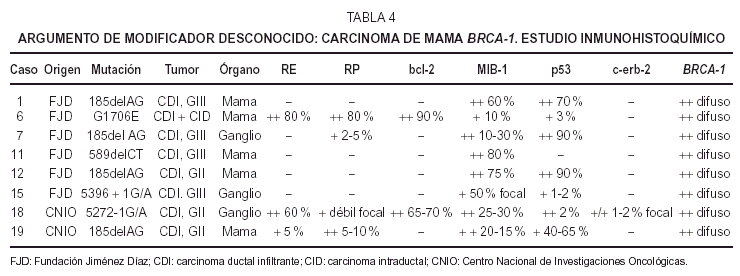
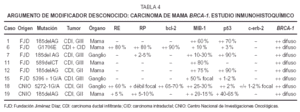
Inmunohistoquímica (tabla 4). Los receptoresestrogénicos (RE) fueron negativos o se expresarondébilmente en 6 casos de CDI, de grados II y III. Tansólo existió positividad en un caso de CDI grado II yen el CID con microinfiltración. La tincióncitoplásmica para el anticuerpo bcl-2 fue paralela a latinción para RE.
Losreceptores deprogesterona (RP) fueron negativos en cuatro CDI, débilmentepositivos en tres e intensamente positivos en elintraductal.
Unaproliferación (MIB-1) alta, mayor del 50 % existía en4 casos (tres de grado III y uno de grado II). En los cuatrorestantes era menor de 30 %; el CID mostró unaproliferación menor a un 10 %.
Laexpresión de proteína p53 fue muy variable: cuatrocasos mostraron positividad mayor del 50 %, dos CDI grado II y dosgrado III. Los otros 4 casos resultaron negativos o mostrarondébil tinción en menos del 5 %. La tinciónpara p53 no se correlaciona con la proliferación ya que dosde los casos positivos muestran baja proliferación y dos delos casos negativos muestran alta proliferación.
C-erb-2 fuenegativo; sólo uno de los casos mostró tincióndébil e incompleta de membrana en 1-2 % de lascélulas (no valorable).
Tumoresováricos
Presentadospor 3 pacientes, todas con cáncer mamario previo,intervenidas en otros centros hospitalarios (tabla 5). La edadoscila entre 46 y 55 años. Dos fueron masas ováricasbilaterales con carcinomatosis peritoneal y la tercera una masaovárica unilateral derecha con implantes pélvicos yabdominales.
En el estudiohistológico los dos primeros casos correspondieron aadenocarcinomas poco diferenciados con alto número demitosis, uno con histología compatible con"metástasis de tumor mamario"; el tercero, de origencelomógeno mostró un patrón de adenocarcinomapapilar seroso poco diferenciado.
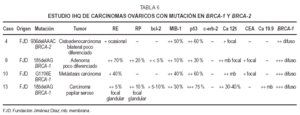
En el estudioIHQ (tabla 6) los dos primeros casos mostraron positividad del 70 y40 %, respectivamente, para RE, mientras que el carcinoma papilarseroso fue positivo focalmente (5 %) en áreas de aspectoglandular. Los RP fueron positivos débilmente en el 20 % enel primer caso de adenocarcinoma poco diferenciado, y focalmente,al igual que los estrógenos, en el papilar seroso; siendonegativos en el caso metastásico. La tinción para elanticuerpo bcl-2 fue positiva débil en el adenocarcinomapoco diferenciado y en el papilar seroso; fue negativa en el casometastásico. El alto índice mitóticoóptico se correlacionó con la expresión deMIB-1, de 10, 40 y 30 %, respectivamente. La tinción para elanticuerpo p53 demostró también positividad alta: 30,60 y 75 % (fig. 1B). C-erb-2 fue negativo en todos loscasos.
El CEA fuepositivo focal en dos casos, Ca 125 así mismo positivo focalen los tres casos y Ca 19.9 positivo focal en un caso.
Latinción para BRCA-1 fue positiva en todos los casos (mama y ovario) ennúcleo, o núcleo/citoplasma sin relación conla dilución del antisuero o con los métodos derecuperación antigénica.
Casos con mutaciónen BRCA-2
Los 8 casoscon mutación en BRCA-2 correspondían a 6 mujeres (cinco con carcinomamamario y una con carcinoma ovárico y mamario previo) y ados hombres con cáncer de mama (v. tablas 1 y 2).
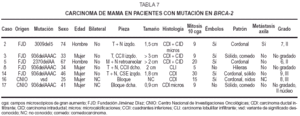
Tumores de mama(tabla7)
Las edades delas pacientes con tumores mamarios estaban comprendidas entre 25 y46 años (media de 35,8 años). Los hombres eran de 74y 67 años.
Ningúncaso fue bilateral o multifocal. La localización fueizquierda en 3 casos y derecha en uno, dos en cuadrantesuperoexterno, dos inferiores y uno retroareolar. El tamañovarió entre 3 y 0,9 cm. Cinco casos mostraron contornosestrellados infiltrativos y uno bien delimitado. Sólo uno delos casos reveló metástasis ganglionaresaxilares.
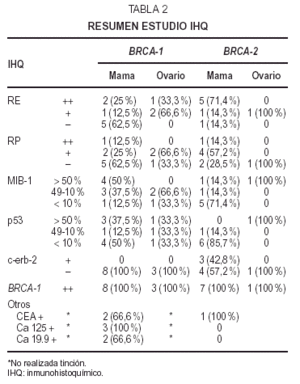
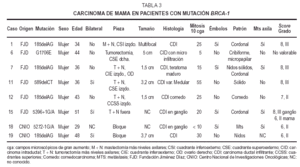
Microscopiaóptica: cinco fueron CDI (tres con componente intraductalasociado), uno carcinoma lobulillar infiltrante (CLI) y el restanteCID tipo comedocarcinoma con microcalcificaciones de alto gradonuclear. De los CDI dos casos eran grado III, dos grado II y en elrestante no se evaluó el grado por tratarse tan sólode pequeño foco infiltrativo. El índicemitótico osciló entre 5 y 30/10 cga (fig. 2A-2B). LosCDI tenían un patrón de crecimiento cordonal o ennidos. El CLI presenta infiltración en hileras decélulas monomorfas. Todos los casos excepto el CID y el CLImostraban múltiples embolizaciones tumoraleslinfáticas.
Fig 2A yB. Carcinoma de mama BRCA-2.A) Carcinoma intraductal-carcinoma ductal infiltrante (HE, x10); B) carcinomalobulillar infiltrante (HE, x 40).
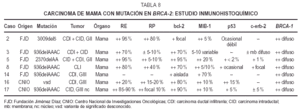
En lainmunohistoquímica (tabla 8) los RE mostraron positividadvariable entre 20 y 95 % en los CDI, intensa en dos de grado II-IIIy CID con microinfiltración; débil en uno grado III;un caso grado III fue negativo. Los RP fueron positivos intensos enmás del 80 % del tumor en 1 caso de grado III, positivosdébiles en menos del 20-15 % en 3 casos y negativos en elmismo caso negativo para RE. La tinción para bcl-2 secorrelacionó con los RE, a excepción de 1caso.
Latinción para MIB-1 fue positiva débil, pero enmás del 70 % en 1 caso de grado III, mientras que en elresto oscila entre un 5-20 % del tumor. p53 es positivo en el 15 %del tumor en un caso de grado III; el resto muestra positividadocasional débil o negatividad. C-erb-2 es débilmentepositivo en 2 casos.
El CIDmuestra intensa positividad en más del 90 % para RE y bcl-2,en menos del 10 % para RP, una proliferación del 10 %, conp53 del 5 % débil y focos positivos débiles parac-erb-2.
El CLI espositivo para RE y bcl-2 en más del 75 %, para RP en el 40%, muestra una proliferación del 5-10 % (MIB-1), ocasional ydébil tinción para p53 y focal parac-erb-2.
Los casos decarcinoma masculinos (2 y 5 de la tabla) corresponden a CDI degrado II, con intraductal asociado, émboloslinfáticos y con metástasis axilares en un caso. Enel estudio IHQ uno de ellos muestra alta expresión de RE,menor de RP, proliferación del 20 % (MIB-1) y ocasional p53y c-erb-2; el otro tiene intensa positividad para receptoreshormonales, con débil y focal expresión de bcl-2,baja proliferación, p53 ocasional y débil y c-erb-2negativos.
Tumorovárico
Elúnico caso de tumor ovárico asociado amutación en BRCA-2 pertenece a una mujer de 54 años; se trata de uncarcinoma bilateral con carcinomatosis peritoneal (tabla 5) pocodiferenciado, que apareció 8 años después uncarcinoma mamario unilateral. Tras revisión de lapunción-aspiración con aguja fina (PAAF)diagnóstica del tumor mamario, se trata de un CDI de altogrado citológico sin receptores hormonales. El estudio IHQdel carcinoma ovárico (tabla 6) reveló unaproliferación del 50 % y expresión de p53 demás del 60 %, los RE débiles y ocasionales, los RP,bcl-2, c-erb-2, CEA y Ca 19.9 negativos y Ca 125 débilmentepositivo focal.
Al igual queel grupo anterior, la tinción con el anticuerpo BRCA-1 de este grupo, fue siemprepositiva (comprobadas distintas concentraciones con controles detejido mamario normal) e independiente de la mutaciónpresentada, con expresión a nivel nuclear ycitoplásmico, tanto del tumor como del parénquimanormal acompañante. Excepcionalmente, algún casomostraba áreas con pérdidas focales detinción.
DISCUSION
Lamutación en BRCA-1 se presenta en un grupo de mujeres jóvenes (media deedad 40 años), con tumores unilaterales (62,5 %), obilaterales (37,5 %) y con un tamaño máximo de 5 cm;predominan en cuadrantes externos y el contorno liso noinfiltrativo sólo aparece en un 25 %.
Desde elpunto de vista histológico los más frecuentes son CDI(87,5 %). En un 12,5 % asociado a componente intraductal. Son pocodiferenciados, grado II-III, score de Bloom 6-8, con altaproliferación (62 %). Sólo existe un caso decarcinoma medular (12,5 %) y no hubo ningún carcinomalobulillar. Un 62,5 % no expresa receptores hormonales. Laagresividad tumoral es alta, con p53 y MIB-1 positivos en un 50 y40 %. No existe expresión de c-erb-2.
Laaparición de tumores ováricos en este grupo esposterior a carcinoma de mama; son poco diferenciados, con altaagresividad, no exhiben marcadores específicos tisulares quepermitan identificarlos como primarios ováricos, y algunos,a pesar de la desdiferenciación, muestran una leveexpresión de receptores hormonales, hecho que no esfrecuente en los carcinomas ováricos. Parece por elloposible plantear de que se tratara de tumores secundarios oquizá multicéntricos.
Conrelación a los carcinomas mamarios, los hallazgos de estaserie concuerdan con los publicados6,14,15, que resaltanmás la citología y agresividad que los gradoshistopatológicos según la variante de BloomRichardson, habitualmente utilizados en nuestro medio parafacilitar el entendimiento entre morfólogos yterapeutas.
Los tumoresmamarios en las mujeres con mutación BRCA-2 muestran un espectromás amplio. La edad media es de 35 años (menor que enel grupo anterior). Los casos masculinos se presentan a partir dela séptima década. En ambos sexos predominan losductales infiltrantes (71,4 %), poco diferenciados (gradoII-III, score deBloom entre 6-9), con sólo 1 caso lobulillar infiltrante(14,3 %). Todos los tumores son de alto grado citológicoconservando la expresión de receptores hormonales (71,4 %),bajo p53 (85,7 %) y débil expresión de c-erb-2 (42,8%).
Elúnico caso ovárico en este grupo es muy agresivoclínica y morfológicamente con altaproliferación y expresión de p53, así comonegatividad para receptores hormonales y citología semejanteal mamario.
Estoshallazgos concuerdan también con lospublicados5,6,8, aunque en algunas series se cita unmayor número de lobulillares e intraductales y ausencia demedular en relación a los aparecidos en los casos demutación BRCA-16,16,17.
Especificandolos hallazgos histológicos diferenciales, en los casos conambas mutaciones la serie presentada no comparte la mayorincidencia de carcinoma medular descrita por otrosautores6,7,9,17,18 en los BRCA-1. Este subtipo medularexhibe características macro y microscópicasparticulares. Se presenta como nódulo único decontorno liso, no infiltrativo (tumor circunscrito) y los criterioscitohistológicos para su diagnóstico son muyestrictos. Por tanto, pueden existir distintos diagnósticossegún diferentes patólogos y casos de carcinomamedular atípico ser interpretados como CDI de grado III, yaque ambos tipos tumorales comparten alto grado nuclear, tasamitótica, márgenes compresivos, ausencia decomponente intraductal y una mayor agresividad histológica,aunque parece que esto no conlleva peorevolución10.
En cuanto alcomponente no infiltrativo o in situ tumoral, muchas de lasseries afirman una menor frecuencia en los BRCA-1 mutados y mayor enlos BRCA-2,bien aislado o acompañando a tumoresinfiltrantes6,9,15,17. Este hecho parece confirmarse ennuestros casos, con solo un CID con microinfiltración (12,5%) en BRCA-1 ydos (uno puro y otro asociado a CDI) en los BRCA-2 mutados (28,5%).
Los hallazgosIHQ concuerdan con los publicados16,19,20,21 y definenlos dos grupos tumorales. La mutación en BRCA-1 tiene menor o nulaexpresión de receptores hormonales (ausencia dehormonodependencia) con alta proliferación, expresiónvariable de p53 y negatividad para c-erb-2. Los casos mutadosen BRCA-2muestraninmunotinción variable preservando a veces la positividadpara receptores hormonales16,19, además deexpresar débilmente c-erb-2 (42 %).
Ambos tiposson de crecimiento rápido, con alta proliferacióntanto en óptica como en IHQ con MIB-1. Este rasgo difieredel cáncer de mama esporádico, neoplasia generalmentemadura con escasas mitosis y MIB-1 entre 2-5 %.
Tal vezasociado a la excesiva proliferación, se ha demostrado porcitogenética5 que la mutación BRCA-1 conlleva mayoraneuploidía que los controles esporádicos asícomo una mayor angiogénesis22, ambascaracterísticas de mayor agresividad tumoral. No obstante,no está demostrada una peor evolución de estaspacientes, muy al contrario, para algunos grupos elpronóstico es mejor en los BRCA-1 mutados que en los casosesporádicos23.
No hay rasgosdiferenciales macroscópicos entre los mutados y losesporádicos en cuanto a la forma infiltrativa predominanteen ambos, la variabilidad de tamaño tumoral, la mayorunilateralidad y la localización más frecuente encuadrantes externos. La edad de presentación es inferior ala de los carcinomas de mama-ovario en mujeres noportadoras.
En cuanto alos carcinomas mamarios del sexo masculino, los dos casospresentados son, moderadamente diferenciados, con expresiónde receptores hormonales, p53 bajo y proliferación variable.Estos hallazgos coinciden con los publicados en otrasseries24, por lo que algunos autores sugieren inclusouna patogenia y evolución25 diferente a losfemeninos. Este hecho no es compartido por otros,considerándolos similares en ambos sexos, aunque resaltan laexpresión constante de receptores hormonales en los casosmasculinos26.
Con respectoa los tumores ováricos existe uniformidadinmunomorfológicas. Son de estirpe epitelial, pocodiferenciados, de alto grado citológico, elevadaexpresión de p53 y MIB-1 y de alta agresividadclínica. Estos datos coinciden con los publicados en laliteratura donde se resalta sobre todo la sobreexpresión dela proteína mutada p5327,28 En alguno de estosestudios11,29 se demuestra que la supervivencia yevolución de las pacientes con mutación enBRCA-1 son mejores que las nomutadas, hecho que deberá comprobarse con series másamplias.
Desde elpunto de vista genético ambos genes se han relacionado conel ciclo celular y la reparación de ADN1,3. Elgen BRCA-1sintetiza unaproteína que parece intervenir en el control de laproliferación celular y la estabilidad genética, porello su mutación provoca tumores con alto índicemitótico. El gen BRCA-2 está relacionado además con unaproteína tisular cuya alteración provoca una malainteracción celular con menor diferenciaciónhistológica15,30-33. La oncogénesispodría además estar influenciada por lainteracción4,34 entre las proteínassintetizadas por estos genes con las proteínas Rad-51 yp53.
No se hapodido demostrar una correlación genotípica-IHQ, quepueda ayudar a identificar los casos portadores en tejido. Elanticuerpo anti-BRCA-1 utilizado (AB1-MS110) es el mejor de los comercializadosactualmente, tiñe en parafina, y la correctavaloración debe establecerse por la positividad nuclear. Noobstante, en nuestra experiencia todos los casos (incluyendocontroles y BRCA-2)son positivos en núcleo, o núcleo/citoplasma sinrelación ni con la dilución ni con larecuperación antigénica. Son escasos los trabajos coneste anticuerpo, y las valoraciones aleatorias35,36, porlo que no creemos que los resultados obtenidos sean valorables. Losanti-BRCA-2disponibles(AB-2) tiñen sólo en congelación por lo que nohan sido utilizados en este estudio, realizado en muestrasincluidas en parafina.
Los datosaportados con esta serie confirman que los carcinomas de uno y otrogrupo BRCA-1 y 2 mutados no sontotalmente distintos en el fenotipo citohistológico e IHQ.Sin embargo, puede afirmarse que la mayoría de los casos conmutación en BRCA-1 corresponde a tumores de mujeres más jóvenes,pobremente diferenciados, sin expresión de receptoreshormonales, con alta reduplicación, a veces compartida conelevada expresión de p53 y sin positividad para c-erb-2. Lamutación BRCA-2 esmenos característica, puede conservar receptores hormonalesy c-erb-2, y sus distintos patrones morfo-IHQ recuerdan mása los carcinomas esporádicos.
No existe unmarcador de identificación a priori ni por rasgos demorfología macro y microscópica ni por IHQ, aexcepción de un grupo de portadoras de BRCA-1. Tal vez, trabajosposteriores amplíen el actual conocimiento, sobre todo si secuenta con anticuerpos monoclonales específicos ante las dosmutaciones. Esto significaría poder identificar a laspacientes portadoras y proponerles un correcto estudiogenético, tanto a ellas como a sus familias, para ulteriorprofilaxis.
AGRADECIMIENTOS
A TrinidadCarrizosa y Alicia Barroso por las técnicasinmunohistoquímicas y moleculares. Al Banco de Tumores delCNIO por canalizar los casos de consulta.