INTRODUCCION
Entre aquellos factores pronósticos aceptados en el cáncer de mama, el grado histológico (Scarf Bloom) es uno de los más fiables junto con el tamaño tumoral y la presencia/ausencia de afectación ganglionar1,2. Recientemente, se han propuesto otros factores biológicos no solo por su significado pronóstico sino también por su valor predictivo, el cual puede repercutir en un beneficio terapéutico.
El proto-oncogén c-erbB-2/HER-2 (HER2) se localiza en el cromosoma 17q12-21.32, y se ha comprobado que codifica para una glicoproteína transmembrana de 185 KDa (p185HER2) perteneciente a una subfamilia de proteínas receptoras de factores de crecimiento con actividad tirosina quinasa (receptores tipo 1)3. Estas proteínas juegan un papel crucial en la mediación de la proliferación y diferenciación de las células normales4. Además de HER2, los receptores tipo 1 comprenden al receptor del factor de crecimiento epidérmico (EGFR), c-erbB-3 (HER3), y c-erbB-4 (HER4). Todos estos receptores presentan la misma estructura básica: un dominio extracelular de unión al ligando, un dominio transmembrana y un intracitoplasmático con actividad tirosina quinasa que es activado por la unión del ligando4. La hiperexpresión de HER2 conlleva la dimerización del receptor, la activación de la función tirosina quinasa, la autofosforilación del receptor, y la activación subsecuente de sustratos con actividad quinasa implicados en los mecanismos de transducción de señales, los cuales afectan eventualmente la trasncripción nuclear de los genes implicados en la progresión del ciclo celular5.
Se ha descrito que el oncogén HER2 se encuentra frecuentemente alterado en los carcinomas humanos5. En el cáncer de mama en particular, la hiperexpresión del gen HER2 se ha descrito entre un 10 % a un 34 % de las muestras, de las cuales, aproximadamente de entre 90 % a un 95 %, la hiperexpresión es consecuencia directa de la amplificación génica6-8. Tras el trabajo original de Slamon y colaboradores8 en 1987, muchos investigadores han considerado el potencial pronóstico del estatus de HER2, en el sentido de que aquellas neoplasias con hiperexpresión/amplificación de HER2 están asociadas con una peor evolución clínica7-9. Más interesantemente, los análisis retrospectivos de ensayos clínicos indican que esta alteración puede ser indicadora de respuesta a ciertos tipos de quimioterapia7,9-11 y tratamiento endocrino7,9,12. Sin embargo, las conclusiones finales permanecen por esclarecer. Por otra parte, estudios en fase preclínica han mostrado que el uso de anticuerpos monoclonales dirigidos contra HER2 son capaces de inhibir tanto la proliferación in vitro de las células que hiperexpresan HER2 como el crecimiento in vivo de cáncer de mama humano xenotransplantado en ratones atímicos9,13. Estos hallazgos han abierto una nueva aproximación en la terapia con anticuerpos monoclonales contra HER2 en el cáncer de mama con Herceptin® (trastuzumab), que ha mostrado ser activa en el tratamiento de pacientes con cáncer de mama metastático que expresan HER2 y en los que el tratamiento quimiterápico previo ha fracasado9,14. Así pues, el uso óptimo de este tipo de terapia requiere la determinación adecuada del estatus del gen HER2, debido a que hasta la fecha, la presencia de esta alteración es el único criterio para el tratamiento con trastuzumab. En este contexto, existe una demanda clínica creciente del análisis del estatus del oncogén HER2 sobre cánceres de mama actuales o archivados ya que éste proporciona una valiosa información desde el punto de vista pronóstico, predictivo y terapéutico. Por lo tanto, el desarrollo de un test sensible y reproductible para la determinación del estatus de HER2 en muestras de cáncer de mama es de gran importancia para optimizar el tratamiento de estas pacientes. En la actualidad existen disponibles una gran variedad de métodos para la determinación del estaus de HER2 sobre tejidos fijados e incluidos en parafina, como son la determinación inmunohistoquímica de la expresión proteica, o la determinación de la amplificación génica mediante hibridación fluorescente in situ (FISH) o PCR diferencial (dPCR)15-17. Recientemente, el Colegio de Patólogos Americanos ha establecido una serie de recomendaciones en relación con el testado del estatus de HER2 en las pacientes con cáncer de mama18, sin embargo, todavía persiste una álgida controversia con relación a la manera en la que se debería realizar este test9,17.
El objetivo del presente estudio es determinar el estatus del oncogén HER2 a nivel de expresión inmunohistoquímica (IHQ), utilizando el anticuerpo monoclonal CB11 y el kit HercepTest de DAKO Corp., así como el grado de amplificación génica mediante FISH y PCR diferencial (dPCR). Para ello se ha estudiado una cohorte de 102 casos de cáncer de mama invasivo seleccionados al azar, y se han comparado de las diversas metodologías con el grado histológico y elegir así la metodología más adecuada para asegurar el estatus de HER2, a la vez que confirmar los estudios previos cuando emplean las mismas metodologías.
MATERIAL Y MÉTODOS
Para este estudio retrospectivo, se han seleccionado al azar 102 bloques de parafina de cáncer de mama invasivo recogidos entre 1982 y 1993 en el Instituto Valenciano de Oncología. Los tumores de mama se graduaron a partir de secciones teñidas con H&E de acuerdo al score modificado de Bloom y Richardson1,2.
Inmunohistoquímica
La hiperexpresión de la proteína HER2 se ha evaluado inmunohistoquímicamente utilizando un anticuerpo monoclonal dirigido contra el domino interno de la proteína, el clon NCL-CB1119 (dilución 1:50; Novocastra Laboratories, Newcastle upon Tyne, England). Brevemente, se cortaron secciones de 4 mm sobre portaobjetos tratados con poli-Lisina a partir de bloques de tejido fijado e incluido en parafina. Tras desparafinar el tejido, se procedió a la inhibición de la peroxidasa endógena con una solución de peroxido de hidrógeno al 3 % durante 30 min. Seguidamente, se potenció la inmunoreactividad con un tratamiento de desenmascaramiento antigénico mediante calor en microondas (700 W) en tampón citrato sódico 10 mM, pH 7 durante 10 min, seguido de un enfriamiento de 20 minutos a temperatura ambiente. Para evitar las uniones inespecíficas, las secciones se bloquearon con una solución al 20 % de suero de caballo en tampón fosfato salino (PBS) para posteriormente ser incubadas con el anticuerpo primario durante una hora a temperatura ambiente. A continuación, las preparaciones se lavan dos veces en PBS y se someten al desarrollo de color utilizando DAB (0,05 % 3'3' diamino-benzidina en agua oxigenada al 0,1 %). El control negativo se preparó sustituyendo el anticuerpo primario por PBS. Los portaobjetos se contratiñeron con hematoxilina de Meyer, se deshidrataron y se montaron para su posterior interpretación.
También se evaluó la hiperexpresión de HER2 empleando para ello el kit HercepTest (Dako Corp., Carpintería, CA) siguiendo el protocolo propuesto por los proveedores y que acompaña al kit.
Hibridación fluorescentein situ (FISH)
La hibridación fluorescente in situ (FISH) se llevó a cabo sobre secciones de tejido fijado en formol e incluido en parafina empleando una sonda de ADN específica del gen HER2/neu (Oncor Inc.) con una sonda a -satélite centromérica para controlar el grado de aneuploidía del cromosoma 17 (D17Z1, Oncor Inc.), en el que se encuentra localizado el gen HER2.
Se lleva a cabo una desparafinización de las secciones de 5 mm en una placa calefactora (56 °C) durante 30 min, seguido de tres lavados de 10 minutos cada uno con xilol y dos lavados de 5 minutos cada uno con metanol. Tras una primera incubación de entre 3-15 minutos en una solución 1M de tiocianato sódico en placa calefactora a 80 °C, fue necesaria una digestión enzimática con Proteinasa K 0.2 % (Sigma), o con Pepsina (4mg/ml en HCl 0.2N) (Sigma) a 37 °C durante 5-30 minutos. Previo a la desnaturalización simultánea de sondas y del ADN nuclear, las preparaciones se lavaron y se sometieron a una serie de soluciones alcohólicas crecientes para su deshidratación. Para la unión de la sonda con el ADN problema, la preparación se incuba en una placa calefactora estable a 78-80 °C durante 10 minutos, seguida de una incubación a 37 °C en cámara húmeda durante toda la noche. Los portaobjetos se lavaron a 42 °C durante 15 minutos en una solución al 50 % de formamida/2XSSC, seguidos de dos lavados en 2XSSC durante 7 minutos cada uno. Las secuencias biotiniladas se detectaron y amplificaron con avidina y un anticuerpo antiavidina conjugado con fluoresceína (Oncor). Por el contrario, las sondas marcadas con digoxigenina, se detectaron y amplificaron con un anticuerpo antidigoxigenina y uno secundario conjugado con rodamina (Oncor). Finalmente, las secciones se contratiñeron con DAPI y se visualizaron utilizando un microscopio Zeiss Axioplan 2 con los filtros adecuados (Jena, Alemania). Las imágenes se capturaron empleando una cámara de vídeo (IMAC_CCD S30) acoplada a un ordenador personal con el software ISIS 2.85 de MetaSystem (Althlusseim, Alemania). El número de señales se analizó en al menos 500 núcleos.
PCR diferencial
El ADN se aisló a partir de 3-5 secciones de 5 mm de tejido incluido en parafina. Tras la desparafinización, el tejido se resuspendió en < 500 ml de una solución de lisis (SDS 0.5 %, Proteinasa K 0,5 mg/ml, Tris HCl 10mM pH 8, NaCl 0.15M, y EDTA 5mM) y se incubó durante toda la noche a 55 °C. La purificación del ADN se llevó a cabo mediante la extracción con fenol/cloroformo/alcohol isoamílico (25:24:1), precipitación con etanol y disuelto en 10-35 µl de agua ultra pura. Para la reacción de dPCR se tomó 1 ml del ADN purificado.
Cada uno de los casos estudiados se analizó con dos reacciones de co-amplificación. En una de estas reacciones, se amplifica un fragmento de 180-pares de bases (pb) del gen HER2 y uno fragmento de 119-pb correspondiente al gen interferón-b (INFb); en la otra reacción se amplifica un fragmento de 98-pb del gen HER2 y uno de 150-pb del gen interferón g (INFg). Las secuencias de los cebadores utilizados han sido descritas anteriormente20,21.
Cada reacción de PCR consta de 25 ml los cuales contienen 1 ml de ADN purificado, KCl 50mM, Tris HCl 10mM pH 8,3, MgCl2 2.5mM para los cebadores INFb y NEU180 (PE-Applied Biosystem, UK), y MgCl2 2mM para los cebadores INFg y NEU98, 0.2mM de cada dNTP, 0,2 mM para los cebadores de los genes del INF, 0,4 mM y 0,15 mM para los cebadores NEU180 y NEU98 respectivamente, y 0,6 U de AmpliTaq Gold (Perkin Elmer, Norwalk, CT, USA). La reacción de amplificación se realizó en un termociclador modelo 9600 de Perkin Elmer (PE, Norwalk, CT, USA), consistiendo en un paso inicial de desnaturalización a 94 °C durante 10 minutos, seguido de 35 ciclos de amplificación a 94 °C 1.5 minutos, 56 °C 1,5 minutos y 72 °C 1,5 minutos, finalizando con un paso de extensión a 72 °C durante 10 minutos. Los productos de PCR obtenidos se visualizan tras realizar una electroforesis en un gel de agarosa al 2 % que contiene bromuro de etidio y se fotografían. La amplificación del gen HER2 se obtiene comparando la intensidad relativa de las dos bandas obtenidas de cada una de las muestras tras un análisis de imágenes (1D Image Análisis Software, Eastman Kodak, Rochester, NY, USA). Así pues, los tumores que exhiben un incremento $ 2 en el número relativo de copias al control de ADN no amplificado se consideran como amplificados.
Análisis estadístico
Para llevar a cabo el análisis estadístico de la amplificación y la hiperexpresión de HER2 empleamos variables binarias que reflejan el estatus de positividad de las determinaciones (sí o no). Para obtener el grado de asociación entre la hiperexpresión y la amplificación de HER2 se empleó el test del x2 de homogeneidad. La asociación con los parámetros histológicos, todos categóricos, también se obtuvo con el test x2 de homogeneidad, o para una tendencia lineal para variables ordinales. El nivel requerido para alcanzar la significación estadística se estableció en el 5 %.
La técnica del FISH se empleó como estándar de referencia, es decir, los casos positivos por este método se consideraron como verdaderos positivos, y los casos negativos como verdaderos negativos y se calcularon la especificidad y la sensibilidad para la IHQ y la dPCR. Todos los test empleados están incluidos en el paquete estadístico SPSS (versión 10.0).
RESULTADOS
Características de los pacientes
La edad media de las pacientes incluidas en este estudio fue de 51 años (rango, 28-75 años). Desde el punto de vista diagnóstico los tumores se distribuyeron en los siguientes tipos histológicos: 94 carcinomas ductales infiltrantes, 4 carcinomas lobulillares infiltrantes, 2 carcinomas invasivos con características ductales y lobulillares, un carcinoma mucinoso (coloide) y un carcinoma papilar invasor. El grado histológico se llevó a cabo utilizando la modificación del sistema de gradación Bloom-Richardson de Ellston y Ellis1,2. Treinta y uno de los carcinomas analizados fueron de grado I (30.4 %), 44 de grado II (43.1 %) y 27 de grado III (26.5 %).
Inmunohistoquímica
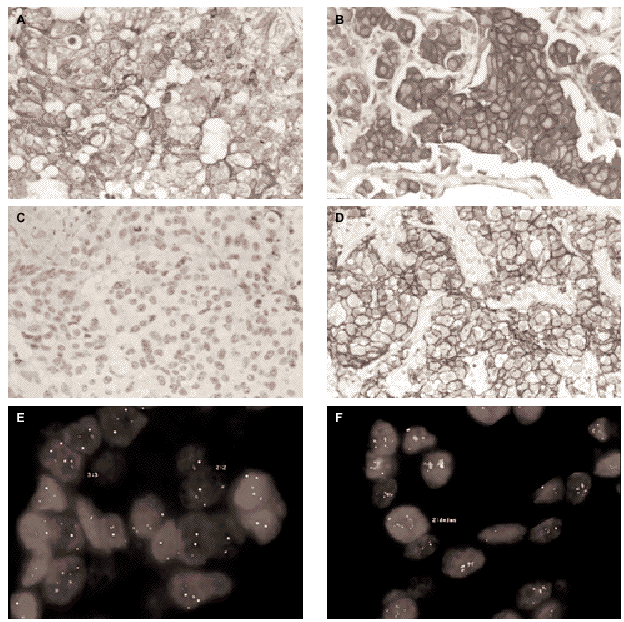
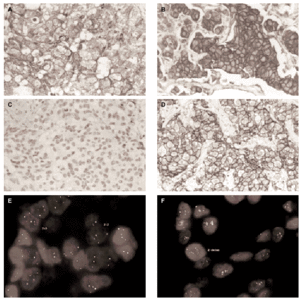
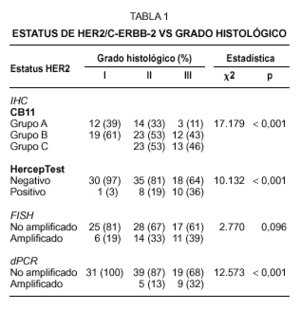
La inmunohistoquímica con el anticuerpo monoclonal CB11 identifica tres grupos de tumores. Grupo A (n = 29, 28,4 %), constituido por tumores sin tinción de membrana, con tinción de membrana completa en menos del 10 % de las células, o tinción membranosa débil incompleta en más del 10 % de las células; grupo B (n = 54, 52,9 %), tumores con una tinción membranosa moderada con o sin tinción citoplasmática dominante (fig. 1A); y grupo C (n = 19; 18,6 %), tumores con una tinción membranosa de débil a intensa, completa en más del 10 % de las células tumorales (fig. 1B). Se observa una fuerte correlación entre la hiperexpresión de HER2 y el grado histológico, observándose que el 46 % de los tumores con un grado histológico III pertenecen al grupo inmunohistoquímico C (tabla 1).
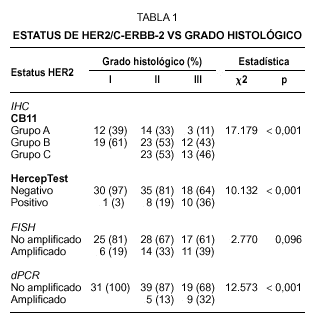
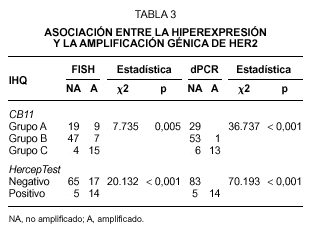
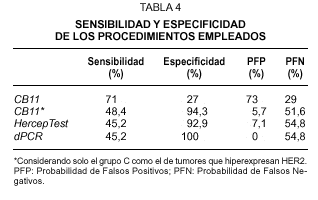
Fig. 1.Determinación del estatus del gen c-erbB-2/HER2 sobre secciones de cáncer de mama invasivo. A) tinción inmunohistoquímica con el clon CB11 mostrando una tinción membranosa moderada y citoplasmática intensa (Grupo B, dudosa positividad). B) tinción inmunohistoquímica con el clon CB11 mostrando una intensa y completa tinción de membrana para HER2 (Grupo C). C y D) tinción inmunohistoquímica con HercepTest de los mismos casos observándose ausencia de tinción (score 0) e intensa hiperexpresión de membrana (store 3+). E y F, muestra una representación del análisis llevado a cabo por FISH con la sondas c-erbB-2 B.5/TRICT y D17Z DG.5/FITC, mostrando un caso no amplificado (3:3) y otro amplificado (2:dmin) respectivamente.
En el caso del procedimiento del HercepTest adoptamos el criterio propuesto en la guía de los proveedores y encontramos que 83 de los 102 casos (81,4 %) pertenecían al grupo catalogado como negativo (score 0 y 1+). Los scores 2+ y 3+ se consideraron como el grupo positivo, haciendo en conjunto una incidencia del 18,6 % de tumores que hiperexpresan la proteína HER2. Como ocurre con el clon CB11, observamos una asociación directa con el grado histológico, aunque la incidencia de los casos positivos en el grado III es inferior que el observado con CB11 (tabla 1).
Se observa una asociación directa entre las técnicas inmunohistoquímicas en la determinación de la hiperexpresión de HER2 (tabla 2). Sin embargo, el procedimiento HercepTest falla en la detección de expresión en 48 casos del grupo B y en 6 casos del grupo C cuando se analizan con el clon CB11. Estas discrepancias son mayores en el grupo B, en el cual únicamente 6 de 54 casos (11 %) exhiben hiperexpresión de HER2 con HercepTest (score 2+). Este grupo está constituido por aquellos tumores con una intensa tinción citoplasmática sin una definición membranosa clara, lo que hace que la interpretación en estas casos sea especialmente dudosa (fig. 1A).
Fig. 2.PCR diferencial para la detección de la amplificación de c-erbB-2/HER2. na, no amplificado; A, amplificado; MWM, marcador de pesos moleculares.
Amplificación génica
El grado de amplificación génica sobre tejido fijado e incluido en parafina se determinó mediante FISH y dPCR. En cuanto al análisis por FISH, y tomando la relación de más de dos señales oncogénicas por centómero del cromosoma 17 como definición de amplificación, encontramos que el 30.4 % de los casos muestran amplificación génica de HER2 (figs. 1E-F). De los 31 casos amplificados, 29 correspondían a carcinomas ductales infiltrantes, uno a un carcinoma invasivo con características ductales y lobulillares y otro caso de un carcinoma lobulillar infiltrante. Aunque observamos una asociación directa entre el FISH y el grado histológico, ésta no alcanza la significación estadística, a diferencia de lo que sucede con la IHQ (tabla 1). Por otra parte, en el caso de la dPCR y a partir del mismo extracto de DNA, las muestras se analizaron en dos ensayos de PCR independientes, cada uno con cebadores diferentes (fig. 2). Observamos un 100 % de reproductibilidad entre ensayos y encontramos amplificación del gen HER2 en 14 carcinomas (13,7 %), todos ellos del tipo ductal infiltrante. Como en el caso de la IHQ, se muestra una asociación directa entre los casos amplificados y el grado histológico, con una mayor incidencia de casos con amplificación de HER2 en los tumores de grado III (tabla 1).
Se observa una correlación directamente proporcional entre los procedimientos de FISH y dPCR (x2 = 36.337; p < 0,001) con una concordancia entre los casos positivos y negativos de un 83 %, de modo que todos los casos en los que se ha detectado amplificación por dPCR también han sido identificados por FISH.
Asociación entre la hiperexpresión y la amplificación génica
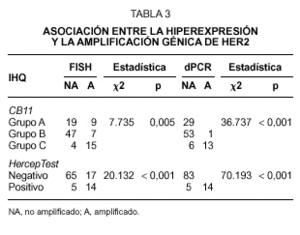
En las 102 muestras tumorales analizadas, detectamos una asociación altamente significativa entre la hiperexpresión y la amplificación de HER2, determinada tanto por FISH como por dPCR (tabla 3). Las concordancias entre resultados positivos y negativos, entre los diferentes procedimientos empleados muestran los siguientes porcentajes. Cuando consideramos el grupo B con el clon CB11 como casos positivos junto con el grupo C, observamos unas concordancias del 41 % y del 42 % con los procedimientos del FISH y dPCR respectivamente. Sin embargo, se alcanza una mayor concordancia cuando únicamente consideramos el grupo C como verdaderamente positivos, siendo las concordancias en este caso del 80 % con el FISH y del 93 % con la dPCR. En el caso del análisis llevado a cabo con el sistema HercepTest, las concordancias encontradas fueron del 78 % y 95 % con los procedimientos de FISH y dPCR respectivamente.
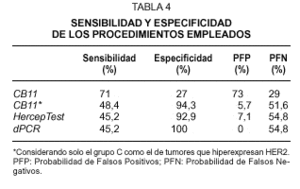
La tabla 4 muestra el grado de sensibilidad, especificidad y las probabilidades de encontrar un resultado falso positivo o falso negativo con las diferentes metodologías empleadas, cuando consideramos el FISH como la técnica estándar "ideal". Es decir, los casos amplificados con este procedimiento se consideran como verdaderos positivos y los no amplificados como verdaderos negativos. Estos resultados, junto con los obtenidos tras el análisis de concordancia, muestran que el ensayo con el clon CB11 sólo es válido cuando se toma como score + el grupo C, y que los métodos de HercepTest y dPCR constituyen técnicas similares para la determinación del estatus de HER2 en tejido fijado e incluido en parafina, aunque la probabilidad de encontrar resultados falsos negativos todavía es alta.
DISCUSION
La demanda oncológica de un procedimiento para la determinación del estaus del oncogén HER2 se ha incrementado considerablemente durante los últimos años, y con ella la necesidad de estandarización de los resultados obtenidos, de modo que puedan ser comparables entre diferentes laboratorios22-24. Aunque el número de procedimientos para la determinación del estatus de HER2 es elevado, no se ha encontrado una concordancia definitiva entre éstos. Actualmente, la FDA (Food and Drug Administration) ha aprobado 4 ensayos comercialmente disponibles para la determinación del estatus de HER2 en las muestras de cáncer de mama (HercepTest, DAKO y CB11 Ventana Medical Systems para inmunohistoquímica; Vysis y Oncor para FISH)16. Además, el Colegio Americano de Patólogos ha propuesto una serie de recomendaciones en relación al testado de los pacientes con cáncer de mama18.
Con el objeto de ganar experiencia personal en el campo creciente del cáncer de mama, en el que la histopatología está llamada a jugar un papel fundamental, hemos llevado a cabo un análisis comparativo entre distintas metodologías disponibles, revisando alrededor de 100 casos de cáncer de mama fijados e incluidos en parafina y tomados al azar y las hemos analizado con 4 procedimientos técnicos. Para llevar a cabo este objetivo hemos empleado dos anticuerpos con la inmunohistoquímica convencional (CB11 de Novocastra y HercepTest de Dako) y los resultados los hemos comparado con los obtenidos por FISH (Oncor) y dPCR. Se ha descrito que la hiperexpresión de la proteína HER2 se ha correlacionado con estadios avanzados del tumor7,12,25, peor evolución clínica7-9,26,27 y una mejor respuesta a la terapia con antiestrógenos y antraciclinas7,10-12,28, así como con el anticuerpo monoclonal, trastuzumab (Herceptin, Genetech, Inc, CA) que actúa directamente frente a la proteína HER2/neu9,14. Todas estas posibilidades pronósticas y terapéuticas subrayan la necesidad de un test válido para la determinación de HER2 en el laboratorio de histopatología.
Aunque la sensibilidad, especificidad y disponibilidad de los tests para la determinación de HER2 han mejorado considerablemente, todavía existe una falta de estandarización metodológica especialmente cuando el procedimiento empleado es la inmunohistoquímica29. La introducción del kit inmunohistoquímico HercepTest de Dako representa un paso hacia la estandarización de la tinción inmunohistoquímica en relación al tumor primario, y a los sistemas tanto de desenmascarado antigénico como de detección. Sin embargo, a pesar de este esfuerzo, los problemas persisten a la hora de la interpretación y valoración de los resultados. La determinación de la expresión de HER2 mediante el kit HercepTest se lleva a cabo sobre tejidos fijados con un protocolo definido, sin embargo, en el presente estudio, las diferencias en cuanto la fijación de las muestras no se ha podido controlar debido a la naturaleza retrospectiva del mismo, y podría explicar, al menos en parte, algunas de las variaciones observadas en el grado de expresión, que pudrían haber afectado al anticuerpo CB11.
Otra crítica en cuanto al análisis inmunohistoquímico tiene que ver con la variabilidad interobservador, principalmente en los niveles intermedios de expresión proteica (store 2+)30. Con el objeto de salvar esta limitación, se han empleado sistemas de análisis de imagen asistidos por ordenador para cuantificar la hiperexpresión de HER231,32. Sin embargo, mientras los resultados cuantitativos proporcionan ventajas en la interpretación de los resultados inmunohistoquímicos, existen una serie de limitaciones que limitan la implantación de esta tecnología a la rutina histopatológica9,17.
Básicamente, se ha establecido que el FISH es el procedimiento que ofrece una mayor especificidad y sensibilidad para la detección de la amplificación génica. Además, los resultados que se han ido publicando estos últimos años encuentran una estrecha relación entre los resultados con FISH con el pronóstico y con la respuesta a la terapia (trastuzumab), lo que le ha merecido la consideración de "estándar de oro"9. Basándonos en estas consideraciones, hemos llevado a cabo este procedimiento sobre nuestro material y hemos considerado un cociente mayor de dos señales génicas/por centrómero del cromosoma 17 para definir la amplificación actual. De este modo, hemos encontrado que el 30.4 % de los casos presentaban amplificación del oncogén HER2. Estos resultados son similares a los recogidos por otros autores en la bibliografía33,34. Parece ser, que la molécula de ADN, diana para las sondas empleadas para el FISH, es menos afectada por las variaciones en cuanto a la fijación del tejido y el procesado de las muestras en relación con lo que le sucede a las proteínas cuando se detectan a nivel inmunohistoquímico. Sin embargo, este último procedimiento es capaz de detectar niveles de expresión de HER2 sobre la superficie de las membranas celulares, sobre las que drogas como el trastuzumab van a actuar específicamente.
El procedimiento de dPCR llevado a cabo en este estudio ha sido menos sensible que el FISH para la determinación de la amplificación génica. Hemos observado una alta correlación entre ambos procedimientos con una concordancia del 83 % tanto para los resultados positivos como para los negativos. Además, el 100 % de los casos en los que se ha demostrado amplificación con dPCR también lo han sido por FISH. O'Malley et al35 han encontrado resultados similares.
El uso de estas dos tecnologías en los laboratorios de histopatología representa una limitación importante, no solo desde el punto de vista técnico, por lo laborioso, sino también económico cuando lo comparamos con el procedimiento inmunohistoquímico9,17. Sin lugar a duda, estas razones son las que hacen que la inmunohistoquímica sea considerada como el procedimiento estándar en los laboratorios de histopatología, limitando el uso del FISH a los casos de difícil interpretación (store 2+). Así pues, la posición más objetiva en este contexto parece ser el uso de métodos de testado para la estandarización inmunohistoquímica con el propósito de ofrecer los resultados de la forma más objetiva posible. La mayoría de las investigaciones en este campo están dirigidas hacia este sentido15,16,36.
Los resultados que aquí se ofrecen con el empleo de dos anticuerpos diferentes para la determinación de la hiperexpresión de HER2 (CB11 y HercepTest) han confirmado estas observaciones. En los 102 casos evaluados en este estudio y tras una interpretación de positividad similar y una evaluación independiente por dos patólogos expertos, hemos encontrado una asociación directa estadísticamente significativa entre ambos procedimientos inmunohistoquímcos. La principal fuente de problemas radicaba en la interpretación de la tinción inmunohistoquímica en aquellos casos con una tinción citoplasmática intensa en combinación con una tinción membranosa en el que los límites de una tinción positiva resultaban dudosos. Este hallazgo se observó con una mayor frecuencia con el empleo del anticuerpo monoclonal CB11 (especialmente en el grupo B), resultando en una especificidad más baja que para el caso del HercepTest (ver tabla 2). Este problema también ha sido descrita por otros investigadores que han empleado anticuerpos similares al clon CB1117,23,31,37. Dadas las dificultades de interpretación que ha suscitado el clon CB11 (grupo B), y habiéndose demostrado que considerando sólo el grupo C como casos realmente positivos para la hiperexpresión del gen HER-2 se obtiene una especificidad y sensibilidad muy similar a la del HercepTest, pensamos que es más recomendable el empleo de este último para la determinación del estatus de HER-2.
El objetivo de esta investigación ha estado principalmente orientado hacia el estudio de diferentes procedimientos para ser aplicados en la detección de la hiperexpresión de HER2 y no en el establecimiento de comparaciones anatomoclínicas con el estadio clínico o evolución clínica de los pacientes analizados. Sin embargo, hemos confirmado publicaciones previas7,12,25 al demostrar la concordancia del grado histológico del tumor con la detección de la hiperexpresión/amplificación tanto por inmunohistoquímica como por FISH tal y como lo muestra la tabla 1. Estos hallazgos potencian el valor de la detección inmunohistoquímica de la hiperexpresión de HER2 como expresión de una mayor agresividad de aquellos carcinomas que hiperexpresan esta proteína. Paradójicamente, únicamente la amplificación detectada por FISH no se asocia estadísticamente con el grado histológico, si bien lo que se observa es una acusada tendencia. Con el objeto de confirmar si estos resultados puedan tener un significado clínico deberían realizarse un mayor número de muestras.
Como conclusión final, los presentes resultados están de acuerdo con la propuesta ofrecida por Schnitt y Jacobs9,17 a modo de guía para la aproximación técnica en la determinación del estatus del oncogén HER2. En ésta se propone que probablemente la inmunohistoquímica (preferiblemente empleando HercepTest) sería el único procedimiento llevado a cabo de forma rutinaria, siendo validada por el FISH especialmente en aquellos casos de difícil interpretación (store 2+).
Este es el procedimiento que se debería seguir hasta que se divise un nuevo test que prediga mejor el pronóstico y la respuesta a la terapia dirigida contra HER2 de aquellos pacientes con un carcinoma de mama.
Agradecimientos
Se agradece la asistencia técnica de Estela Pons, Elisa Alonso y Laura Martínez.