El Ki67 es un marcador de proliferación celular cuya expresión en tumores mamarios se ha relacionado con peor pronóstico y buena respuesta al tratamiento con quimioterapia. Sin embargo, aún no es considerado un marcador independiente y su uso no está extendido en la práctica clínica. El objetivo principal es estudiar el valor del Ki67, determinando su relación con cada uno de los demás factores pronósticos y predictivos clásicos utilizados en el cáncer de mama.
Pacientes y métodoEstudio transversal descriptivo analítico que incluyó 110 pacientes consecutivas con cáncer de mama en estadios iniciales y candidatas a cirugía como primer tratamiento. Se analizó la relación entre el Ki67 y una serie de factores pronósticos y predictivos clásicos del cáncer de mama.
ResultadosEl porcentaje de expresión del Ki67 fue significativamente mayor en los tumores con tamaño mayor a 15mm, grado histológico 3, y que no expresan receptores hormonales. Además se observó una relación inversa entre la sobreexpresión de Ki67 y la expresión del receptor de estrógenos.
ConclusionesNuestros resultados indican que existe una relación significativa entre el Ki67 y el grado histológico, el tamaño tumoral y los receptores hormonales.
Ki67 is a biomarker of cell proliferation and its expression in breast tumors has been associated with worse prognosis and a better response to chemotherapy. However, Ki67 is not yet considered an independent marker and is not yet widely used in clinical practice. The aim of this study was to analyze the value of Ki67, by determining the relationship between Ki67 and each of the other predictive and prognostic factors used in breast cancer.
Patients and methodsThis cross-sectional, analytic and descriptive study included 110 consecutive patients with early-stage breast cancer who were candidates for surgery as the initial treatment. We analyzed the relationship between Ki67 and a series of other classical prognostic and predictive factors.
ResultsThe percentage of Ki67 expression was significantly higher in tumors larger than 15mm, histological grade 3, and tumors not expressing hormone receptors. Linear regression analysis showed a significant inverse relationship between Ki67 expression and estrogen receptor expression.
ConclusionsOur results showed a significant association between Ki67 and histological grade, tumor size, and hormone receptors.
La mortalidad por cáncer de mama ha disminuido significativamente en países desarrollados a partir de 1990. Los factores que han influido en la mejoría de la supervivencia global y libre de enfermedad del cáncer de mama, son la creación de sistemas de cribado para la detección temprana, así como la utilización sistemática y desarrollo de las terapias adyuvantes1. Desde el descubrimiento de la existencia de receptores hormonales y la buena respuesta a tratamientos específicos para los tumores portadores de estos receptores, siguiendo por el hallazgo de la sobreexpresión del HER2 y el nacimiento de una terapia específica o diana para este subtipo tumoral, la investigación en el cáncer de mama se ha centrado en la búsqueda de la optimización del tratamiento. Actualmente las pautas del tratamiento adyuvante en el cáncer de mama se basan en las características tumorales o biomarcadores, también llamados factores pronósticos y predictivos del cáncer de mama2.
Los factores pronósticos y predictivos utilizados clásicamente en el cáncer de mama nos han permitido diseñar estrategias de tratamiento y conocer mejor el pronóstico de cada paciente. Estos factores cobran especial importancia en los tumores en estadios tempranos, permitiendo ajustar el tratamiento, de tal forma que no se trate en exceso a aquellos pacientes que no se beneficiarán del tratamiento adyuvante con quimioterapia, sin dejar escapar aquellos que de no tratarse tendrán una recaída3. Entre ellos los más utilizados en la práctica diaria son: edad, tamaño tumoral, afectación ganglionar, tipo histológico, grado histológico, presencia de receptores hormonales y sobreexpresión de HER24–11.
La proliferación celular siempre ha tenido un papel en la clasificación tumoral y por lo tanto es parte de los factores pronósticos y predictivos. Está incluida dentro del grado histológico tumoral, al tomar en cuenta las mitosis celulares del tumor. Además, es una de las características fenotípicas en que difieren en los subtipos genéticos del cáncer de mama. El Ki67 es una forma de medir la proliferación celular del tumor, utilizando técnicas de inmunohistoquímica12. Es una proteína que ha demostrado tener un papel importante en la regulación del ciclo celular, ausente en las células estacionadas o sin replicación, y alcanza niveles máximos de expresión durante la mitosis. El gen de Ki67 está ubicado en el brazo largo del cromosoma humano número 1013. Varios estudios han comprobado la relación entre el Ki67 con otros marcadores de proliferación celular como el índice mitótico y la tirosina quinasa14.
Actualmente el uso de Ki67 como factor pronóstico o predictivo es controvertido. Esto se debe principalmente a una falta de consenso sobre qué niveles de Ki67 son considerados de peor pronóstico y a que se basa en un método que genera mucha variabilidad de interpretación entre laboratorios y obervadores15. Sin embargo, estudios han reconocido su valor como factor predictivo, demostrando su utilidad para medir la respuesta a un determinado tratamiento adyuvante, además, altos niveles de Ki67 predicen una mejor respuesta al tratamiento con quimioterapia16. En cuanto a su papel como factor pronóstico, altos niveles de Ki67 se asocian a mayor probabilidad de recaída en cáncer en estadios tempranos, independientemente de la afectación axilar17.
Los subtipos genéticos del cáncer de mama pueden clasificar mejor el tipo de enfermedad y la mayoría de los estudios actuales buscan relacionar fenotípicamente estos subtipos con los factores clásicos utilizados en el cáncer de mama. La intención es tener mayor precisión en el pronóstico de la enfermedad, y predecir el comportamiento frente a los tratamientos adyuvantes de una manera más certera18. El último Consenso Internacional de Expertos de St. Gallen 201319 incluye el nivel de expresión de Ki67 como marcador fenotípico para diferenciar entre los subtipos moleculares del cáncer de mama.
En este consenso se utiliza el Ki67 como marcador diferencial principal, entre los subtipos moleculares del cáncer de mama, por ejemplo el Luminal A, presenta un Ki67 bajo o menor del 20%, mientras el Luminal B, presenta valores de Ki67 altos >20%. Igualmente se reconoce que hasta ahora siguen existiendo dificultades para la unificación de la medición de Ki67, así como la definición del punto de corte para clasificar Ki67 de alto o bajo grado. Sin embargo, el consenso de St. Gallen 2013 explica también la importancia de la utilización del Ki67, y que a pesar de este inconveniente, habrá que trabajar para lograr unificación de criterios sobre la lectura y la obtención de Ki6719.
Los biomarcadores tumorales cada día toman un papel fundamental en el pronóstico y el tratamiento del cáncer de mama. El Ki67 aún no es considerado un marcador independiente de mal pronóstico y no está establecido dentro del estudio sistemático de la paciente con cáncer de mama. El objetivo de este trabajo es evaluar en nuestra serie la relación entre el Ki67 con cada uno de los demás biomarcadores clásicos utilizados en el cáncer de mama, para analizar la importancia del nivel de expresión Ki67 como factor pronóstico y predictivo en cáncer de mama.
Pacientes y métodoSe realizó un estudio transversal descriptivo analítico de 110 pacientes con cáncer de mama estadios I y II, candidatas a cirugía como primer tratamiento, que fueron atendidas en nuestras consultas de ginecología, de la Unidad de Patología Mamaria del Hospital Universitario La Paz, entre octubre de 2011 y abril 2012, siguiendo las normativas del comité de ética de nuestra institución.
Se revisaron las historias de las pacientes atendidas en el periodo seleccionado, se excluyeron las pacientes que eran candidatas a quimioterapia neoadyuvante, las pacientes con carcinomas intraductales y las pacientes con cáncer en estadios avanzados. Las variables independientes estudiadas fueron: tamaño tumoral radiológico, fue preferiblemente obtenido mediante ecografía, resonancia magnética o por última instancia en mamografía. El tamaño patológico se obtuvo del informe de anatomía patológica definitivo, sobre la pieza de la cirugía. Para los tumores multifocales o multicéntricos se analizó tanto el tamaño del foco mayor como el tamaño de la suma de todos los focos. El tipo histológico, el grado histológico, la presencia de invasión linfovascular, y la afectación ganglionar también fueron extraídos del informe definitivo de anatomía patológica sobre la pieza de la cirugía. Para el análisis tomamos como positivos aquellos ganglios centinelas con macrometástasis.
Para el análisis anatomopatológico se realizaron cortes de 4μm de la pieza y se introdujeron durante 30 minutos a 65°C en estufa para secarlos. La desparafinización y la recuperación antigénica se realizaron en el equipo PTL Link DAKO y la inmunotinción se realizó en un equipo de inmunotinción automática en horizontal (Autostainer Plus, DAKO). Se emplearon los siguientes anticuerpos: para los receptores de estrógenos el clon EP-1, mouse, prediluido, Dako, para los receptores de progesterona clon PgR636, mouse, prediluido, Dako y para el HER2 HercepTest, Dako. Para Ki67 clon MIB1, prediluido, mouse, Dako. La expresión de los receptores hormonales se valoró como el porcentaje de los núcleos de las células tumorales teñidos en el tumor, desde el 1% se consideraron positivos.
La cuantificación de la expresión de Ki67 se realizó de modo semicuantitativo de acuerdo a las recomendaciones internacionalmente aceptadas («International Ki67 in Breast Cancer Working Group»20). Se realizó una valoración de Ki67 mediante el recuento de los núcleos tumorales teñidos en la zona evaluada (200 núcleos) sin tener en cuenta la intensidad de la inmunotinción y excluyendo del recuento los núcleos de células estromales y células inflamatorias. El índice de proliferación se estableció como la media de los valores obtenidos en tres zonas diferentes de la preparación (incluyendo las zonas con mayor y menor proliferación). El Ki67 se analizó como una variable continua y también estableciendo el punto corte de interpretación mayor o menor del 20%.
Se utilizó como soporte informático el programa IBM SPSS statistics 20. Para el análisis descriptivo se utilizó la media, la mediana y el rango intercuartílico. La comparación de medias se realizó mediante t de Student y test no paramétricos y análisis de la varianza, la comparación de frecuencias con Chi cuadrado. El error α se estableció al 5%.
ResultadosLa muestra presentó mayoritariamente factores de buen pronóstico. La edad de las pacientes se encontraba principalmente entre los 50-60 años (media 59,7±12, rango 35-88 años), la mayoría de los tumores fueron del tipo histológico ductal infiltrante, tamaños tumorales pequeños (media tamaño tumoral 17,0mm±11,5, rango 1-60mm), grado histológico moderandamente diferenciado y la gran mayoría sin afectación axilar ni invasión linfovascular. Así mismo la mayoría de los tumores presentaron receptores hormonales positivos, y muy pocos tumores con sobreexpresión de HER2. Correspondiéndose estas características favorables con que la gran mayoría de los tumores mostraron valores de expresión de Ki67 por debajo del 20%. La tabla 1 resume los resultados.
Resumen de las variables independientes estudiadas y su relación con la expresión de Ki67
| Ki67 | Ki67 <20% | Ki67 ≥ 20% | ||
| N (%) | Media ± DS | N (%) | N (%) | |
| Edad (años) | ||||
| <45 | 11 (10,9) | 19,3 (±9,5) | 7 (63,6) | 4 (36,4) |
| 45-60 | 42 (41,6) | 17,0 (±17,5) | 30 (71,5) | 12 (28,5) |
| 60-75 | 33 (32,7) | 15,0 (±14,3) | 26 (78,6) | 7 (21,4) |
| >75 | 15 (14,9) | 16,9 (±11,4) | 10 (66,7) | 5 (33,3) |
| Tamaño tumoral | ||||
| > 15 mm | 56 (50,9) | 1,5 (±18,0) | 36 (64,3) | 20 (35,7) |
| < 15 mm | 54 (49,1) | 19,5 (±17,9) | 44 (81,5) | 10 (18,5) |
| Grado histológico | ||||
| GI | 25 (26,9) | 9,0 (±6,2) | 24 (96,0) | 1 (4,0) |
| GII | 40 (43,0) | 13,2 (±8,5) | 32 (80,0) | 8 (20,0) |
| GIII | 28 (30,1) | 29,7 (±20,1) | 11 (39,3) | 17 (60,7) |
| Invasión linfovascular | ||||
| Sí | 17 (18,5) | 17,9 (±14,8) | 11 (64,7) | 6 (35,3) |
| No | 75 (81,5) | 16,9 (±14,5) | 55 (73,3) | 20 (26,7) |
| Receptores estrógeno | ||||
| Positivo | 95 (89,6) | 14,4 (±10,9) | 73 (76,8) | 22 (23,2) |
| Negativo | 11 (10,4) | 40,6 (±29,6) | 4 (36,4) | 7 (63,6) |
| Receptores progesterona | ||||
| Positivo | 80 (75,5) | 13,2 (±10,8) | 63 (78,8) | 17 (21,2) |
| Negativo | 26 (24,5) | 29,5 (±21,6) | 15 (57,7) | 11 (42,3) |
| HER2 | ||||
| Positivo | 3 (3,1) | 16,0 (±0,0) | 0 | 3 (100) |
| Negativo | 95 (96,9) | 30,0 (±14,5) | 72 (75,8) | 23 (24,2) |
| Ganglio centinela | ||||
| Positivo | 19 (19,2) | 14,6 (±9,0) | 14 (73,7) | 5 (26,3) |
| Negativo | 80 (80,8) | 16,4 (±15,9) | 61 (76,2) | 19 (23,8) |
| Tipo histológico | ||||
| Ductal | 81 (85,3) | 17,4 (±15,1) | 59 (72,9) | 22 (27,2) |
| Lobulillar | 14 (14,7) | 12,3 (±8,9) | 12 (85,7) | 2 (14,3) |
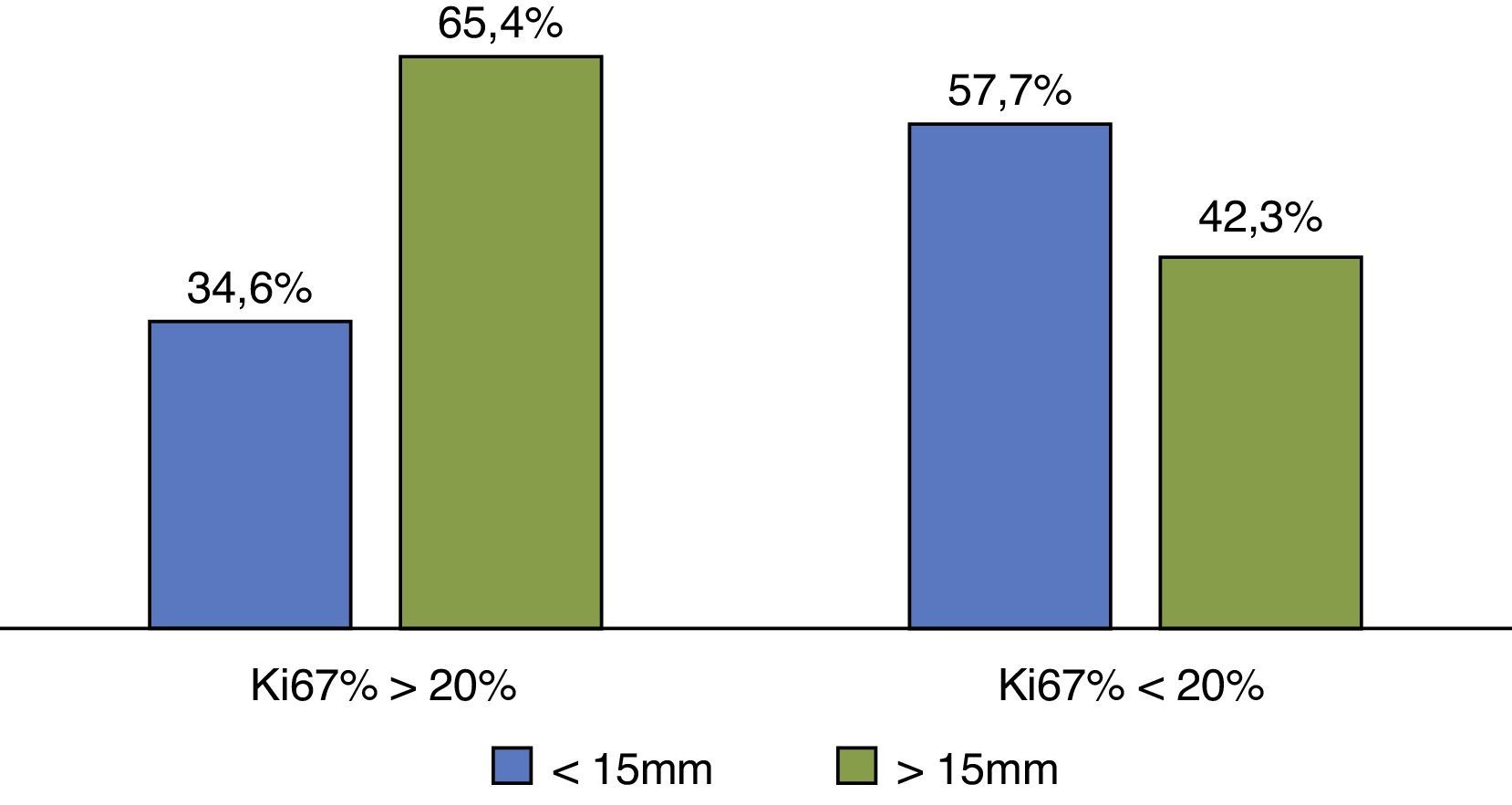
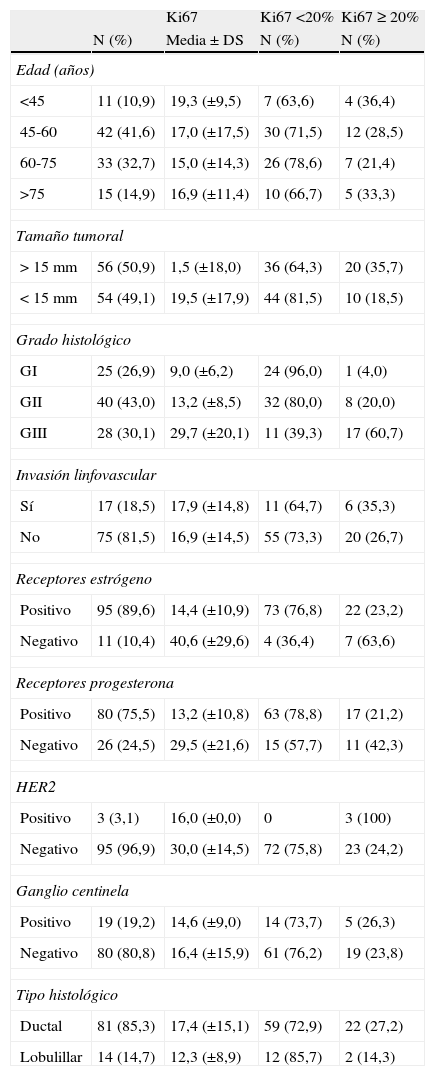
Al agrupar los tumores según el tamaño, en aquellos menores y mayores de 15mm, y comparar los niveles de expresión de Ki67 por encima o por debajo de 20%, se observó que la mayoría de los tumores de menor tamaño presentaron una expresión de Ki67 por debajo del 20%, y los tumores con más de 15mm de tamaño se asociaron a niveles de Ki67 por encima del 20% (P <0,05) (fig. 1).
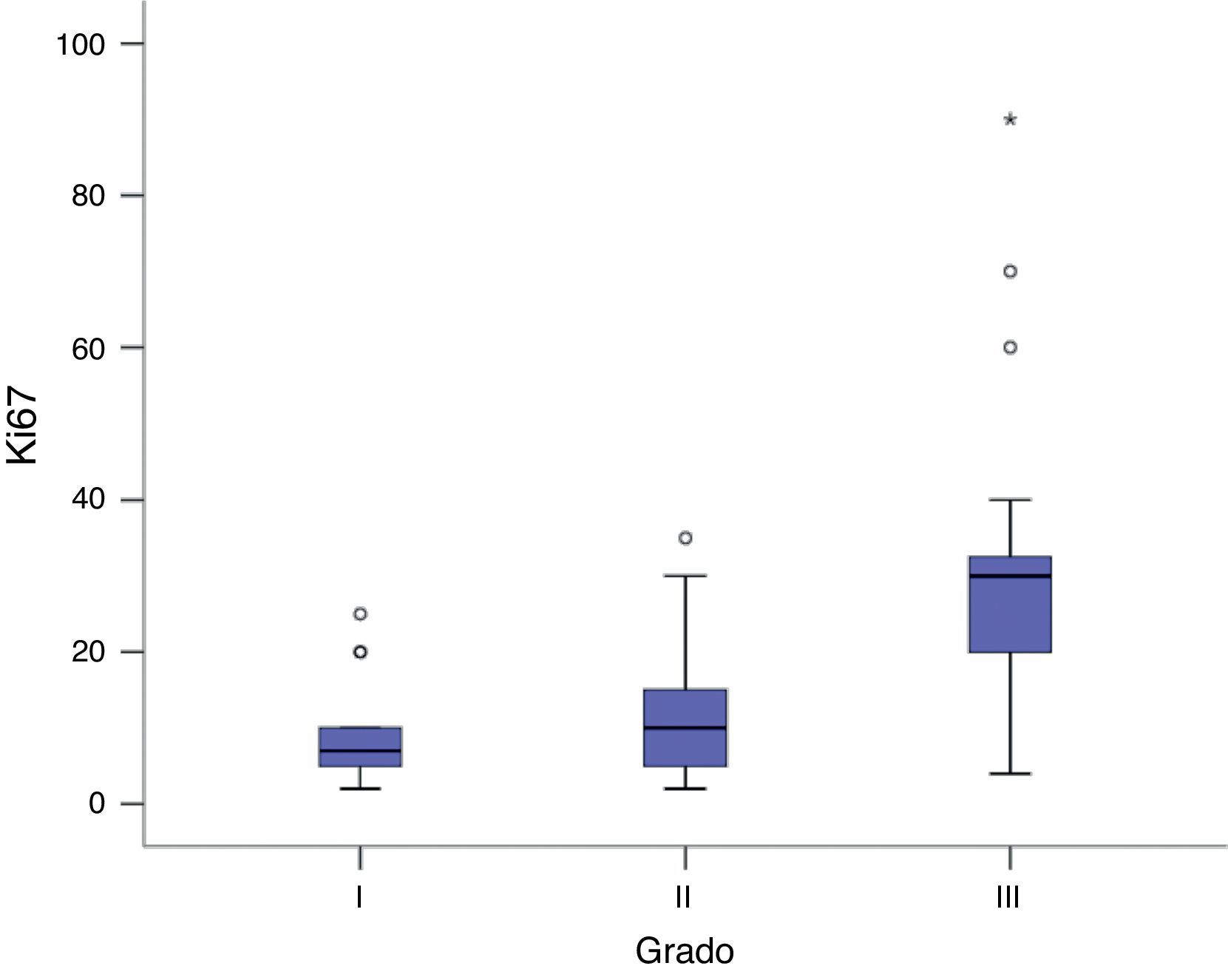
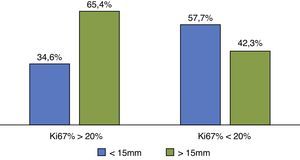
Al comparar linealmente los niveles de expresión de Ki67 con el grado histológico se observó que a mayor grado histológico, los tumores expresaron mayor nivel de Ki67. En los tumores bien diferenciados la expresión de Ki67 presentó una media de 9,04±6,2% y un máximo de 25%, mientras que los tumores moderadamente diferenciados tenían una media de expresión de Ki67 del 13,21 ± 8,5% y un máximo de 35%. En los tumores indiferenciados la expresión de Ki67 tenía una media de 29,7 ± 20,6% y un máximo de 90% (P <0,05) (fig. 2).
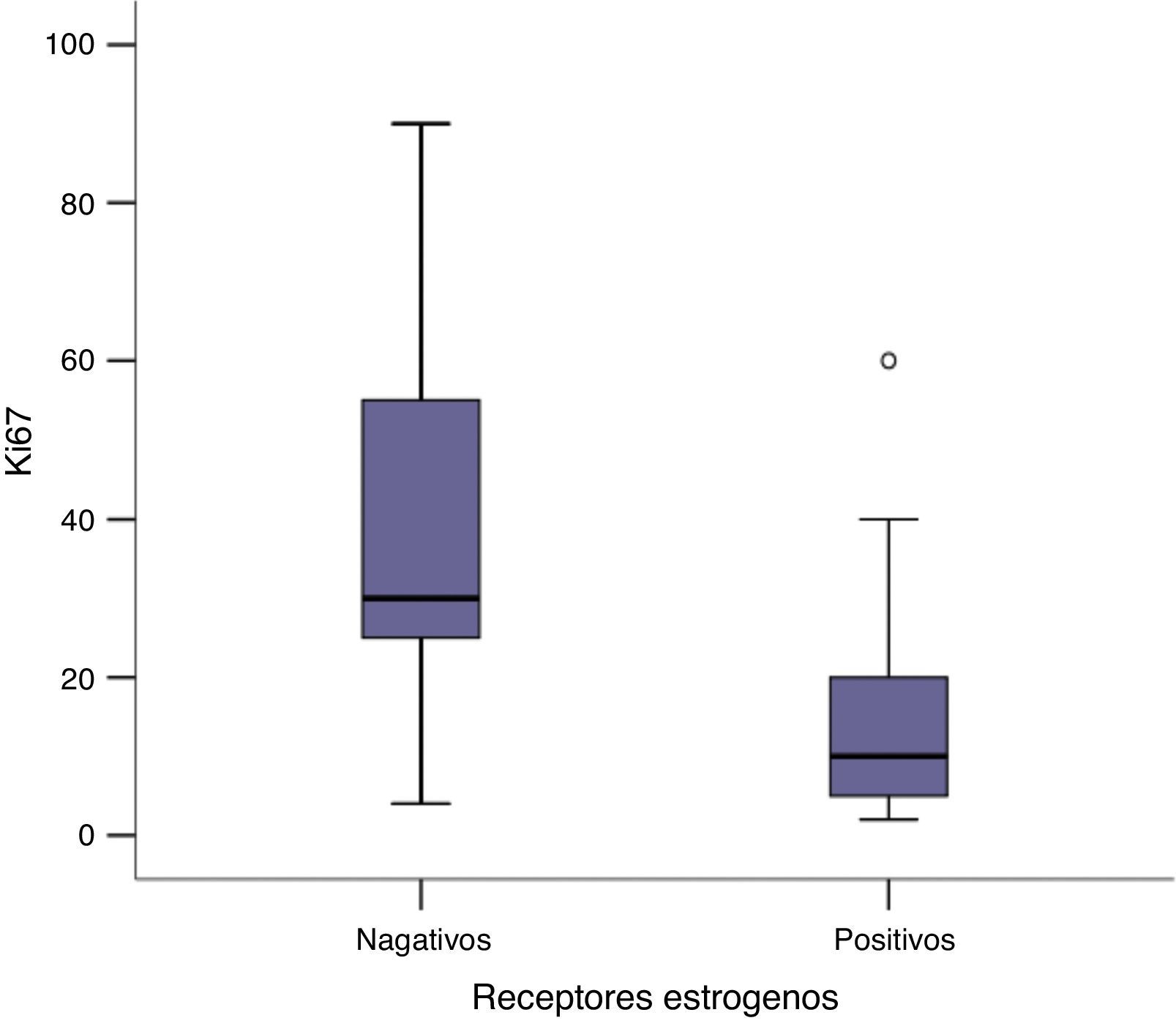
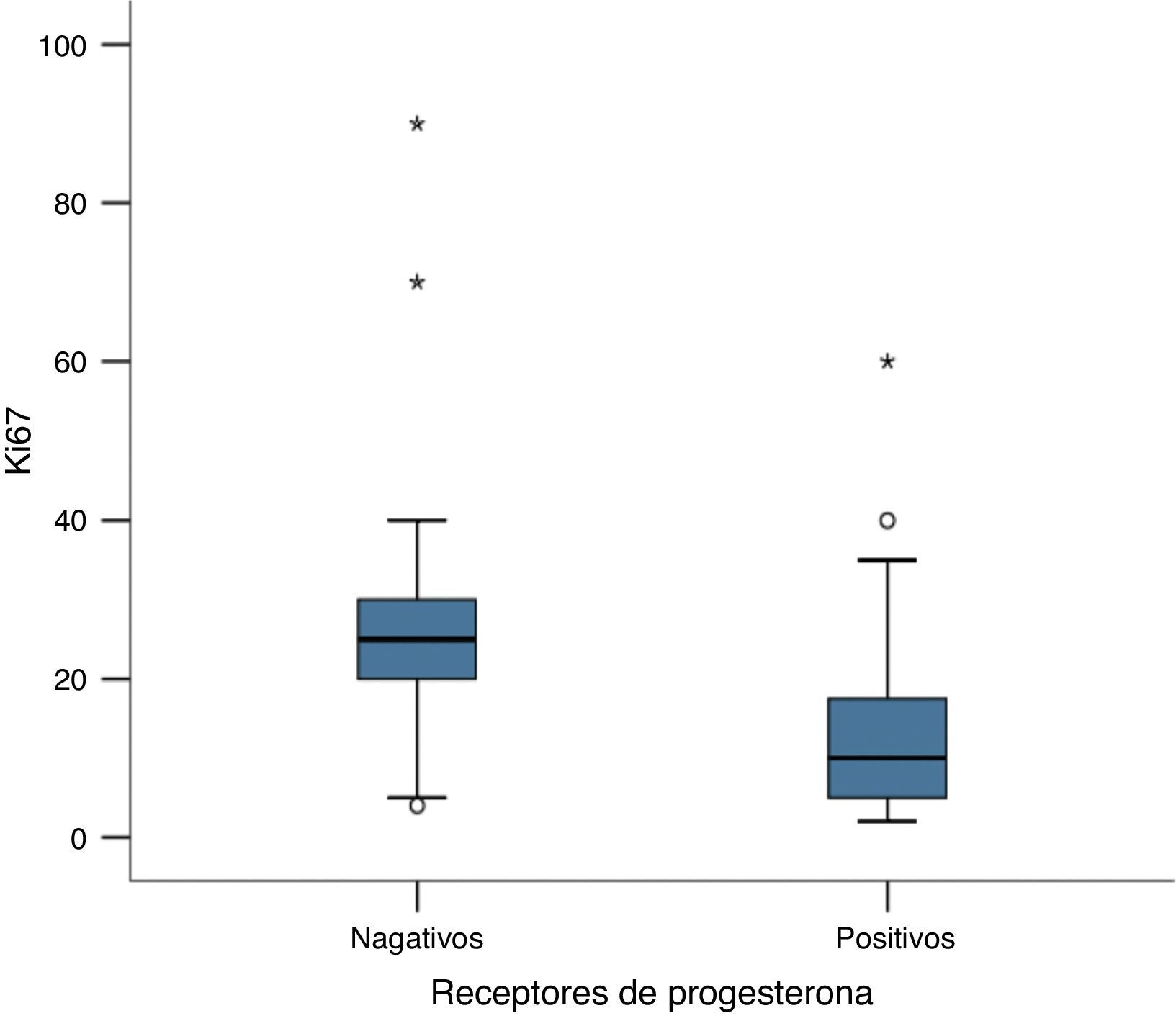
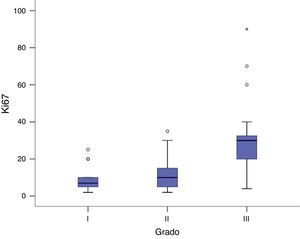
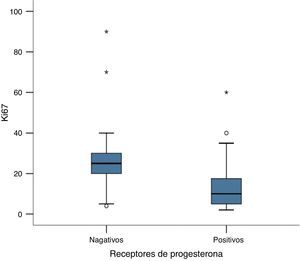
Encontramos una asociación inversa significativa entre la expresión de receptores hormonales y la expresión de Ki67 (P <0,05). Esta diferencia es más destacada para los receptores de estrógeno, en los que encontramos que, en los tumores con receptores de estrógenos positivos, el Ki67 presentó una media de 14,9 ±10,9%, en cambio, en los tumores con receptores de estrógenos negativos, el Ki67 presentó una media de 40,57 ± 27,8%, una diferencia importante entre las medias, de casi 4 veces mayor (P <0,05), (fig. 3). Igualmente en los receptores de progesterona la diferencia observada también fue significativa, aunque menor que la encontrada en los receptores de estrógeno. Mientras que en los tumores con receptores de progesterona positivos la media de expresión de Ki67 fue de 13,25 ± 10,84%, en los tumores con receptores de progesterona negativos la media de expresión de Ki67 fue de 29,47 ± 21,57%, P<0,05) (fig. 4). El análisis de regresión lineal entre la expresión del Ki67 en porcentaje y receptores de estrógenos en porcentaje fue significativo (P< 0,001), con un coeficiente beta –0,387, lo que se puede interpretar como que por cada 1% que aumenta la expresión del receptor de estrógeno, la expresión del Ki67 disminuye un 0,387%.
No se ha encontrado relación estadísticamente significativa entre el grado de expresión tumoral del Ki67 con la edad, la invasión linfovascular, la afectación del ganglio centinela, la sobreexpresión de HER2 y el tipo histológico de carcinoma infiltrante.
DiscusiónLa población estudiada incluyó mayoritariamente pacientes con enfermedad de buen pronóstico, por tener tumores en estadios iniciales y ser candidatas a cirugía como primer tratamiento. A pesar de ser una muestra reducida, hemos encontrado una distribución de factores pronósticos y predictivos favorables, en la mayoría de las pacientes. Esta distribución se corresponde a su vez con valores de expresión Ki67 por debajo del 20%, también en la mayoría de las pacientes, siendo esta relación significativa con el tamaño tumoral, los receptores hormonales y el grado histológico. Los resultados del metaanálisis realizados en el Reino Unido1, muestran que el Ki67 es un marcador pronóstico, y que a mayores niveles de expresión de Ki67 empeora la supervivencia de las pacientes con cáncer de mama en estadios tempranos, lo que había sido ya descrito en múltiples estudios17,21. Sin embargo, no ha sido suficientemente estudiada la relación del Ki67, con el resto de los factores pronósticos y predictivos clásicos utilizado en el cáncer de mama. Esta correlación observada en nuestro estudio apoya la utilidad e importancia de la determinación del Ki67 en la práctica diaria.
Hemos encontrado que los tumores mayores de 15 milímetros tienen niveles de expresión de Ki67 por encima del 20%. Sin embargo esta relación proporcional con la expresión de Ki67, en los pocos estudios que hay publicados al respecto no resultó significativa22. Probablemente esta diferencia se debe a que las poblaciones de los estudios no son comparables.
Otros estudios han calculado la expresión de Ki67 como marcador pronóstico, y estos resultados muestran similares rangos de riesgo relativo y cociente de riesgos que otros factores pronóstico, como con los receptores de estrógenos, y el grado histológico1,23,24, coincidiendo que estos factores pronósticos clásicos han mostrado relación estadísticamente significativa en nuestro estudio. Podíamos ya intuir, que si el grado histológico incluye un marcador de proliferación celular, como lo es la cuantificación de mitosis celulares, existiría una relación entre ellos, la cual se ha confirmado en este estudio.
Con respecto a la relación inversa entre el Ki67 y la expresión de niveles de estrógenos ya había sido mostrada en otros estudios25,26. Además hay estudios que han observado que se puede encontrar expresión de Ki67 muy baja, menor del 3%, en tejido mamario sano. Sin embargo, esta mínima expresión en tejido sano, solo se encuentra en células sin receptores de estrógenos27.
En nuestro estudio no hemos encontrado una asociación significativa entre los niveles de Ki67 y la afectación ganglionar. En algunos estudios, se demuestra que el mal pronóstico que confiere un alto grado de expresión de Ki67, se aplica tanto para pacientes con ganglios afectos, como para pacientes con ganglios negativos1,17. Es necesario destacar que al tratarse en nuestro estudio de una muestra con mayoría de pacientes en estadios iniciales, el número de pacientes con ganglios afectados es muy reducido, lo que no permite estudiar esta relación.
Existe evidencia científica acumulada en torno al importante papel de la expresión de Ki67, en la valoración de la paciente con cáncer de mama, como factor pronóstico y predictivo1,19,20. Se ha demostrado también la asociación entre la expresión del Ki67, riesgo de recidiva de enfermedad, disminución de supervivencia libre de enfermedad y disminución de la supervivencia global17. A pesar de toda esta evidencia, actualmente no se acepta la expresión de Ki67, como factor determinante a la hora de tomar decisiones en la práctica clínica. Para la extensión de su aplicación rutinaria, es indispensable la determinación sistemática de la expresión del Ki67, con normas unificadas para su obtención e interpretación. Ya existen propuestas para la unificación de criterios19,20,28, como las normas que hemos aplicado en este estudio para el análisis anatomopatológico de la expresión del Ki67 (International Ki67 in Breast Cancer Working Group20). Sin embargo, todavía no se ha llegado a un consenso definitivo.
En conclusión, en nuestro estudio hemos encontrado una relación significativa entre la expresión de Ki67 y otros factores predictivos y pronósticos clásicos del cáncer de mama. Nuestros resultados mostraron que tumores mayores de 15mm, con una menor expresión de receptores de estrógeno y de progresterona y un mayor grado histológico estaban asociados a mayor expresión de Ki67.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.