El cáncer de próstata metastásico es frecuente en nuestro país. Existen factores que pueden asociarse a una respuesta adecuada al tratamiento de privación androgénica. El uso de otros regímenes terapéuticos se ha propuesto para mejorar resultados.
ObjetivoIdentificar factores que influyen en la respuesta a la privación androgénica en pacientes con cáncer de próstata metastásico a hueso.
Material y métodosSe incluyeron pacientes con cáncer de próstata metastásico en 7 años; se valoraron factores del paciente durante el tratamiento de privación androgénica y su evolución. Se evaluó la asociación entre los factores y la respuesta con análisis bi- y multivariado.
ResultadosSe incluyeron 89 pacientes. Los factores que se asociaron al desarrollo de resistencia a la castración fueron: edad, escala de Gleason, reducción del antígeno prostático>95%, tiempo al nadir menor a 9 meses y duración de la terapia de privación androgénica. El haber recibido radioterapia paliativa y periodos de intermitencia fueron los factores que se asociaron a mortalidad cáncer-específica en forma contrastante. Otros factores de la cinética del antígeno no alcanzaron significación en el análisis multivariado.
ConclusiónEn pacientes con cáncer de próstata metastásico los factores mencionados están asociados a la respuesta a la terapia de privación androgénica.
Metastatic prostate cancer is a frequent disease in Mexico. There are factors that can be associated with an adequate response to androgen deprivation therapy. Other therapeutic regimens have been proposed to improve results.
AimTo identify factors influencing the response to androgen deprivation therapy in patients with prostate cancer and bone metastases.
Materials and methodsThe study covered a 7-year period and included patients that presented with metastatic prostate cancer. Patient factors were evaluated during androgen deprivation therapy and follow-up. The association between factors and response was assessed through bivariate and multivariate analyses.
ResultsEighty-nine patients were included in the study. The factors associated with the development of castration resistance were: age, Gleason score, prostate-specific antigen reduction>95%, less than 9 months to reach the nadir, and androgen deprivation therapy duration. Having received palliative radiotherapy and periods of intermittence were the factors that were contrastingly associated with cancer-specific mortality. Other factors related to prostate-specific antigen kinetics were not statistically significant in the multivariate analysis.
ConclusionsThe described factors were associated with the response to androgen deprivation therapy in patients with metastatic prostate cancer.
El cáncer de próstata se ha diagnosticado de manera más frecuente en estadios tempranos a nivel mundial, sin embargo en México se siguen diagnosticando de forma frecuente estadios avanzados, que se manejan habitualmente con algún tipo de terapia de privación androgénica (TPA)1.
Las opciones de tratamiento incluyen castración farmacológica con análogos de hormona liberadora de hormona luteinizante (LHRH) o antagonistas de hormona liberadora de gonadotropinas, castración quirúrgica y uso de antiandrogénos.
En las guías actuales los pacientes con metástasis al diagnóstico requieren de TPA como tratamiento de primera línea por 24-36 meses2, sin embargo existen pacientes que no presentan una respuesta adecuada a dicho tratamiento y que desarrollan resistencia a la castración o fallecen de forma rápida, antes de siquiera poder concluir el periodo mínimo de tratamiento.
El objetivo del estudio es identificar factores que se asocien a la respuesta a la TPA en pacientes con cáncer de próstata con metástasis óseas en una institución.
Material y métodosSe llevó a cabo un estudio de cohorte retrospectivo, en el que se incluyeron todos los pacientes con cáncer de próstata, que presentaron metástasis óseas al momento del diagnóstico, que fueron tratados con TPA y cuyos expedientes clínicos contaron con información completa durante su seguimiento. El periodo de revisión abarcó los 7 años previos a la realización de esta investigación.
Las variables independientes que se valoraron y que fueron consideradas en este estudio como factores posiblemente asociados fueron al inicio del seguimiento: edad, antígeno prostático específico (APE) inicial, características del tacto rectal (estadificación), escala de Gleason, número de fragmentos positivos en la biopsia, escala de funcionalidad valorada mediante ECOG (Eastern Cooperative Oncology Group), sitio de metástasis óseas y tipo de TPA empleada. Durante el seguimiento se consideró: APE de control, nadir de APE, tiempo para alcanzar el nadir, uso de radioterapia paliativa a sitios de metástasis, duración de la TPA, la existencia de periodos de intermitencia y APE previo al reinicio del tratamiento después de la intermitencia.
Las variables dependientes fueron 2, como estimación de la respuesta al tratamiento: desarrollo de resistencia a la castración y mortalidad específica por cáncer de próstata.
La definición empleada para resistencia a la castración es la más reciente, que implica «niveles de testosterona en rangos de castración<50ng/dL más evidencia de progresión bioquímica con 3 elevaciones consecutivas del APE con una semana de separación resultando en 2 incrementos de más del 50% del nadir con APE>2ng/mL o evidencia de progresión radiológica con aparición de 2 o más lesiones óseas nuevas en el gammagrama óseo o aumento de tamaño de una lesión de tejidos blandos utilizando los criterios de RECIST»3.
Se evaluó, mediante la prueba exacta de Fisher, la existencia de asociación bivariada, entre APE de control a los 3 meses, magnitud de reducción del APE, nadir y tiempo al nadir con el desarrollo de resistencia a la castración y la mortalidad específica por cáncer de próstata. También se realizaron curvas de Kaplan-Meier para evaluar la probabilidad de desarrollar resistencia a la castración y la probabilidad de muerte dependiendo del tipo de TPA establecida. Mediante la prueba log-rank se buscaron diferencias estadísticamente significativas entre las curvas.
Finalmente se realizó un análisis multivariado (regresión de Cox) para identificar las variables independientes que, al estar asociadas significativamente con las variables dependientes, funcionan como factores potencialmente predictores de la respuesta al tratamiento. Se empleó para el análisis estadístico el programa SPSS versión 21.0 (IBM Corp, Armonk, NY, EE. UU.).
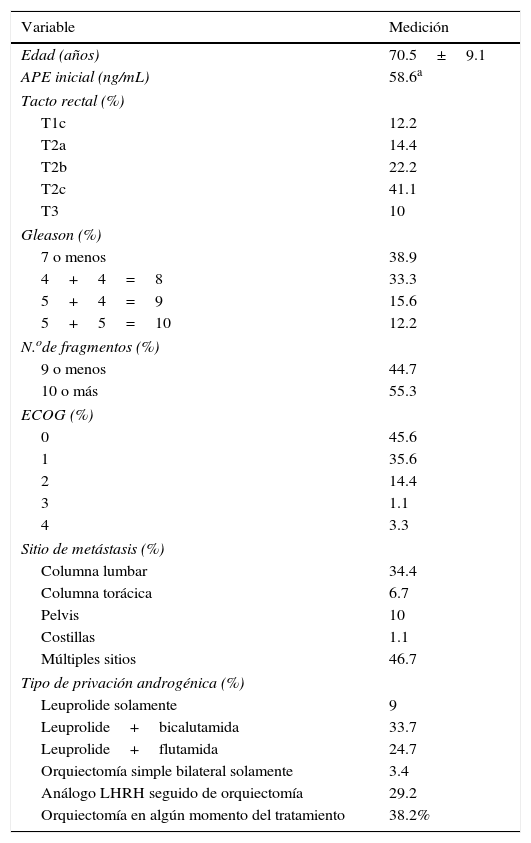
ResultadosLa población de estudio fueron 89 pacientes, cuyo promedio de edad fue de 70 años. En la tabla 1 se detallan las características de los pacientes al inicio del seguimiento. Se observa, entre otras cosas que, la mediana de APE inicial fue de 58.6ng/mL, el estadio más frecuentemente encontrado fue el cT2c (41.1%), el 55.3% de la población de estudio tuvo 10 o más fragmentos positivos a la biopsia, en la escala de funcionalidad ECOG el dato más frecuente fue de cero (45.6%), el sitio de metástasis más frecuente fue la columna lumbar (34.4%), así como también múltiples sitios (46.7%). El tipo de TPA más frecuentemente utilizada fue la castración quirúrgica en algún momento del tratamiento (38.2%) y la combinación de leuprolide con bicalutamida (33.7%).
Características basales de los pacientes
| Variable | Medición |
|---|---|
| Edad (años) | 70.5±9.1 |
| APE inicial (ng/mL) | 58.6a |
| Tacto rectal (%) | |
| T1c | 12.2 |
| T2a | 14.4 |
| T2b | 22.2 |
| T2c | 41.1 |
| T3 | 10 |
| Gleason (%) | |
| 7 o menos | 38.9 |
| 4+4=8 | 33.3 |
| 5+4=9 | 15.6 |
| 5+5=10 | 12.2 |
| N.ode fragmentos (%) | |
| 9 o menos | 44.7 |
| 10 o más | 55.3 |
| ECOG (%) | |
| 0 | 45.6 |
| 1 | 35.6 |
| 2 | 14.4 |
| 3 | 1.1 |
| 4 | 3.3 |
| Sitio de metástasis (%) | |
| Columna lumbar | 34.4 |
| Columna torácica | 6.7 |
| Pelvis | 10 |
| Costillas | 1.1 |
| Múltiples sitios | 46.7 |
| Tipo de privación androgénica (%) | |
| Leuprolide solamente | 9 |
| Leuprolide+bicalutamida | 33.7 |
| Leuprolide+flutamida | 24.7 |
| Orquiectomía simple bilateral solamente | 3.4 |
| Análogo LHRH seguido de orquiectomía | 29.2 |
| Orquiectomía en algún momento del tratamiento | 38.2% |
En la tabla 2 se muestran las características de los pacientes tras el inicio del tratamiento. Se observa que el 50% de los pacientes tuvieron un APE de control a los 3 meses de 1.8ng/mL. El 73.8% tuvo dicho APE de control por debajo de los 10ng/mL. La mediana del porcentaje de reducción del APE con respecto al inicial fue del 97.2%. Sin embargo, el 57.5% de los pacientes lograron una reducción del APE mayor al 95%. La mediana del nadir del APE fue 0.12ng/mL. El 51.9% logró un nadir del APE menor a 0.20ng/mL. La mediana del tiempo al nadir fue 9 meses. La duración mediana de TPA fue de 15 meses. El 16.9% recibió radioterapia paliativa a sitios de metástasis óseas. El 27% de los pacientes cursaron con algún periodo de intermitencia, la duración mediana de esta en meses fue de 10.5 y la duración del bloqueo androgénico previo al inicio de la intermitencia, fue de 12 meses. El APE previo al reinicio de la privación androgénica tras la intermitencia fue 4ng/mL.
Características de los pacientes tras el inicio del tratamiento
| Variable | Medición |
|---|---|
| APE control (ng/mL) | 1.8a |
| APE de control menor de 10ng/mL a los 3 meses de inicio del tratamiento (%) | |
| Sí | 73.8 |
| No | 26.2 |
| % reducción del APE respecto al inicial a los 3 meses de inicio del tratamiento | 97.2a |
| Reducción de APE más del 95% a los 3 meses de inicio del tratamiento (%) | |
| Sí | 57.5 |
| No | 42.5 |
| Nadir de APE (ng/mL) | 0.12a |
| Nadir de APE menor de 0.2ng/mL (%) | |
| Sí | 51.9 |
| No | 48.1 |
| Tiempo para alcanzar el nadir (meses) | 9a |
| Tiempo para alcanzar nadir de APE<9 meses (%) | |
| Sí | 49.4 |
| No | 50.6 |
| Duración de la privación androgénica (meses) | 15a |
| Radioterapia paliativa a columna (%) | 16. 9 |
| Intermitencia (%) | |
| Sí | 27 |
| No | 73 |
| Duración de privación androgénica previo a intermitencia (meses) | 12a |
| Duración de la intermitencia (meses) | 10.5a |
| APE para reiniciar privación androgénica tras intermitencia (ng/mL) | 4a |
| Meses para desarrollo de resistencia a la castración | 18a |
| Mortalidad global (%) | 37.5 |
| Mortalidad cáncer-específica (%) | 25 |
| Resistencia a la castración (%) | 28.1 |
El 28.1% de la población estudiada presentó resistencia a la castración y la mediana del tiempo transcurrido para el desarrollo de esta fue de 18 meses. El 25% de la población estudiada falleció por cáncer de próstata.
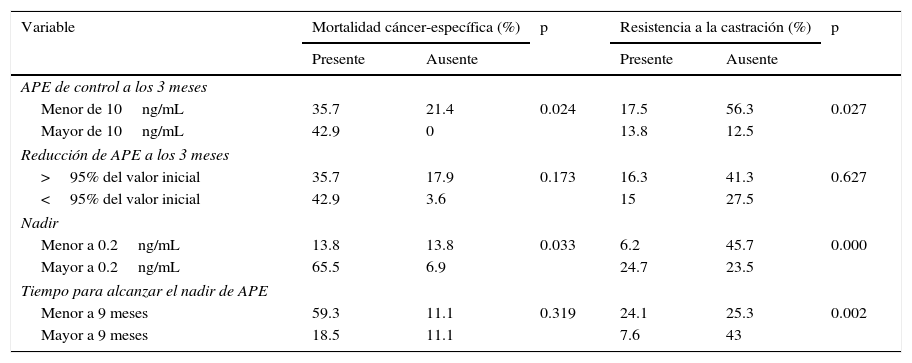
En la tabla 3 se aborda el análisis de asociación bivariado, mediante la prueba exacta de Fisher, en el que se muestra que la presentación del fenómeno de resistencia a la castración fue más frecuente cuando el APE a los 3 meses fue menor a los 10ng/ml (17.5 vs. 13.8%, p=0.027), es decir que tienen un riesgo un 72% menor de desarrollar resistencia a la castración (RR=0.28, IC95% 0.099-0.805) en comparación con quienes su APE a los 3 meses es mayor a 10ng/ml. Las cifras de nadir<0.2ng/mL se asociaron a un riesgo un 88% menor de desarrollar resistencia a la castración (RR=0.12, IC95% 0.042-0.396, p=0.000) y el tiempo para alcanzar el nadir fue menor a 9 meses en quienes presentaron resistencia a la castración (24.1 vs. 7.6%, p=0.002).
Análisis bivariado comparando los factores de respuesta con mortalidad cáncer-específica y desarrollo de resistencia a la castración mediante prueba exacta de Fisher
| Variable | Mortalidad cáncer-específica (%) | p | Resistencia a la castración (%) | p | ||
|---|---|---|---|---|---|---|
| Presente | Ausente | Presente | Ausente | |||
| APE de control a los 3 meses | ||||||
| Menor de 10ng/mL | 35.7 | 21.4 | 0.024 | 17.5 | 56.3 | 0.027 |
| Mayor de 10ng/mL | 42.9 | 0 | 13.8 | 12.5 | ||
| Reducción de APE a los 3 meses | ||||||
| >95% del valor inicial | 35.7 | 17.9 | 0.173 | 16.3 | 41.3 | 0.627 |
| <95% del valor inicial | 42.9 | 3.6 | 15 | 27.5 | ||
| Nadir | ||||||
| Menor a 0.2ng/mL | 13.8 | 13.8 | 0.033 | 6.2 | 45.7 | 0.000 |
| Mayor a 0.2ng/mL | 65.5 | 6.9 | 24.7 | 23.5 | ||
| Tiempo para alcanzar el nadir de APE | ||||||
| Menor a 9 meses | 59.3 | 11.1 | 0.319 | 24.1 | 25.3 | 0.002 |
| Mayor a 9 meses | 18.5 | 11.1 | 7.6 | 43 | ||
APE: antígeno prostático específico; p: significancia estadística.
Por otro lado, también se observa que hay un porcentaje significativamente más alto de mortalidad específica por cáncer de próstata entre quienes tenían un APE de control a los 3 meses mayor a 10ng/mL (42.9 vs. 35.7%, p=0.024) lo que refleja un riesgo un 38% menor de fallecer por el cáncer en aquellos con cifras<10ng/mL (RR=0.62, IC95% 0.428-0.914) y un nadir mayor a 0.2ng/ml (65.5 vs. 13.8%, p=0.033), que implica un 90% menor probabilidad de fallecer por cáncer en aquellos con cifras de nadir<0.2ng/mL (RR=0.10, IC95% 0.014-0.786, p=0.033), en comparación con quienes su nadir fue>0.2ng/mL.
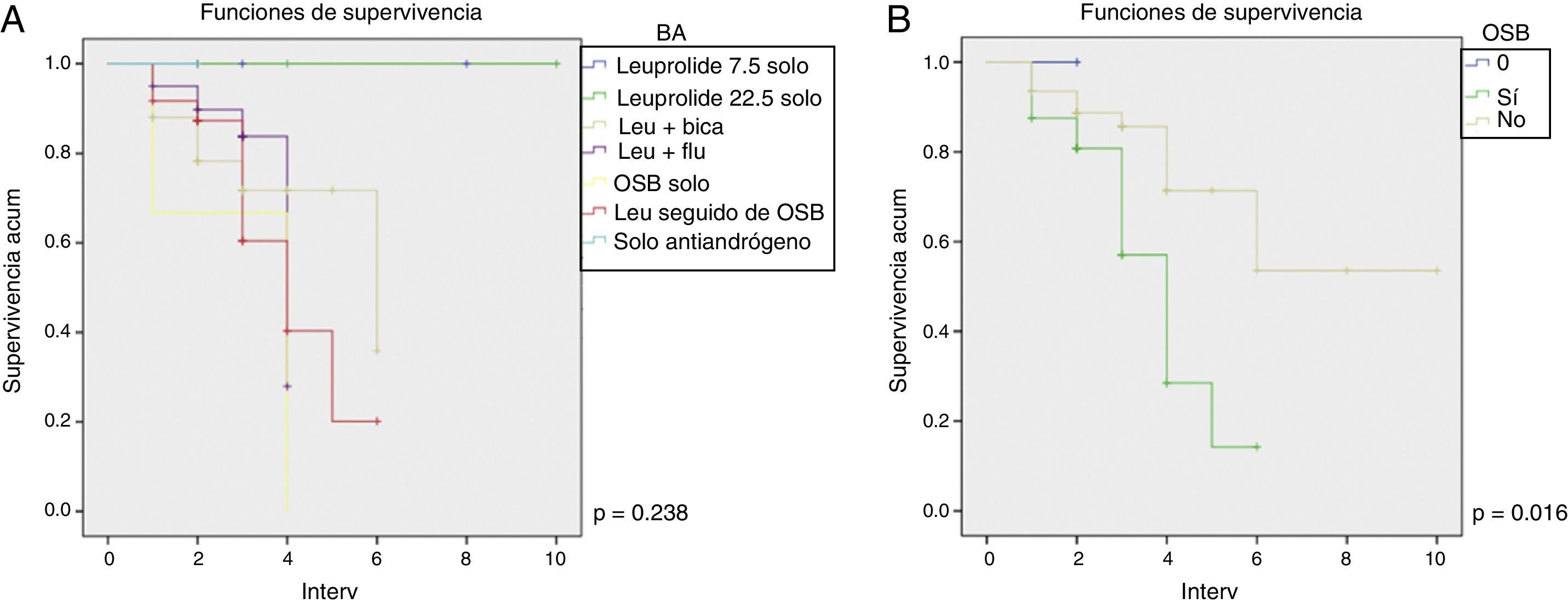
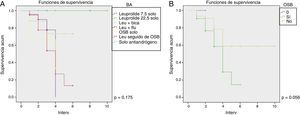
En la figura 1 se muestran las curvas de Kaplan-Meier para evaluar la probabilidad de desarrollar resistencia a la castración dependiendo del tipo de TPA establecida. Se observa que con leuprolide como monoterapia no hubo casos suficientes para el análisis. La probabilidad de desarrollar resistencia a la castración, al mes de iniciado el tratamiento con leuprolide+bicalutamida fue del 88%, a los 2 meses del 78.2%, a los 3 meses del 71.7% y a los 6 meses fue del 35.9%.
Con leuprolide+flutamida, la probabilidad de desarrollar resistencia a la castración al mes de iniciado el tratamiento fue del 95%, a los 2 meses del 89.7%, a los 3 meses del 83.7% y a los 4 meses del 27.9%.
Respecto a leuprolide seguido de orquiectomía simple bilateral (OSB), la probabilidad al mes fue del 91.7%, a los 2 meses del 87.3%, a los 3 meses del 60.4%, a los 4 meses del 40.3%, a los 5 meses del 20.1% y a los 6 meses del 0%. Con todo ello, la prueba de análisis estadístico (log rank) indicó que no hubo diferencias estadísticamente significativas por tipo de TPA indicada (p=0.238).
La probabilidad de desarrollar resistencia a la castración al mes de habérsele realizado únicamente OSB fue del 87.5%, a los 2 meses del 80.8%, a los 3 meses del 57%, a los 4 meses del 28.5%, a los 5 meses del 14.3% y a los 6 meses del 0%.
La probabilidad de desarrollar resistencia a la castración cuando no se le realizó OSB al mes fue del 93.5%, a los 2 meses del 88.7%, a 3 meses del 85.6%, a los 4 meses del 71.4%, a los 5 meses del 53.5% y a los 10 meses del 0%. Existe una diferencia estadísticamente significativa entre la probabilidad de desarrollo de resistencia a la castración cuando se realizó una OSB en comparación a cuando no se realizó (p= 0.016).
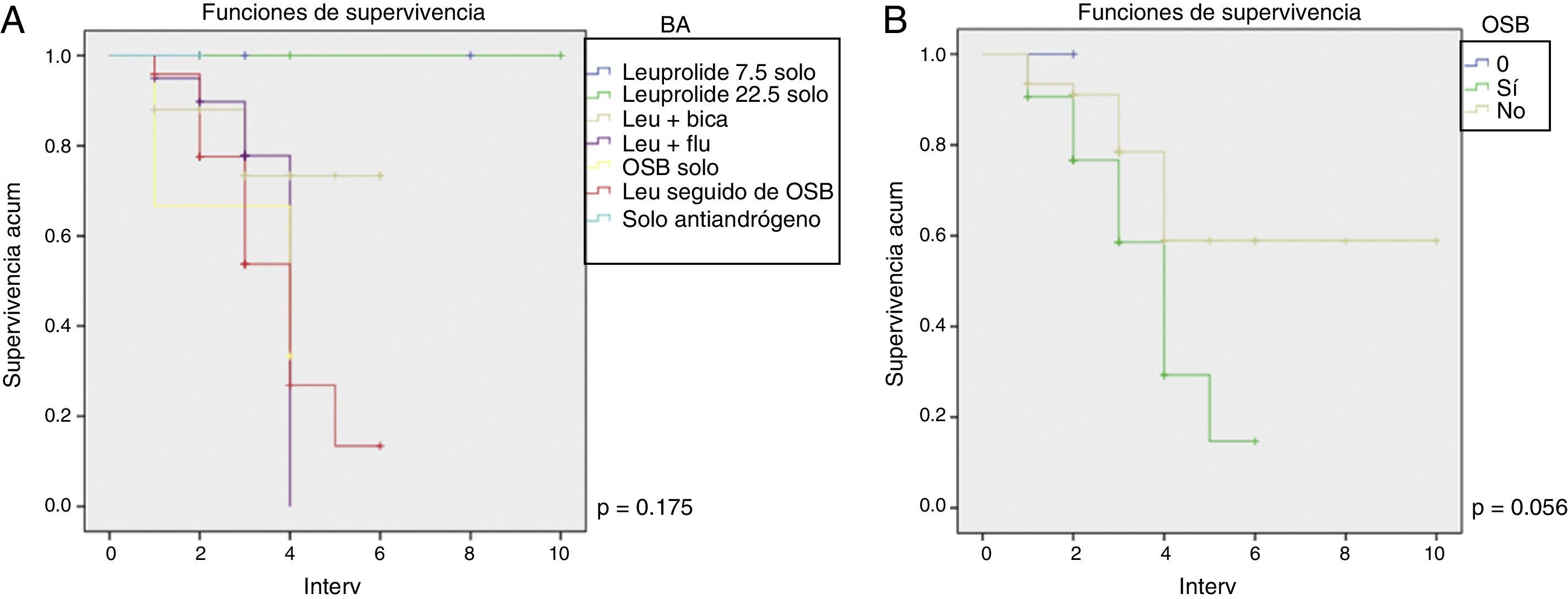
En la figura 2 se muestra un análisis similar, pero considerando la probabilidad de supervivencia después de iniciada la TPA. Se observa que la probabilidad de sobrevivir a 3 meses de iniciado el tratamiento con leuprolide+bicalutamida fue del 73.3%, cuando el bloqueo fue con leuprolide+flutamida la probabilidad fue del 77.8% y cuando fue mediante OSB, dicha probabilidad bajó al 33.3%, mientras que cuando el tratamiento fue con leuprolide seguido de OSB la probabilidad de sobrevivir a 3 meses fue del 53.7%. Es importante indicar que no hubo diferencias estadísticamente significativas por tipo de tratamiento (p=0.175).
La segunda gráfica de esta figura hace referencia a la probabilidad de sobrevivir cuando se realizó únicamente castración quirúrgica o no. Se observó que la probabilidad de sobrevivir al mes de haberle realizado OSB fue del 90.6%, a los 2 meses del 76.7%, a los 3 meses fue del 58.6%, a los 4 meses del 29.3%, a los 5 meses del 14.7% y a los 6 meses del 0%.
En quienes no se les realizó la OSB, la probabilidad de sobrevivir al mes fue del 93.5%, a los 2 meses del 91.1%, a los 3 meses del 78.5% y a los 4 meses del 58.9%. A los 10 meses fue del 0%. La significación estadística muestra un valor limítrofe (p=0.056).
Finalmente, se realizó una regresión de Cox para identificar de entre los factores inicialmente considerados como potencialmente predictivos, cuáles de ellos están realmente asociados al desarrollo de resistencia a la castración. Para ello se probaron las variables: edad, tipo de TPA, estadio T clínico, Gleason, ECOG, sitio de metástasis, porcentaje de reducción del APE, duración de la TPA, radioterapia paliativa e intermitencia.
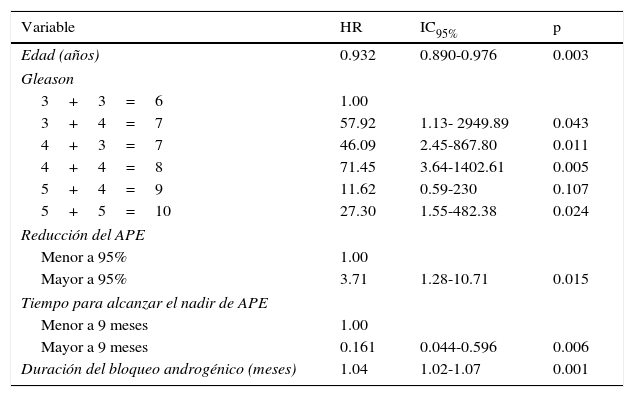
De entre ellas, las que se asociaron significativamente según el modelo multivariado de Cox fueron las que se muestran en la tabla 4. Así, se puede afirmar que en la población estudiada, por cada año de edad, disminuye un 6.8% el riesgo de resistencia a la castración, el riesgo es mayor cuando existe Gleason de 7, 8 o 10 en comparación con Gleason de 6. Cuando la reducción del antígeno prostático es mayor al 95% a los 3 meses de iniciada la TPA, el riesgo de castración resistencia es 3 veces mayor que cuando dicha reducción es menor al 95%. Los pacientes con tiempo al nadir mayor a 9 meses, tuvieron un 83.9% menos probabilidad de desarrollar resistencia a la castración en comparación con los que su tiempo al nadir fue menor a 9 meses. Finalmente, por cada mes de duración de la TPA, aumentó un 4% la probabilidad de desarrollar resistencia a la castración.
Variables asociadas al desarrollo de resistencia a la castración
| Variable | HR | IC95% | p |
|---|---|---|---|
| Edad (años) | 0.932 | 0.890-0.976 | 0.003 |
| Gleason | |||
| 3+3=6 | 1.00 | ||
| 3+4=7 | 57.92 | 1.13- 2949.89 | 0.043 |
| 4+3=7 | 46.09 | 2.45-867.80 | 0.011 |
| 4+4=8 | 71.45 | 3.64-1402.61 | 0.005 |
| 5+4=9 | 11.62 | 0.59-230 | 0.107 |
| 5+5=10 | 27.30 | 1.55-482.38 | 0.024 |
| Reducción del APE | |||
| Menor a 95% | 1.00 | ||
| Mayor a 95% | 3.71 | 1.28-10.71 | 0.015 |
| Tiempo para alcanzar el nadir de APE | |||
| Menor a 9 meses | 1.00 | ||
| Mayor a 9 meses | 0.161 | 0.044-0.596 | 0.006 |
| Duración del bloqueo androgénico (meses) | 1.04 | 1.02-1.07 | 0.001 |
Modelo de regresión de Cox.
Para identificar las variables asociadas a la probabilidad de muerte por cáncer de próstata, se probaron con la regresión de Cox las mismas variables mencionadas previamente y se observó que únicamente se asociaron significativamente en la población de estudio, las variables radioterapia paliativa y la intermitencia, el primero factor protector y el segundo factor de riesgo, ya que a quienes se les brindó radioterapia paliativa tuvieron un 68.8% menos probabilidad de fallecer en comparación con a los que no se les ofreció dicha terapia (RR=0.312, IC95% 0.14 a 0.69, p=0.004) independientemente de la influencia de otros factores. Por otro lado, quienes fueron sometidos a intermitencia, tuvieron 6 veces el riesgo de fallecer, en comparación con quienes no tuvieron dicha intermitencia (RR=6.07, IC95% 1.42 a 25.89, p=0.015).
DiscusiónDesde que se inició la TPA se han intentado identificar predictores de respuesta a la misma, ya que a pesar de que el cáncer de próstata se presente con enfermedad metastásica, su comportamiento y desenlace suele ser menos agresivo que para otras neoplasias del cuerpo; aún cuando existe una respuesta importante en la mayoría de los pacientes a los que se les inicia la TPA con disminución notable del antígeno prostático, la mediana de supervivencia libre de falla de este tratamiento es alrededor de un año4.
Se han realizado numerosos estudios que han intentado resolver esta interrogante. Se han propuesto en diversos estudios mediciones de la cinética del antígeno como predictores de respuesta en pacientes vírgenes a TPA con enfermedad metástasica, entre los que se encuentran el nadir del antígeno, el tiempo para alcanzar el nadir y la vida media del antígeno5–14. De ellos el que se ha asociado de forma más consistente es el nadir del antígeno, proponiendo en algunos estudios incluso que el APE debe llegar a niveles indetectables para mejorar desenlaces15; sin embargo de forma más reciente ha tomado relevancia la vida media del antígeno. Kim et al. evaluaron la vida media del APE en la primera visita tras el inicio de la TPA como un marcador pronóstico, encontrando que pacientes con vidas medias largas se asociaban a mayor mortalidad cáncer-específica y menor supervivencia16. Este tipo de observaciones se han realizado también en pacientes con resistencia a la castración17. En el presente estudio no pudimos valorar la vida media del antígeno pues las determinaciones del APE durante el seguimiento no estaban estandarizadas, probablemente debido a la variabilidad de las guías de seguimiento a lo largo de los años, y no se contaba con la información suficiente para realizar dicho cálculo.
El inconveniente de los estudios que han evaluado factores predictores ha sido su reproducibilidad en otras poblaciones, por lo que no se ha logrado un consenso18.
Otro factor que hay que tomar en cuenta es la heterogeneidad de la población estudiada, pues los estándares de tratamiento para los pacientes metastásicos era diferente antes; a algunos pacientes que fueron tratados a finales de la década pasada se les otorgaba la TPA por un tiempo menor y ello pudo haber influido en su respuesta posterior al tratamiento.
En nuestro estudio encontramos que en la población mexicana con cáncer de próstata metastásico que acude a nuestra institución, la primer cifra de APE que se toma a los 3 meses de iniciado el bloqueo androgénico es de relevancia pues puede orientarnos si el paciente puede tener un desenlace indeseado como fallecer o desarrollar resistencia a la castración. En nuestro estudio el punto de corte fue de 10ng/mL; esta cifra en particular no se había reportado previamente. Cabe mencionar que se encontraron resultados ambiguos respecto a dicha cifra, pues por una parte niveles menores de 10ng/mL se asociaron a menor riesgo de muerte por cáncer de próstata y por otra estos niveles se asociaron a mayor riesgo de desarrollar resistencia a la castración; no existe una explicación clara que justifique este comportamiento, sin embargo pudiera asociarse a que en aquellos pacientes que tienen disminuciones rápidas del antígeno con la TPA, algunas células neoplásicas pueden estar desarrollando mecanismos de resistencia a la castración de manera más temprana; esta situación deberá investigarse con estudios más específicos a nivel molecular en nuestra población. Asimismo encontramos que la cifra de nadir de APE<0.2ng/mL se asocia de manera importante con una menor posibilidad de fallecer y desarrollar resistencia a la castración en nuestra población. En cuanto al tiempo para alcanzar el nadir, se encontró que un tiempo menor a 9 meses se asoció con mayor propensión a desarrollar resistencia a la castración; sin embargo en este grupo existen pacientes cuya disminución del antígeno es escasa y alcanzan un nadir considerablemente alto a los pocos meses, lo cual consideramos pudo haber influido para que se haya encontrado esta asociación en el análisis. Otro factor como el porcentaje de reducción del APE a los 3 meses no se encontró relacionado de manera significativa. Cabe mencionar que estos hallazgos se encontraron en el análisis bivariado y no alcanzaron significación estadística en el análisis multivariado, probablemente por el tamaño de muestra.
En el análisis multivariado se corroboraron factores que previamente se han asociado con el riesgo de desarrollar resistencia a la castración como la escala de Gleason; en base a los resultados pareciera existir un grupo de pacientes susceptibles de desarrollar resistencia a la castración de manera temprana, aquellos pacientes jóvenes que comienzan con metástasis y presentan una reducción rápida del APE al iniciar la TPA, los cuales serían probablemente los más susceptibles de recibir un tratamiento diferente desde el inicio. Respecto a la mortalidad cáncer-específica pudo haber influido la variabilidad en los criterios para iniciar y suspender los periodos de intermitencia en nuestra población a lo largo del tiempo, los pacientes pudieron haber tenido periodos de TPA de duración menor, con inicio de intermitencia de manera temprana y eso pudo haber influido en que presentaran más muertes por cáncer al no lograr un control adecuado del cáncer durante el ciclo inicial de TPA. Respecto al menor riesgo de muerte por cáncer al haber recibido radioterapia paliativa no encontramos una explicación más que el potencial efecto benéfico sobre el control de las metástasis sintomáticas en estos pacientes.
En población mexicana no se había estudiado si estos factores efectivamente se podían asociar a una respuesta pobre.
La población que atendemos en nuestro centro tiene sus peculiaridades. Son personas generalmente de bajos recursos que deben costear por sí mismos sus tratamientos. Los tratamientos de privación androgénica no son baratos; a pesar de que los análogos de LHRH han disminuido sus costos, una buena cantidad de pacientes (el 38% en nuestra institución) termina optando por realizarse castración quirúrgica por falta de recursos, en un promedio de 5 meses de iniciado el análogo de LHRH. Asimismo estos pacientes presentaron cierta tendencia hacia una mayor mortalidad y desarrollo de resistencia a la castración, sin que se haya identificado una causa por la que se asocien estos hallazgos con la realización de la orquiectomía.
Un rubro que está tomando relevancia en el manejo del cáncer de próstata avanzado es el uso de quimiohormonoterapia temprana. La quimioterapia con docetaxel demostró desde principios de este siglo su utilidad en pacientes con cáncer de próstata con resistencia a la castración19, determinándose posteriormente el régimen óptimo actual20.
Es bien conocido que los pacientes sintomáticos con resistencia a la castración se pueden beneficiar de quimioterapia con docetaxel, sin embargo algunos estudios recientes han evaluado el papel de la quimioterapia de forma temprana con resultados alentadores antes de desarrollar la resistencia a la castración y, así, prolongar la supervivencia4.
Sweeney et al.21 en 2015 demostraron en el estudio CHAARTED que con el uso de quimiohormonoterapia basada en docetaxel de forma temprana se puede prolongar la supervivencia global en promedio de 13 meses cuando se compara con hormonoterapia convencional; a pesar de que no se haya corroborado este beneficio en el estudio de GETUG-AFU1522, parece ser una alternativa que pudiera mejorar los desenlaces de los pacientes metastásicos con algunas características de alto riesgo, lo cual pretende corroborarse en el estudio STAMPEDE en curso.
El objetivo de nuestro estudio consistía en determinar factores que pudieran ayudarnos a identificar pacientes propensos a tener una pobre respuesta al tratamiento de privación androgénica estándar de la forma más temprana posible. Prolongar, como indican las guías, hasta los 24 meses a un paciente que no está teniendo una respuesta óptima a la TPA no parece ser lo apropiado, pues muy probablemente desarrolle resistencia a la castración y/o fallezca antes de dicho plazo. En base a las tendencias actuales proponemos que aquellos pacientes cuya cifra de APE no disminuya a menos de 10ng/mL a los 3 meses de iniciado el tratamiento y/o sus cifras de nadir no alcancen menos de 0.2ng/mL en un periodo máximo de 12 meses, así como pacientes jóvenes (menores de 60 años) con reducción rápida del APE, pudieran ser valorados para administración concomitante de quimioterapia con docetaxel con la finalidad de prolongar la supervivencia. Estamos conscientes que en un país como el nuestro no se puede administrar docetaxel como estándar a todos los pacientes metastásicos, pero sí podemos administrarlo a un grupo de pacientes que pudiera beneficiarse en mayor medida al identificarlos de manera temprana mediante los perfiles de cinética del APE como adyuvante a los criterios que se han descrito para definir a pacientes de alto riesgo.
Los resultados obtenidos en el estudio nos refuerzan el concepto de que el enfoque en el manejo de los pacientes con cáncer de próstata tenderá cada vez más a la individualización de cada caso basándonos en las características propias de cada paciente, ya sea a nivel genético, molecular, bioquímico o clínico, para lo cual se deben seguir estudiando dichas variables en diversos escenarios.
ConclusionesEn pacientes con cáncer de próstata y metástasis óseas al diagnóstico, los factores previamente mencionados se asocian al desarrollo de resistencia a la castración y mortalidad cáncer-específica en nuestra institución; la identificación de estos factores al inicio y durante el tratamiento pueden ayudarnos a individualizar los esquemas de tratamiento de forma oportuna.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo existió ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A todos mis maestros y compañeros de la residencia durante estos años.