La meibografía es una tecnología que nos permite evaluar la morfología de las glándulas de Meibomio in vivo de una forma no invasiva y con pocas o nulas molestias. Nuevas tecnologías en el mercado nos permiten realizarla sin necesidad de tocar al paciente y con la ayuda de programas computacionales es posible evaluar de forma objetiva y cuantitativa la pérdida de las mismas. Otras tecnologías de imagenología como la microscopia confocal pueden además analizar el tejido celular adyacente a las glándulas de Meibomio para monitorizar la respuesta al tratamiento instituido. La presente revisión analiza la meibografía desde sus inicios y los avances más recientes en esta área.
Meibography is a technology that allows us to evaluate the morphology of the Meibomian glands in vivo in a noninvasive manner and with little or no discomfort to the patient. New technologies in the market allow us to do it without touching the patient and with the help of computer programs can be assessed objectively and quantitatively the loss of the Meibomian glands. Other imaging technologies such as confocal microscopy can also analyze the cellular tissue adjacent to the Meibomian glands to monitor treatment response. This review examines the Meibography since its inception and the latest developments in this area.
La unidad funcional lagrimal está compuesta por la película lagrimal, las glándulas que secretan sus componentes, así como los nervios que controlan esta secreción además de los párpados que son los encargados de la distribución y eliminación de la lágrima; cualquier alteración de alguno de sus componentes puede producir un síndrome de disfunción lagrimal, enfermedad definida en el 2007 por el Taller Internacional sobre Ojo Seco como una enfermedad multifactorial de la película lagrimal y la superficie ocular que causa síntomas de malestar, trastornos visuales e inestabilidad de la película lagrimal con daño potencial en la superficie ocular que va acompañada por un incremento en la osmolaridad de la película lagrimal e inflamación de la superficie ocular1.
Para una comprensión más sencilla, se ha descrito que la película lagrimal está compuesta de 3 capas. La capa superficial se forma sobre la parte acuosa de la misma a partir de las secreciones oleosas de las glándulas de Meibomio (GM) y las glándulas sebáceas accesorias de Zeis y de Moll, las aberturas de las GM se distribuyen a lo largo del borde palpebral, inmediatamente por detrás de los folículos de las pestañas; la capa intermedia es la fase acuosa, que es secretada por la glándula lagrimal principal y las glándulas accesorias de Krause y de Wolfring; y la capa más interna es delgada, mucoide elaborada por células caliciformes de la conjuntiva y también por las criptas de Henle y las glándulas de Manz.
La clasificación más actual del síndrome de disfunción lagrimal está basada en su etiopatogenia y divide la enfermedad en deficiencia acuosa asociada o no a síndrome de Sjogren y enfermedad de tipo evaporativo, ya sea por una alteración intrínseca como la deficiencia de la secreción de las GM, ya por desordenes de la alteración de la apertura palpebral o de la frecuencia del parpadeo así como por interacción medicamentosa especialmente con la isotretinoína (nombres comerciales: Roaccutan®, Neotrex®, Isotrex®, Oratane®, Trevissage®), y una forma extrínseca por deficiencia de vitamina A, el uso de conservadores tópicos o lentes de contacto y enfermedades de la superficie ocular como la alergia1.
Disfunción de las glándulas de MeibomioLa disfunción de las GM, también llamada blefaritis posterior, es la causa principal de ojo seco de tipo evaportativo2,3 y se define como una anormalidad crónica y difusa de las GM. La disfunción de las GM puede ser de 3 tipos: hipersecretora, hiposecretora y obstructiva4–9, siendo esta última la más frecuente. Estudios clínicos y en animales muestran que la obstrucción de las GM son el resultado de una hiperqueratinización del epitelio ductal, lo que produce una obstrucción de los orificios de salida, dilatación quística del conducto y finalmente una atrofia difusa de los acinos, lo que genera pérdida de las glándula, siendo posible identificar los 2 primeros pasos mediante una exploración con lámpara de hendidura mientas que los 2 últimos solo es posible diagnosticarlos mediante estudios de meibografía.
Glándulas de MeibomioLas GM son una variante de las glándulas sebáceas situadas en las placas tarsales de los párpados superior e inferior. Estas glándulas son las encargadas de sintetizar y secretar activamente el meibomio, una compleja mezcla de cera, ésteres de colesterol, triglicéridos y fosfolípidos10 que forman parte de la capa externa de la película lagrimal, fomentando la estabilidad y evitando su evaporación11–13.
Cada GM se compone de múltiples acinos secretores que contienen meibocitos, ductos laterales, un conducto central y un conducto excretor terminal que se abre en el margen posterior del párpado. La cantidad y volumen de las GM es mayor en el párpado superior (30-40), en comparación con el inferior (20-30)14 aunque el aporte funcional relativo en la película lagrimal de las glándulas de ambos párpados aún no se ha determinado con exactitud.
Las GM están densamente inervadas y su función está regulada por andrógenos, estrógenos, progestágenos, ácido retinoico, factores de crecimiento, y posiblemente, por neurotransmisores. Las glándulas producen lípidos polares y no polares a través de un proceso complejo y no completamente entendido. Estos lípidos se secretan dentro de los conductos a través de un proceso holocrino; la salida de la secreción sebácea se presenta en los orificios glandulares, los cuales se encuentran situados justo por delante de la unión mucocutánea del borde palpebral, y esta se produce debido a la contracción muscular durante el movimiento del párpado.
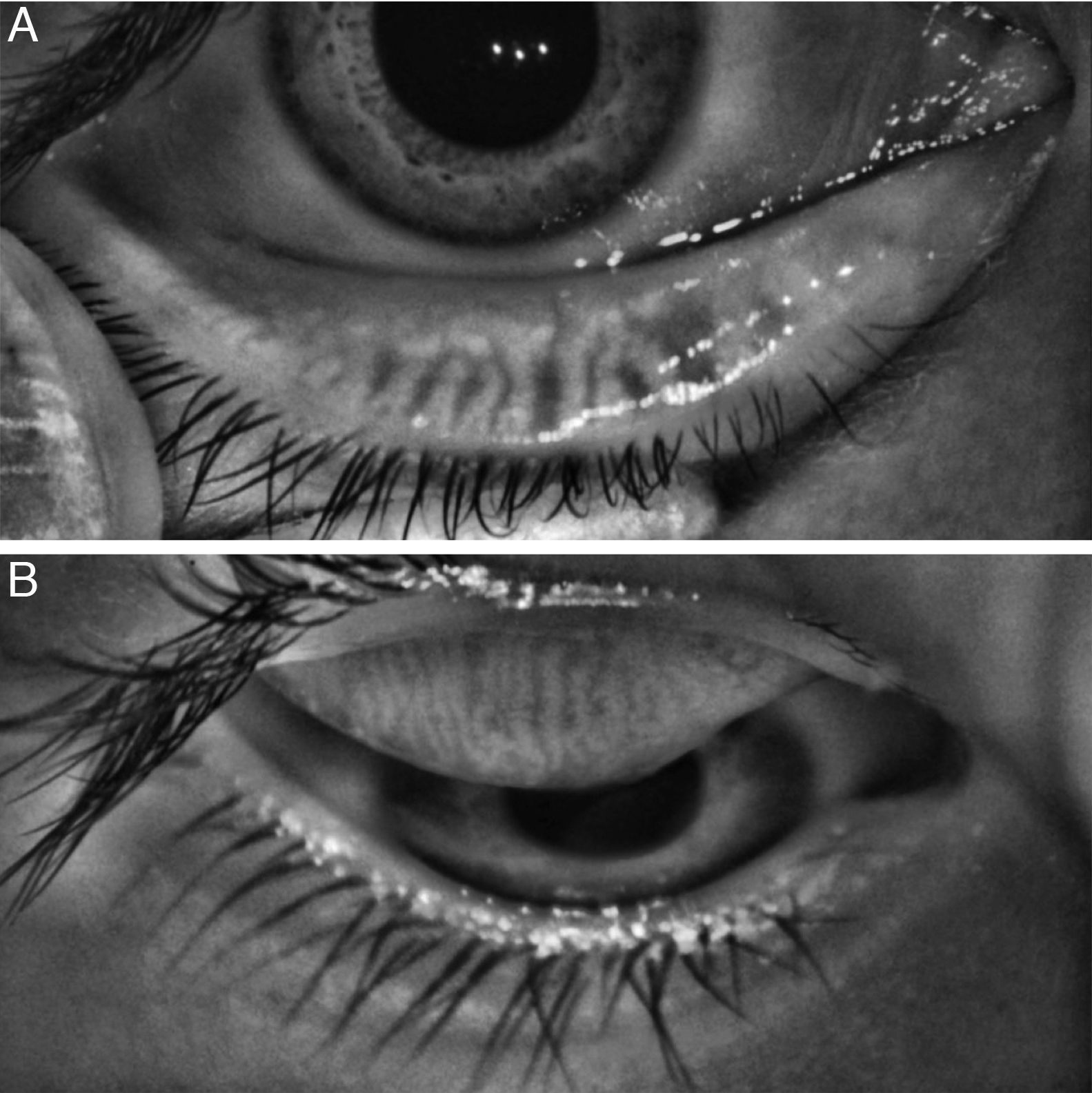
La forma más accesible de evaluar las GM es mediante la exploración con lámpara de hendidura; con esta técnica es posible visualizar cambios anatómicos del borde palpebral como la presencia de telangiectasias, hiperemia, engrosamiento vascular, obstrucción de los orificios de salida, remplazo anterior o posterior de la unión mucocutánea, y mediante la expresión de las GM por presión de los párpado es posible evaluar tanto la calidad como la cantidad de la secreción de las glándulas14–17, cambios que se correlacionan de manera adecuada con la disfunción de las GM18.
MeibografíaLa meibografía es un técnica diagnóstica que permite la evaluación in vivo de la morfología de las GM19–21, ya que estas no son accesibles a la visualización directa como la mayoría de las estructuras oculares, y se han desarrollado varias técnicas para ello, además de maneras de documentarlas y analizarlas.
Meibografía con luz infrarrojaLa meibografía fue descrita en 1977 por Tapie22 quien utilizó luz ultravioleta para producir la fluroescencia de los ductos de las GM además de luz infrarroja (IR) para iluminar las glándulas y documentarlas mediante fotografía IR; en 1985 Robin et al. describieron una técnica biomicroscópica de transiluminación del párpado evertido desde la piel y documentación fotográfica IR23, y en 1994 Mathers et al.24 utilizaron el registro mediante video para el seguimiento de estos pacientes; posteriormente Arita et al.20 modifican la técnica a una evaluación de no contacto con documentación videográfica y más recientemente se incluye un análisis computacional de las imágenes adquiridas lo que la convierte en una técnica objetiva y reproducible25.
Existen varios equipos para la realización de la meibografía digital IR, el equipo desarrollado inicialmente por Arita et al. se montaba sobre una lámpara de hendidura equipada con un filtro de transmisión IR (IR 83, Hoya, Tokio, Japón) y una cámara IR acoplada a la lámpara de hendidura (XC-E150, Sony, Tokio, Japón)20, en el 2012 Pult et al.26 desarrollaron un meibógrafo portátil usando un video dispositivo de carga acoplada (CCD) IR (802CHA CCD; Shenzhen LYD Technology Co. Ltd. Shenzhan, China) al que se le adaptó un sistema de lentes para observación cercana; además de estos, otros instrumentos de meibografía IR de no contacto se encuentran disponibles actualmente en el mercado, la compañía CSO (Construzionne Strumenti Oftalmici, Florencia, Italia) la incluye en el tomógrafo de cámara de Sheipglug Sirius®, en la cámara de fondo de ojo Cobra® y el topógrafo de anillos de plácido Antares® que utilizan una iluminación LED IR de 890nm; la casa comercial Oculus (Wetzlar, Alemania) comercializa en el mercado el Keratograph®27 que utiliza una iluminación IR de 840nm, equipo con características similares al Antares®, además la compañía Topcon en su modelo TOPCON BG-4M para lámpara de hendidura, incluye un sistema de iluminación IR con una CCD externa para la grabación de la meibografía.
Meibografía con láser confocalEn 2005, Kobayashi et al.28 demostraron la visualización de las GM utilizando un láser confocal, con la ventaja de poder documentar no solo la morfología sino también la histología de las glándulas y el tejido que las rodea29; en 2008, Matusomoto et al.29 describieron 2 parámetros objetivos para el diagnóstico de disfunción de las GM mediante la medición de la densidad de acinos glandulares y el diámetro de la unidad acinar, ambos parámetros medidos con un programa incluido en el láser confocal (the Rostock Corneal Software Version 1.2 of the HRTII-RCM Heidelberg Retina Tomograph II- Rostock Cornea Module, Heidelberg Engineering GmbH, Dossenheim, Alemania); posteriormente estos mismos autores describieron la presencia de un infiltrado de células inflamatorias y fibrosis periglandular asociada a la disfunción de las GM, utilizando esta técnica para el seguimiento del manejo antiinflamatorio y reportando una disminución de la infiltración inflamatoria posterior a su uso30. La medición de la densidad de acinos, la densidad de la unidad acinar y la infiltración inflamatoria ha demostrado tener una buena sensibilidad y especificidad para diagnosticar disfunción obstructiva de las GM y una buena correlación con otros estudios de dinámica lagrimal y pérdida de las GM31; entre las desventajas de esta tecnología se encuentra que es una técnica de contacto ya que requiere el toque del lente al tejido estudiado lo que conlleva mayores molestias para los pacientes, y la poca accesibilidad a la tecnología.
Meibografía con tomografía de coherencia ópticaEl uso de la tomografía de coherencia óptica (OCT) para la valoración de las GM fue reportado por primera vez por Bizheva et al.32 quienes utilizaron un OCT de 1,060nm de alta resolución para evaluar en 2 y 3 dimensiones in vivo las GM; a diferencia de otras tecnologías, el uso del OCT agrega la posibilidad de evaluar el volumen que ocupa la GM, más recientemente Hwang et al. describieron el uso de un OCT de segmento anterior con resultados similares a la meibografía con luz IR33. Liang et al.34 encontraron una disminución del ancho y largo de las GM en pacientes con disfunción de las GM obstructiva en comparación con pacientes sanos.
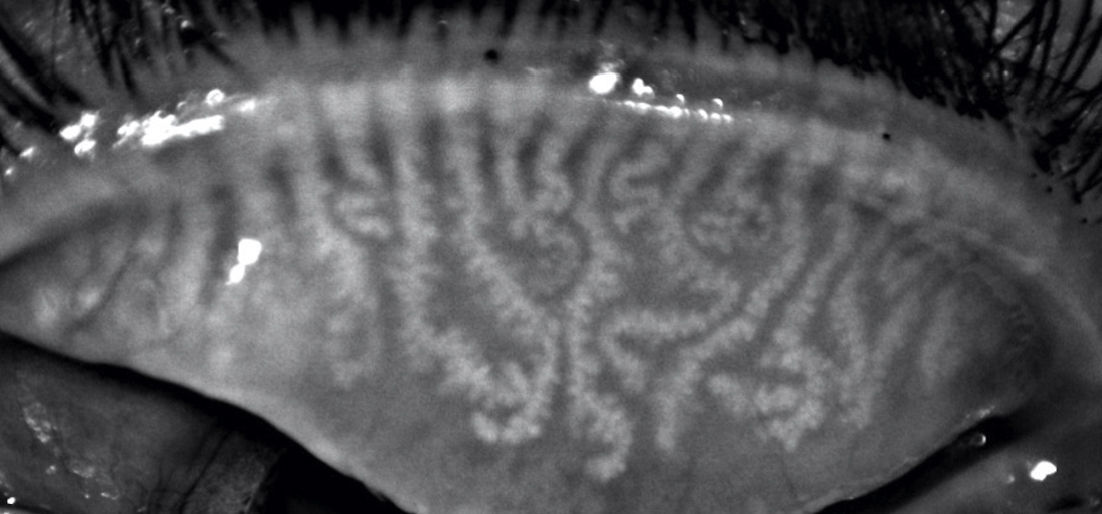
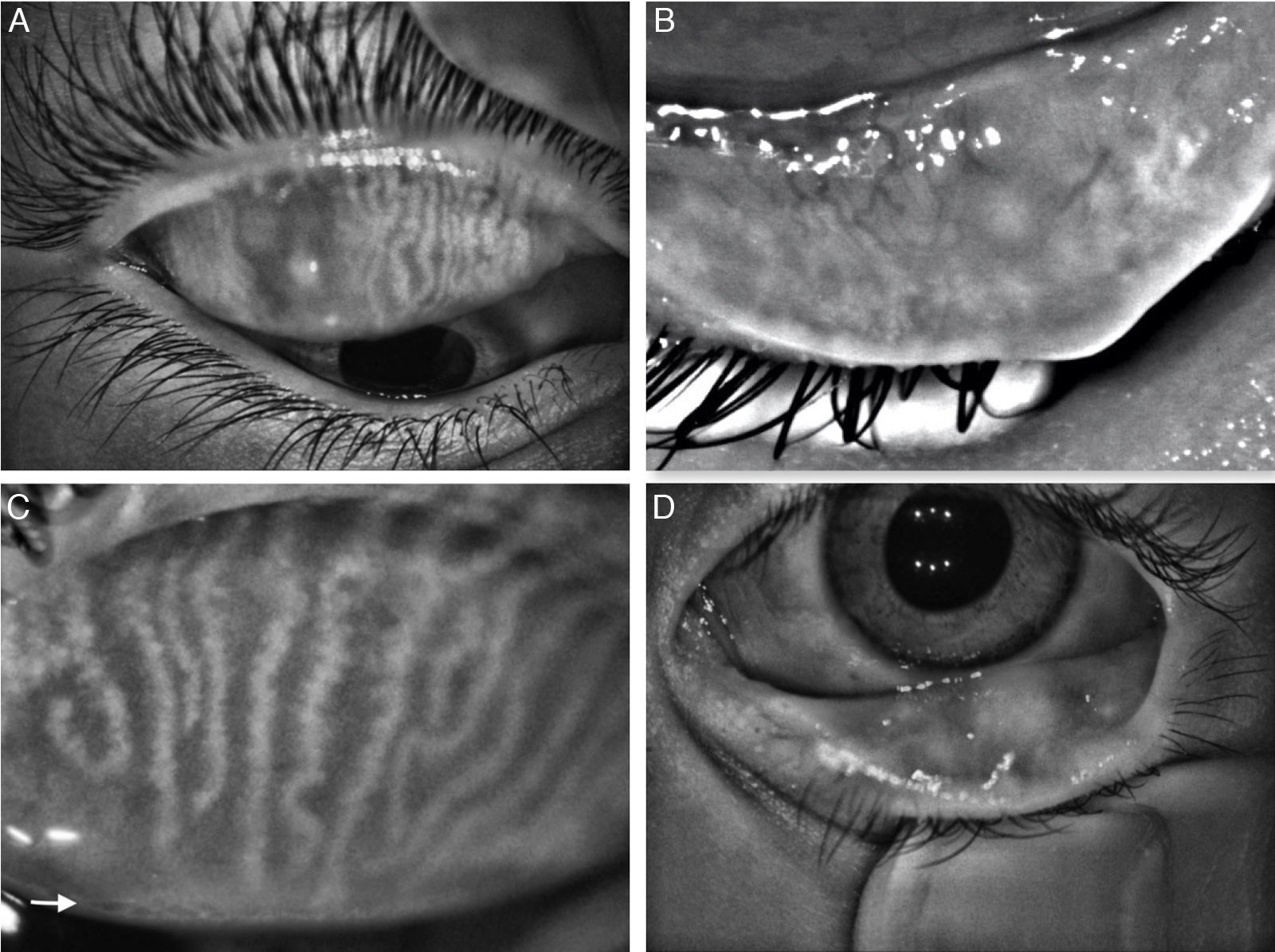
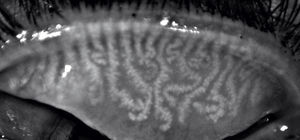
Análisis de la meibografíaEn la meibografía por luz IR, las GM se observan como agregados en forma de racimos de uva con acinos que se dirigen hacia el borde palpebral en línea recta o ligeramente tortuosa y que son hiperreflécticos (fig. 1, topógrafo Antares®; fig. 2, topógrafo Keratograph®).
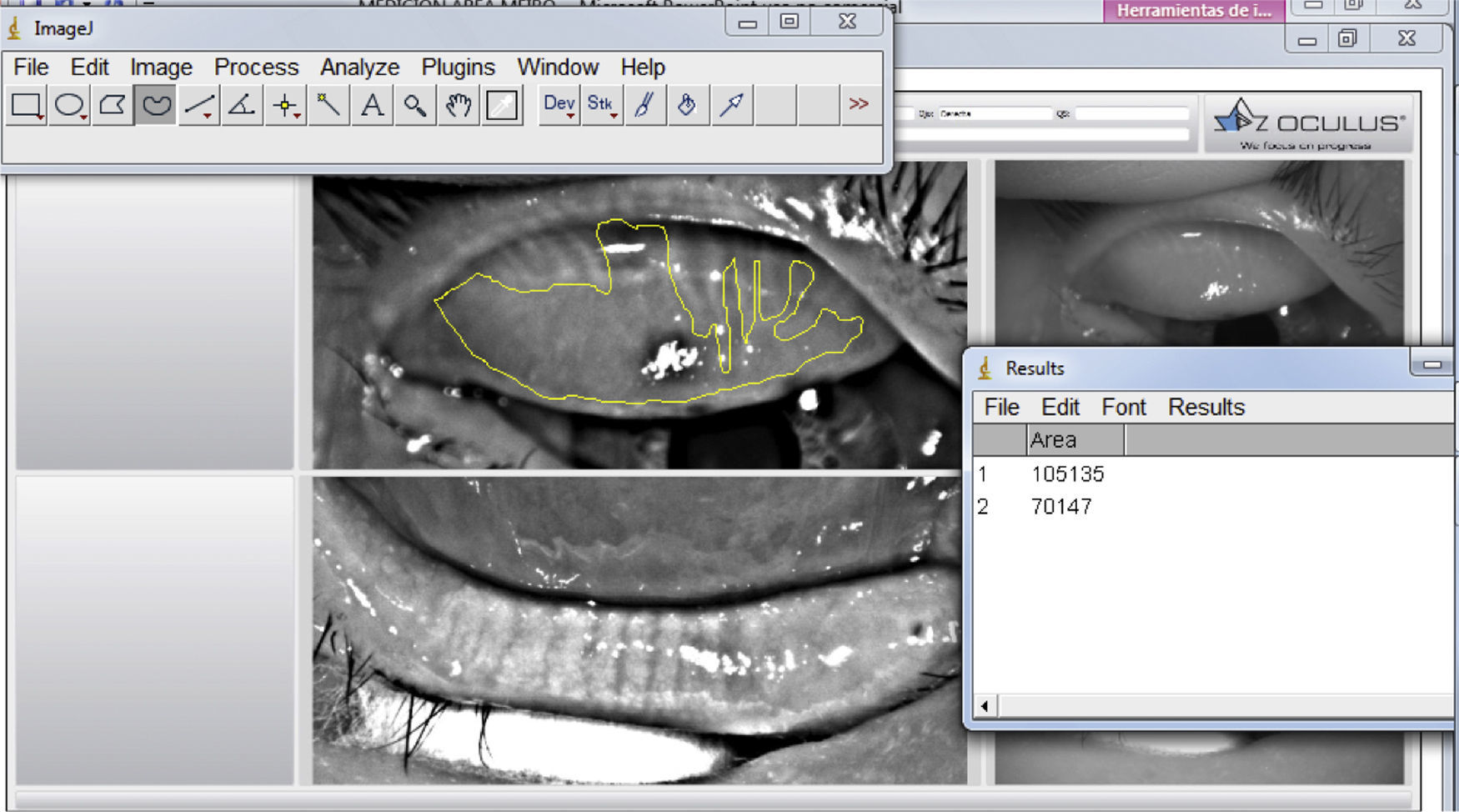
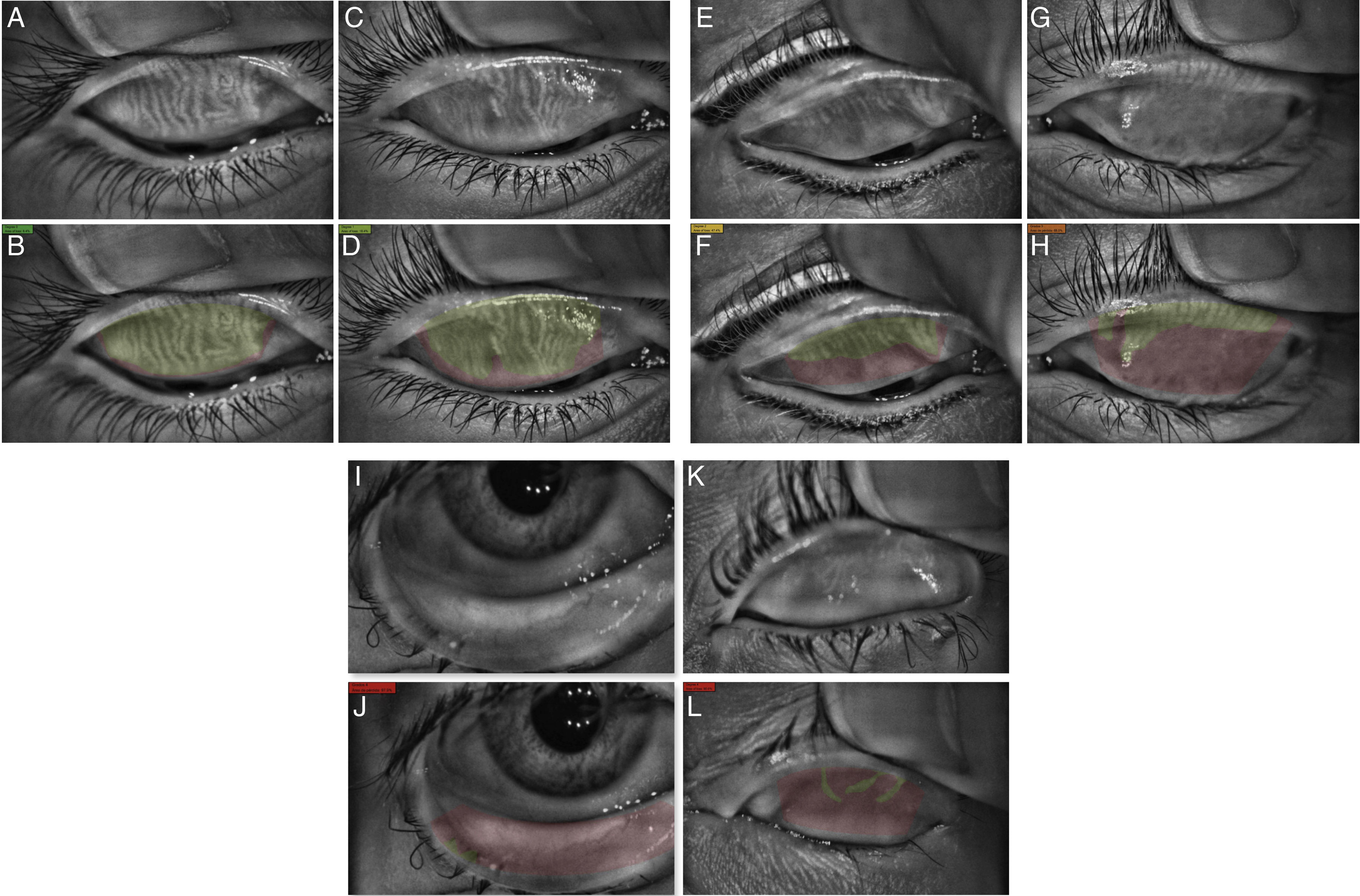
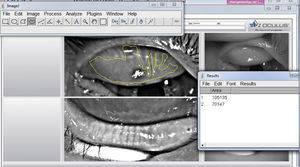
Desde su introducción, la medición de la pérdida de GM se ha cuantificado de diferentes formas. Arita et al. en 2008 desarrollaron un marcador llamado Meiboscore el cual estadificaba la pérdida de GM en 4 pasos (del 0 al 3) de acuerdo al porcentaje alterado, siendo 0 cuando no hay pérdida, 1 cuando la pérdida es menor a un tercio del área, grado 2 entre 1/3 y 2/3 de pérdida y grado 3 cuando la pérdida es mayor de 2/3 del área estudiada; una vez estadificados el párpado superior e inferior se suman para obtener un marcador final20, encontrando una buena correlación entre el marcador y la edad así como las anormalidades del margen palpebral y el tiempo de rotura lagrimal. Pult et al.35 desarrollaron una escala de 5 grados con el objetivo de aumentar su sensibilidad a cambios más pequeños, estadificando en grado 0 cuando no hay pérdida, grado 1≤25%, grado 2 del 26-50%, grado 3 del 51-75% y grado 4>75%, que al utilizarse mediante un análisis computacional con el programa de edición fotográfico del Instituto Nacional de Salud de los EE. UU. (image editing software Image J National Institute of Health; http://imagej.nih.gov/ij) presenta un buen acuerdo intra- e interobservador (fig. 3)36. Esta escala es la utilizada en el programa Phoenix de la casa comercial CSO, en la que, a diferencia del equipo Keratograph® donde es necesario utilizar un programa externo, el análisis se realiza en el mismo programa del equipo con una estadificación automática (fig. 4). Más recientemente Arita et al. describieron el uso de un programa computacional para el análisis cuantitativo del área de las GM que mediante filtros que incrementan el contraste y disminuyen el ruido en la imagen identifican la luminosidad de las GM y cuantifican de forma automática el área de pérdida25.
Análisis de meibografía infrarroja del párpado superior con el equipo Keratograph® por medio del programa Image J. La línea amarilla representa el área de pérdida glandular (número 2 en la ventana de resultados en el extremo inferior derecho). El número 1 es el área total, la cual fue medida previamente.
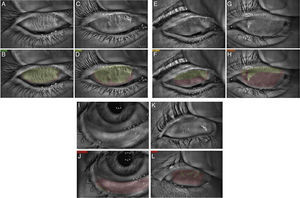
Análisis de estudio de meibografía infrarroja con el equipo Antares® donde se observa la foto clínica en la parte superior (A, C, E, G, I,K) y la estadificación de la pérdida de las GM por selección del área con glándulas (verde) y áreas de pérdida glandular (rojo) en la parte inferior (B, D, F, H, J, L). En el grado 0 (A, B, color verde oscuro) no se observa pérdida de las GM; grado 1 (C, D, color verde olivo) pérdida menor del 25%; el grado 2 (E, F, color amarillo) la pérdida es entre 25 y 50%; grado 3 (G, H, color anaranjado) pérdida entre 50 y 75% y grado 4 (I-L, color rojo) pérdida mayor al 75%.
Para la meibografía con láser confocal, Ibrahim et al. describieron valores de corte para diagnosticar la disfunción de las GM, siendo de 65μm para el diámetro más largo del acino, 25μm para el más corto, 300 células/mm2 para la densidad de células inflamatorias y 70 glándulas por mm2 para la densidad de la unidad acinar, con una sensibilidad y especificidad mayor del 81% para todos los parámetros31.
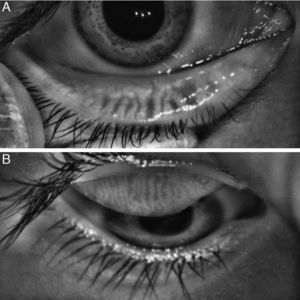
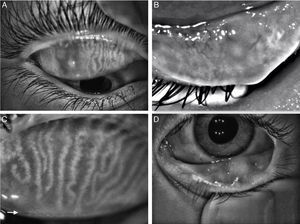
Aplicación clínicaAdemás de los daños descritos en pacientes con disfunción de las GM, a través de la meibografía se ha podido determinar daños en las GM en otras enfermedades como: orzuelo (fig. 5A), queratoconjuntivitis atópica (fig. 5B)37, conjuntivitis alérgica (fig. 5C)38, rosácea (fig. 5D)39, enfermedad injerto vs. huésped40,41, parálisis facial42, síndrome de Sjögren43, orbitopatía de Graves44 y distrofia granular tipo 2 de la córnea45; además también se ha demostrado daño en las GM en pacientes operados de trabeculectomía46, los que utilizan prótesis oculares47 o lentes de contacto48 y usuarios crónicos de medicamentos antiglaucomatosos49,50. Finalmente, también se han descrito cambios de la anatomía del borde palpebral y la morfología de las GM asociadas a la edad en pacientes sin disfunción de GM, siendo estos cambios más importantes en los hombres que en las mujeres18,20.
(A) Análisis de estudio de meibografía infrarroja con el equipo Antares® del párpado superior de un paciente masculino de 19 años con orzuelo de 2 semanas de evolución con pérdida total de las GM y un área hiperrefléctica que coincide con la localización del orzuelo; (B) estudio Keratograph® que demuestra una ausencia glandular severa en paciente de 8 años de edad con queratoconjuntivitis atópica; (C) estudio Antares® del párpado superior de un paciente masculino de 9 años con conjuntivitis alérgica perenne donde se observan las papilas como anillos hiperreflécticos con una área hiporrefléctica central, con una pérdida de las GM grado 1 (11.9%); (D) estudio Antares® del párpado inferior de una niña de 4 años con cuadros recurrentes de chalazión y afectación corneal por rosácea ocular con pérdida casi total de las GM.
En conclusión, la meibografía es un estudio in vivo que nos permite conocer las alteraciones anatómicas de las GM y su respuesta patológica los que nos puede ayudar a indicar un tratamiento más preciso y monitorizar la respuesta al mismo de forma no invasiva y sin riesgos.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesNinguno.