El estómago, un órgano importante en el proceso de la digestión, realiza una variedad de funciones que incluyen el almacén y exposición de los alimentos al ácido que secreta, además de proveer una barrera que prevenga el paso de microorganismos al intestino1.
A pesar del ataque constante que sufre la mucosa gástrica por múltiples agentes nocivos endógenos (ácido clorhídrico, pepsina, ácidos biliares, enzimas pancreáticas) y exógenos (alcohol, fármacos y bacterias) así como una variedad de condiciones inflamatorias (colitis ulcerosa y enfermedad de Crohn)2, su integridad se conserva gracias a un intrincado sistema que proporciona defensa y reparación de la mucosa3.
Las prostaglandinas están involucradas en funciones fisiológicas como la protección de la mucosa del estómago, la agregación plaquetaria y la regulación de la función renal, pero también tienen funciones patológicas como su implicación en la inflamación, la fiebre y el dolor4. El ácido acetilsalicílico (AAS) conocido popularmente como aspirina, ejerce sus acciones analgésicas, antipiréticas y antiinflamatorias mediante la inhibición de la enzima ciclooxigenasa (COX) y por lo tanto la prevención de la formación y liberación de prostaglandinas5, haciendo más susceptible a la mucosa gástrica de sufrir algún daño. El mecanismo por el cual suceden estos procesos se comenta más adelante.
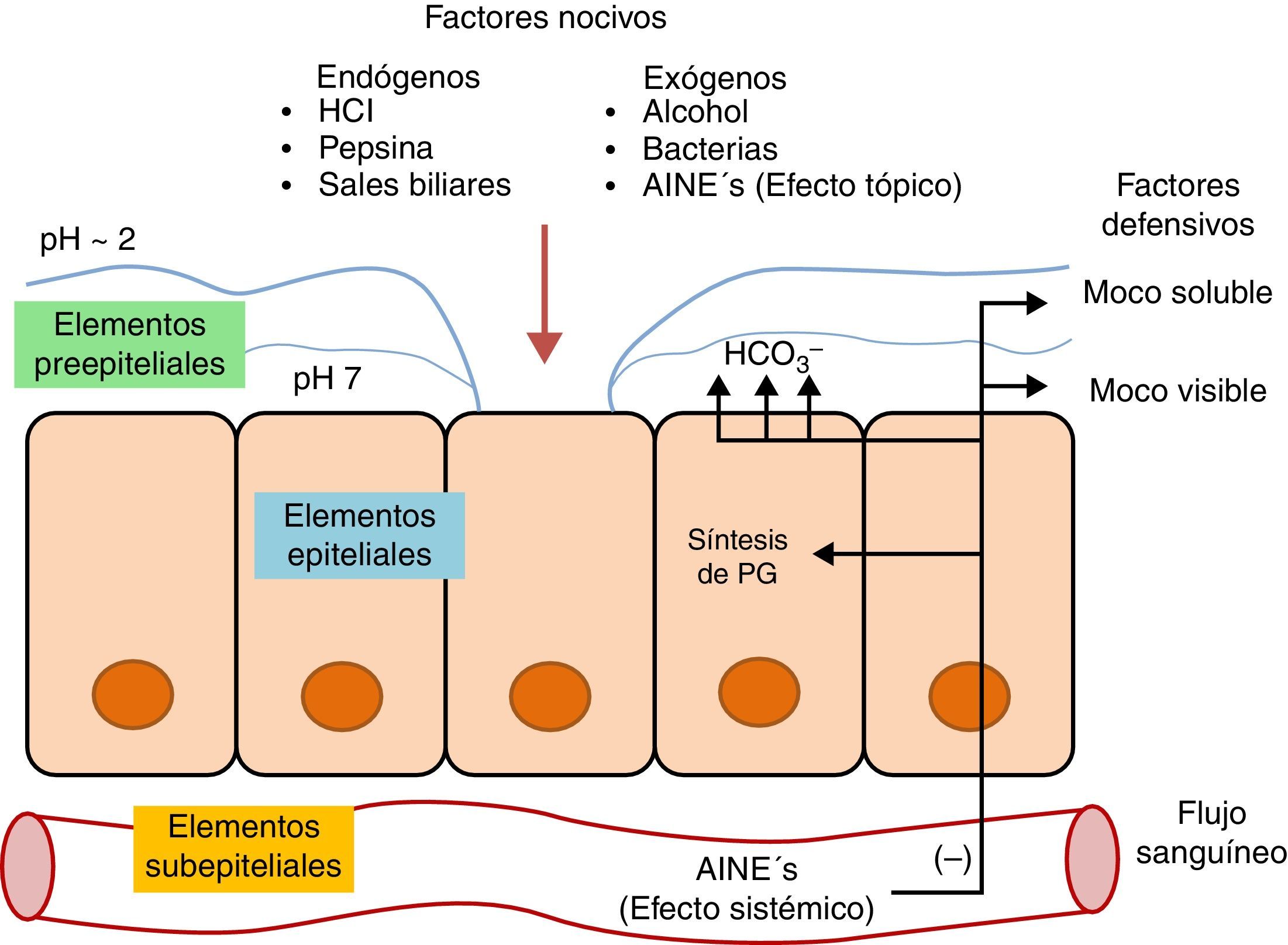
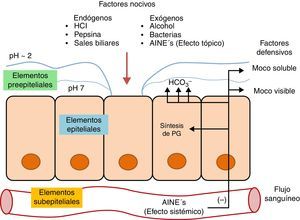
Mecanismos de defensa de la mucosa gástricaDesde un punto de vista conceptual y didáctico los mecanismos de defensa se pueden visualizar como una barrera de tres niveles, compuesta por elementos preepiteliales, epiteliales y subepiteliales (fig. 1). En cada uno de estos niveles existen importantes mecanismos encaminados a mantener la homeostasis de la mucosa3,6.
Elementos preepitelialesEste nivel comprende una capa de moco y bicarbonato que actúa como una barrera fisicoquímica contra múltiples moléculas. La totalidad de la superficie de la mucosa gástrica existente entre las glándulas posee una capa continua de células mucosas superficiales, encargadas de secretar un moco viscoso para cubrir las células epiteliales. El grosor de esta capa es casi siempre mayor de 1mm3.
Los componentes principales son mucinas (glicoproteínas), bicarbonato (HCO3−), lípidos y agua (95%). En el estómago se han identificado principalmente dos tipos distintos de mucinas: MUC5AC secretadas por las células mucosas superficiales y MUC6 secretadas por las células mucosas del cuello. Otros tipos reconocidos son las MUC1, MUC4, MUC16 cuya función parece estar ligada a señalización de transducción y fenómenos de adhesión1.
El moco gástrico está dispuesto en dos capas: La capa interna también denominada moco visible, forma un recubrimiento gelatinoso con una alta concentración de bicarbonato para mantener un pH neutral (7.0), protegiendo a la mucosa del ácido corrosivo, retardando la difusión retrógrada de iones hidrógeno (H+) y manteniendo el HCO3− secretado por el epitelio. Las moléculas de mucina contenidas en esta capa se entrelazan por puentes disulfuro confiriéndole una consistencia altamente viscosa y con la capacidad de expansión al hidratarse.
La capa externa o moco soluble es menos viscosa debido a la falta de enlaces disulfuro entre las moléculas de mucina que contiene. Esta capa se encarga de la liberación constante de óxido nítrico (NO) y de la unión con agentes nocivos, se mezcla con los alimentos y se desprende. El estímulo para el engrosamiento de ambas capas es distinto, sin embargo, ambas responden al estímulo de la PGE2, las razones aún no han sido claramente establecidas.
La estabilidad de la mucosa se incrementa por la presencia de péptidos pequeños conocidos como factores trefoil1,7.
Factores trefoilLos factores trefoil son péptidos pequeños y compactos que participan en la reparación de las superficies mucosas mediante los procesos de restitución y regeneración epitelial8.
Estructuralmente están formados por uno o dos dominios en trébol, cada dominio en trébol consta de 42-43 residuos de aminoácidos con seis residuos de cisteína formando tres enlaces disulfuro y así creando una estructura característica de tres hojas.
En humanos se han identificado tres tipos: TFF-1, TFF-2 y TFF-3, siendo el estómago el único órgano en el que se expresan los tres tipos7,8. Las células productoras de mucina y las células caliciformes son los principales sitios de síntesis.
En comparación con otros tejidos, el colon y el estómago muestran los más altos niveles de expresión del ARNm de TFF-1. TFF-2 se restringe únicamente a la mucosa del estómago y a las glándulas de Brunner y TFF-3 muestra una distribución más general en las superficies mucosas.
La producción de los tres péptidos trefoil está regulada primordialmente en los sitios de daño gastrointestinal, sus genes presentan un patrón distinto de expresión después de la lesión, TFF-2 se consideran de respuesta temprana y TFF-3 de respuesta tardía.
Cuando se produce una lesión en la mucosa, uno de los primeros procesos de reparación es la migración de las células supervivientes desde el borde de la región dañada sobre el área denudada para volver a establecer la continuidad del epitelio2.
Elementos epitelialesLas células epiteliales brindan protección mediante diversos factores. Entre estos se encuentran transportadores iónicos que mantienen el pH intracelular, la producción de moco, HCO3−, péptidos trefoil y proteínas de choque térmico. Estas últimas impiden la desnaturalización de proteínas, protegiendo a las células de ciertos factores como el aumento de temperatura, agentes citotóxicos o estrés oxidativo3.
La exposición de la mucosa a diversos agentes agresores puede causar un desequilibrio entre la pérdida y la renovación celular. Cuando se presenta el daño, en la restitución celular intervienen factores como el factor de crecimiento epidérmico (EGF, epidermal growth factor), el factor transformador del crecimiento (TGF, transforming growth factor) α y β, el factor de crecimiento de los fibroblastos (FGF, fibroblast growth factor) y los factores trefoil1,3.
El receptor de EGF (EGFR) es una proteína transmembrana al que también se unen otros ligandos como el TGF, la anfirregulina (AR) y la betacelulina (BTC). En muchos estudios el efecto que tiene el EGF sobre la mucosa no dañada es insignificante, esto se atribuye a que el EGFR en las células epiteliales está restringido a la superficie basolateral, por lo que únicamente existe interacción ligando-receptor cuando hay un daño2.
Por otra parte al mismo tiempo que ocurre la renovación epitelial tiene lugar la angiogénesis cuyos principales reguladores son el FGF, el factor de crecimiento del endotelio vascular (VEGF, vascular endotelial growth factor) y las prostaglandinas3.
Elementos subepitelialesLa microvasculatura subepitelial tiene el efecto protector más importante de la mucosa gástrica. Tiene a cargo mantener el flujo sanguíneo ininterrumpido hacia las células epiteliales, sirviendo como medio de transporte de nutrientes y productos de desecho, además de ser una fuente productora de prostaglandinas importante1. Estas sustancias fungen como las encargadas de estimular los mecanismos protectores.
ProstaglandinasSon sustancias de carácter lipídico estructuralmente formadas por un anillo ciclopentano y dos cadenas alifáticas. Junto con los tromboxanos (TX) y las prostaciclinas (PGI) conforman la familia de los prostanoides, cuyos precursores inmediatos son ácidos grasos poliinsaturados (C20) denominados icosanoides, el más importante es el ácido araquidónico mismo que podemos obtenerlo de la dieta a través del ácido linoleico9,10.
Se les considera hormonas de acción local porque actúan cerca de sus sitios de síntesis, tienen una vida media corta y no se almacenan. Tras su liberación rápidamente son captadas por las células en donde son inactivadas. Los pulmones son un lugar importante para su catabolismo.
Las tres clases principales de prostaglandinas son las series A, E y F. Actualmente se sabe que las PGE2 son un elemento clave en la defensa de la mucosa gástrica y que funcionan como ligando de subtipos específicos de receptores EP11. Es de considerar que la función de una prostaglandina puede variar en los distintos tejidos.
La activación de los receptores EP1 provoca un aumento de flujo sanguíneo en la mucosa, disminución de la motilidad gástrica y aumento en la secreción de bicarbonato. Por su parte la activación de los receptores EP3 provoca una disminución de AMPc y por tanto una inhibición de la secreción de ácido gástrico. La estimulación de la secreción de moco ocurre a través del receptor EP412,13.
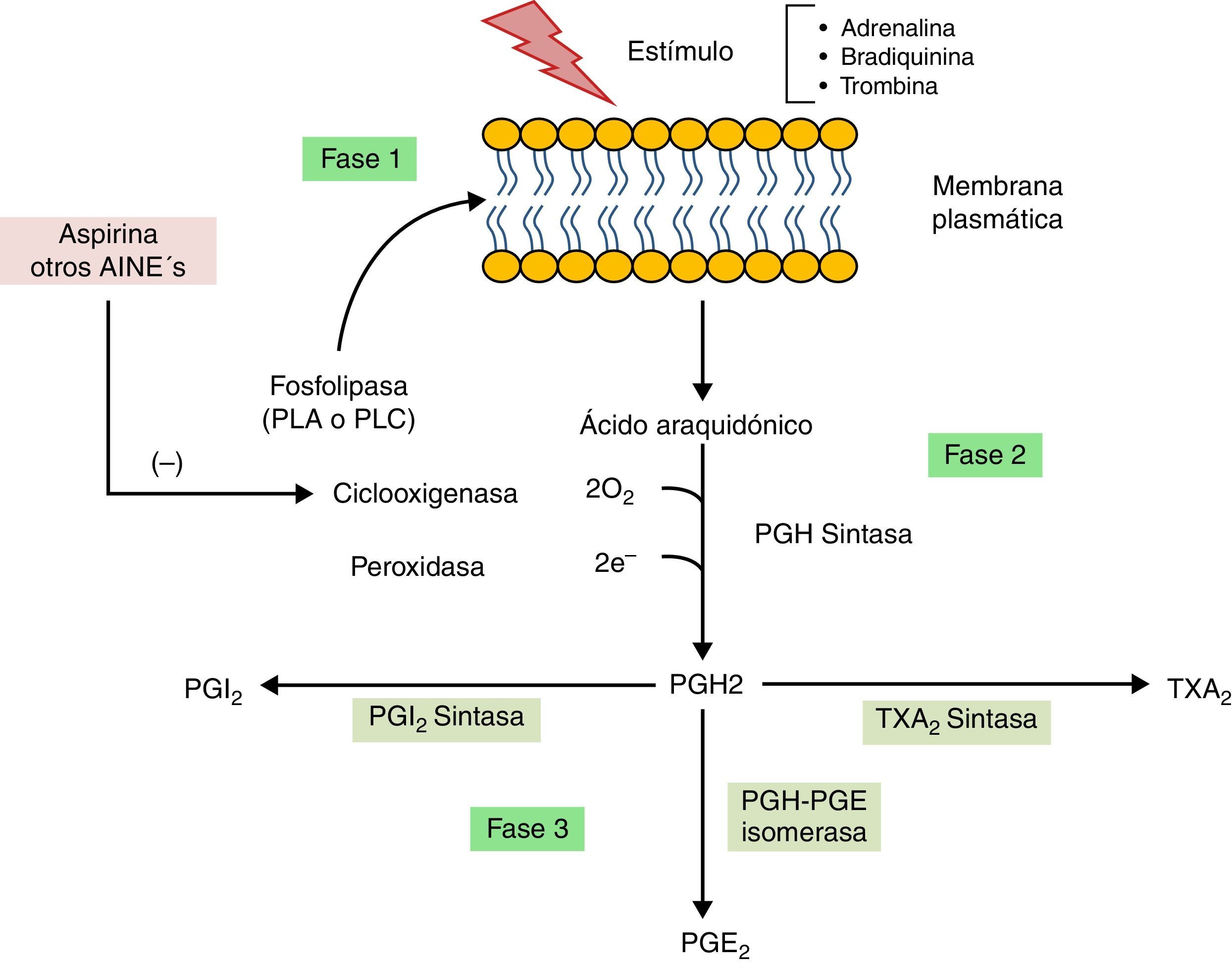
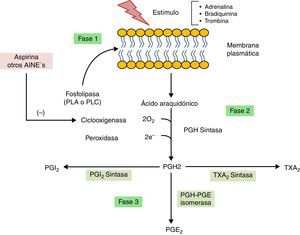
BiosíntesisEl proceso de síntesis de las prostaglandinas se puede resumir en tres fases (fig. 2). En la primera fase ocurre la liberación del ácido araquidónico a partir de los fosfolípidos de membrana por acción de una fosfolipasa (PLA o PLC) como consecuencia de estímulos específicos de los tejidos, pueden ser hormonales (bradiquinina o adrenalina) o por proteasas (trombina)11.
En la segunda fase, la ciclooxigenasa (COX) también llamada prostaglandina H sintasa (PGH sintasa) ejerce acción en el ácido araquidónico para formar PGH2. COX posee dos formas distintas (COX-1 y COX-2), mismas que son blancos importantes para la acción de los antiinflamatorios no esteroides (AINEs)10. En la última fase la PGH2 se convierte en otras prostaglandinas y tromboxano A2 por diversas enzimas específicas11.
Efectos del ácido acetilsalicílico en la mucosa gástricaEl ácido acetilsalicílico fue sintetizado en el año 1897 por el químico alemán Felix Hoffman y comercializado bajo el nombre de “aspirina” dos años más tarde. A partir de entonces se ha convertido en uno de los fármacos más utilizados debido a sus propiedades antiinflamatorias, analgésicas y antipiréticas, sin embargo, paso mucho tiempo sin saber la forma en que actuaba este fármaco. No fue sino hasta el año de 1971 cuando el científico británico John Vane pudo elucidar el mecanismo de dichos efectos4,5.
Las acciones farmacológicas de la aspirina y otros AINEs se deben a la inhibición irreversible de la ciclooxigenasa por acetilación de un residuo de serina específico9, alterando de esta manera la síntesis de prostaglandinas, tromboxanos y prostaciclinas (fig. 2). Cuando la acetilación del residuo de serina ocurre en la COX de las plaquetas, provoca pérdida de la capacidad de agregación, razón por la cual la administración de AAS es muy útil en la prevención de ataques cardiacos y accidentes cerebrovasculares5.
Los efectos benéficos del AAS ocurren mediante la inhibición de COX-2 responsable de inducir la inflamación, la hipertermia y el dolor. COX-2 es una enzima de carácter inducible debido a que su expresión aumenta en respuesta a ciertos estímulos (por ejemplo el PAF, platelet-activating factor, el LPS bacteriano o la interleucina-1). Por el contrario la inhibición de COX-1, una enzima que se encuentra de manera constitutiva en la mucosa del estómago, riñones, plaquetas y endotelio vascular, evita la síntesis de prostaglandinas fisiológicamente importantes para la protección de daños en estos tejidos3,9,11.
Los mecanismos de lesión del AAS y otros AINEs se producen por vía tópica y sistémica (fig. 1). Estos se caracterizan por tener una constante de disociación baja (ácidos débiles), en su estado no ionizado son lipofílicos favoreciendo su capacidad de difusión a través de las membranas para alcanzar el citoplasma de las células mucosas. El pH intracelular de estas células (alrededor de 7) permite su ionización para pasar a ser hidrosolubles y quedar atrapados en este medio. Este atrapamiento celular lesiona la célula, originando un aumento de la permeabilidad celular, paso de hidrogeniones y flujo iónico, con el consecuente edema celular y citolisis. Además, los AINEs alteran la barrera mucosa afectando a otros mecanismos como la secreción de moco y bicarbonato, permitiendo el paso de ácido y pepsina para lesionar la superficie epitelial6.
El daño gástrico se incrementa por la adhesión de neutrófilos al endotelio de la microcirculación debido a una deficiencia en la producción de prostaciclinas. Las consecuencias a dicho proceso pueden comenzar con una disminución de flujo sanguíneo que puede agravarse hasta producir isquemia tisular por obstrucción total de la luz de un vaso12.
FinanciamientoNo se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de interesesEl autor declara no tener conflicto de intereses.