La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo, caracterizado por la pérdida progresiva de neuronas monoaminérgicas, en especial dopaminérgicas. En las últimas décadas, se han desarrollado diversos biomarcadores para el estudio de los pacientes con EP. Un grupo de estos biomarcadores son las neuroimágenes, como la resonancia magnética cerebral y las imágenes moleculares, en particular, la tomografía por emisión de positrones (PET) y la tomografía por emisión de fotón único (SPECT). Estas técnicas, se han empleado en el diagnóstico temprano de la EP, así como para mejorar el diagnóstico diferencial entre EP y otros parkinsonismos y para monitorizar la progresión de la enfermedad. Con estos fines, se ha utilizado la capacidad de estas técnicas para evaluar la pérdida de la actividad dopaminérgica y de otras vías monoaminérgicas, al igual que la posibilidad de valorar la inflamación y el metabolismo a nivel cerebral. Recientemente, los nuevos criterios para el diagnóstico de la EP reconocen al PET y SPECT como herramientas valiosas en el diagnóstico de esta enfermedad. En este artículo, se analiza la utilidad actual de las técnicas de imagen en pacientes con EP y otros parkinsonismos y sus potenciales aplicaciones futuras.
Parkinson's disease (PD) is a neurodegenerative disorder characterized by a progressive loss of monoaminergic neurons, particularly dopaminergic cell groups. Biomarkers have been developed in the last decades for the study of PD patients. Neuroimages, including Magnetic Resonance Imaging (MRI), Positron Emission Tomography (PET) and Single Photon Emission Computed Tomography are part of these biomarkers evaluated in PD. These techniques had been used for the early diagnosis of PD, for the differential diagnosis between PD and other parkinsonisms and to monitor the progression of these disorders. The ability of these images to evaluate loss of monoaminergic activity and their capacity to estimate inflammatory and metabolic changes in the brain has been used. Recently the new criteria for diagnosis of PD have incorporated to PET and SPECT as useful tools in the diagnosis of this disorder. In this article, we review the utility of the neuroimages in patients with PD and some of their potential future applications.
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo, caracterizado neuroquímicamente por la pérdida de neurotransmisores cerebrales monoaminérgicos, en particular dopamina. Afecta a cerca del 1% de la población mayor de 60 años y genera un marcado impacto en la calidad de vida de pacientes, cuidadores y familiares 1,2.
Clínicamente la EP se manifiesta como un cuadro progresivo de enlentecimiento (bradicinesia) y rigidez, usualmente de predominio unilateral, asociado en un alto porcentaje de los pacientes a temblor de reposo. Existe una variedad de condiciones que pueden asociarse a enlentecimiento y rigidez, produciendo lo que se conoce como síndrome parkinsoniano o parkinsonismo. La EP es el parkinsonismos más frecuente en la mayoría de las series y está definido, en último término, por la presencia a la anatomía patológica de los hallazgos habituales, tales como muerte neuronal dopaminérgica y depósito de cuerpos de Lewy en las neuronas dopaminérgicas remanentes 3,4. Si bien el cuadro clínico (historia y examen físico y neurológico) constituye el pilar fundamental del diagnóstico, varios trabajos han demostrado que la certeza diagnóstica es baja en los pacientes con EP idiopática, aún en manos expertas y requiere en ocasiones de varios años de evolución de las manifestaciones motoras, para poder establecer con certeza el diagnóstico 5–7. Debido a esto, desde hace ya varias décadas existen esfuerzos continuos por establecer métodos de imágenes estructurales y funcionales, que permitan mejorar el diagnóstico de esta enfermedad 8,9.
Adicionalmente se ha intentado determinar mediante neuroimágenes el avance o progresión de la muerte neuronal y evaluar el potencial terapéutico de compuestos que detengan o enlentezcan este proceso. Además, en las últimas décadas, se ha realizado intenso trabajo en detectar manifestaciones clínicas que aparecen antes del inicio de los síntomas clásicos de la EP 10–12. Esas manifestaciones precoces o prodrómicas, podrían facilitar un diagnóstico más temprano y permitir establecer terapias modificadoras de la EP de mayor beneficio 13. También se ha propuesto la utilidad de las neuroimágenes en este aspecto de la EP.
Los objetivos fundamentales del uso de las neuroimágenes en EP son:
- •
Contribuir al diagnóstico diferencial con otros cuadros clínicos.
- •
Uso como biomarcador de progresión de la enfermedad y, por ende, demostrar la utilidad de potenciales terapias que retarden el avance de la misma.
- •
Permitir el diagnóstico pre-sintomático o prodrómico en aquellos sujetos en riesgo de padecer EP.
- •
Predecir la aparición de complicaciones motoras y no motoras.
En esta revisión se abordará el empleo de la resonancia magnética cerebral y las neuroimágenes moleculares: tomografía por emisión de positrones (PET) y tomografía por emisión de fotón único (SPECT) en el estudio de pacientes con EP. Este es un campo de rápido desarrollo y con frecuencia aparecen nuevas técnicas o aplicaciones, por lo que este artículo se centra en los usos más consolidados de las distintas técnicas, sin abordar en detalle cada uno de los avances recientes en cada caso.
RESONANCIA MAGNÉTICA CEREBRALLa EP es secundaria a la degeneración progresiva de diversas regiones cerebrales, de ellas la más afectada es la sustancia nigra pars compacta (SNpc), donde se encuentran los somas de las neuronas dopaminérgicas que proyectan al estriado, para ejercer allí el efecto modulador de este neurotransmisor sobre los ganglios basales 14. Una limitación del uso de la RM en el estudio de la EP es la falta de adecuado contraste para identificar las estructuras afectadas por la EP 15,16. En especial, las secuencias convencionales en equipos de 1.5T ponderadas en T1 y T2 muestran una estructura normal de la SNpc en la EP y no son por tanto útiles en el diagnóstico de esta condición. Diversos autores han presentado variadas secuencias centradas en el estudio de la sustancia nigra, con probable utilidad en distinguir el compromiso de esta región en EP y en especial en distinguir sujetos con EP de controles sanos. La Tabla 1 presenta algunos de estos trabajos.
TÉCNICAS DE RESONANCIA MAGNÉTICA EMPLEADAS Y SUS HALLAZGOS EN ENFERMEDAD DE PARKINSON
| TÉCNICA | ALTERACIÓN EN EP |
|---|---|
| Transferencia de Magnetización | Reducción del 15% del volumen de la SN. Reducción significativa del RTM en SN y ganglios basales (globo pálido, putamen, caudado). |
| Secuencias sensibles a melanina | Reducción significativa de la intensidad de la señal en SNpc sugerente de reducción del contenido neuronal de neuromelanina. |
| Relaxometría | Disminución del tiempo de relajación y aumento del radio de relajación en la SN (secundario al aumento del contenido de fierro en la SN). |
| Resonancia magnética funcional | Aumento de la difusividad en el estriado y tálamo. |
| Tractografía | Reducción de la conectividad entre la SN y el putamen/tálamo contralateral. Reducción de la conectividad entre la SN y el caudado izquierdo/globo pálido. |
| Espectroscopía por RM | Disminución del radio de NAA/colina o NAA/Creatina. |
| Conectividad funcional en estado de reposo | Aumento de la conectividad funcional en el circuito cerebelo-talámico. |
SN: Sustancia nigra. NAA: N-acetilaspartato.
(Referencias 18, 76).
Pese a lo anterior, la práctica habitual no recoge estas secuencias para estudio dirigido de la SNpc y, por lo tanto, el empleo habitual de la RM en EP se limita a: detectar presencia de lesiones estructurales que causen o contribuyan al parkinsonismo, identificar magnitud y extensión de enfermedad cerebrovascular asociada y ayudar a diferenciar EP de parkinsonismo vascular y determinar presencia de las alteraciones características de los parkinsonismos atípicos, tales como atrofia multisistémica (AMS) o parálisis supranuclear progresiva (PSP)16–18 (Tabla 2).
HALLAZGOS CARACTERÍSTICOS EN RM CEREBRAL ESTRUCTURAL EN ENFERMEDAD DE PARKINSON Y PARKINSONISMOS ATÍPICOS
| ENFERMEDAD DE PARKINSON | ATROFIA MULTISISTÉMICA VARIANTE PARKINSONIANA | PARÁLISIS SUPRANUCLEAR PROGRESIVA |
|---|---|---|
| Normal | Atrofia putaminal | |
| Marcado borde putaminal hiperintenso | Leve borde putaminal hiperintenso | |
| Marcada atrofia puente y vermis cerebeloso | Leve atrofia puente y vermis cerebeloso | |
| Signo de la cruz en protuberancia | Atrofia mescencéfalo | |
| Hipointensidad putaminal | ||
(Referencia 77).
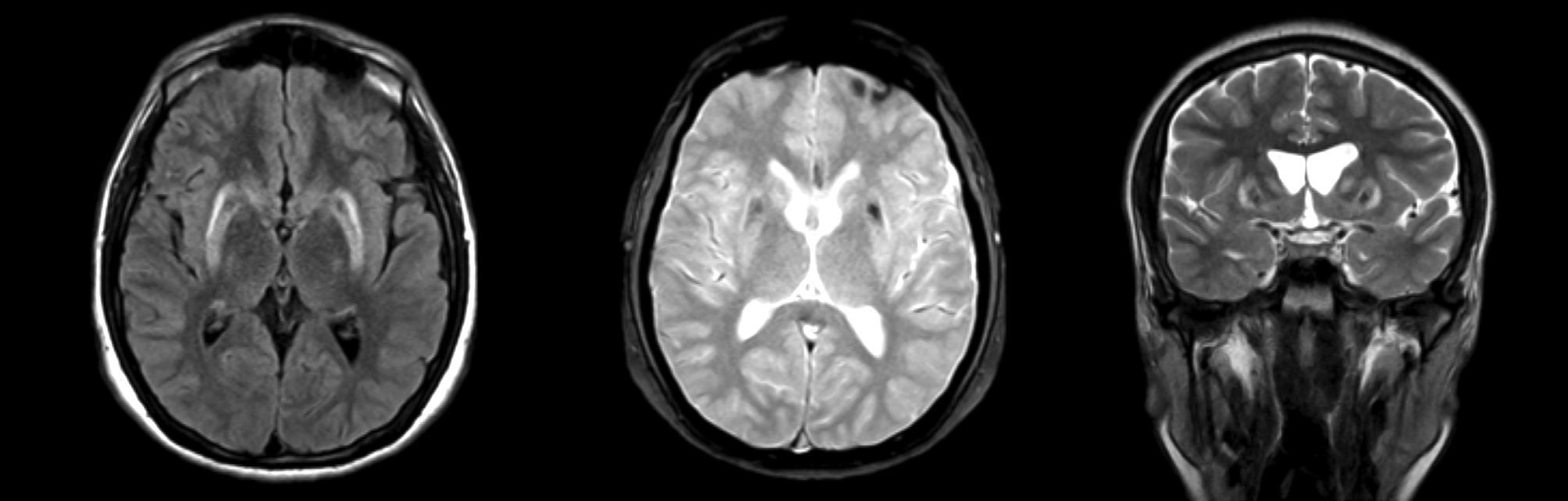
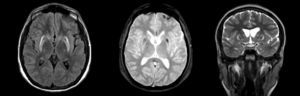
Entre las causas secundarias detectables por RM estándar se encuentran lesiones estructurales de los ganglios basales, tales como: tumores, granulomas, calcificaciones, alteraciones vasculares o depósito de metales, como cobre en la enfermedad de Wilson (Figura 1) y manganeso en exposición a este metal. También es útil para descartar la presencia de hidrocéfalo16.
ALTERACIONES DE RESONANCIA MAGNÉTICA CEREBRAL CARACTERÍSTICAS EN UN PACIENTE CON PARKINSONISMO SECUNDARIO A ENFERMEDAD DE WILSON
Se observa disminución de volumen del estriado, asociado a aumento de señal en secuencia T2 y FLAIR y artefacto de susceptibilidad magnética en secuencia T2 gradiente.
Dentro de las técnicas más recientes, destaca la detección de la hiperintenidad dorsolateral de la SNpc (nigrosoma 1) mediante RM de alto campo magnético (3 Tesla) y de muy alto campo (7 Tesla). Se ha encontrado que la ausencia del nigrosma 1 permite una sensibilidad del 100% y especificidad de 84.6%, para distinguir EP de controles sanos y se relaciona con la lateralidad de la EP 19.
IMÁGENES MOLECULARES (PET Y SPECT)Las imágenes moleculares mediante PET y SPECT, son una herramienta poderosa para detectar cambios cerebrales in vivo. Ambas técnicas determinan la distribución de los radioligandos empleados, entregando información tanto estructural como cinética sobre la molécula analizada 20. Mediante estas técnicas es posible evaluar distintas vías de neurotransmisión, así como cambios inflamatorios y metabólicos a nivel cerebral.
Si bien ambas técnicas de medicina nuclear (PET y SPECT) permiten el estudio de procesos neurobiológicos in vivo a nivel cerebral, existen diferencias entre ellas. El PET presenta una sensibilidad 2 a 3 órdenes de magnitud sobre el SPECT (capacidad para detectar y registrar un porcentaje de eventos emitidos), así como una mejor resolución temporal y espacial (aproximadamente 5mm en PET y 10mm en SPECT). Además la técnica de PET tiene una mayor capacidad técnica en estudios cuantitativos, especialmente en cuantificación de flujo sanguíneo cerebral y densidad de receptores de neurotransmisores 21. El SPECT, en tanto, se caracteriza por ser una técnica de menor costo y mayor disponibilidad. En este artículo, nos referiremos a ambas técnicas de imagen, centrándonos en los resultados de interés clínico o fisiopatológico y no abordaremos nuevamente los detalles referentes a las diferencias técnicas entre ambos estudios.
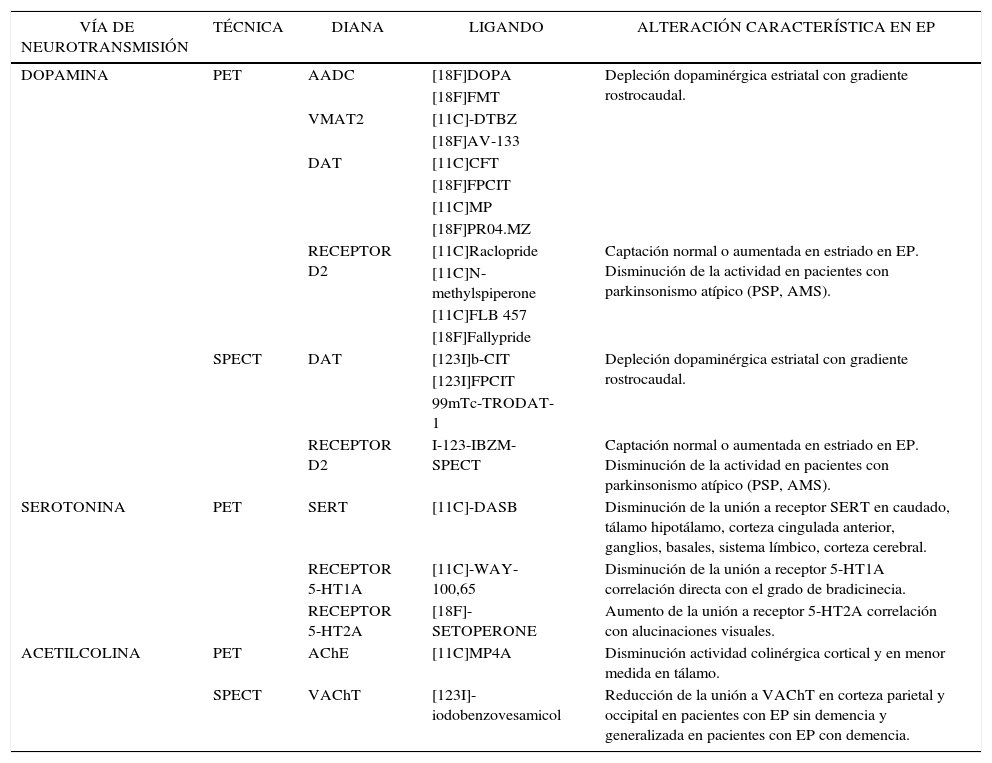
A continuación se presentan los resultados del uso de estas técnicas en pacientes con EP y otros parkinsonismos. En la Tabla 3 se muestra los hallazgos característicos en pacientes con EP, obtenidos con el empleo de diferentes radioligandos.
RADIOLIGANDOS UTILIZADOS PARA EL ESTUDIO EN PACIENTES CON ENFERMEDAD DE PARKINSON
| VÍA DE NEUROTRANSMISIÓN | TÉCNICA | DIANA | LIGANDO | ALTERACIÓN CARACTERÍSTICA EN EP |
|---|---|---|---|---|
| DOPAMINA | PET | AADC | [18F]DOPA | Depleción dopaminérgica estriatal con gradiente rostrocaudal. |
| [18F]FMT | ||||
| VMAT2 | [11C]-DTBZ | |||
| [18F]AV-133 | ||||
| DAT | [11C]CFT | |||
| [18F]FPCIT | ||||
| [11C]MP | ||||
| [18F]PR04.MZ | ||||
| RECEPTOR D2 | [11C]Raclopride | Captación normal o aumentada en estriado en EP. Disminución de la actividad en pacientes con parkinsonismo atípico (PSP, AMS). | ||
| [11C]N-methylspiperone | ||||
| [11C]FLB 457 | ||||
| [18F]Fallypride | ||||
| SPECT | DAT | [123I]b-CIT | Depleción dopaminérgica estriatal con gradiente rostrocaudal. | |
| [123I]FPCIT | ||||
| 99mTc-TRODAT-1 | ||||
| RECEPTOR D2 | I-123-IBZM-SPECT | Captación normal o aumentada en estriado en EP. Disminución de la actividad en pacientes con parkinsonismo atípico (PSP, AMS). | ||
| SEROTONINA | PET | SERT | [11C]-DASB | Disminución de la unión a receptor SERT en caudado, tálamo hipotálamo, corteza cingulada anterior, ganglios, basales, sistema límbico, corteza cerebral. |
| RECEPTOR 5-HT1A | [11C]-WAY-100,65 | Disminución de la unión a receptor 5-HT1A correlación directa con el grado de bradicinecia. | ||
| RECEPTOR 5-HT2A | [18F]-SETOPERONE | Aumento de la unión a receptor 5-HT2A correlación con alucinaciones visuales. | ||
| ACETILCOLINA | PET | AChE | [11C]MP4A | Disminución actividad colinérgica cortical y en menor medida en tálamo. |
| SPECT | VAChT | [123I]-iodobenzovesamicol | Reducción de la unión a VAChT en corteza parietal y occipital en pacientes con EP sin demencia y generalizada en pacientes con EP con demencia. |
El sistema dopaminérgico en humanos se localiza fundamentalmente en la vía nigro estriada, dedicada mayormente al control motor y en las vías mesolímbica, mesocortical y tuberoinfundibular, las que participan en funciones límbicas, cognitivas y control hipofisiario respectivamente 22.
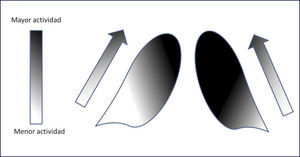
La depleción dopaminérgica de la vía nigroestriada constituye el elemento más característico de la enfermedad de Parkinson. En esta vía, la pérdida de la actividad dopaminérgica en pacientes con EP idiopática sigue un patrón característico, de modo tal que, al inicio de la enfermedad, los pacientes con síntomas predominantemente unilaterales, tienen una mayor reducción de la actividad dopaminérgica en el putamen posterior dorsal contralateral al lado de los síntomas clínicos 15,23,24. A medida que progresa la enfermedad, la depleción dopaminérgica compromete el putamen anterior, y el caudado dorsal, para finalmente comprometer la cabeza central del caudado (Figura 2) 25. La afectación de estriado ventral es de menor magnitud en la mayoría de los pacientes. Así, se reconoce que el patrón de pérdida dopaminérgica rostrocaudal (de putamen posterior a caudado) es el más característico de los pacientes con EP típico o idiopático. En otros parkinsonismos este patrón de pérdida no suele observarse, detectándose una depleción más intensa y bilateral de la actividad dopaminérgica, con compromiso más precoz del putamen anterior y del caudado 26,27.
La tomografía por emisión de positrones (PET) y la tomografía computada por emisión de fotón único (SPECT) se han empleado para el estudio del sistema dopaminérgico pre y post sináptico, tanto en humanos como en modelos animales de parkinsonismo 28, mediante el desarrollo de radiofármacos específicos que permiten estudiar distintos aspectos de la función dopaminérgica. Los radioligandos con afinidad por moléculas que participan en la síntesis de dopamina y por los transportadores de dopamina evalúan la neurona presináptica o nigroestriatal. Los radioligandos con afinidad por los receptores dopaminérgicos valoran la integridad de las neuronas postsinápticas. La información obtenida en las imágenes PET y SPECT es funcional (integridad de la vía nigroestriatal) y molecular (distribución y concentración de enzimas, transportadores y receptores) 8,25.
a) Imágenes para el estudio de la función presináptica:Su objetivo es la evaluación de la integridad funcional de las proyecciones nigroestriatales presinápticas. Algunos de los radioligandos presinápticos más usados son:
i) Medición de la actividad de la enzima L-aminoácido aromática decarboxilasa (AADC) estriatal.
La AADC en condiciones fisiológicas permite la conversión de levodopa a dopamina en la terminal sináptica. El marcador 6-[18F] fluoro-L-dopa (18F-DOPA) es un análogo de la levodopa, que captado por las neuronas dopaminérgicas, mediante la acción de la AADC, se transforma en [18F] fluorodopamina (FDA), el cual es almacenado en las vesículas sinápticas. Por lo tanto, este ligando es útil como marcador de la síntesis, almacenaje y recambio de dopamina en la neurona 29,30. La 18F-DOPA es el trazador PET de uso clínico más utilizado para el diagnóstico diferencial del síndrome parkinsoniano de origen degenerativo 31.
Diversos estudios han demostrado que la actividad dopaminérgica en el estriado, evaluada mediante 18F-DOPA, correlaciona con la magnitud de los síntomas parkinsoniano, en particular con la rigidez y la bradicinesia contralaterales, no obstante no existe correlación con el temblor 32.
En pacientes con EP inicial se ha demostrado pérdida cercana al 50-60% de la actividad dopaminérgica estriatal en el estriado contralateral al lado más afecto. Esta pérdida es progresiva a lo largo de la evolución de la enfermedad, lo que puede ser cuantificado mediante el estudio con 18FDOPA secuencialmente a lo largo de los años 33,34. La pérdida de actividad dopaminérgica afecta también a regiones extraestriatales, comprometiendo áreas motoras corticales y tardíamente regiones de asociación frontal 35.
ii) Medición de la unión del transportador de dopamina presináptico (DAT)
El transportador de dopamina (DAT) es una proteína de transmembrana dependiente de sodio localizada en la superficie presináptica de las neuronas dopaminérgicas. Es responsable de la recaptura de dopamina de la sinapsis 36. Se ha demostrado que el DAT está presente exclusivamente en las neuronas que sintetizan dopamina y por ello es considerado como un marcador específico de estas neuronas en el SNC 37. La mayor concentración de DAT se encuentra en el estriado y el tubérculo olfatorio, con niveles muy inferiores en la amígdala, hipotálamo, hipocampo, algunos núcleos talámicos y neocórtex 38,39. Debido a que la distribución del DAT en el SNC coincide con la inervación dopaminérgica, se han desarrollado diversos radioligandos derivados del tropano, análogos a la cocaína, para medir in vivo la densidad de DAT mediante PET y SPECT 25,40.
Todos estos trazadores proporcionan una medida indirecta de la integridad del sistema dopaminérgico presináptico y en los pacientes con EP muestran hallazgos similares a los encontrados con PET usando 18F-DOPA, por lo que constituyen un método adecuado para diferenciar pacientes en etapas tempranas con déficit del sistema dopaminérgico de aquellos sujetos sin afectación, con una sensibilidad cercana al 90% 15.
De los radioligandos de DAT utilizados en SPECT, el I123-B-CIT es el que proporciona la mejor relación de captación estriado/fondo, pero este compuesto también tiene afinidad por los transportadores de serotonina (SERT) (selectividad DAT/SERT: 1,7:1) 41. La captación estriatal a las 24 horas después de la administración intravenosa refleja principalmente la unión a DAT, mientras que la actividad una hora posterior a su administración refleja la unión SERT en el mesencéfalo 37,41. De manera similar a la 18F-DOPA, la captación de 123I-B-CIT en el estriado se correlaciona bien con el estado de la enfermedad y la gravedad de los síntomas de la EP, en particular con la bradicinesia al igual que con la pérdida dopaminérgica en la SNpc 42,43. Una desventaja de este radiomarcador, es su lenta cinética de absorción en el estriado, alcanzado el equilibrio a las 24 horas después de su administración 44.
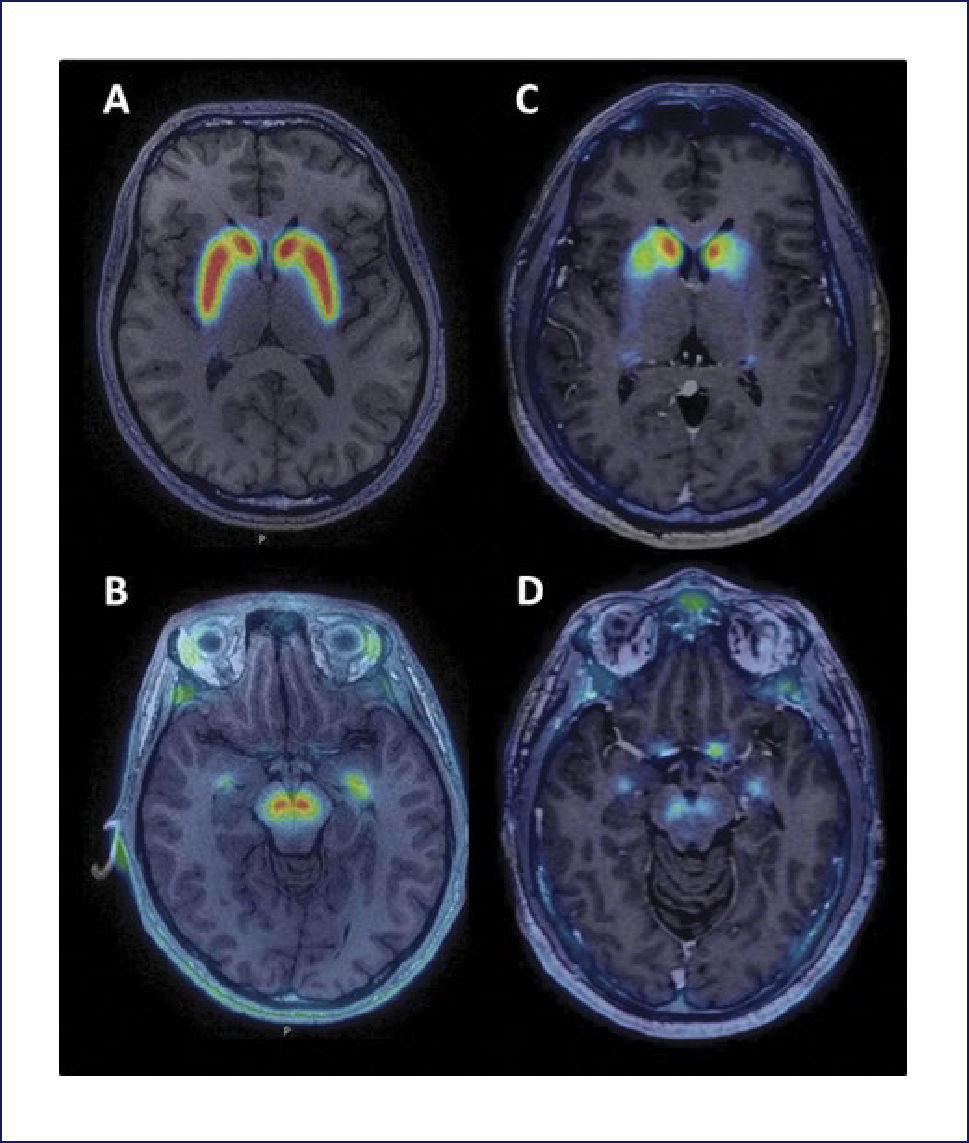
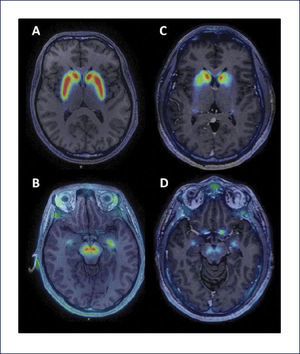
Existen trazadores más recientemente desarrollados para SPECT. Uno de ellos, 123I-FP-CIT se une de manera más selectiva con el DAT, siendo la afinidad por el SERT inferior al 123I-B-CIT (selectividad DAT/SERT: 2,8:1). La relación de captación estriado/fondo es inferior a la 123I-B-CIT, pero su cinética es más rápida y permite realizar la adquisición entre 3-6 horas después de su administración. Otro radioligando del DAT de interés es el 99mTc-TRODAT-1 que tiene la ventaja de ser un compuesto unido a tecnecio, lo que facilita su disponibilidad y su costo es menor, aunque su relación estriado/fondo es inferior a otros radioligandos 45. También existen ligandos del DAT para uso en PET, como [11C] CFT, [18F] FPCIT y [11C] MP31. Recientemente se ha publicado el uso de un nuevo marcador de DAT para PET, 18F PR04.MZ, un derivado de cocaína con alta afinidad selectiva por DAT46 (Figura 3).
IMÁGENES DE 18F-PR04.MZ PET FUSIONADA CON RESONANCIA MAGNÉTICA CEREBRAL
Sujeto control a nivel de estriado (A) y mesencéfalo (B) y en los mismos niveles en un paciente con enfermedad de Parkinson (C y D). Se observa una marcada disminución de la actividad dopaminérgica a nivel estriatal (caudado y putamen) y en mesencéfalo, en el área correspondiente a la sustancia nigra.
(Imágenes gentileza Dres. Horacio Amaral y Vasko Kramer).
ii) Medición del transportador vesicular de monoamina tipo 2 (VMAT2)
La función del transportador de monoamina vesicular tipo 2 (VMAT2) es el almacenamiento de monoaminas desde el citosol a las vesículas sinápticas. Por ello, los trazadores específicos del VMAT2 permiten medir las monoaminas en las vesículas sinápticas (dopamina, serotonina, norepinefrina, histamina) 29,47, por lo tanto, una desventaja principal de imágenes VMAT2 es su falta de especificidad teórica para dopamina. Sin embargo, desde una perspectiva práctica el 90% de la unión VMAT2 en el cuerpo estriado es con neuronas dopaminérgicas 40.
Existen ligandos específicos para VMAT2 que se han desarrollado para uso mediando PET (11C-dihidrotetrabenazina, 11C-DTBZ y [18F] 9-fluoropropyl-(+)-dihydrotetrabenazine, 18F-DTBZ) o SPECT 123I-IBVM29,47. Los estudios con estos ligandos sugieren que tienen la ventaja de una captación en el estriado menos afectada que otros trazadores por la medicación habitualmente utilizada en los pacientes con EP y por los cambios compensatorios propios de la EP, no obstante es menos específico por dopamina ya que esta proteína también participa en el almacenaje de otras monoaminas cerebrales.
b) Imágenes para el estudio de la función postsináptica:Además de la evaluación de la función dopaminérgica presináptica, en algunos casos también tiene interés el estudio de los receptores postsinápticos. La principal justificación del estudio de receptores de dopamina en los pacientes con parkinsonismo es la diferenciación con la EP en la que existe exclusivamente degeneración dopaminérgica presináptica, de aquellos cuadros parkinsonianos en que las alteraciones patológicas se extienden también a la neurona postsináptica, como ocurre en los parkinsonismo atípicos (AMS, PSP, DCB) 47,48.
Existen distintos subtipos de receptores de dopamina, pero son los receptores D2 los que tienen mayor interés para el estudio in vivo de los pacientes con parkinsonismos. Los compuestos más utilizados para el estudio del receptor D2 son: 11C-Raclopride o18F-Fallypride para estudios PET y 123I-io-dobenzamida (IBZM) para SPECT 49–51. Al igual que con los ligandos con afinidad por los componentes presinápticos, la imagen de receptores de dopamina se caracteriza por la elevada captación en los estriados debido a la alta densidad de terminaciones nerviosas dopaminérgicas existentes en los mismos.
Se ha mostrado que la captación estriatal de IBZM es normal o está ligeramente aumentada en el putamen en pacientes con EP no tratados, probablemente debido a un mecanismo de compensación como respuesta a la disminución de la dopamina presináptica, mientras que en pacientes tratados durante largo tiempo la captación de IBZM se normaliza (si estaba previamente aumentada) o está ligeramente reducida. Por otra parte, se ha comprobado que la captación estriatal de IBZM se correlaciona con la respuesta de los pacientes a los fármacos dopaminérgicos, como la apomorfina y con la respuesta favorable al tratamiento con L-dopa. De esta manera, una captación estriatal normal de IBZM sugiere el diagnóstico de EP, sobre todo cuando se realiza en las fases iniciales de la enfermedad 15,52. Resultados similares se han reportado con PET usando 11C-Raclopride.
Recomendaciones sobre el uso de imágenes dopaminérgicas en pacientes con enfermedad de Parkinson y otros parkinsonismosDiferentes estudios han mostrado que el diagnóstico clínico de EP carece de la exactitud deseada 6. Un reciente metanálisis de los trabajos publicados en las últimas décadas, muestra que la certeza diagnóstica de médicos no especialistas fue 73.8% y aumenta a casi 84% en manos de expertos en trastornos del movimiento después de seguimiento 5. Estudios evaluando la utilidad del SPECT con ligandos de DAT han mostrado una sensibilidad de 100% para distinguir EP de controles sanos 53. La principal indicación de los marcadores presinápticos, tanto en PET como SPECT, es distinguir pacientes con EP o parkinsonismo con pérdida dopaminérgica presináptica (PSP, MSA, DCB, demencia por cuerpos de Lewy), de pacientes sin compromiso presináptico, como es el caso de sujetos sanos, pacientes con temblor esencial o con parkinsonismo farmacológico por bloqueo de receptores postsinápticos y pacientes con enfermedad de Alzheimer 54. Lo anterior, ha sido recientemente recogido por los criterios de diagnóstico clínico de la EP, según los cuales, la ausencia de depleción dopaminérgica presináptica (evaluada por PET o SPECT) excluye el diagnóstico de EP 55. No obstante lo anterior, no se considera necesario realizar estos estudios para realizar el diagnóstico de EP 55.
Respecto a los marcadores postsinápticos, en la práctica clínica diaria, no se considera necesario la realización de imágenes para marcadores de receptores dopaminérgicos de forma rutinaria, para el diagnóstico de EP en los pacientes que se presentan con las manifestaciones clínicas habituales. El empleo de estos marcadores postsinápticos, se reserva únicamente para aquellos casos en existan dudas sobre si la sintomatología parkinsoniana es producida por otras entidades distintas a la EP, como la AMS o PSP 15. No obstante lo anterior, su utilidad clínica es limitada y su interpretación compleja, debido fundamentalmente a los cambios producidos por la medicación dopaminérgica.
2) EVALUACIÓN DE OTROS SISTEMAS DE NEUROTRANSMISIÓNa) Estudio de la inervación serotoninérgica: La presencia de manifestaciones no motoras, tales como depresión, trastornos del sueño, fatiga y demencia, son frecuentes en pacientes con EP 56. Lo que ha incrementado el interés por explorar otras vías de neurotransmisión aparte de la actividad dopaminérgica. Existe evidencia que la pérdida serotoninérgica estriatal y extraestriatal, es marcada y progresiva a lo largo de la EP y tendría un papel en los síntomas tanto motores como no motores 57.
Se han desarrollado diversos radioligandos dirigidos a dianas específicas del sistema serotoninérgico 58. En estudios de cerebro en humanos 18F-MPPF se ha empleado como ligando del receptor 5-HT1A, 18F-setoperone para el receptor 5-HT2A y 11C-AZ10419369 para receptores 5-HT1B 57,59.
También existen ligandos para el transportador de serotonina (SERT). En especial 11C-y más recientemente 11C-DASB 60. Los estudios en EP han mostrado una pérdida progresiva de la inervación serotoninérgica, con un patrón de depleción predominante en caudado, seguido por putamen, ínsula y cíngulo posterior. Respecto a su relación con los síntomas de la EP, estudios han mostrado que la actividad serotoninérgica medida en el rafe relacionaría con la presencia de temblor, en particular de tipo postural 57. Este hallazgo es relevante por cuanto el temblor característicamente no se relaciona con el nivel de pérdida medido por marcadores dopaminérgicos y puede sugerir que en su origen participan mecanismos serotoninérgicos. También se ha mostrado mediante estudios en animales y recientemente en humanos que la disfunción serotoninérgica juega un papel en la presencia de discinesias inducidas por levodopa, una complicación frecuente en pacientes en uso crónico de terapia dopaminérgica. Adicionalmente la modulación del sistema serotoninérgico, mediante el uso de buspirona (agonista del receptor de serotonina tipo 1ª) disminuye la aparición de discinesias inducidas por levodopa 61.
Respecto de las manifestaciones no motoras, existen evidencias de alteración de la actividad serotoninérgica en el sistema límbico en pacientes con EP afectados por depresión comparado con EP sin depresión 40,59. También existen datos que sugieren disfunción de la actividad de la serotonina estriatal y extraestriatal en la aparición de fatiga y alteraciones del sueño en esta población.
No obstante el importante caudal de información existente, en la actualidad el empleo de estudios de la vía serotoninérgica está restringido a actividades de investigación en pacientes con EP.
b) Estudio de la inervación colinérgica: Existen dos vías fundamentales de inervación colinérgica cerebral, el sistema del núcleo basalis de Meynert, que inerva fundamentalmente a la corteza cerebral y el derivado del núcleo pedúnculo pontino (PPN) en el troncoencéfalo, que entrega la inervación colinérgica predominante a los ganglios basales, tálamo, cerebelo y médula espinal. Ambos sistemas degeneran en pacientes con EP62,63. La disfunción de las vías de neurotransmisión colinérgica cerebral han sido implicadas en pacientes con EP en las manifestaciones motoras, especialmente temblor y alteración de la marcha, complicaciones motoras, como discinesias y en manifestaciones no motoras tales como: trastorno conductual del sueño REM, pérdida del olfato y trastornos cognitivos y demencia 64. Los 2 trazadores de PET más usados son los análogos de acetilcolina [11C] metil-4-piperidil acetato ([11C]MP4A) y [11C]metil-4-piperidinil propionato ([11C]PMP)49,62,65. Ambos son metabolizados por la enzima acetilcolinesterasa (AChE) y por lo tanto reflejan la distribución de esta enzima. AChE se ha demostrado como un buen marcador de las vías colinérgicas cerebrales 62,66.
La evaluación de la actividad de la acetilcolinesterasa mediante PET (AChE-PET) ha mostrado que la denervación de las vías relacionadas al sistema núcleos basalis de Meynert-corteza cerebral se asocia con alteraciones cognitivas y demencia, mientras que el daño de las vías del PPN se asocian fundamentalmente a alteración de la marcha y trastorno conductual del REM25. Los estudios por AChE-PET han demostrado asociación entre denervación colinérgica y severidad de síntomas depresivos, así como entre hipoactividad colinérgica límbica y cortical con menor capacidad de detección de olores (hiposmia)
3) ESTUDIO DE LA ACTIVACIÓN MICROGLIALLa presencia de inflamación es un fenómeno común a la inmensa mayoría de las enfermedades que afectan al sistema nervioso central. Esto también es válido para las enfermedades neurodegenerativas y en particular a la EP67. Se ha dividido el estudio de la inflamación mediante neuroimágenes funcionales, según los mecanismos principales involucrados:
- a.
Activación de las células inmunocompetentes del sistema nervioso central.
- b.
Alteración de la barrera hematoencefálica.
- c.
Infiltración del Sistema nervioso central por células inmunes circulantes.
- d.
Consecuencias patológicas de la neuroinflamación (desmielinización y muerte celular).
De todos los ligandos disponibles para el estudio de la neuroinflamación, los más estudiados en EP son los relacionados a la proteína translocadora (TSPO), un marcador de membrana mitocondrial con mínima expresión en cerebro normal, pero que se expresa de modo abundante en microglia activada, por lo que permite evaluar esta vía de neuroinflamación 68. El radioligando más usado para este fin es 11 C-PK11195 PET, aunque en la actualidad existe una amplia variedad de marcadores disponibles. En el estudio de pacientes con EP, se ha demostrado activación microglial desde etapas tempranas de la enfermedad, tanto a nivel cortical, como en núcleos profundos 69. No existe clara relación entre el nivel de actividad microglial y el grado de avance motor de la EP, mientras que alguna relación existiría con el compromiso cognitivo, asociado a las etapas más avanzadas de la enfermedad 40.
4) ESTUDIO DEL METABOLISMO CEREBRAL DE LA GLUCOSA (18F-FDG)A nivel del sistema nervioso central, la captación de glucosa parece depender de la actividad sináptica de cada región y aparentemente es reflejo de la captación de 18F-FDG por los astrocitos cercanos a las neuronas. En EP, se ha planteado que la disminución de las aferencias dopaminérgicas podría desencadenar un aumento de la actividad sináptica a nivel estriatal 70.
Los hallazgos característicos descritos con FDG en EP son hiperactividad de los ganglios basales y tálamo en especial en el lado contra lateral al hemicuerpo más afectado. Este patrón es inverso al observado en el envejecimiento normal, en el cual se reduce característicamente la captación de FDG en estos territorios71. También se observa la presencia de alteraciones a nivel cortical con un aumento de la captación en la corteza premotora contralateral al lado más afecto, incluso precediendo al inicio de los síntomas 72.
Las diferencias demostradas mediante FDG permiten discriminar entre sujetos normales, portadores de EP y especialmente entre EP y parkinsonismos atípicos 73. Sin embargo, existe variabilidad a nivel individual, por lo que los mejores resultados se obtienen al comparar grupos de pacientes. El uso de análisis de componente principal ha permitido obtener un patrón metabólico característico que puede observarse incluso desde etapas tempranas de la enfermedad 74. En la actualidad desde la perspectiva clínica el uso de FDG PET resulta especialmente en el diagnóstico diferencial entre EP y parkinsonismo atípicos, ya que en estos últimos predomina el hipometabolismo a nivel cerebeloso y estriatal en sujetos con atrofia multisistémica o asimétrico a nivel cortical y talámico y estriatal en pacientes con degeneración ganglionar córtico basal 73.
Imágenes de denervación cardíacaSe ha evaluado la integridad del sistema simpático periférico en pacientes con EP. El compuesto Metoiodobenzilguanidina (MIBG) es un análogo fisiológico de la noreprinefina y se ha utilizado para determinar la ubicación, integridad y función de las neuronas noradrenérgicas. La cintigrafía cardíaca con 123I-MIBG es una herramienta útil para estimar el daño simpático miocárdico 75. La presencia de denervación noradrenérgica simpática postsináptica es un hallazgo frecuente en pacientes con EP, la que puede detectarse en ausencia de otros hallazgos de denervación autonómica. Diferentes estudios han mostrado denervación cardíaca intensa y precoz e sujetos con EP, al igual que en pacientes con demencia por cuerpos de Lewy, falla autonómica pura y probablemente en sujetos con trastorno conductual del REM, pero no ocurre en pacientes con otros parkinsonismos tales como atrofia multisistémica, parálisis supranuclear progresiva y degeneración ganglionar cortico basal. Un metanálisis, mostró sensibilidad y especificidad cercana al 90% para el diagnóstico de EP versus parkinsonismo atípicos. El grado de captación de MIBG miocárdico es mayor en pacientes con EP con predominio del temblor, respecto a los pacientes con compromiso axial y caídas 75). Una menor captación se asocia a mayor tiempo de evolución, mayor compromiso motor y mayor edad. No existe relación clara entre captación miocárdica de MIBG y síntomas disautonómicos en pacientes con EP.
CONCLUSIONES Y PERSPECTIVASLas neuroimágenes son herramientas cada vez más utilizadas en pacientes con EP. Si bien su uso inicial estaba dedicado a descartar causas secundarias de parkinsonismo originado por lesiones estructurales, en la actualidad existen diversas técnicas de resonancia magnética y en particular de imágenes moleculares (PET y SPECT) que permiten aproximarse a un diagnóstico diferencial más preciso y que prometen ser una alternativa útil para conocer “in vivo” los mecanismos fisiopatológicos responsables del proceso neurodegenerativo, para determinar los diferentes fenotipos asociados a la enfermedad y para evaluar el posible papel de terapias modificadoras de la EP. El avance de estas técnicas podría permitir un diagnóstico más precoz y certero y monitorizar de modo preciso el avance de la enfermedad y la utilidad de posibles terapias neuroprotectoras.
CJ es financiado por proyecto FONDECYT N° 11130534.
Los autores declaran no tener conflictos de interés, en relación a este artículo.