El embarazo gemelar se presenta en 1 de cada 100 embarazos y su frecuencia ha aumentado en los últimos años como resultado de técnicas de fertilización asistida y la mayor edad materna. Por definición, es un embarazo de alto riesgo dado su mayor asociación con enfermedades del embarazo. El parto prematuro es la principal complicación, seguido de síndromes hipertensivos y restricción de crecimiento fetal. Hay complicaciones específicas de la placentación gemelar, como la transfusión feto fetal, la restricción de crecimiento selectivo y la perfusión arterial reversa. Todas ellas aumentan la morbimortalidad perinatal.
Twin pregnancy presents in 1 every 100 pregnancies and it's frequency has risen in the last years due to assisted fertility and advanced maternal age. By definition is a high risk pregnancy and is associated with increased risk of premature delivery, pregnancy induced hypertension and fetal growth restriction. Complications associated with abnormal twin placentation is feto-fetal transfusion, selective growth restriction and reversed arterial perfusion. All of them increases perinatal morbimortality.
La frecuencia clásicamente se describe 1 en 80 para los gemelares dobles y 1 en 6.400 para los triples. La frecuencia de éstos se ha incrementado en un 70% en los últimos 30 años, presentándose en 32,1 por cada 1.000 embarazos (1). Las causas de este aumento se explican por la reproducción asistida y también por el aumento en la edad materna para los embarazos gemelares dicigóticos (2).
El embarazo gemelar se asocia con mayor frecuencia a complicaciones maternas y fetales. Las mujeres embarazadas con gemelos presentan mayor frecuencia de abortos, hiperemesis gravídica, anemia, hipertensión gestacional, trastornos hemorragíparos y mayor frecuencia de cesárea. Las complicaciones fetales más frecuentes son las asociadas al parto prematuro, muerte fetal y restricción de crecimiento fetal. Complicaciones específicas asociadas a la corionicidad son la transfusión feto fetal y la perfusión arterial reversa; y relacionadas con la amnionicidad, la muerte fetal asociada al entrecruzamiento de cordón en los embarazos monoamnióticos.
Diagnóstico de corionicidadEl riesgo asociado al embarazo gemelar depende de su corionicidad y no de su cigocidad. De los embarazos dobles, 2/3 son bicigóticosy 1/3 monocigóticos. Desde el punto de vista obstétrico es importante definir la corionicidad o número de placentas y amnionicidad o número de sacos amnióticos.
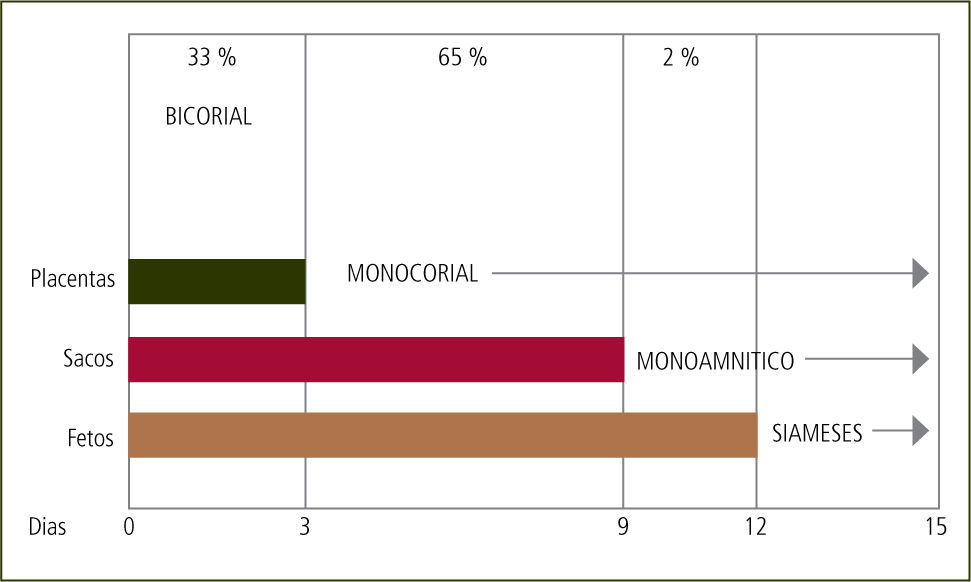
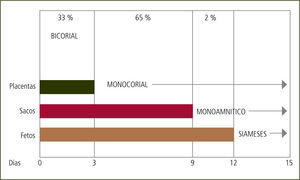
Todos los embarazos bicigóticos son bicoriales. La corionicidad de los embarazos monocoriales depende del momento en que se divide el huevo. Si la división ocurre hasta el 3er día post concepción, el embarazo es bicorial y biamniótico. Si ocurre entre el 3er y 9no día el embarazo es monocorial y biamniótico. Entre el 9no y 13avo día será monocorial y monoamniótico. Luego del 13avo día el embarazo es monocorial, monoamnióticoy con fusión de los fetos o pagos (siameses) (figura 1).
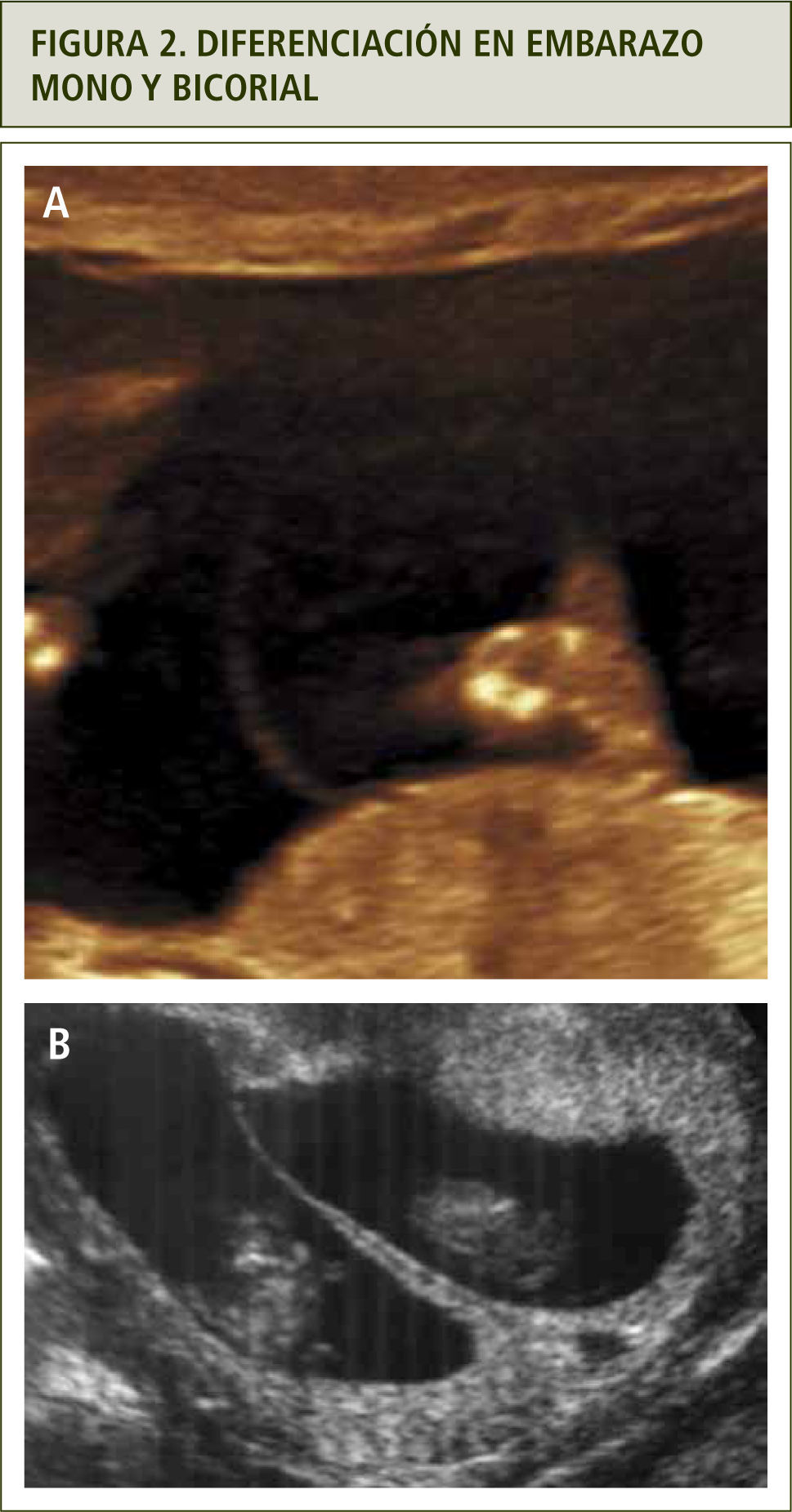
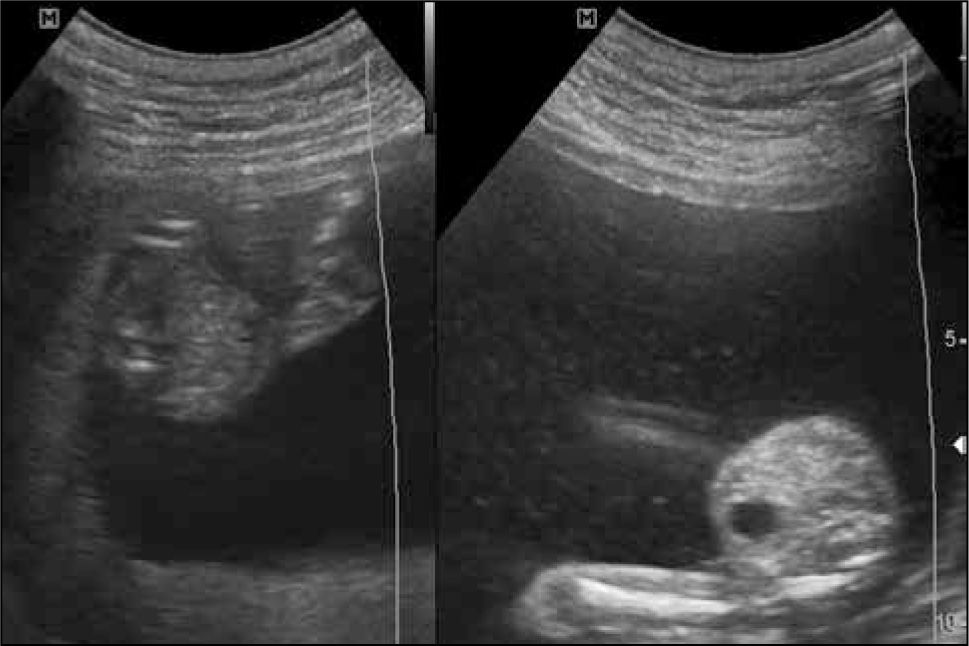
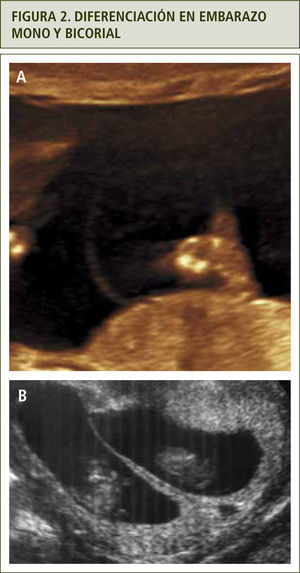
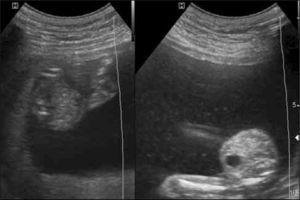
El diagnóstico de corionicidad se realiza mediante ecografía. La presencia del signo de lamda (sacos amnióticos con corion entre las membranas) es patognomónica de bicorionicidad en cualquier momento del embarazo. El signo de la “T” o amnios fusionados sin corion en la base del saco se observa en los embarazos monocoriales, pero este signo pierde sensibilidad después de las 16 semanas (figura 2). otras formas de diagnosticar bicorionicidad son la presencia de placentas separadas y los sexos fetales distintos; lo que combinados, dan una sensibilidad y especificidad mayor al 90% (3). Si no es posible definir la corionicidad, se recomienda clasificar el embarazo como monocorial para asegurar un adecuado control y evitar la no pesquisa de complicaciones asociadas a la monocorionicidad.
Se recomienda definir a los gemelos como uno y dos y describir la posición de los fetos como arriba/abajo y derecha/izquierda para no confundirlos en ecografías sucesivas.
Para un embarazo triple, existen diversas combinaciones. Si hay tres placentas y tres amnios, se define como tricorial triamniótico. Si hay dos placentas y tres amnios, se define como un bicorial triamnótico, lo que implica que un par es monocorial. Si hay dos placentas y dos sacos amnióticos, se define como un embarazo triple bicorial biamniótico lo que implica que un par es monocorial monoamniótico.
Se sugiere fechar el embarazo gemelar en la ecografía de 11–14 semanas (LCN 44–84mm), según el LCN en caso de una FUR no segura ni confiable. La curva de LCN de embarazo único se aplica para el embarazo gemelar ya que no hay diferencias significativas en la biometría embrionaria entre embarazos simples y múltiples (4). Si hay discordancia entre la LCN y la FUR, se establecerá la edad gestacional basándose en la longitud céfalo nalgas del feto de mayor tamaño para evitar el error de datar según la longitud de un feto con restricción precoz (5).
Seguimiento del embarazo gemelarTodo embarazo gemelar debe ser controlado por un médico gineco-obstetra y matrona y ser referido a un centro de atención terciaria o secundaria si se cuenta con un obstetra.
Luego del control de ingreso prenatal se solicitará una ecografía entre las 11 y 14 semanas. Definido el número de fetos y la corionicidad, el seguimiento será diferenciado. El control de ingreso deberá incluir una anamnesis dirigida en la búsqueda de factores de riesgo para parto prematuro y síndromes hipertensivos del embarazo, examen físico, peso y talla con cálculo de IMC (Índice de Masa Corporal) y presión arterial.
ExámenesLos exámenes de control prenatal incluyen hemograma, grupo sanguíneo y Rh, Coombs indirecto, sedimento de orina, urocultivo, glicemia en ayunas, VDRL y ViH.
Se discutirá caso a caso el tamizaje de enfermedades tiroideas con TSH, antígeno de superficie de Hepatitis a y cultivo cervical o PCR para Chlamydia, especialmente en mujeres jóvenes dada su alta prevalencia.
Los exámenes se repetirán, solicitando Hemograma a las 20–24 semanas y 28 semanas. PTG con 75 gr de glucosa a las 24–26 semanas y urocultivo y VDRL a las 28 semanas.
Suplemento vitamínicoSe recomienda iniciar ácido fólico en dosis de 5mg/día hasta las 14 semanas y suplemento de fierro desde el inicio dado la mayor prevalencia de anemia en embarazos gemelares. No hay evidencia que sugiera la suplementación con calcio, vitamina C y E o ácidos grasos omega 3, por lo que no se deberán indicar de forma rutinaria (6–8).
DietaEn cuanto a la dieta y sugerencia de incremento de peso, ésta dependerá del IMC en el primer control prenatal. No hay recomendaciones específicas para el embarazo gemelary se deberán aplicar los criterios de incremento de peso sugeridos para el embarazo único (9). Se recomienda no comer “por dos” e informar que el requerimiento calórico sólo se incrementa en 300 cal/día en la segunda mitad del embarazo. Se deberá derivar al nutricionista a embarazadas con IMC sobre 30kg/m2 y comentar la contraindicación de bajar de peso durante el embarazo.
EcografíasSe solicitará a las 11–14 semanas donde, además de definir corionicidad, se ofrecerá tamizaje de enfermedades cromosómicas (ver más adelante). Se realizará una ecografía entre las 20–24 semanas para la pesquisa de malformaciones anatómicas. El uso generalizado de medición de cérvix y Doppler de arterias uterinas para la pesquisa de parto prematuro y preeclampsia no está recomendado (10). En el caso del embarazo monocorial, las ecografías de 16 a 24 semanas tienen el objetivo de pesquisar signos de transfusión feto fetal (ver más adelante). Las ecografías de 24 semanas en adelante serán de crecimiento donde se deberá estimar el peso fetal y definir el percentil de crecimiento según las tablas de embarazo único, dado que no hay diferencias significativas al usar tablas de embarazos múltiples. En Chile, se recomienda usar la tabla de alarcón-Pitaluga para este efecto (11). En cada ecografía se estimará el peso y su discrepancia (feto de mayor peso-feto menor peso/feto de mayor peso) además del volumen de líquido amniótico. El Doppler estará indicado en caso de crecimiento discordante (mayor de 25% y/o un feto con crecimiento menor al percentil 10).
Control prenatal- -
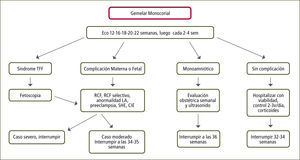
Embarazo Monocorial: Se recomiendan al menos nueve controles. Éstos deberán incluir control de policlínicoy ecografía a las semanas 16, 18, 20, 22, 24, 28, 32, 34 y 36.
- -
Embarazo Bicorial: Se recomiendan seis controles. Luego del ingreso prenatal y ecografía para definir la corionicidad, se recomienda control obstétrico y ecografía a las 20, 24, 28, 32, 34 (sin ecografía) y 36 semanas (12).
- -
Embarazo Triple: El seguimiento será definido según la corionicidad con la diferencia que estos controles se harán hasta la semana 34.
- -
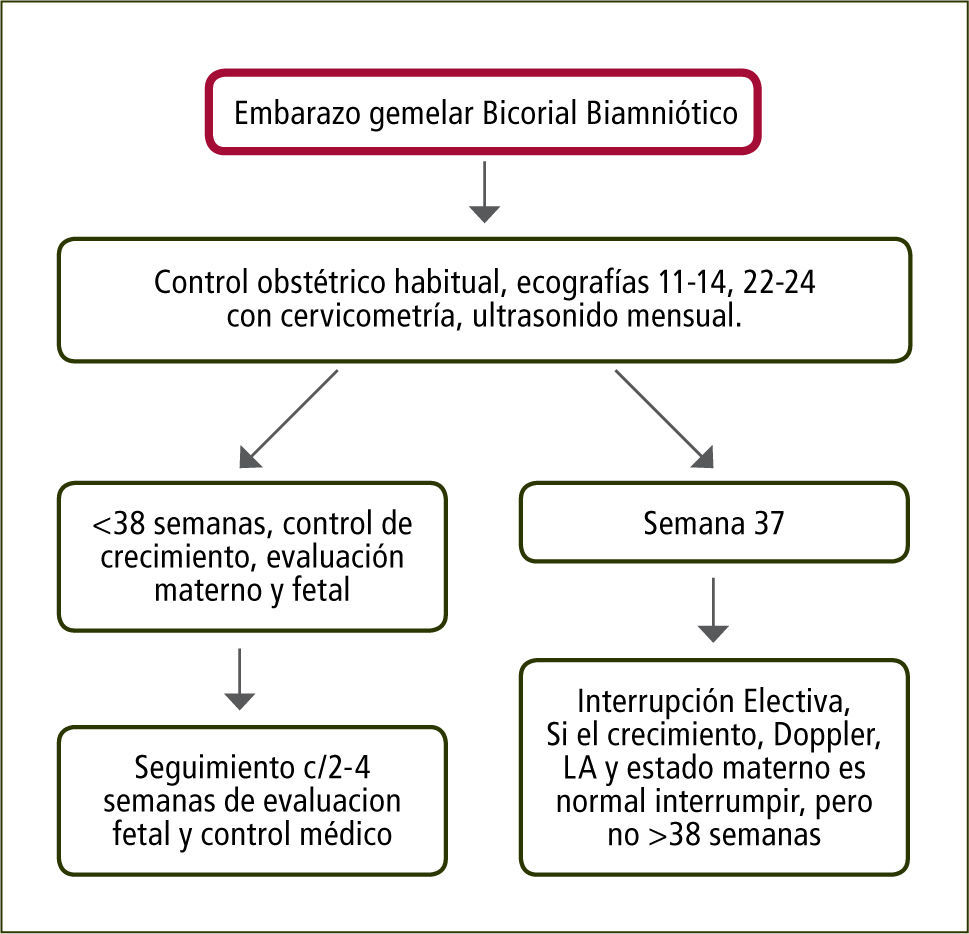
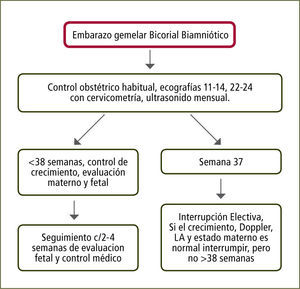
Embarazo Bicorial Biamniótico: Considerando que el 60% de estos embarazos nacen espontáneamente antes de las 37 semanas y que el riesgo de muerte fetal inesperada aumenta desde las 38 semanas en adelante, se recomienda la interrupción a las 37 semanas (figura 3).
- -
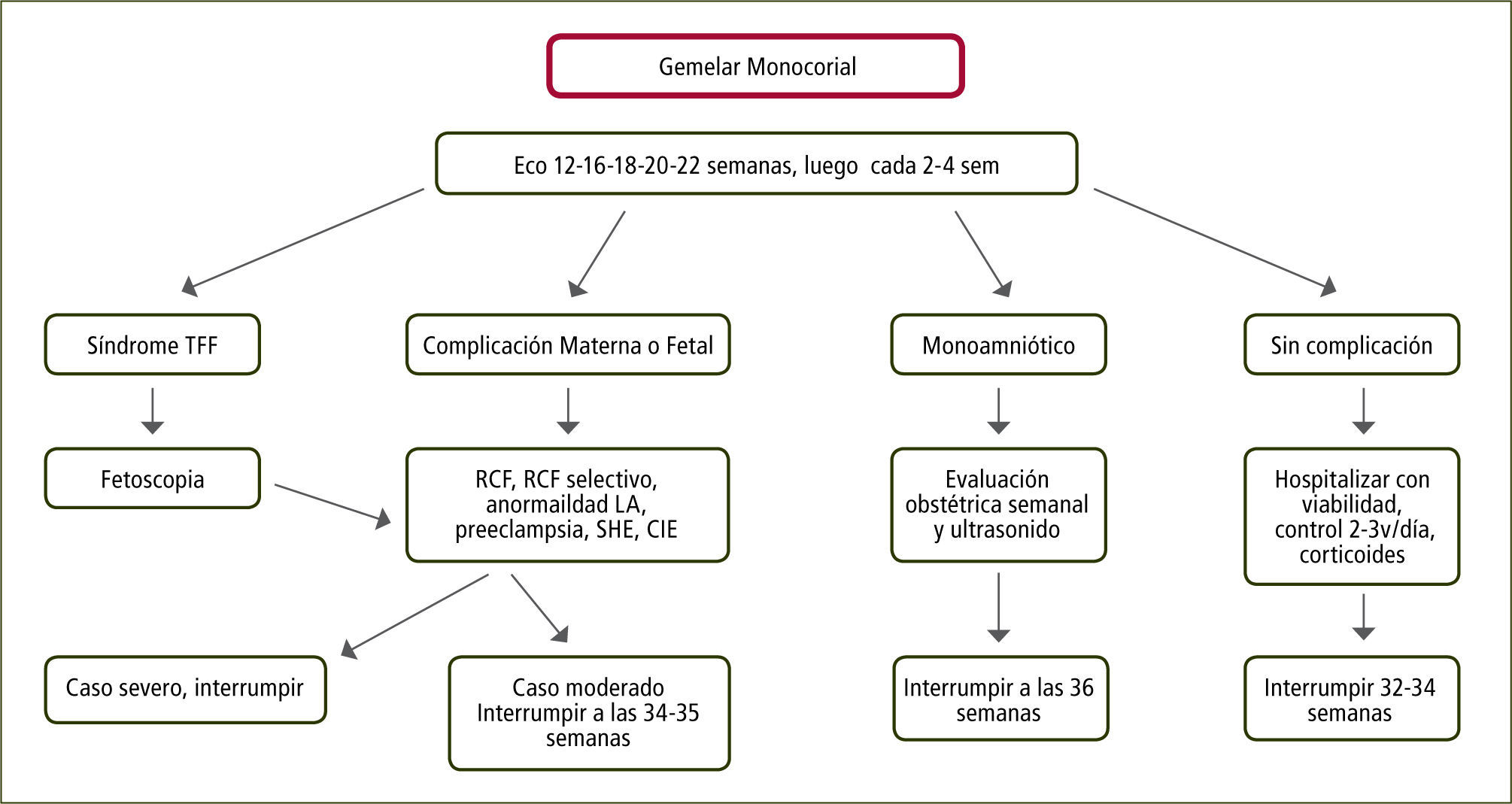
Embarazo Monocorial Biamniótico: Considerando que el 60% de estos embarazos nacen espontáneamente antes de las 37 semanas y que el riesgo de muerte fetal inesperada aumenta desde las 38 semanas en adelante, se recomienda la interrupción a las 36 semanas previa dosis de maduración pulmonar (figura 4).
- -
Embarazo Triple: Considerando que el 75% de estos embarazos nacen espontáneamente antes de las 35 semanas y que el riesgo de muerte fetal inesperada aumenta desde las 36 semanas en adelante, se recomienda la interrupción a las 35 semanas previo uso de corticoides (12).
Indicaciones absolutas de parto por cesárea son el embarazo monoamniótico, gemelos pagos e independiente de la corionicidad, la presentación no cefálica del primer gemelar. indicación relativa es la presentación cefálica del gemelo uno con presentación no cefálica del gemelo dos.
Tamizaje de enfermedades cromosómicasEl tamizaje de enfermedades cromosómicas se realiza en la ecografía de 11–14 semanas mediante la combinación del riesgo asociado a la edad materna, marcadores ecográficos como la traslucencia nucal, presencia de hueso nasal, flujo tricuspídeo, ductus venoso y marcadores bioquímicos (B-hCG libre y PAPA-A).
Si sensibilidad del tamizaje para trisomía 21 en gemelos es de 87% para la combinación de edad materna y marcadores ecográficos y sube a 93% con la adición de marcadores bioquímicos (13,14).
El DNA fetal en sangre materna, aún cuando ha mostrado alta sensibilidad en el screening de trisomía 21 en embarazo múltiple, no se puede recomendar dado el bajo número de estudios publicados hasta el momento (15).
Parto prematuroEl parto prematuro está considerablemente aumentado en el embarazo gemelar, siendo el 50% de los partos menor a las 37 semanas y el 10% antes de las 32 semanas (10). Esto está directamente relacionado con el número de fetos, siendo la frecuencia de parto prematuro en embarazo triple aún mayor (30% bajo las 32 semanas).
Predicción de parto prematuro: El antecedente de un parto prematuro y cérvix menor a 25mm entre las 20–24 semanas son los mejores predictores de parto prematuro en embarazos gemelares (16). La monitorización de actividad uterina, fibronectina y cultivos vaginales de rutina en búsqueda de infecciones cérvico vaginales no han mostrado utilidad en la predicción del parto prematuro.
En relación a la prevención del parto prematuro, el reposo en cama, tocolíticos orales de mantención y cerclaje no han mostrado ser de utilidad en la prevención del parto prematuro (17,18). La progesterona si bien no ha disminuido la frecuencia de parto prematuro, en un metaanálisis mostró disminuir la morbilidad neonatal compuesta asociada a la prematurez, motivo por el que podría recomendarse su uso en dosis de 200mg /día vaginal (19).
Los corticoides tienen la misma indicación que para embarazos simples con amenaza de parto prematuro entre las 24 y 35 semanas.
Síndromes hipertensivos del embarazoEl embarazo múltiple presenta un riesgo mayor de presentar preeclampsia que el embarazo simple. Es así como el riesgo se triplica en el embarazo doble y es nueve veces mayor en el embarazo triple (20). Varios estudios han evaluado diversos métodos de tamizaje, ya sea presión arterial, proteinuria y Doppler de arterias uterinas. Hasta ahora, el método más efectivo es la toma de presión arterial en cada control obstétrico. El Doppler de arterias uterinas tiene una baja sensibilidad en el segundo trimestre para la predicción de preeclampsia y no hay estudios predictivos a las 11–14 semanas, motivo por el que no se recomienda (21). Las guías NICE recomiendan para la prevención de la preeclampsia el uso de aspirina a dosis de 75mg/día desde las 16 a 32 semanas en mujeres con embarazo múltiple que cumplan con cualquiera de los siguientes criterios: primigesta, mayor de 40 años, período intergenésico sobre 10 años, historia familiar de preeclampsia o IMC sobre 35Kg/m2(22).
Complicaciones específicas de los embarazos monocorialesSíndrome de Transfusión Feto-FetalSe presenta en 3 de 100.000 RNV. El 20–25% de los embarazos son monocoriales y 10–15% de éstos se complicarán con una transfusión, la que se produce por desequilibrio de las anastomosis arteriovenosas placentarias. En su presentación más severa se presenta en uno de cada siete embarazos monocoriales con un 70 a 90% de mortalidad o daño neurológico severo (23). El seguimiento ecográfico en embarazos monocoriales debe ser cada dos semanas entre las semanas 16 y 24, y en caso de haber plegamiento de las membranas amnióticas, el seguimiento deberá ser semanal.
El diagnóstico se realiza bajo las 26 semanas mediante ecografía con la secuencia anhidramnios/polihidramnios donde el saco amniótico mayor mide >8cm (bajo 20 semanas) y >10cm entre las 20 y 25 semanas con vejiga fetal grande en el feto receptor y saco <2cm y ausencia de vejiga en el feto donante o stuck twin (figura 5). La clasificación más usada es la de Quintero y colaboradores (24) (tabla 1).
Estadios clínicos de quintero para la clasificación de síndrome de transfusión feto-fetal
| Etapa 1 | Secuencia polihidramnios/ anhidramnios (receptor/ donante), vejigas visibles |
| Etapa 2 | Vejiga de gemelo donante no visible en al menos 60 minutos de observación, Doppler fetal de ambos gemelos dentro de límites normales |
| Etapa 3 | Doppler críticamente alterado en cualquiera de los gemelos: arteria umbilical con flujo ausente/reverso al fin de diástole, ductus venoso con flujo reverso, vena umbilical con flujo pulsátil |
| Etapa 4 | Presencia de ascitis, derrame pleural o pericárdico, edema cutáneo o hídrops presente en uno o ambos gemelos |
| Etapa 5 | Muerte de uno o ambos gemelos |
El tratamiento es mediante fetoscopía con ablación láser de las anastomosis A-V superficiales para los estadios 2 a 4 de Quinteros. Para el Estadio 1, la conducta es expectante con seguimiento y tratamiento de progresar a Estadio 2 (25). El pronóstico en general para la coagulación láser es de una sobrevida de 30% para ambos gemelos, 30% sobrevida para un feto y 30% mortalidad intrauterina para ambos (26).
El amniodrenaje bajo las 26 semanas no se recomienda dado su asociación con peor resultado neurológico a largo plazo y menor sobrevida. aún falta evidencia para recomendar la ablación láser sobre las 26 semanas (27,28).
Se sugiere la interrupción electiva para los estadios 1 y 2 a las 35 semanas y a las 32 semanas para los estadios 3 y 4.
Restricción de crecimiento selectiva RCFsSe presenta en el 15–25% de los embarazos monocoriales. Se diagnostica cuando uno de los gemelos se encuentra creciendo bajo el percentil 10 para la edad gestacional. La discordancia mayor de 25% no es criterio de RCFs, pero es indicación de seguimiento ecográfico más estricto.
Existen tres tipos definidos por el flujo diastólico en el Doppler de la arteria Umbilical (AU) (29).
Clasificación y pronóstico de la RCF selectiva en embarazo monocorial
| TIPO | DOPPLER ARTERIA UMBILICAL (AU) | DETERIORO Y MUERTE |
|---|---|---|
| Tipo I | Flujo diastólico presente en la AU | 0%-2,6% |
| Tipo II | Flujo diastólico ausente/reverso persistente en la AU | 90%-0% |
| Tipo III | Flujo diastólico intermitente ausente/ reverso en AU | 10%-15% |
El manejo de la RCFs depende de la clasificación del feto afectado:
RCFs tipo I: Dado buen pronóstico, progresión infrecuente y a su nula o escasa secuela neurológica el manejo es expectante con seguimiento ecográfico semanal o bisemanal. En caso de mantener Doppler normal, se sugiere la interrupción después de las 35 semanas.
RCFs tipo II: Este grupo se asocia a un deterioro precoz intrauterino en aproximadamente el 90% de los casos con tasas elevadas de mortalidad tanto del feto afectado (29%) como del feto sano (22%). El deterioro precoz requiere frecuentemente interrupción a las 30 semanas. El manejo activo con ligadura del cordón del gemelo con restricción ofrece las tasas más altas de sobrevida del gemelo normal en comparación con la foto coagulación láser de la placenta (90,9% vs. 74%, respectivamente) (30,31). Dado el marco legal en Chile, éste es un tratamiento que no se puede ofrecer y la recomendación es el seguimiento ecográfico e interrupción en caso de deterioro fetal. La consejería a las padres es fundamental en estos casos. La interrupción se sugiere después de las 28 semanas.
RCF tipo III: El manejo puede ser expectante o activo. No existen estudios randomizados que establezcan la mejor terapia en RCFs con flujo reverso intermitente umbilical. opiniones de expertos plantean que el manejo expectante debe ser similar al tipo ii, con seguimientos ecográficos con Doppler semanal si el Doppler venoso es normal, o seguimientos más frecuentes si hay alteraciones venosas iniciales. El manejo activo con mejores resultados de sobrevida del gemelo sano es la coagulación del cordón del gemelo RCF. La fotocoagulación láser se asocia con tasas muy elevadas de mortalidad del feto afectado (75%) durante la primera semana post procedimiento, pero con reducción significativa de mortalidad del gemelo sano (32). Se plantea la interrupción a las 32–34 semanas.
Secuencia Perfusión arterial Reversa (Feto acardio/acéfalo)La frecuencia es de 1 en 30 mil embarazos (1% de los monocoriónicos). Se produce por una malformación vascular placentaria donde un feto recibe por su vena umbilical sangre pulsátil desoxigenada desde la arteria umbilical de feto donante. Desde el receptor, acardio y acéfalo, se observa una arteria umbilical con sangre más desoxigenada y flujo no pulsátil hacia la placenta. El pronóstico depende del tamaño del feto acardio, con un 100% de mortalidad para el feto donante si éste pesa 70% o más que el feto donante.
El tratamiento se ofrece entre las 16 y 18 semanas y hay diversos métodos como la oclusión fetoscópica del cordón del feto acárdico mediante pinza bipolar o la coagulación con láser o alcohol de los vasos peri umbilicales de este feto, todos con resultados similares (50–60% sobrevida) (33).
Síndrome de Anemia policitemia(TAPS Twin anemia-policitemia syndrome)Es un grado menor de transfusión feto fetal que aparece en el tercer trimestre y que se caracteriza por anemia en el feto donante y policitemia en el receptor, sin discordancia de líquido amniótico. El criterio diagnóstico prenatal se realiza con la velocidad de la arteria cerebral media cuando el donante se encuentra bajo 0,5 MoMs y el receptor sobre 1,5 MoMs (34). Ni la transfusión sanguínea al feto anémico ni la fetoscopía con coagulación laser han mostrado utilidad en esta patología (27), y probablemente, hecho el diagnóstico después de las 30 semanas, la indicación es la interrupción (35).
Embarazo monocorial monoamnióticoOcurre en el 1% de los embarazos monocoriales. antiguamente la mortalidad era de un 50%, pero con el diagnóstico precoz, corticoides, control obstétrico e interrupción precoz esta es ahora entre un 10–20%. La principal causa de muerte es el entrecruzamiento de los cordones. Se recomienda la vigilancia fetal estricta 2–3 veces al día (ecografía mas registro basal no estresante) hospitalizado desde las 26–28 semanasy corticoides precoces dada la alta tasa de prematurez. Se estima que la muerte fetal inesperada y súbita ocurre entre un 5 a 10% después de las 32 semanasy se recomienda la interrupción a las 32–34 semanas (36).
Muerte fetal en el embarazo gemelarLa muerte fetal en gemelares se presenta en mayor frecuencia que los embarazos únicos. Considerando que en Chile la frecuencia de muerte fetal es de 7 en 1.000 embarazos (37), el embarazo bicorial presenta este evento adverso en 12 por 1.000 y el triple en 31 por 1.000 embarazos (38). La muerte de un gemelo es particularmente riesgosa en el embarazo múltiple. Las primeras 48 horas son las más riesgosas, dado que se asocia a un 12% de muerte del otro gemelo en el caso de monocoriales y 4% en bicoriales (39). Dado los cambios hemodinámicos asociados a este evento, el feto superviviente puede presentar alteración severa del neuro-desarrollo hasta en un 20% de los casos.
Se sugiere que para gemelos bicoriales con muerte fetal entre las 24 a 34 semanas, el manejo será expectante con interrupción luego de corticoides a las 34 semanas. En monocoriales se sugiere evaluar anemia fetal mediante arteria cerebral media en el gemelo sobreviviente, con transfusión sanguínea o interrupción inmediata. Si no hay compromiso hemodinámico se sugiere interrupción a las 32–34 semanas previo corticoides (40).
El autor declara no tener conflictos de interés, en relación a este artículo.