El cáncer de la cavidad oral se asocia principalmente a factores de riesgo como consumo de tabaco y alcohol. Si bien es posible evaluar con visión directa las lesiones de la cavidad oral, la pesquisa precoz de lesiones es baja y el porcentaje de lesiones diagnosticadas en estadios I en Chile son cercanos al 5%. Debido a esto, la educación de profesionales y pacientes en la detección temprana de desórdenes potencialmente malignos, como la leucoplasia y la eritroplasia, y la detección de tumores malignos en estadios precoces son uno de los principales desafíos de los diferentes especialistas que trabajan en el territorio oral y maxilofacial.
The oral cavity cancer is associated mainly with risk factors such as tobacco and alcohol consumption. Although it is possible to assess oral cavity lesions with direct vision, early detection of oral cavity lesions is low and the percentage of tumors diagnosed in stage I in Chile is close to five percent. Due to this, the education of professionals and patients in the premature detection of potentially malignant disorders, such as leukoplakia and erythroplakia, and the detection of malignant tumors in early stages are one of the main challenges of the different specialists working in the oral and maxillofacial territory.
El cáncer de cabeza y cuello es una entidad poco conocida por los profesionales de la salud no especialistas y que corresponde al 3% del cáncer en general, siendo el sexto tipo más común en el mundo1,2. La región de la cabeza y el cuello presentan múltiples sitios anatómicos que se pueden ver afectados por la aparición de un tumor, entre estas se encuentra la cavidad oral, comprendida desde los labios, los dos tercios de la parte anterior de la lengua, la mucosa bucal (cara interna de mejillas), piso de la boca, las encías, el trígono retromolar y el paladar duro1,3,4. Dentro de los diversos tipos histológicos que afectan la cavidad oral, el tipo escamoso corresponde a más del 90% de las lesiones de carácter maligno que afectan a esta región5,6. Se reconocen múltiples factores de riesgo en la etiología de este tumor principalmente asociados a los hábitos. Si bien, una de las ventajas es el acceso a la visión directa de las lesiones, tanto por profesionales de la salud como por parte de los pacientes, la mayoría de tumores diagnosticados en Chile corresponden a estadios avanzados, III y IV7, con un mayor avance en el tamaño tumoral, compromiso local, regional y sistémico de éste, determinando menores porcentajes de sobrevida y mayor mortalidad, por lo que el diagnóstico precoz y la educación en la detección temprana para profesionales y pacientes es uno de los principales desafíos de los diferentes especialistas que trabajan en el territorio oral y maxilofacial.
FACTORES DE RIESGODiversas alteraciones intrínsecas, tanto desórdenes hematológicos, como la anemia de Fanconi8, el Plummer Vinson9 ó genodermatosis como la disqueratosis congénita han sido relacionadas como factores de riesgo y de susceptibilidad genética para el cáncer de cavidad oral (CCO). Se reconocen también otros factores de riesgo relacionados a los hábitos de los pacientes y que se asocian al desarrollo de CCO, donde el consumo de tabaco sin duda es uno de los constituyentes más determinantes. Se ha descrito que el uso simultáneo de tabaco y alcohol establecen un factor de riesgo multiplicativo de 10 a 20 veces mayor que aquellos que no fuman o no beben, funcionado de manera sinérgica10,11.
Existen otros factores de riesgo como el hábito de masticar tabaco, el fumar cigarrillos de tabaco de manera invertida y el consumo de la nuez de betel o Areca12, sin embargo, en Chile, estas conductas no están asociadas a nuestra cultura, por lo que no son un blanco de educación al momento de realizar intervenciones de prevención primaria y secundaria en la comunidad. Otros factores menos frecuentes son el bajo consumo de frutas y verduras ricas en flavonoides13, la exposición a cantidades elevadas de metales pesados como el níquel14 y el rol del microbioma como factor determinante en el desarrollo del cáncer oral15,16, pese a esto se requieren de más estudios que permitan establecer una relación directa de estos factores con el desarrollo de cáncer oral. Finalmente en relación al Virus del Papiloma Humano, éste virus tiene un rol sobresaliente en la etiología del cáncer de orofaringe4,17,18, pero hasta el momento no se ha logrado establecer su relación etiológica en el desarrollo del CCO19.
DESÓRDENES POTENCIALMENTE MALIGNOSDurante muchos años diversos estudios han mostrado que el cáncer de cavidad oral presenta lesiones precursoras que no son consideradas neoplasias, pero, se relacionan con una mayor probabilidad de evolucionar a un cáncer escamoso. Estas lesiones son conocidas como Desórdenes Potencialmente Malignos (DPM) y corresponden a diferentes entidades que inclusive no están directamente relacionadas con las neoplasias malignas. La organización mundial de la salud (OMS), en su última clasificación del año 201720, considera 12 condiciones como DPM (Tabla 1).
Desórdenes potencialmente malignos, Organización Mundial de la Salud, 2017
| Desórdenes potencialmente malignos orales |
|---|
| Leucoplasia |
| Eritroplasia |
| Eritroleucoplasia |
| Fibrosis oral submucosa |
| Disqueratosis congénita |
| Queratosis del masticador de tabaco |
| Lesiones palatinas asociadas con fumar al revés |
| Candidiasis crónica |
| Liquen plano |
| Lupus eritematoso discoide |
| Glositis sifilítica |
| Queilitis actínica |
Ref. 20
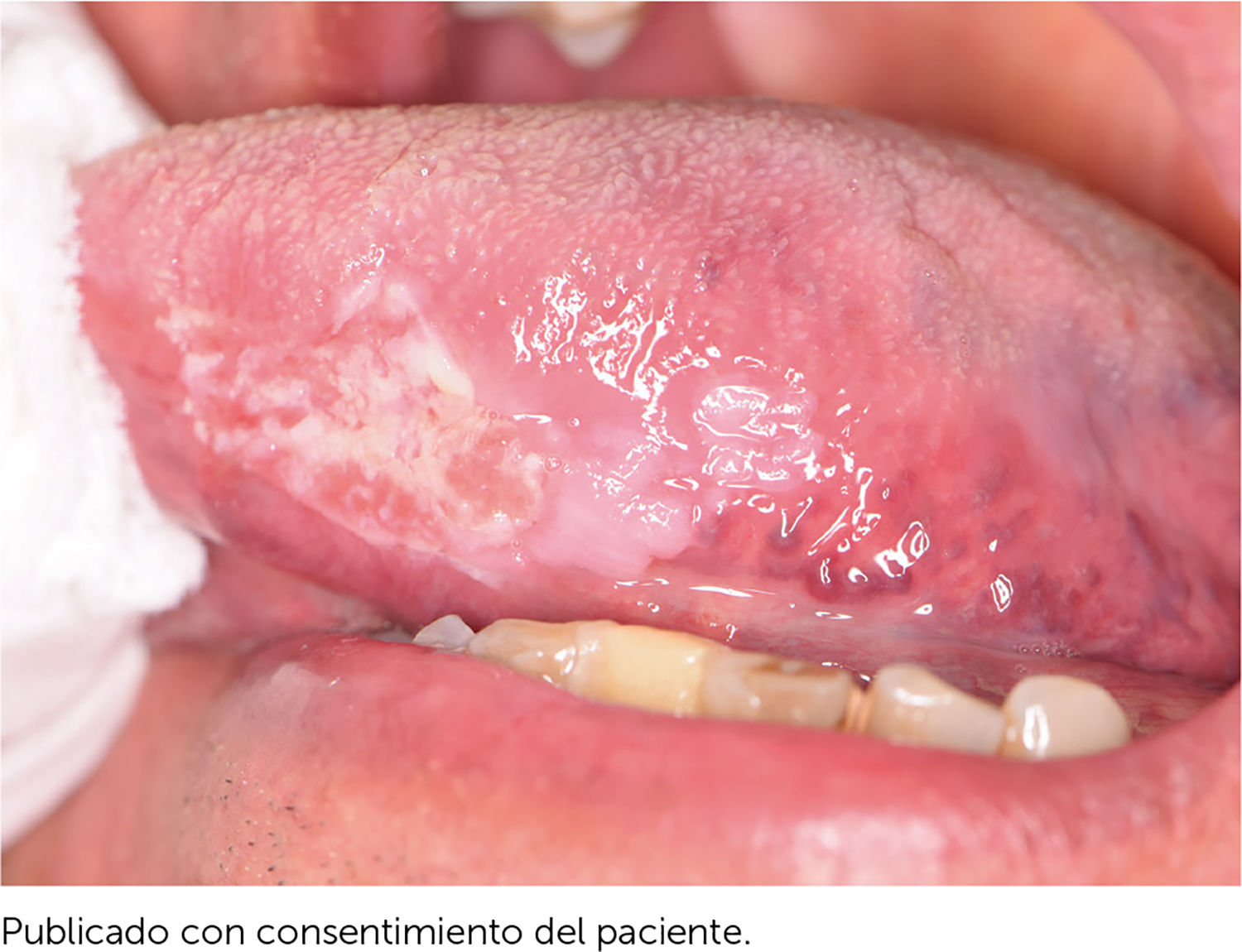
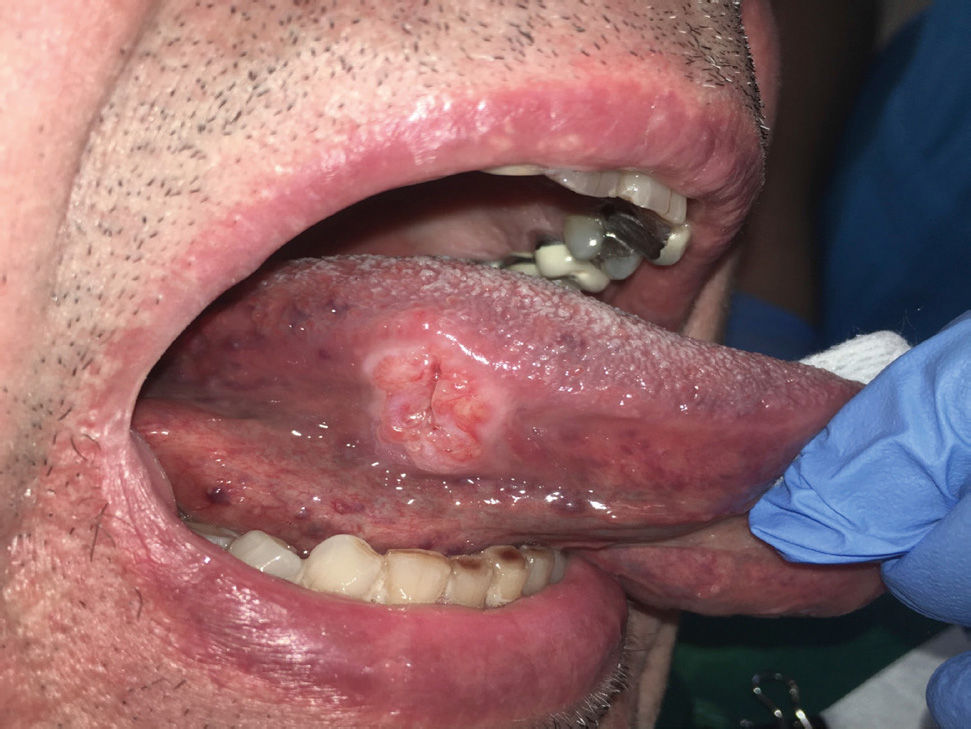
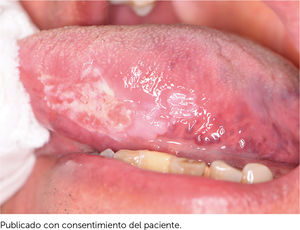
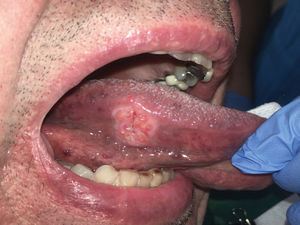
Es relevante comprender que la presencia de estos DPM no determina la progresión obligatoria a un CCO y aunque los pacientes que presenten estas lesiones debiesen tener mayor riesgo de evolucionar a un cáncer escamoso en estos sitios21, también pueden desarrollar un CCO en otros sitios de la mucosa oral que incluso estén clínicamente sanas22. La relación con el CCO de los DPM se fundamenta en cuatro aspectos que están relacionados con la clínica, las alteraciones moleculares y morfológicas. Estos aspectos son: la progresión de DPM a CCO en estudios longitudinales, en que pacientes con CCO presentan simultáneamente la presencia de DPM (Figura 1), que comparten alteraciones histopatológicas y morfológicas y en que los DPM y el CCO comparten alteraciones moleculares y genéticas22. Los clínicos deben comprender que los DPM corresponden a un concepto clínico, y que más que evaluar una lesión de riesgo, se evalúa a un paciente en contexto de enfermedad que es susceptible al desarrollo de CCO.
En el análisis histológico de los DPM se debe analizar la presencia o no de displasia epitelial, pudiendo encontrarse cambios epiteliales sin displasia, como la hiperqueratosis, hiperplasia epitelial, atrofia epitelial o epitelio oral sin alteraciones, o alteraciones displásicas como: pleomorfismo celular y nuclear, mitosis atípicas, queratinización aislada en el estrato espinoso, pérdida de polaridad, entre otros21. Considerando la presencia de criterios displásicos, la OMS expone dos formas para graduar la presencia de la displasia epitelial20, uno es el sistema por graduación de displasia, que presenta tres categorías: leve, moderada y severa; y una nueva propuesta de manera binaria que considera solo dos estados, la displasia de bajo grado y la displasia de alto grado23.
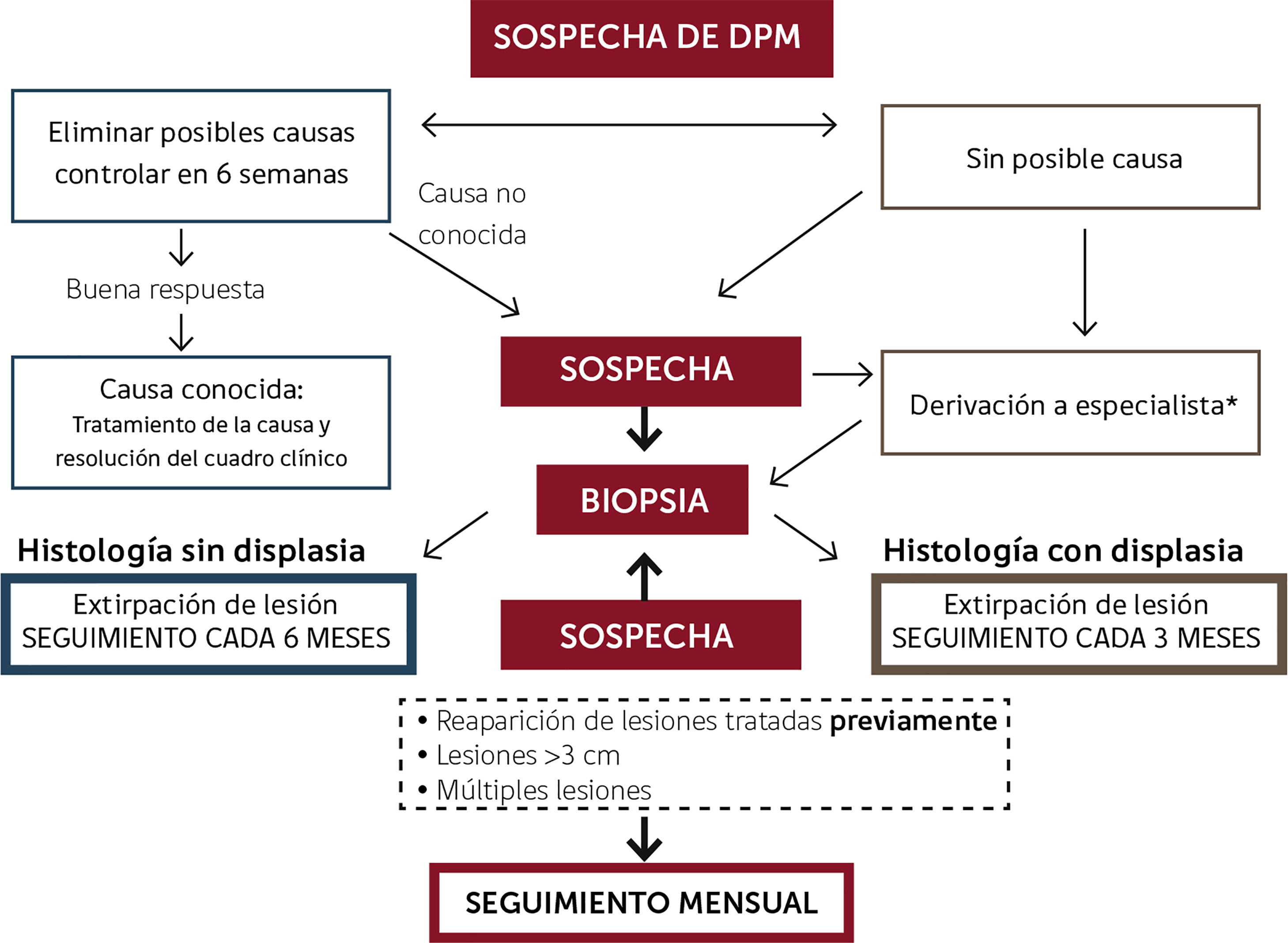
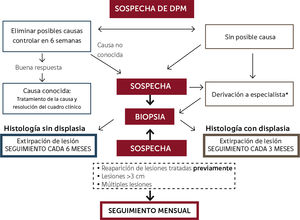
Sin embargo, pese a las diversas graduaciones, el mayor impacto clínico ha sido determinado por la presencia o no de displasia epitelial según el algoritmo de seguimiento propuesto por Isaäc van der Wall24, donde el paciente que presenta una leucoplasia con confirmación histológica de displasia, debiera ser controlado periódicamente cada 3 meses y aquellos pacientes que presenten DPM sin displasia, debieran ser controlados periódicamente cada 6 meses. Otras propuestas en los últimos 2 años consideran la evaluación por un especialista en el reconocimiento de DPM y CCO, que permita personalizar el seguimiento ante los factores de riesgo del paciente, la presentación clínica, considerando incluso controles mensuales e indicando la toma de nuevas biopsias en periodos menores a 12 meses, en lesiones extensas, ante la recurrencia de una lesión ya intervenida o en el caso de cualquier sospecha clínica de lesiones orales25,26. En la Figura 2 se propone un algoritmo para el abordaje y seguimiento de desórdenes potencialmente malignos.
MALIGNIZACIÓN DE DESÓRDENES POTENCIALMENTE MALIGNOS Y CÁNCER DE CAVIDAD ORALLa progresión de DPM a CCO, en revisiones sistemáticas, se ha reportado en un promedio de un 3.5%. Las variables de mayor influencia en la malignización incluyen: el género femenino, lesiones combinadas como eritro-leucoplasia, superficies superiores a 200mm2, edad avanzada, y grados altos de displasia26,27.
La descripción semiológica del paciente con CCO suele considerar el grupo de riesgo con pacientes varones de la sexta a octava década de vida, con consumo elevado de tabaco, alcohol3 y con mala higiene, que desarrollaban lesiones clínicas de aspecto ulcerativo, exofíticas e indoloras. Sin embargo, la presentación clínica se relaciona directamente con los diferentes sitios anatómicos de la cavidad oral comprometidos, incluso esta presentación varía acorde al crecimiento endofítico de las lesiones y la diseminación perineural asociándose, por ejemplo, a síntomas como el dolor, aún en tumores de pequeño tamaño clínico. Los grupos etarios jóvenes no debiesen ser una característica de exclusión al momento de sospechar de CCO, ya que son muchos los reportes donde se relaciona el desarrollo de CCO en pacientes menores de 40 años, afectando principalmente sitios como la lengua1,10. En torno a la presentación asociada al género, se han descrito variaciones por ejemplo cuando analizamos el CCO por sitio anatómico, donde la encía afecta más a las mujeres, así como también se ha descrito un aumento en los últimos años de cáncer de lengua en mujeres jóvenes28,29. El clínico debe realizar una completa anamnesis que le permita relacionar los diferentes aspectos de la historia clínica del paciente con los hallazgos pesquisados en el examen físico, como se describe en la Tabla 2.
| Historia clínica de paciente | Hallazgos del examen físico |
|---|---|
| Relata un aumento de volumen progresivo | Presenta una tumoración, úlcera o nódulo firme a la palpación con o sin cambio de coloración. |
| Historia de dolor | Presencia de úlcera sensible al tacto. |
| Relato de sangrado espontáneo o asociado a alimentos. | Hallazgo clínico de tumoración ulcerada. |
| Pérdida de pieza dentaria espontánea o historia de extracción dental. | Movilidad dentaria aumentada, ausencia de diente en alveólo sin cicatrizar. |
| Síntomas neurosensitivos: parestesia, motilidad alterada. | Fijación de lengua, alteración en movilidad, desviación al protruir. |
| Dificultad y/o dolor a la apertura bucal. | Trismus y fijación de lengua. |
| Aumento de volumen cervical | Linfoadenopatía única o múltiples, de manera visible o la palpación. |
El clínico debe ser capaz de relacionar la historia clínica del paciente con los hallazgos clínicos presentes en su examen físico. Este examen no solo debe considerar una inspección visual, sino que debe incluir la palpación de la región cervical y de las lesiones de la cavidad oral junto con el examen de la función motora de la lengua junto a la dinámica mandibular.
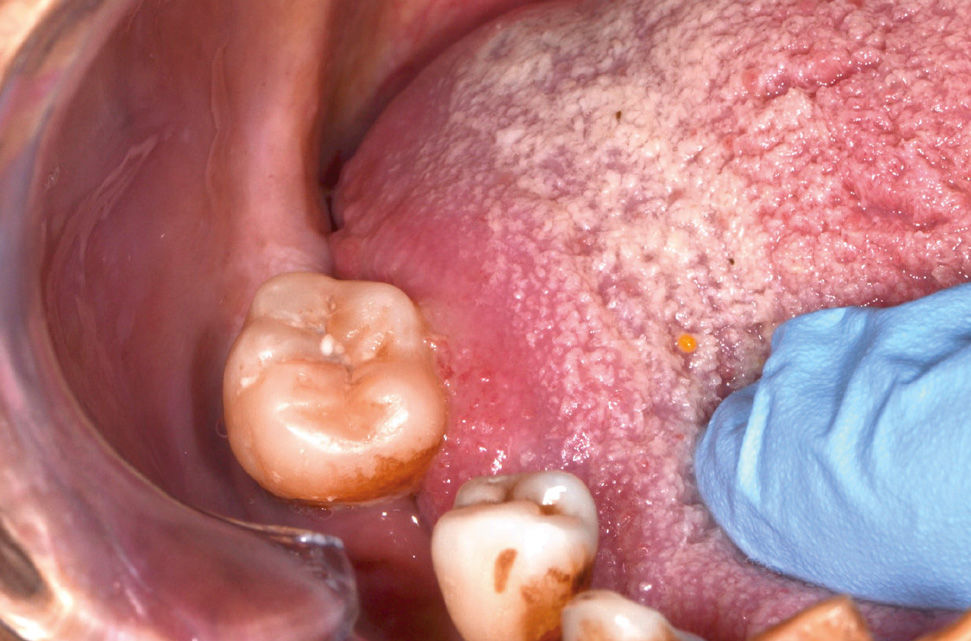
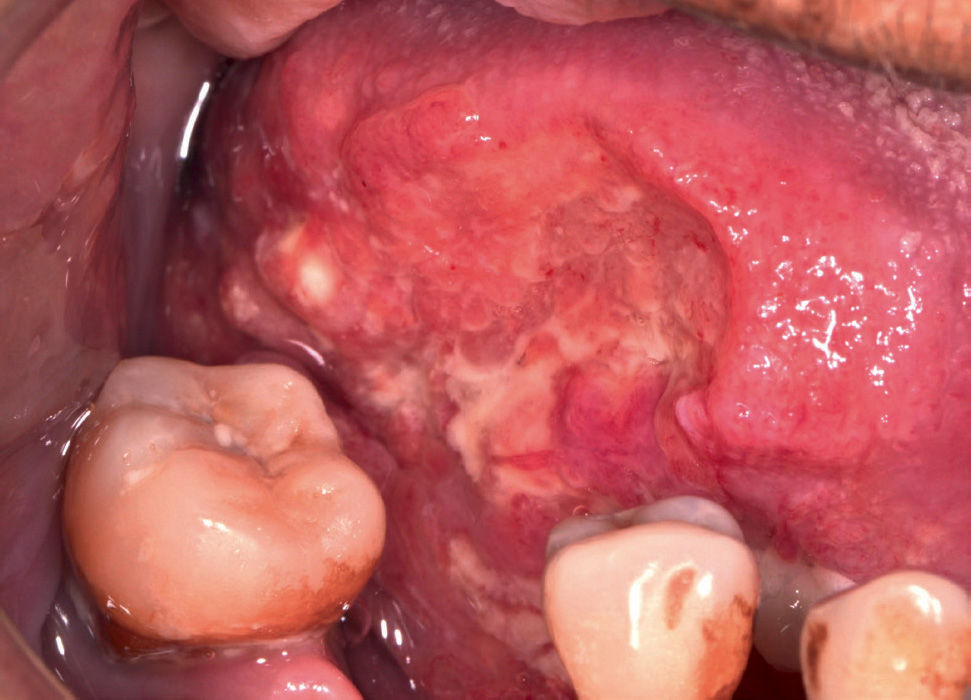
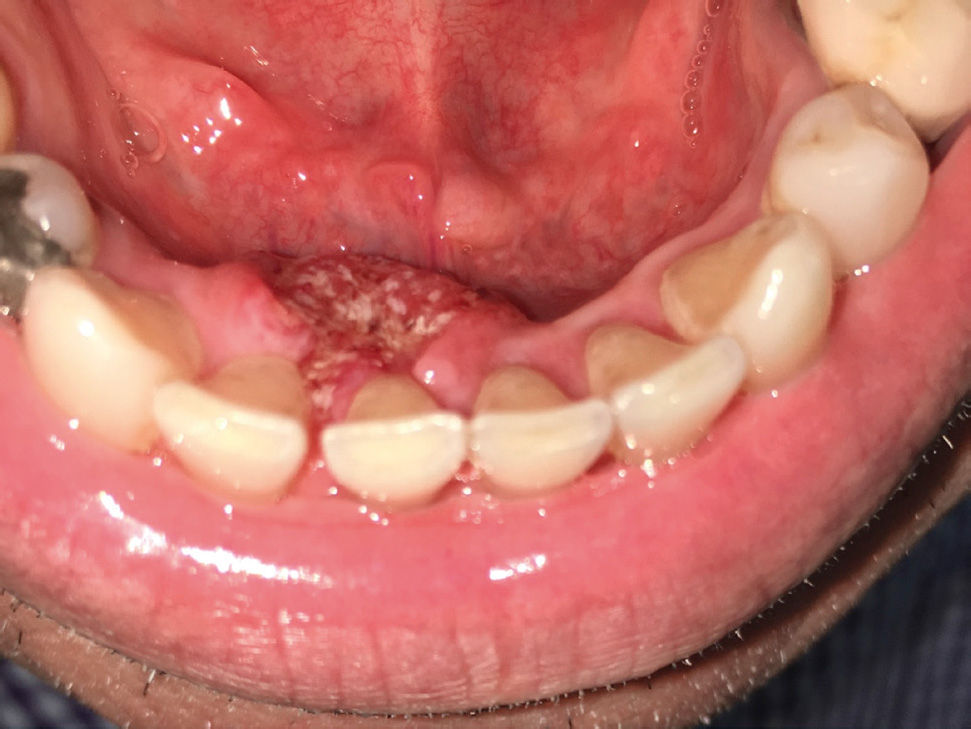
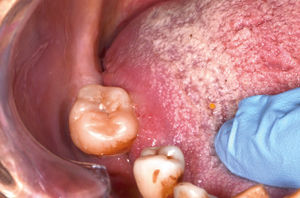
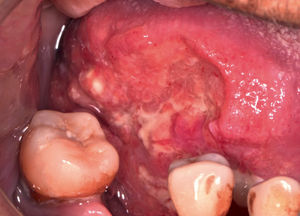
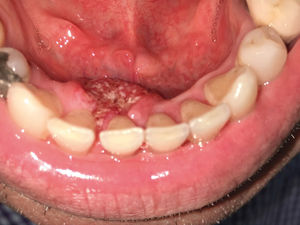
El trauma de la mucosa oral se ha descrito como un posible determinante en la evolución de un carcinoma30,31, debido a la presencia de factores inflamatorios constantes y reparativos, pese a esto, no existen trabajos con nivel de evidencia tipo I que relacionen el trauma de mucosa oral con el desarrollo de CCO. No obstante, si se presenta una lesión de CCO asociada a constante trauma de los dientes o estructuras protésicas en la superficie del tumor, esto va a favorecer a la ulceración, el crecimiento endofítico y la aparición de síntomas como el dolor (Figura 3a y 3b).
DETECCIÓN TEMPRANA Y EXAMEN ORALLas características anatómicas de la cavidad oral permiten un acceso fácil a la visión directa de las lesiones, tanto por profesionales de la salud como por parte de los pacientes, a pesar de esto, el principal porcentaje de tumores diagnosticados en Chile corresponden a estadios avanzados. Según una serie reportada por el Instituto Nacional del Cáncer de Chile, el 56.9% de los tumores revisados correspondieron a tamaños T4 y más del 60% de los pacientes fueron diagnosticados presentando estadio IV, solo un 5.1% fueron diagnosticados en estadio I7. La sobrevida asociada a los diferentes tumores guarda estricta relación con el estadio clínico que éstos presentan, siendo alrededor de un 50% a los 5 años1,3,7. Debido a esto, la detección temprana por parte de los clínicos y de conocimiento de autoexamen oral por los pacientes son las principales herramientas en el diagnóstico temprano del cáncer oral. Sin embargo existen trabajos que han determinado que mientras más aumenta el nivel de especialización por parte de los odontólogos, menor es el conocimiento sobre las lesiones incipientes como los DPM, al comparar por ejemplo estudiantes de tercero, quinto año y profesionales, siendo los estudiantes de tercer año, quienes más conocimiento tienen de los DPM32,33. Junto con esto se ha descrito que solo un 17.8% de los profesionales de atención primaria (médicos y odontólogos) realizan un examen de cavidad oral rutinario a sus pacientes34.
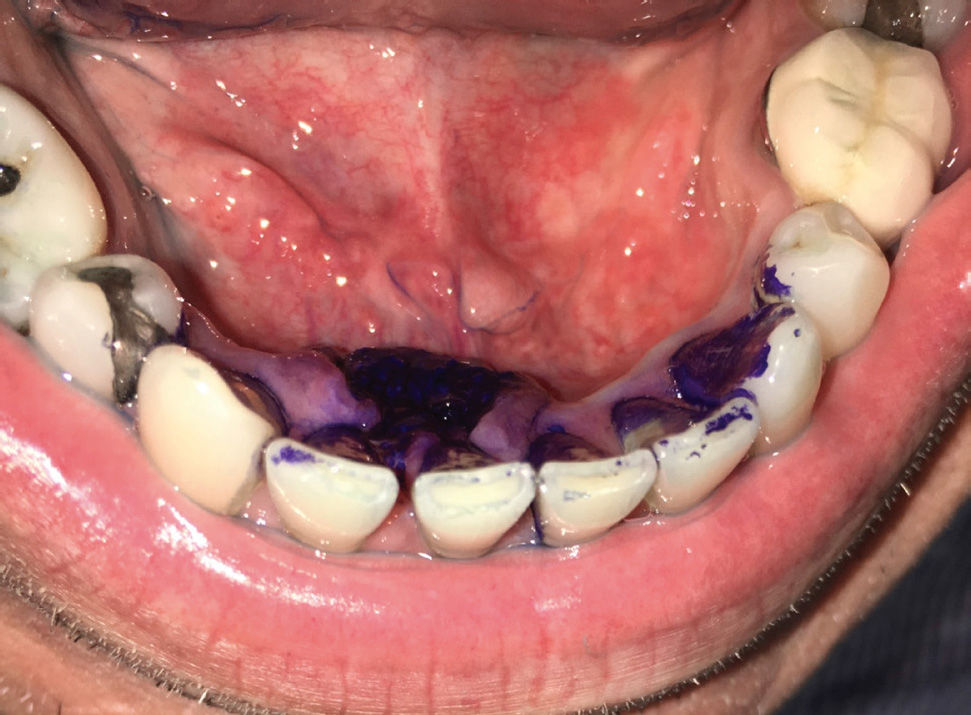
Este examen no solo debe considerar la observación de la cavidad oral, el National Institue of Health de Estados Unidos, considera un examen óptimo para detección precoz de cáncer cuando este incluye la palpación de la región cervical y la palpación de lesiones sospechosas de la cavidad oral, como también palpación rutinaria de la lengua, junto a la tracción y observación de esta en todas sus caras35 (Figura 4). Cambios de coloración, de textura y brillo de la mucosa oral, que se manifiesten clínicamente como presencia de manchas y parches blancos (leucoplasia), rojizos (eritroplasia), superficies opacas con o sin fisuras, leucoplasias con grietas, áreas ulcerativas mayores a 14 días de evolución, lesiones nodulares dolorosas, masas detectadas a la palpación o asociadas a alteraciones en la motilidad de la lengua y pérdida de dientes en sitios de alveolos con más de 14 días en proceso de cicatrización, deben ser sugerentes de la toma de una muestra y/o de la evaluación por parte de profesionales capacitados en el diagnóstico de este tipo de lesiones.
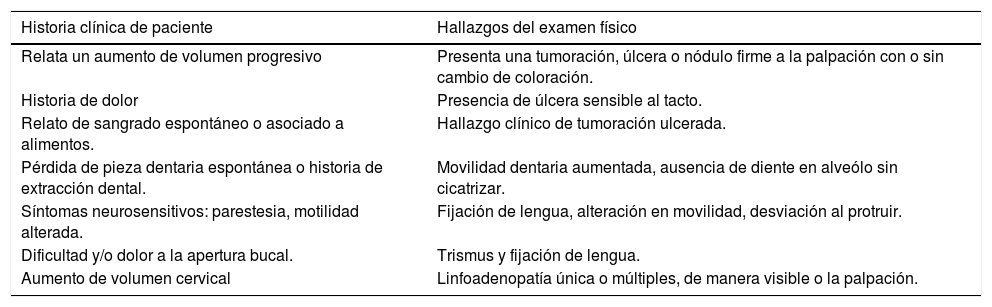
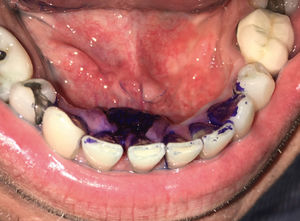
En ocasiones existen dudas en la selección de la toma de muestras en lesiones extensas o con múltiples focos en la cavidad oral. Para esto, existen ayudas diagnósticas como el azul de toluidina al 1%, un colorante con alta afinidad por ácidos nucleicos y que se encuentran directamente relacionados con lesiones displásicas o con presencia de neoplasias malignas36. La técnica se describe como positiva si al pincelar la lesión con azul de toluidina al 1% y después de lavar el sitio con ácido acético al 1%, la lesión analizada mantiene el color azul intenso (Figura 5). Aunque el azul de toluidina tiene una sensibilidad y especificidad superiores a un 97% en la detección de los sitios de displasia37, esta técnica no es un sinónimo de biopsia atraumática, ni menos puede reemplazar la toma de la biopsia. Los profesionales que evalúan la cavidad oral, tanto especialistas como profesionales no especialistas, tienen la responsabilidad de realizar un examen extraoral e intraoral de manera rutinaria, junto con educar a estos pacientes, sobre la realización de un adecuado autoexamen oral, la detección de alteraciones y el requerimiento de una evaluación oportuna por parte de los especialistas en relación a las alteraciones que pesquisen.
CONFIRMACIÓN DIAGNÓSTICA: HISTOLOGÍA E IMÁGENESEl principal aporte en la pesquisa e identificación precoz de lesiones cancerizables, debiese ser que ante la presencia de una lesión sospechosa el profesional sea capaz de realizar, o al menos indicar, la toma de una muestra de mucosa oral.
Muchas veces el diagnóstico es eminentemente clínico, sin embargo, la toma de una muestra y el posterior estudio histopatológico permiten confirmar la hipótesis clínica, e inclusive descartar otros diagnósticos diferenciales de úlceras crónicas e induradas de la región maxilofacial como: la úlcera traumática de estroma granulomatoso y eosinofílico (úlcera eosinofílica), la úlcera por tuberculosis, la úlcera por sífilis, úlceras relacionadas a infecciones micóticas y enfermedades tropicales, que podrían verse asociadas a pacientes turistas o que se hayan encontrado fuera del país previo al diagnóstico38.
En la octava edición del manual de etapificación del American Joint Committee on Cancer, el estudio histopatológico aporta nuevos aspectos en el TNM, considerando no solo la extensión en superficie clínica que presenta el tumor, sino que también el compromiso endofítico, evaluado como profundidad de invasión de manera histopatológica y que se determina en relación a una línea perpendicular a la horizontal desde el margen del tejido sano39.
Junto con la confirmación diagnóstica histopatológica, el paciente debe ser sometido a estudios imagenológicos que permitan evaluar tanto el compromiso local a nivel cervical, y además evaluar el compromiso metastásico que pueda presentar40. Para ello el estudio mediante imágenes como: la tomografía computada con contraste de la región maxilofacial, cervical y del tórax; la resonancia magnética, en la evaluación del compromiso a nivel del canal mandibular o el compromiso a nivel del espacio masticador y de estructuras nerviosas hacia la base del cráneo41; y la utilización de la Tomografía Computada por Emisión de Positrones (PET CT), que permite una adecuada evaluación del componente metastásico o desarrollo de segundos tumores primarios42.
DERIVACIÓN DEL PACIENTE CON DIAGNÓSTICO DE CÁNCER DE CAVIDAD ORALEl paciente con CCO tiene asociados cambios funcionales y estéticos importantes, que se presentan tanto por la enfermedad como consecutivo al tratamiento oncológico43. Por ello, muchos pacientes tienen miedo de enfrentar la enfermedad en relación al impacto estético y funcional que ésta conlleva44. Está descrita la alta complejidad del tratamiento del cáncer oral, y los costos asociados al tratamiento de reconstrucción y rehabilitación45 y que el mayor porcentaje de éxito terapéutico va de la mano de equipos médicos multidisciplinarios entrenados y con constante exposición a casos de CCO46. Considerando estos aspectos una vez que se confirma el diagnóstico de CCO, el paciente debe ser derivado a equipos médicos multidisciplinarios, compuestos de otorrinolaringólogos especializados en oncología, cirujanos de cabeza y cuello oncólogos y reconstructivos, oncólogos radioterapeutas, oncólogos médicos, fonoaudiólogos, psico-oncólogos y odontólogos47, que permitan abordar el tratamiento oncológico de manera integral, considerando parámetros de cirugía oncológica y adecuado manejo del compromiso cervical, incorporación de criterios de oncología médica y radioterapia además del manejo funcional de la deglución, manejo de la voz y abordaje de complicaciones orales que estos puedan presentar, permitiendo así la reinserción social de estos pacientes.
CONCLUSIONESLos mejores resultados oncológicos se obtienen cuando se considera la prevención y la educación de los pacientes junto a los diversos profesionales que trabajan en el territorio oral y maxilofacial permitiendo detectar lesiones precoces y en estadios tempranos. Para lograr esto, los profesionales deben incorporar el examen de la cavidad oral de manera rutinaria, a fin de evaluar y diagnosticar de manera oportuna lesiones sospechosas como DPM y CCO. La toma de la biopsia de mucosa oral puede ir acompañada de la selección de una ayuda diagnóstica para elegir el sitio más representativo o incluso la determinación de derivar a un especialista para la toma de la muestra. Sin embargo, no se debe retrasar la confirmación del cuadro clínico, y mientras el profesional tenga las capacidades técnicas y teóricas debiera funcionar bajo el concepto de “sospecha=biopsia”. Una vez confirmado el diagnóstico, el paciente debe ser derivado a un equipo médico con experiencia en tumores de cabeza y cuello a fin de recibir el tratamiento oncológico bajo los conceptos del equipo multidisciplinario oncológico.
Declaración de interésDeclaro no presentar conflictos de interés.