La radioterapia ha experimentado avances importantes en la última década, lo que ha resultado en un aumento de la curación de los cánceres urológicos y una disminución en las complicaciones por radiación. Estos avances han sido posibles por el trabajo de equipo médico multidisciplinario y la incorporación y consolidación de nuevas tecnologías. El avance en la planificación virtual tridimensional ha permitido que el radio oncólogo defina con precisión los volúmenes que alojan el cáncer y también los órganos sanos que debe proteger. La incorporación de radioterapia por modulación de intensidad en su forma estática, IMRT, intensity modulated radiotherapy o la modulación volumétrica de intensidad en arco, VMAT, volumetric modulated arc therapy, permite depositar en forma muy precisa la dosis de radiación en el volumen blanco de tratamiento y proteger los órganos vecinos. El avance se complementa con una mejor localización del volumen a tratar mediante el desarrollo de la radioterapia guiada por imágenes, IGRT, image guided radiotherapy. Otra área de avances importantes ha sido la braquiterapia beneficiada por el desarrollo de los sistemas de planificación tridimensional y el uso de las imágenes para guía de los volúmenes de tratamiento y posicionamiento de las fuentes radioactivas. El presente artículo describe la aplicación de estos avances en los diferentes tipos de cánceres urológicos.
Radiation therapy has experienced significant advances during the last decade, resulting in improved control of urologic cancer and decrease in radiation toxicity. The advances have been possible due to the multidisciplinary teamwork and the development of new technologies. Advances in virtual 3D treatment planning, allows the radiation oncologist to define with precision de volumes occupied by cancer and protect the normal tissue. The incorporation of IMRT, intensity modulated radiotherapy and VMAT, volumetric modulated arc therapy, allows excellent precision to treat the target volume and protect the normal organs. The better dose distribution complements advances in treatment localization with the development of IGRT, image guided radiotherapy. Brachytherapy has also experienced significant advances with 3D treatment planning systems, imaging to determine treatment volumes and brachytherapy source positioning. The present paper describes the application of these advances to urologic cancer.
La radioterapia ha tenido un avance muy importante en la última década, que ha permitido aumentar la curación del cáncer y disminuir la toxicidad. En este cambio han sido responsable múltiples factores tanto médicos como tecnólogos médicos (1).
Los principales factores médicos que han contribuido al avance han sido la mejor definición en la indicación de tratamiento empleando bases científicas y el trabajo basado en un equipo de tratamiento multidisciplinario (2,3)
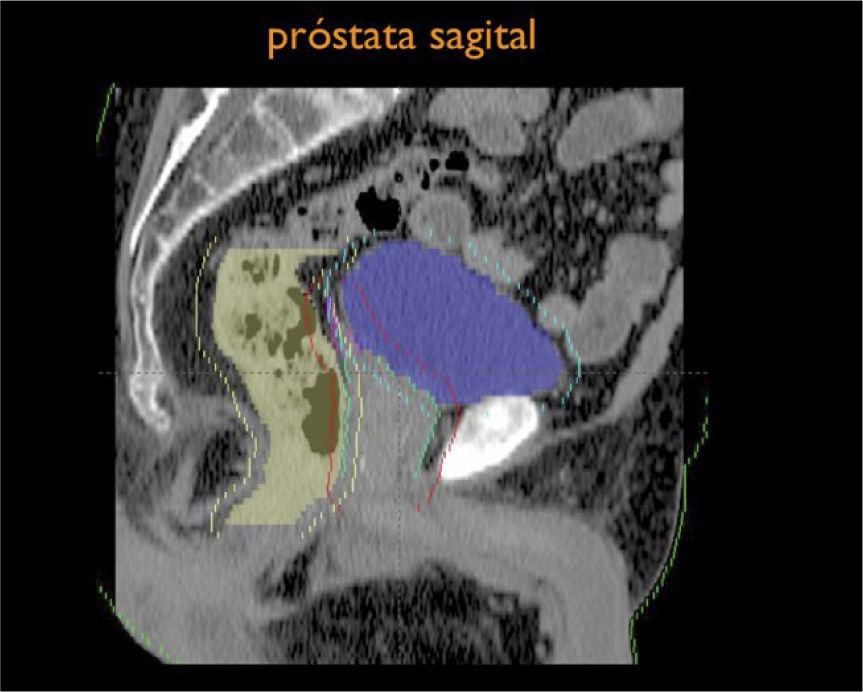
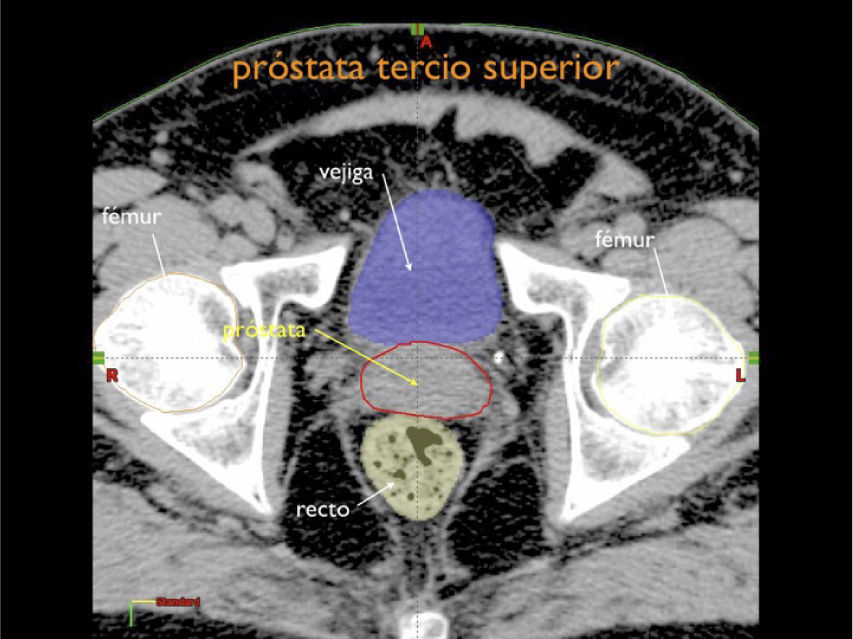
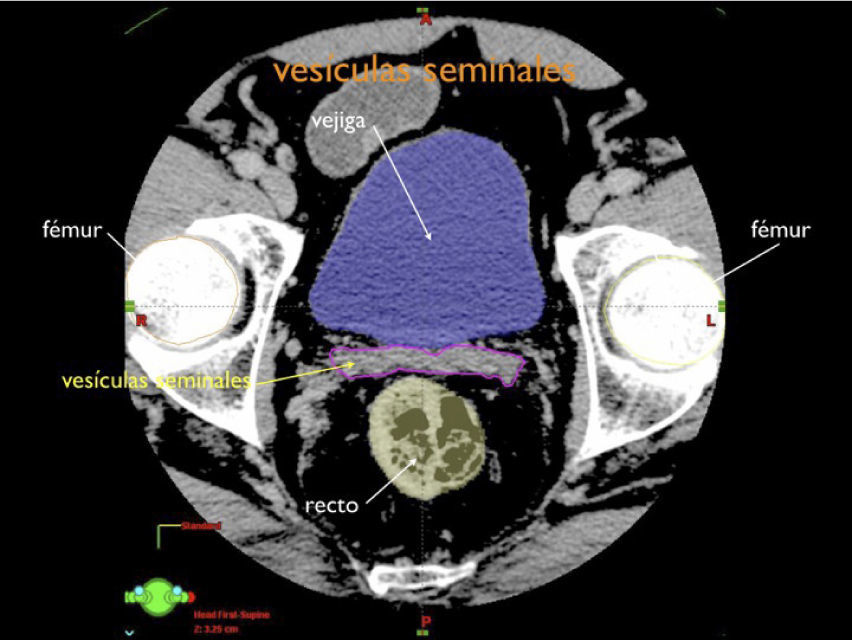
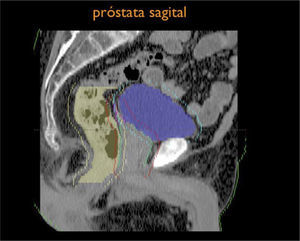
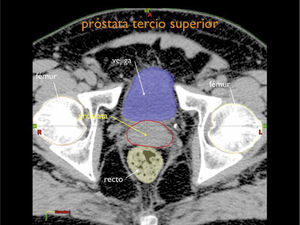
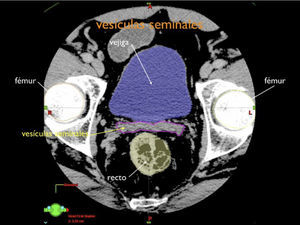
Otro avance médico fundamental es el desarrollo de consensos para la definición tridimensional de los volúmenes de tratamiento, a partir de las imágenes de tomografía axial computada, (TAC), tanto para los volúmenes blancos de tratamiento como para la definición de órganos a riesgo u órganos sanos que lo rodean (4,5) (Figuras 1-3).
Para mejor definición de los volúmenes blanco se incorpora la utilización de todos los tipos de imágenes tomográficas disponibles, TAC con y sin contraste, resonancia nuclear magnética, RNM, tomografía por emisión de positrones, PET CT con diferentes isotopos. Las imágenes de apoyo son fusionadas a la imagen de planificación para una óptima definición de los volúmenes (1).
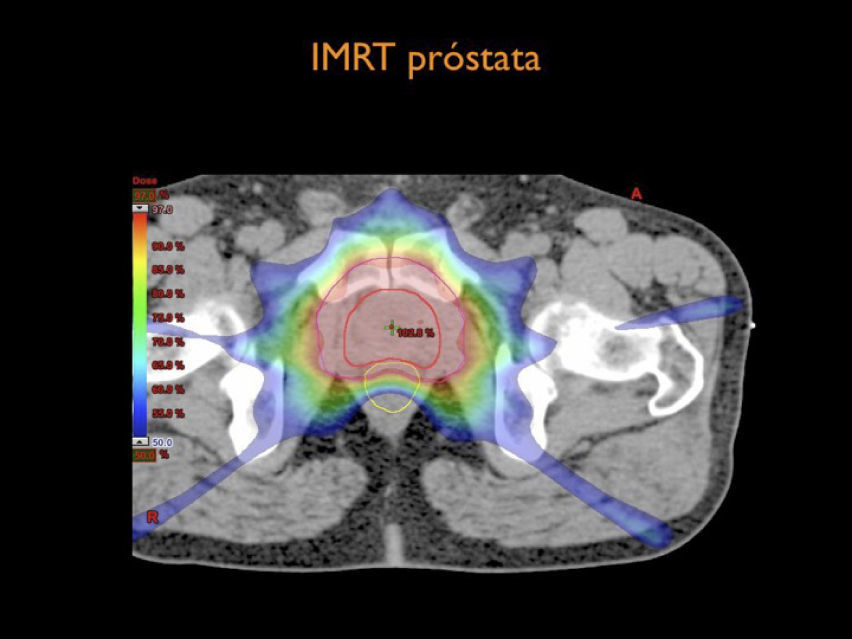
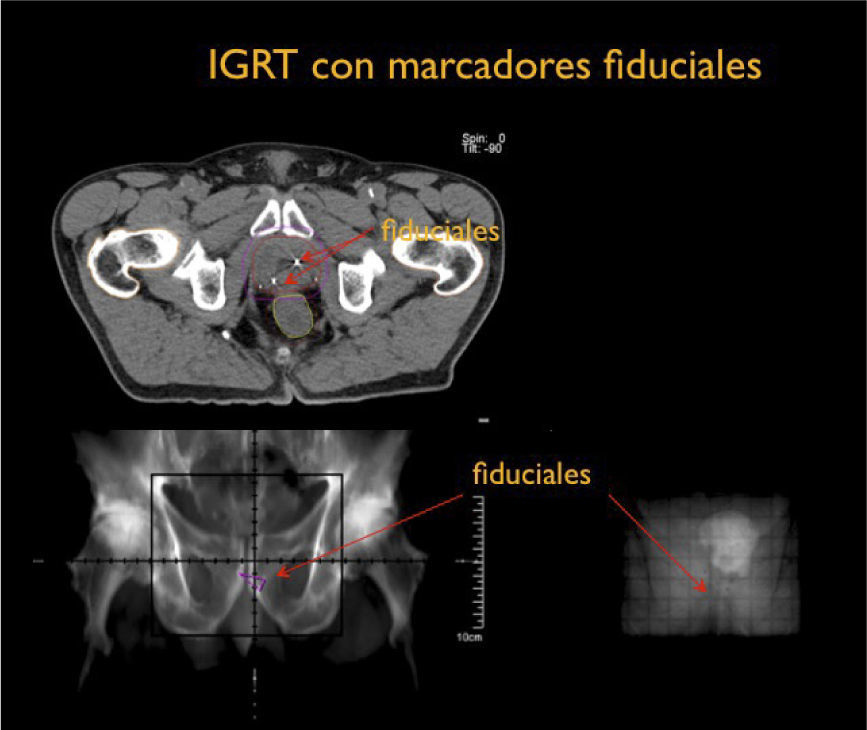
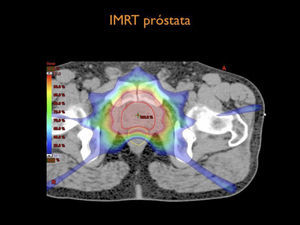
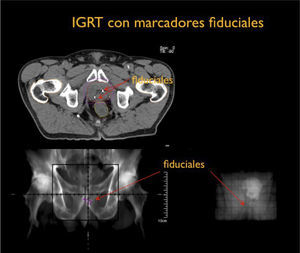
Por otra parte el desarrollo tecnológico ha sido inmenso mejorando la precisión en la distribución de la radiación con el uso de radioterapia por modulación de intensidad en su forma estática, IMRT, intensity modulated radiotherapy o modulación volumétrica de intensidad en arco, VMAT, volumetric modulated arc therapy(1) (Figura 4). Otro desarrollo fundamental ha sido la optimización en la precisión para depositar la radiación en el sitio planificado. Con el fin de optimizar la ubicación del blanco de tratamiento se han mejorado los sistemas de inmovilización y se implementó la radioterapia guiada por imágenes, IGRT (image guided radiotherapy), con campos ortogonales o mediante la obtención de TAC en la máquina de tratamiento, CBCT (one beam computed tomography) (6,7). Se implementa además el uso de marcadores fiduciales, insertos en el volumen blanco, los que facilitan la verificación de la posición del volumen (6) (Figura 5).
Otra área de desarrollo tecnológico ha sido la braquiterapia, que consiste en colocar fuentes radioactivas dentro del cuerpo en el volumen que se va a tratar. La braquiterapia deposita la radiación en forma muy precisa en el volumen deseado, lo que permite aumentar la dosis, con una baja irradiación de los tejidos vecinos (1). Se ha perfeccionado la braquiterapia tanto para los implantes permanentes en los que se implantan semillas radioactivas dentro del volumen a tratar, como para los implantes transitorios, que utilizan aplicadores que se posicionan en el volumen de tratamiento y luego se cargan remotamente con fuentes radioactivas de alta tasa, que entregan la dosis de radiación en minutos (8,9).
El posicionamiento de semillas o aplicadores para la braquiterapia es guiado por imágenes de ultrasonido, TAC o RNM. El uso de imágenes ha permitido mejorar la distribución de la radiación (9). Todos estos avances tecnológicos han sido posibles gracias a un estricto control de calidad realizado por los físicos médicos. El físico médico controla todo el proceso de radioterapia de alta tecnología, desde la generación de la radiación hasta su entrega en el paciente, incluyendo los procesos de planificación, transmisión del plan a la máquina de tratamiento y la verificación de cada plan, ejecutando un tratamiento de prueba en maniquíes, donde se mide la dosis y la precisión de la distribución, comparándola al plan de tratamiento.
Radioterapia en cáncer de próstataLa radioterapia se utiliza en el cáncer de próstata en tres situaciones: como tratamiento curativo, como tratamiento complementario post prostatectomía radical y en el manejo paliativo de las metástasis.
Radioterapia curativaRecientemente se publicó un estudio aleatorizado que comparó en más de quinientos pacientes por rama la prostatectomía radical versus radioterapia versus observación. El trabajo muestra que las probabilidades de curación son iguales entre la cirugía y la radiación, sobrevida cáncer específica a 10 años 98.8% en ambos y sobrevida libre de progresión 91.1% para cirugía y 91% para radioterapia, lo que debe interpretarse considerando que las definiciones de falla son diferentes para ambas modalidades (10). La calidad de vida es mejor con radioterapia por menores molestias urinarias y sexuales (11). Otra publicación confirma estos resultados, indicando además que la percepción de toxicidad a los quince años es igual para prostatectomía y radioterapia (12). Los avances tecnológicos permitieron aumentar la dosis de radiación sin aumentar toxicidad lo que produce mayor curación (13,14). Es importante recalcar que los resultados actuales se logran con el uso de tecnología que permite entregar la dosis necesaria protegiendo los órganos en riesgo.
Enfermedad de bajo riesgo: En la enfermedad de bajo riesgo se han empleado tanto la radioterapia externa como la braquiterapia con similares resultados. La radioterapia externa debe realizarse con IMRT o VMAT y el posicionamiento debe verificarse con imágenes en la mesa del acelerador lineal, IGRT (6,15). La braquiterapia se puede aplicar con semillas radioactivas que se colocan dentro de la próstata, llamado implante permanente (8,16). También puede realizarse con un implante transitorio mediante la colocación de agujas que posteriormente se cargan con fuentes radioactivas de alta tasa entregando la dosis en pocas sesiones (9,17).
Enfermedad de riesgo intermedio: se trata principalmente con radioterapia externa y se puede o no combinar con bloqueo androgénico dependiendo del sub grupo de riesgo. La técnica empleada debe ser similar a los casos de bajo riesgo (15). Los estudios de braquiterapia en esta etapa son menores por lo que su uso está por definir.
Enfermedad de alto riesgo: la enfermedad de alto riesgo se caracteriza por la probabilidad elevada de tener compromiso tumoral extra prostático, traspasando la cápsula, invasión de vesículas seminales o metástasis a ganglios linfáticos (15).
En esta etapa la radioterapia externa tiene un rol importante al poder tratar todas las áreas con riesgo de alojar cáncer. Se debe tratar con IMRT o VMAT y el posicionamiento verificarse con IGRT. Se trata la próstata y vesículas seminales pudiendo o no incluir los ganglios pelvianos. En el último tiempo se ha estudiado la posibilidad de agregar braquiterapia de alta tasa como sobre impresión a la próstata, boost, para alcanzar una dosis más alta en la próstata (17). En esta etapa siempre se utiliza bloqueo androgénico concomitante aumentando la sensibilidad de la célula cancerosa a la radiación (18).
Radioterapia post prostatectomía radicalLa radiación se utiliza como tratamiento adyuvante en los casos que la cirugía fue insuficiente o también como rescate años después de la cirugía si se produce una falla bioquímica, que se manifiesta en que el antígeno prostático específico comienza a aumentar su valor (19).
Radioterapia adyuvante: La radioterapia post operatoria precoz se indica en los casos que la enfermedad se extiende fuera de la próstata, los márgenes son positivos o tienen compromiso de vesículas seminales (3). En estos casos el riesgo de residiva es mayor al 60%. El tratamiento de radioterapia adyuvante debe iniciarse después de tres meses de la cirugía para no alterar el proceso de cicatrización y lograr una óptima continencia (19,20).
Radioterapia de rescate: En el seguimiento de los pacientes con prostectomía radical el antígeno prostático específico debe mantenerse indetectable. La elevación progresiva del marcador indica la presencia de células tumorales o recidiva de la enfermedad. La radioterapia aplicada al lecho quirúrgico puede rescatar estos pacientes eliminando el remanente tumoral. Dependiendo del riesgo de diseminación ganglionar puede incluirse las regiones ganglionares pelvianas. El inicio de la radioterapia tiene mejor resultado mientras más bajo sea el antígeno prostático específico, es decir debe iniciarse en forma precoz al diagnosticarse la falla. Se recomienda agregar bloqueo androgénico a la radioterapia, lo que aumenta la sobreviva global como se demuestra en estudio randomizado (21,22).
Radioterapia paliativaEl cáncer de próstata en sus etapas avanzadas produce metástasis óseas frecuentemente. Las metástasis óseas producen dolor y existe riesgo de fractura. La radioterapia tiene un rol fundamental en el tratamiento del dolor de las metástasis y prevención de la fractura. Se debe complementar con medicamentos para promover la re osificación como ácido Zolendronico o anticuerpos monoclonales como el Denosumab, que estimulan los osteoblastos (23).
Radioterapia en cáncer de vejigaLa radioterapia curativa en el cáncer de vejiga músculo invasor tiene como objetivo preservar el órgano. Los pacientes diagnosticados con cáncer de vejiga son en general de edad avanzada, con una mediana de 70 años y portadores de patología cardiovascular, por compartir el factor de riesgo tabáquico, por lo que suelen tener un riesgo quirúrgico aumentado. Con los avances tecnológicos la radio quimioterapia es en general bien tolerada y se puede conservar una función vesical adecuada. La sobrevida global a cinco años es 48%, con preservación de la vejiga cercana al 90% y una disminución de la capacidad vesical promedio de 56 ml (24). La radioquimioterapia es hoy una alternativa a cirugía.
Otra indicación es la radioterapia post operatoria después de cistectomía radical en los casos que tienen extensión extra vesical. Estos pacientes tienen riesgo sobre el 30% de recidiva local y se benefician de la radioterapia (25). Esta había dejado de utilizarse de forma rutinaria pero hoy se ha definido mejor su indicación.
Los avances tecnológicos, IMRT y VMAT también han beneficiado a este grupo de pacientes permitiendo irradiar las regiones ganglionares y al mismo tiempo proteger el tubo digestivo. La mejor localización mediante IGRT permite disminuir los límites de seguridad en torno al blanco de tratamiento y por lo tanto irradiar menos tejidos sanos.
Radioterapia en cáncer testicularLa radioterapia se usó por años como adyuvante a la cirugía en el seminoma estadio I. La recidiva con cirugía es entorno al 10 a 20%. El seguimiento estricto mediante imágenes por cinco años permite el diagnostico precoz y un rescate adecuado evitando irradiar a la mayoría de los pacientes (26). Hoy solo se considera la irradiación en los casos que se presentan en forma avanzada, grandes tumores, más de 4 centímetros, o compromiso de las túnicas. También debe considerarse en aquellos que no pueden cumplir el seguimiento. La curación con radioterapia ocurre en más del 98% de los casos.
La radioterapia en seminoma trata las regiones ganglionares a las que drenan los testículos. Los avances tecnológicos han permitido una mejor protección renal, para la irradiación de la región paraaórtica, al poder definir con precisión las regiones ganglionares y los riñones. La dosis requerida para tratar seminoma es baja por lo que tiene mínima toxicidad tardía (27).
Radioterapia en otros cÁnceres urológicasEn el cáncer ureteral la extensión tumoral, fuera del uréter es muy frecuente y la falla local tiene un riesgo alto. La radioterapia post operatoria debe evaluarse en forma multidisciplinaria y puede ser indicada con o sin quimioterapia (28). Los avances tecnológicos permiten irradiar el retroperitoneo protegiendo los órganos abdominales.
En los cánceres renales con compromiso extra renal y sin metástasis también se puede utilizar radioterapia en casos seleccionados (29). Al igual que en el caso de los tumores ureterales los avances permiten proteger los órganos abdominales tratando adecuadamente el lecho tumoral.
El cáncer de uretra es muy poco frecuente ocurriendo en menos del uno por ciento de los cánceres. Su tratamiento debe ser dirigido por un comité multidisciplinario que incluya urólogos, radio oncólogos y oncólogos médicos (30).
En casos seleccionados de enfermedad temprana de la uretra femenina la braquiterapia está indicada pudiendo conservar la función urinaria.
En el caso de cáncer de pene la radioterapia debe considerarse como parte del manejo multidisciplinario. En ocasiones es posible conservar el órgano (31). Los avances tecnológicos han sido fundamentales para poder irradiar estos casos. El uso de IMRT permite distribuir la radiación en forma adecuada a volúmenes distribuidos de manera muy irregular, pene, región inguinal y ganglios pélvicos.
Efectos adversos de radioterapiaLos efectos adversos de la radiación en los tumores urológicos son urinarios o gastrointestinales y pueden ser agudos, durante la radioterapia y hasta tres meses después del término, o tardíos, que ocurren meses y hasta años después. Los efectos urinarios agudos son poliaquiuria, nicturia, urgencia e incontinencia. Los efectos gastrointestinales son aumento de frecuencia de las deposiciones, urgencia rectal e incontinencia. En el caso de irradiarse la pelvis los efectos gastrointestinales son aumento de frecuencia de las deposiciones, diarrea, urgencia rectal e incontinencia. Al irradiar abdomen puede haber náuseas y vómitos. Los efectos tardíos más frecuentes de la radiación son la cistitis y rectitis actínicas. La cistitis actínica se presenta con hematuria, que puede ser profusa con formación de coágulos y obstrucción urinaria secundaria. La cistoscopía muestra ulceración y proliferación vascular en la mucosa. La rectitis actínica se presenta con hematoquesia, que es en general con sangre roja. La endoscopía demuestra ulceración de la mucosa. Los riñones deben protegerse adecuadamente para evitar falla renal tardía, que se manifiesta por elevación de la creatinina.
En el cáncer de próstata los efectos adversos de radioterapia a largo plazo con técnica de IMRT-IGRT son escasos, la toxicidad grado 3 o que requiera tratamiento, para el sistema gastrointestinal es de 1% y genitourinaria 2 a 3%. La molestia principal es la rectitis y la cistitis actínica, que se manifiesta con sangrado (14,32). Un estudio poblacional reciente y dos estudios de cohorte prospectiva comparan la toxicidad tardía de radioterapia 3D conformacional, con las nuevas técnicas de IMRT más IGRT en cáncer de próstata, demostrando que IMRT más IGRT disminuyen la toxicidad, grado 2 o mayor, por lo que se recomiendan como el nuevo estándar de tratamiento (33,34). En el cáncer de vejiga la toxicidad severa de la radio-quimioterapia ocurre principalmente durante los primeros meses. Después de un año la toxicidad severa grado 3, cistitis actínica severa grado 3 ocurre en el 3% de los casos. La capacidad vesical disminuye en promedio 56ml (24).
ConclusiónLos avances de la radioterapia con la incorporación de nuevas tecnologías y mejor indicación terapéutica, ha permitido aumentar la curación de los cánceres urológicos, aumentar la conservación de órganos, disminuir la toxicidad y mejorar la calidad de vida de los pacientes. La radioterapia es hoy, una alternativa de tratamiento a la cirugía en el cáncer de próstata y cáncer de vejiga.
El autor declara no tener conflictos de interés, en relación a este artículo.