La infección profunda de la herida después del reemplazo de la articulación de la cadera es una de las complicaciones más devastadoras que enfrentan tanto el médico como el paciente, El cemento óseo mezclado con antibiótico está bien aceptado para el tratamiento de una infección establecida. Sin embargo, su papel en la profilaxis de la infección sigue siendo controvertido debido a cuestiones relacionadas con el aumento de la resistencia bacteriana, la eficacia y el coste. Hemos revisado la bibliografía sobre el uso extendido del cemento óseo mezclado con antibióticos. Concluimos que se debe valorar el riesgo-beneficio individual en el momento de indicar el uso del cemento mezclado con antibióticos en la profilaxis de prótesis de cadera.
Deep infection after hip joint replacement is one of the most devastating complications faced by the both clinician and patient. The bone cement mixed with an antibiotic is well accepted for an established infection. However, its role in infection prophylaxis remains controversial due to doubts associated with bacterial resistance, efficacy, and cost. A literature review was performed on the extended use of bone cement mixed with an antibiotic. It is concluded that the individual risk-benefit must be evaluated when indicating the use of cement mixed with antibiotics in the hip replacement prophylaxis.
El desarrollo de una infección después de una artroplastia de cadera es una complicación grave que es difícil de curar con antibióticos debido a que el crecimiento del biofilm protege las bacterias contra los efectos sistémicos de los antibióticos y el sistema inmune del huésped1-3. Aunque la incidencia estimada de la infección prostética de cadera es baja (alrededor del 1%)3, la frecuencia absoluta de estas infecciones se está incrementando junto con el aumento de estos procedimientos4,5 y el envejecimiento de la población6.
Los estudios sobre infección en prótesis de cadera consideran la artroplastia total de cadera (PTC) y la hemiartroplastia de cadera conjuntamente, y la gestión de la infección se aborda de manera similar para ambos tipos de implantes, aunque existen importantes diferencias entre las indicaciones y las posibles consecuencias de la infección. Una PTC, además de estar formada por mayor cantidad de componentes, suele ser un procedimiento electivo en comparación con la prótesis parcial de cadera, que solo consta del componente femoral, generalmente cementado, y se realiza como una emergencia, además de realizarse en pacientes ancianos7.
Hay mayor porcentaje de infección en las hemiartroplastias de cadera que en las PTC8-10, y también se ha obtenido peor resultado clínico y funcional en pacientes con infección del sitio quirúrgico11-18. Existe consenso en el uso de antibióticos sistémicos perioperatoriamente para prevenir la infección periprotésica. Un estudio experimental sugirió que el uso de cemento con vancomicina podría alargar la duración de la actividad antibacteriana en la articulación de 28 a 40h19. Según Dunbar20, teniendo en cuenta los costes asociados al tratamiento de las infecciones en las PTC, el uso del cemento mezclado con antibióticos como profilaxis primaria estaría justificado; su uso ha sido práctica habitual en algunos países europeos20,21. Sin embargo, para otros autores su uso en la población general no estaría justificado22-24. La FDA norteamericana ha autorizado el uso de productos comerciales de cemento óseo mezclado con antibióticos solo para la segunda etapa de una revisión articular total en dos tiempos, después de la extracción de la prótesis original y la erradicación de la infección periprotésica activa.
Pretendemos en este artículo revisar las propiedades de elución del antibiótico de polimetilmetacrilato (PMMA); actualizar las pruebas disponibles que respalden el uso rutinario de cemento con antibióticos en prótesis de cadera, totales y parciales, basado en su efecto en la reducción de la infección profunda y en el riesgo de cirugía de revisión para la infección o por cualquier causa, y destacar las principales preocupaciones sobre el uso rutinario del cemento con antibióticos en la cirugía protésica de la cadera primaria; la reducción de las propiedades mecánicas del cemento, los riesgos de reacciones alérgicas o la toxicidad debido a los antibióticos, el riesgo de desarrollo de resistencias antimicrobianas y el coste económico.
Propiedades de elución del polimetilmetacrilatoDurante la reacción de polimerización del cemento óseo aumenta la temperatura, lo que produce burbujas de aire. Algunas de estas burbujas escapan del cemento y otras causan porosidad en él. La porosidad final del cemento óseo depende no solo de la composición y el método de manipulación, sino también de la viscosidad del cemento2. Una mayor porosidad del cemento causa una disminución de las propiedades mecánicas pero aumenta la capacidad de liberar moléculas de antibiótico25-27. La composición de los distintos cementos difiere y el potencial de liberación de antibióticos también; el cemento Palacos® parece liberar mayores concentraciones de gentamicina que otros cementos debido a su alta viscosidad28. Pero también la liberación es diferente dependiendo del antibiótico; CMW1® fue mejor que Palacos® y Simplex® en la liberación de vancomicina29. La liberación inicial después de la exposición del cemento impregnado con antibióticos a un fluido es un fenómeno de superficie, mientras que la liberación sostenida en los días siguientes es un fenómeno de difusión en masa2. La liberación de antibióticos desde el cemento puede ser eficaz durante mucho tiempo30, aunque otros autores sostienen que el proceso es efectivo unas pocas horas31,32. Sin embargo, la hidrofobicidad del cemento limita la liberación de antibióticos a menos del 10%, y la mayor parte del antibiótico se libera en las primeras horas tras la cirugía2,33,34. Tres días después de su uso no hay un efecto antimicrobiano para las bacterias más comúnmente implicadas en la infección protésica34. La liberación se puede mejorar mediante el uso de antibióticos líquidos, pero esta elección reduce la resistencia a la compresión del cemento35.
El uso de la mezcla al vacío del cemento causa una reducción en la porosidad del cemento2 y diferentes efectos sobre las propiedades de liberación de los antibióticos en distintos cementos comercialmente disponibles36. Sin embargo, la técnica de mezcla con vacío se ha relacionado con una menor cantidad y menor tamaño de burbujas en el cemento y, por lo tanto, menor porosidad, pero también se ha visto peor liberación del antibiótico en los tejidos circundantes37.
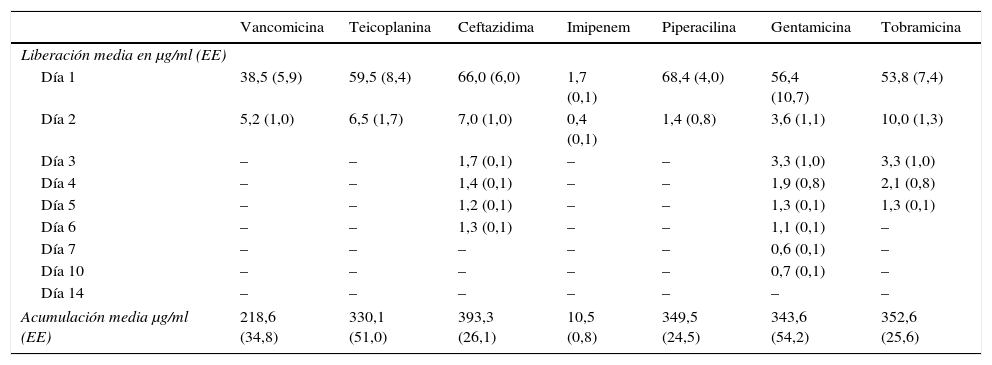
Los antibióticos más utilizados para ser mezclados con el cemento son los aminoglucósidos (gentamicina y tobramicina)37, pues conservan sus propiedades antibacterianas manteniendo mayor duración de la actividad contra la mayoría de las bacterias patógenas38,39. Otro antibiótico de uso frecuente es la vancomicina, debido a su actividad contra patógenos grampositivos, que son la causa más frecuente de infección en prótesis articulares, pero carece de cualquier efecto sobre los gramnegativos39. Chang et al.39 determinaron la liberación y duración de varios tipos de antibióticos mezclados con PMMA (vancomicina, teicoplanina, ceftazidima, imipenem, piperacilina, gentamicina, tobramicina) medidos mediante cromatografía líquida de alta eficacia (HPLC), mezclados a razón de 1g de antibiótico por 40g de PMMA, encontrando que el más efectivo era la gentamicina; su efecto antibacteriano se mantuvo 3días para Staphylococcus aureus sensible a la meticilina, un día para Staphylococcus aureus resistente a la meticilina, 3días para Staphylococcus coagulasa negativo, 10días para Pseudomonas aeruginosa, 6días para Escherechia coli y un día para Klebsiella pneumoniae (tabla 1).
Liberación diaria y acumulativa de antibióticos en muestras de cemento durante 14 días mediante cromatografía líquida de alta eficacia (HPLC)
| Vancomicina | Teicoplanina | Ceftazidima | Imipenem | Piperacilina | Gentamicina | Tobramicina | |
|---|---|---|---|---|---|---|---|
| Liberación media en μg/ml (EE) | |||||||
| Día 1 | 38,5 (5,9) | 59,5 (8,4) | 66,0 (6,0) | 1,7 (0,1) | 68,4 (4,0) | 56,4 (10,7) | 53,8 (7,4) |
| Día 2 | 5,2 (1,0) | 6,5 (1,7) | 7,0 (1,0) | 0,4 (0,1) | 1,4 (0,8) | 3,6 (1,1) | 10,0 (1,3) |
| Día 3 | – | – | 1,7 (0,1) | – | – | 3,3 (1,0) | 3,3 (1,0) |
| Día 4 | – | – | 1,4 (0,1) | – | – | 1,9 (0,8) | 2,1 (0,8) |
| Día 5 | – | – | 1,2 (0,1) | – | – | 1,3 (0,1) | 1,3 (0,1) |
| Día 6 | – | – | 1,3 (0,1) | – | – | 1,1 (0,1) | – |
| Día 7 | – | – | – | – | – | 0,6 (0,1) | – |
| Día 10 | – | – | – | – | – | 0,7 (0,1) | – |
| Día 14 | – | – | – | – | – | – | – |
| Acumulación media μg/ml (EE) | 218,6 (34,8) | 330,1 (51,0) | 393,3 (26,1) | 10,5 (0,8) | 349,5 (24,5) | 343,6 (54,2) | 352,6 (25,6) |
EE: error estándar de la media; –: por debajo del límite de detección.
Fuente: Chang et al.39.
El uso sistemático de más de un antibiótico se justifica por la posible combinación sinérgica de antibióticos40. La vancomicina y los aminoglucósidos (gentamicina o tobramicina) son una combinación habitual en los cementos óseos con antibiótico y la combinación de tobramicina y vancomicina mejora la liberación de ambos antibióticos in vitro41. La combinación de clindamicina y gentamicina (Copal G+C®) se mostró más efectiva en la prevención de la formación de biofilm y liberación de antibióticos que el uso de gentamicina sola (Palacos R-G®) in vitro42.
Efecto del cemento con antibióticos en la profilaxis en artroplastias de caderaEl cemento óseo de PMMA sirve como adhesivo y transfiere las solicitaciones desde el hueso hasta la prótesis. Las primeras aplicaciones médicas de PMMA fueron en odontología, y comenzaron en cirugía ortopédica con los primeros trabajos de John Charnley43 sobre prótesis totales de cadera en los años cincuenta y sesenta. El uso de cemento óseo impregnado con antibióticos fue introducido por Buchholz y Engelbrecht44 añadiendo gentamicina al cemento.
Los estudios sobre PTC del Registro Noruego de Artroplastias han señalado que la tasa de revisión por infección y la tasa de revisión por cualquier causa era menor si se usaba cemento impregnado con antibióticos25,26,45-48. Un estudio aleatorizado ha demostrado que la gentamicina mezclada con cemento fue más eficaz en la reducción de la tasa de infección en las PTC que los antibióticos sistémicos49. Sin embargo, en una revisión posterior del mismo grupo con un seguimiento a más largo plazo no demostró significación estadística50. Lynch et al.51, en un estudio de cohortes retrospectivo con 1.542 caderas, no encontraron diferencias entre el uso de cemento con y sin antibióticos a los 12meses de la cirugía para prevenir infecciones. Sí hubo diferencias en cuanto a revisiones por otras causas, siendo mayor en el grupo de cementado sin antibióticos. Yi et al.52, en su revisión sobre 26.791 pacientes, encontraron que el uso de cemento óseo mezclado con antibióticos en artroplastias totales de articulaciones primarias no condujo a una disminución en la tasa de infección. Heng et al.53 vieron en 123.788 pacientes que el uso de cemento con antibióticos solo, sin acompañar con antibióticos intravenosos, no era efectivo para prevenir infecciones en prótesis primarias. Recomiendan para la profilaxis de la infección protésica combinar los antibióticos sistémicos con cemento impregnado con antibiótico y ventilación convencional. Sin embargo, Wang et al.21, en un metaanálisis con una muestra de 6.381 artroplastias, concluyeron que el uso profiláctico de cemento con antibióticos reducía la tasa de infección profunda en artroplastias totales primarias, mientras que no observaron la reducción de la tasa de infección superficial en comparación con el control.
La Agencia Canadiense para las Drogas y las Tecnologías en Salud (CADTH)54 presentó una revisión sistemática y un metaanálisis en el que analizaron todos los estudios que comparaban cemento mezclado con antibióticos con cemento simple, ventilación de flujo laminar, escafandra quirúrgica, ventilación convencional y combinaciones de estas diversas tecnologías tanto en prótesis de cadera como en prótesis de rodilla. Concluyeron que la mayoría de las pruebas sugieren que el cemento con antibióticos no aporta ningún beneficio sobre el cemento simple en prótesis de cadera y rodilla. Dada la diversidad de resultados, es difícil llegar a una conclusión con respecto a la efectividad del uso del cemento con antibióticos en las artroplastias primarias.
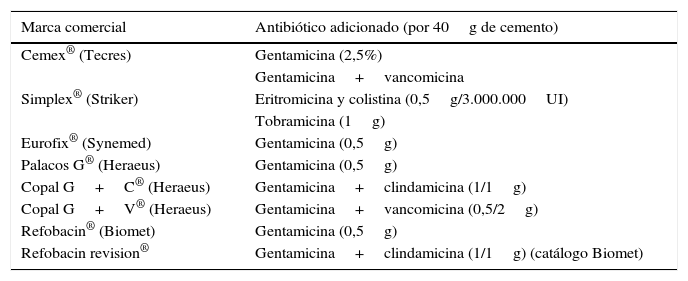
Propiedades mecánicas del cemento óseo cargado con antibióticosExiste la creencia de que la adición de antibióticos puede debilitar la estructura y las propiedades mecánicas del cemento. Los estudios realizados con Palacos-R®, CMW1, LVC® Zimmer, con y sin gentamicina, o Simplex-P® con gentamicina, eritromicina, colistina o tobramicina, no muestran efectos significativos sobre la resistencia a la fatiga en comparación con los respectivos cementos simples40,55, aunque cabe señalar que la mayoría de los estudios que demostraron una desventaja teórica del cemento mezclado con antibióticos son estudios in vitro56. La alteración de la resistencia a la compresión solo se observa con altas dosis de antibióticos, es decir, al añadir más de 1g de antibiótico por cada 40g de cemento34,40. En otros estudios se estableció un 5% de antibiótico como la cantidad óptima para mejorar la liberación manteniendo, al mismo tiempo, las propiedades mecánicas39,40. Algunas mezclas, incluso en bajas dosis, parecen alterar las propiedades mecánicas del PMMA reduciendo su resistencia39, así como los antibióticos líquidos35 (tabla 2).
Marcas comerciales de cementos cargados con antibiótico
| Marca comercial | Antibiótico adicionado (por 40g de cemento) |
|---|---|
| Cemex® (Tecres) | Gentamicina (2,5%) |
| Gentamicina+vancomicina | |
| Simplex® (Striker) | Eritromicina y colistina (0,5g/3.000.000UI) |
| Tobramicina (1g) | |
| Eurofix® (Synemed) | Gentamicina (0,5g) |
| Palacos G® (Heraeus) | Gentamicina (0,5g) |
| Copal G+C® (Heraeus) | Gentamicina+clindamicina (1/1g) |
| Copal G+V® (Heraeus) | Gentamicina+vancomicina (0,5/2g) |
| Refobacin® (Biomet) | Gentamicina (0,5g) |
| Refobacin revision® | Gentamicina+clindamicina (1/1g) (catálogo Biomet) |
Fuente: Consejo General de Colegios Oficiales de Farmacéuticos de España60.
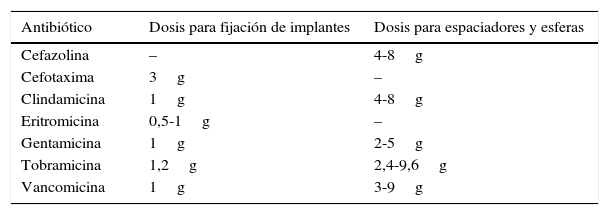
La dosificación del antibiótico varía según el uso al que se destine el cemento. En caso de infecciones agudas deben emplearse altas dosis de antibiótico, más de 2g por 40g de cemento, usualmente de 6 a 8g cada 40g, para una liberación prolongada y efectiva contra patógenos. Considerando que si el cemento mezclado con antibiótico se utiliza para la profilaxis en los primeros implantes, donde el cemento debe fijar el implante, el antibiótico se puede mezclar en dosis bajas, de 0,5 a 2g de antibiótico por cada 40g de cemento. Una dosis inadecuada puede ser vista como la causa del fallo de la prótesis y puede generar la aparición de bacterias resistentes34,40,57-59 (tabla 3).
Dosis de antibióticos utilizadas en mezclas de cemento (por cada paquete de cemento de 40g)
| Antibiótico | Dosis para fijación de implantes | Dosis para espaciadores y esferas |
|---|---|---|
| Cefazolina | – | 4-8g |
| Cefotaxima | 3g | – |
| Clindamicina | 1g | 4-8g |
| Eritromicina | 0,5-1g | – |
| Gentamicina | 1g | 2-5g |
| Tobramicina | 1,2g | 2,4-9,6g |
| Vancomicina | 1g | 3-9g |
Fuente: Consejo General de Colegios Oficiales de Farmacéuticos de España60.
Para algunos autores existen suficientes datos para pensar en el potencial desarrollo de resistencia a los antibióticos al mezclarlos con el cemento60. Kendall et al.61 observaron la supervivencia de bacterias sobre cemento mezclado con antibióticos in vitro. Hope et al.62 revisaron 91 PTC infectadas con Staphylococcus coagulasa negativo y encontraron que de los pacientes en los que se había usado cemento mezclado con antibiótico en su reconstrucción, el 88% habían desarrollado bacterias resistentes, mientras que entre los pacientes que no lo habían utilizado solo el 16% tenía bacterias resistentes. Por otra parte, también se ha dicho63 que no hay relación directa entre el desarrollo de resistencias bacterianas y el uso de cemento con antibiótico. Walker et al.64 concluyen que la eficacia del uso de cemento mezclado con antibióticos no está plenamente probada y que, por el contrario, sería la causa de la formación de biofilm y de cepas resistentes. Además, también se ha señalado que el antibiótico contenido en la interfaz cemento-hueso influye en los cultivos del líquido articular65 y de los tejidos durante la cirugía de revisión33. Es importante considerar la presencia de antibióticos en la interfaz del cemento, al evaluar el aspirado y los cultivos de tejidos para decidir si un fallo protésico es aséptico o séptico24.
Toxicidad local y sistémicaSe han señalado reacciones tóxicas locales, con particular interés para la función de osteoblastos y osteocitos, cuando se usan antibióticos en altas concentraciones, viendo que la actividad de la fosfatasa alcalina disminuyó significativamente en todos los cultivos con una concentración de gentamicina >100μg/ml66-68. Bistolfi et al.69 no encontraron reacciones toxicas sistémicas con la utilización de antibióticos en el cemento, y la mayoría de los casos recogidos como afectación orgánica están basados en los informes de insuficiencia renal aguda posterior a la implantación de espaciadores de cemento con altas dosis de antibiótico, en la cirugía de revisión protésica por infección70-72. Aeng et al.73 concluyeron que el 20% de los pacientes tratados con espaciadores con altas dosis de antibióticos desarrollaron una insuficiencia renal aguda. En la profilaxis de infecciones protésicas los aminoglucósidos son los antibióticos más utilizados, pero los estudios clínicos no han mostrado reacciones tóxicas, incluso en presencia de insuficiencia renal, cuando las dosis son bajas74. Kimmel et al.75 analizaron la incidencia de insuficiencia renal aguda en pacientes sometidos a artroplastias primarias, y al ver que el 15% de los pacientes presentaron insuficiencia renal aguda, lo relacionaron con un índice de masa corporal alto, la edad avanzada y el filtrado glomerular bajo previo a la cirugía.
Coste económico del uso de cemento cargado con antibióticosGonzález et al.76 determinaron un incremento del 134% en los costes directos cuando se presenta una infección en un reemplazo total de cadera (11.940€ de exceso de coste), pero no explican si la implantación protésica se realizó usando cemento ni tampoco el tipo de profilaxis antibiótica usada. Jiranek et al.77 calcularon que la tasa de infección periprotésica profunda necesitaría reducirse del 1,5 al 0,3% para recuperar los costes asociados con el uso rutinario de cementos cargados de antibiótico en las artroplastias primarias. Las tasas, en su estudio, están entre 0,4 y 1,3451,78,79. Cummings et al.80 estimaron un coste de un paquete de 40g de cemento con antibióticos en 365$ y el cemento sin antibiótico en 65$, de lo que resulta un coste adicional de 600$ por artroplastia total primaria de cadera. Usando, de promedio, dos paquetes de cemento con antibióticos por procedimiento y tomando en cuenta solo las revisiones por infección en PTC primaria, señalaron que el uso del cemento tenía una relación coste-efectividad incremental de 37,355$ por años de vida ajustados por calidad (quality-adjusted life years [QALY]) en comparación con el cemento sin antibióticos. Sus conclusiones fueron que el uso de cemento óseo mezclado con antibióticos en la artroplastia total primaria de cadera puede ser de valor limitado a menos que su coste se reduzca sustancialmente. En un estudio similar llevado cabo en Australia, Merollini et al.81 determinaron que la estrategia mejor desde el punto de vista de coste-efectividad sería el uso de profilaxis intravenosa combinado con el uso cemento cargado con antibióticos, con una ganancia de 32QALY y un ahorro de 123.000$ australianos (86,440€). Con estos datos es difícil establecer si se justifica utilizar cemento cargado de antibióticos en todas las cirugías de artroplastia de cadera primaria. Habría que realizar estudios prospectivos aleatorizados para valorar si esta práctica es coste-efectiva o solo aplicable a pacientes de alto riesgo.
Pacientes de alto riesgoJiranek et al.77 definieron las poblaciones de pacientes que han demostrado tener mayor tasa de infección periprotésica que la población con artroplastias en su conjunto. Establecieron la importancia de estas debido a que están en mayor riesgo de infección temprana, es decir, infección por contaminación directa en el momento de la cirugía en oposición a la propagación hematógena posterior, ya que estos grupos pueden obtener el mayor provecho del cemento óseo mezclado con antibióticos. Consideró tres tipos de pacientes de riesgo: 1)pacientes con mayor carga de contaminación, sometidos a revisión protésica (porcentaje de infección profunda del 4-8%), y pacientes cuyo tiempo quirúrgico es superior a 150min (3%); 2)pacientes con historia de infección articular (5-9%), y 3)pacientes con inmunidad disminuida: artritis reumatoide (2-8%), diabetes mellitus (3-7%), trasplante de órgano previo (5-19%), uso previo de esteroides articulares, malnutrición (<1.500linfocitos/cc, albúmina sérica <35g/l), obesidad (6% en IMC>30) y hemofilia (10-13%).
Para algunos autores la edad >80años es un factor de riesgo para infección de artroplastias de cadera. En un estudio prospectivo, García-Álvarez et al.82 determinaron el perfil inmunológico de pacientes con una edad promedio de 83años a los que se implantaron 25PTC y 69 hemiartroplastias de cadera cementadas, sin especificar el tipo de cemento usado. Registraron solo un caso de infección periprotésica y consideraron como factor de riesgo para la infección de la herida quirúrgica el porcentaje de leucocitos que disminuyen con la edad. Para estos autores, la IgE y el porcentaje de CD19 pueden servir como indicadores de un mayor riesgo de desarrollar una infección de la herida postoperatoria.
Los pacientes fumadores tienen un riesgo de infección aumentado con respecto a los no fumadores sometidos a artroplastias totales83. Dejar de fumar antes de la cirugía reduce el riesgo de complicaciones postoperatorias, así como el de infección de la herida quirúrgica84. La mayoría de los informes sugieren dejar de fumar entre 4 y 8semanas antes de la cirugía85-89. En pacientes con anemia preoperatoria la incidencia de infección es del 4,3%, frente a menos del 2% en pacientes con cifras de Hb>12g/dl en mujeres y >13g/dl en varones90,91. Estos pacientes tienen más riesgo de recibir transfusiones posoperatorias, las cuales se relacionan con un aumento en la incidencia de infección periprotésica92. Los pacientes con historia de consumo de alcohol tienen un riesgo aumentado de infección de la herida quirúrgica, además de una alteración del sistema inmune y alteraciones psicológicas93,94. Tønnesen et al.94 señalaron que el cese de consumo de alcohol 4semanas antes de la cirugía redujo significativamente la morbilidad postoperatoria en los altos consumidores de alcohol, sin que se haya demostrado que el cese del consumo disminuya la incidencia de infecciones periprotésicas. Muchos de estos factores son modificables, y con una intervención médica previa podrían evitar o disminuir la tasa de infecciones protésica. En aquellos en los que no podemos intervenir habría que valorar si el uso de cemento con antibióticos para la implantación de una PTC o una hemiartroplastia de cadera nos aportaría mayores beneficios que riesgos.
ConclusiónSobre la base de los datos disponibles, parece razonable sugerir que el uso del cemento óseo mezclado con antibióticos debe considerarse un método de profilaxis para ciertos pacientes de alto riesgo sometidos a artroplastia de cadera; cuando el tiempo quirúrgico sea superior a 150min, con historia de infección articular, artritis reumatoide, diabetes mellitus, trasplante de órgano previo, uso previo de esteroides articulares, recuento de linfocitos <1.500/cc, albúmina sérica <35g/l, IMC>30, hemofilia y en los que se haya realizado alotransfusión hemática reciente o se prevea inevitable. Desde nuestro punto de vista se debe valorar el riesgo-beneficio individual en el momento de indicar el uso del cemento cargado con antibióticos en la profilaxis de prótesis de cadera. Es aconsejable realizar estudios prospectivos y aleatorizados para determinar la eficacia clínica del cemento cargado con antibióticos para profilaxis en prótesis de cadera.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.