Entre los diferentes mecanismos biológicos que justifican los efectos analgésicos de la acupuntura, el del sistema purinérgico está tomando especial interés en los últimos años y, en concreto, por la activación de los receptores de adenosina tipo A1. En diferentes modelos experimentales en animales y en humanos se ha mostrado que la activación de los receptores A1 tiene efectos analgésicos. Además, la acupuntura es capaz de provocar la elevación local de la concentración de purinas en el punto de inserción de la aguja. Los valores de adenosina dependen de la formación a partir del ATP (trifosfato de adenosina) y de su degradación, ambos procesos regulados por reacciones enzimáticas. Mediante la manipulación farmacológica del metabolismo de la adenosina o de sustancias agonistas se podrían incrementar los efectos analgésicos de la acupuntura. Una de las posibilidades exploradas es la inyección local en un punto de acupuntura de la ectonucleotidasa PAP (fosfatasa ácida prostática), que degrada el AMP (monofosfato de adenosina) a adenosina aumentando su concentración y potenciando el efecto antinociceptivo. Se ha llegado a acuñar el término “acupuntura PAP” para referirse a esta manipulación. El conocimiento profundo del metabolismo de los neurotransmisores implicados en la modulación del dolor a través de la acupuntura no solo puede lograr proporcionar más eficacia, sino que constituye un bello ejemplo de fusión entre las disciplinas médicas oriental y occidental.
Among the different biological mechanisms proposed to be involved in the acupuncture-mediated analgesia, the relevance of the purinergic system is growing over the last years, especially by activation of the A1 adenosine receptors. In different experimental models, both in humans or in animals, the activation of these receptors produces analgesia. The insertion of an acupuncture needle in an acupuncture point promotes the local elevation of purines. Adenosine are synthesized from ATP and degraded by mean of several enzymes. Through the pharmacological manipulation of these enzymatic reactions, the concentration of adenosine could be enhanced and the therapeutic potential of the acupuncture improved. One of such attempts was coined with the term “PAPupuncture”. PAPupuncture is the local injection in an acupuncture point of the prostatic acid phosphatase (PAP), an ectonucleotidase which hydrolyzes extracellular AMP to adenosine. PAPupuncture has shown to highly enhance the antinociceptive effects of acupuncture. The knowledge of the biological processes implicated in the modulation of pain could increase de analgesic potential of the acupuncture and could not only increase efficacy, but is also a fine example of a collaboration bridge between Oriental and Western medicines.
Los mecanismos biológicos de la principal acción canónica de la acupuntura —la analgesia— son numerosos y la investigación ofrece, cada vez más, nuevas perspectivas. El conocimiento profundo de cuáles son esas vías, de la bioquímica y farmacología subyacentes es, por un lado, necesario para el reconocimiento definitivo de la ciencia, pero además puede permitir modular los efectos de la terapia haciéndola más eficaz en su efecto y más duradera en el tiempo, mediante la manipulación de las reacciones enzimáticas de generación y degradación de los metabolitos activos.
Se han descrito muchos mediadores biológicos implicados en la analgesia acupuntural, de los cuales el sistema más involucrado clásicamente sigue siendo el de los opiáceos endógenos1. Retomaremos otro, el purinérgico, ya que en la actualidad se están haciendo muchos avances en su conocimiento.
El concepto de señalización purinérgica se remonta a principios de la década de los setenta del pasado siglo2, pero hasta ya entrado el presente siglo no se ha demostrado que el trifosfato de adenosina (ATP) actúa como cotransmisor tanto en el sistema nervioso central como en el periférico. Los receptores purinérgicos se describieron por primera vez en 19763 y poco más tarde se identificaron los 2 tipos principales (denominados P1 y P2) que tienen como agonistas naturales la adenosina y el ATP/difosfato de adenosina (ADP) (para una detallada descripción se remite el lector a las revisiones de Burnstock de 20074 y 20165). Los receptores se adenosina están formados por varios subtipos denominados A1, A2A, A2B y A3 y pueden formar estructuras de varias subunidades de un solo tipo (homómeros) o combinaciones de varios (heterómeros). Más recientemente, Fredholm et al6 han revisado la composición de estos receptores. La expresión de estos receptores está muy extendida en prácticamente todos los tejidos corporales4.
La participación de los receptores purinérgicos P2, activados por ATP en la analgesia acupuntural, se ha estudiado muy extensamente extensamente (Burnstock, 20097; Tang et al., 20168), y la relación con los activados por adenosina (P1) es más reciente. En una de las últimas grandes contribuciones al conocimiento de las bases científicas de la acupuntura, Goldman et al9 establecieron en 2010 la clara relación entre la estimulación de un punto de acupuntura y la activación del subtipo de receptor de adenosina de tipo 1 (Pérez Samartín, 201010).
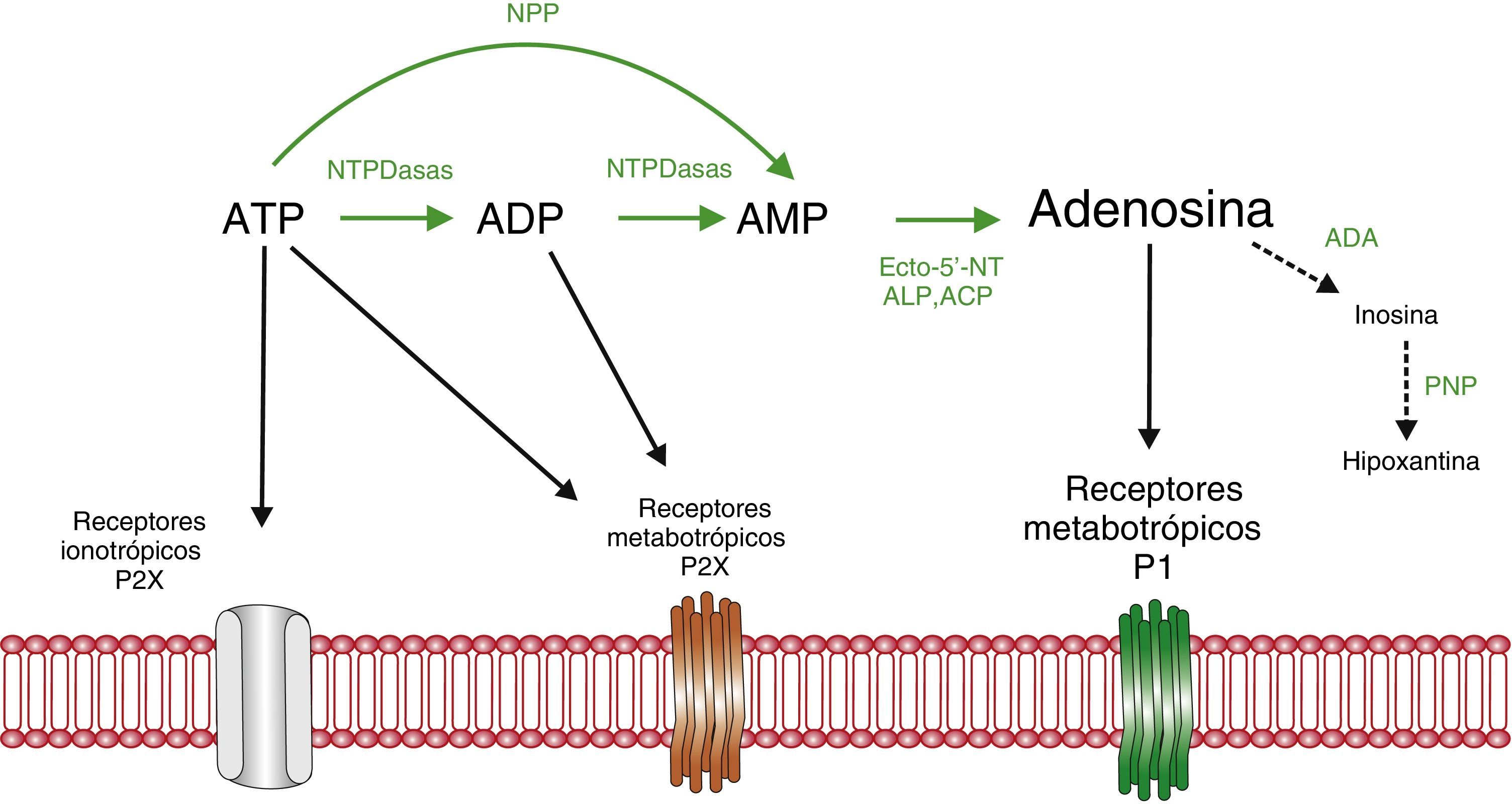
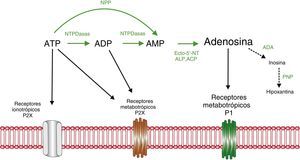
La adenosina es una purina sintetizada en el cuerpo a partir de varios aminoácidos o del monofosfato de adenosina (AMP). Está implicado en importantes procesos celulares energéticos, transducción de señales intracelulares o neuromodulador. En la figura 1 se resume su metabolismo11.
Resumen del metabolismo del trifosfato de adenosina (ATP) y nucleótidos relacionados. El ATP se degrada por ectonucleotidasas (que provocan hidrólisis) y ectoquinasas (que provocan fosforilación) hasta dar lugar a la adenosina. Existen 4 familias principales de ectonucleotidasas: las difosfohidrolasas del nucleósido trifosfato (NTPDasas), las pirofosfatasas/fosfodiesterasas de nucleótidos (PNP), la fosfatasa acalina (ALP) y la fosfatasa ácida (ACP) y las ecto-5’-nucleotidasas (CD73). A su vez, la adenosina se convierte en inosina a través de la enzima adenosina deaminasa (ADA) y esta en hipoxantina por la acción de la fosforilasa de nucleósidos de purina (PNP). ADP: difosfato de adenosina; AMP: monofosfato de adenosina. Modificado de Burnstock y Verkhratsky (2012)11.
La adenosina ha sido utilizada en clínica como agente antiarrítmico y vasodilatador, pero también se ha involucrado en el dolor. Hay numerosas aportaciones en la literatura científica sobre el uso clínico de purinas (adenosina y ATP) y fármacos generados para provocar analgesia.
De los diferentes subtipos de receptores de adenosina, los A1 se encuentran en muchas regiones del sistema nervioso relacionadas fundamentalmente con el procesamiento del dolor (sustancia gelatinosa de la médula espinal, sustancia gris periacueductal, tronco cerebral, etc.). Los receptores de adenosina tipo A2A se expresan probablemente en los ganglios de las raíces dorsales espinales y en otras regiones nerviosas no tan directamente implicadas en el procesamiento del dolor (estriado, corteza somatosensorial, amígdala, tálamo e hipotálamo). Los receptores de adenosina de los tipos A2B y A3 no están tan directamente implicados en la nocicepción, sino que tienen efectos complejos en situaciones patológicas como la inflamación y la respuesta inmune (para una extensa revisión, véase Sawynok, 201312).
La aplicación de adenosina tiene, por un lado, acciones dispares como la de provocar dolor por sensibilización de aferentes nociceptivos (Bleehen y Keele, 197713), pero, por otro lado, también presenta la capacidad de inhibir la vía de dolor en la médula espinal y en el cerebro (Sawynok y Sweeney, 198914). Este efecto aparentemente contradictorio parece deberse a la dosis de adenosina utilizada en el experimento. A altas dosis provoca dolor, mientras que a bajas dosis su efecto es analgésico. Las distintas subunidades de receptores de adenosina tienen diferentes afinidades. Los receptores de adenosina P2 tienen baja afinidad, por lo que necesitan altas dosis de adenosina para activarse14, mientras que, al tener mayor afinidad, los P1 se activan con dosis más bajas (Reeve y Dickenson, 199515).
El uso de la adenosina o de fármacos que activen estos mismos receptores (agonistas) también se ha ensayado en clínica. Los primeros intentos de activación de receptores A1R mediante adenosina o sus agonistas para tratar diferentes modalidades de dolor no han llevado a conclusiones claras. A ello se suman los numerosos efectos secundarios cardiocirculatorios, respiratorios y otras acciones sobre el sistema nervioso que presenta la activación de los receptores de adenosina. Las estrategias se centran actualmente en el desarrollo de agonistas parciales como el MCPA (8-metilamino-N(6)ciclopentiladenosina) o el 2’dCPA (2’deoxirribosa-N6-ciclopentil-adenosina), moduladores alostéricos positivos como TRR469 o agonistas A1R altamente selectivos como el 5′-cloro-5′-deoxi-(±)-ENBA, que posee una altísima especificidad por los receptores A1R y no interactúa sobre los demás (Franchetti et al., 200916). En el artículo de Sawynok de 2016 se hace una revisión detallada17.
Asimismo, Goldman et al9 estudiaron la relación entre la adenosina y el dolor y comprobaron que la inserción de una aguja en el punto de acupuntura Zusanli (E 36) provoca efectos antiinflamatorios y antinociceptivos en modelos experimentales de dolor en ratones. Este grupo, y previamente otros (Johansson et al18, 2001; Wu et al., 200519), ya habían comprobado que en ratones genéticamente manipulados (knockout), que no expresan el receptor P1, se bloquea el efecto analgésico provocado por la adenosina.
3La adenosina en los puntos de acupunturaComo otros neurotransmisores, el ATP se puede liberar a través de vesículas de células nerviosas. También se conoce que las células dañadas o que están en proceso de muerte pueden igualmente liberar ATP. Pero no solo en estas situaciones patológicas, sino que fisiológicamente también las células de diferentes tejidos pueden liberar ATP (p. ej., por la deformación o estiramiento de tejidos5) pudiendo, de estar manera, ser una fuente indirecta de adenosina en un punto de acupuntura.
La propia inserción de una aguja en un punto de acupuntura es capaz de producir una elevación local de ATP. Langevin et al20 demostraron que la inserción y rotación de una aguja modifica las propiedades morfológicas y bioquímicas de los fibroblastos del tejido conjuntivo. Esto tiene como consecuencia la liberación de ATP a los tejidos cercanos al lugar de inserción, llegando a valores significativamente elevados que se mantiene más de 20min (Langevin et al., 201321). Durante ese intervalo de tiempo, el neurotransmisor puede actuar directamente activando sus receptores (P2) o bien los P1 a través de la generación de adenosina. También se ha demostrado que la actividad nerviosa de los axones situados en el entorno de la aguja puede ser responsable de la liberación local de ATP (Fields y Ni, 201022).
Los experimentos de Goldman et al9 muestran que la inserción de una aguja de acupuntura en el punto Zusanli (E 36) en ratones provoca el aumento local de la concentración de adenosina y de los subproductos metabólicos relacionados (fig. 1), determinado con la técnica analítica de microdiálisis9. Resulta especialmente interesante el hecho de que en el mismo tipo de experimentos realizados en humanos se encuentra que los valores de adenosina en Zusanli (E 36) se mantienen 30min después de la aplicación de la acupuntura y que ello solo tienen lugar si la aguja se manipula mediante rotaciones y no por el simple hecho de tener una aguja insertada en un tejido (Takano et al., 201223). El hallazgo es específicamente derivado de la acupuntura, ya que la correcta inserción y manipulación de una aguja en Zusanli (E 36) en una pierna no afecta a los valores de adenosina en el mismo punto contralateral; de la misma forma que la estimulación de un punto no acupuntural cercano tampoco provoca elevaciones de adenosina en el punto Zusanli (E 36) ipsilateral.
4La acupuntura PAPComo se apuntaba al comienzo de esta breve revisión, en virtud de la hipótesis de la implicación de la adenosina en la acupuntura, toda manipulación farmacológica que lleve a un incremento de los valores de adenosina o del bloqueo de su degradación debería contribuir a aumentar sus efectos antinociceptivos. Así, tal y como demostró el grupo de Goldman et al9, la inyección en Zunsali (E 36) de agonistas de los receptores A1 tiene unos claros efectos analgésicos que duran varias horas. En un comentario a ese mismo artículo, Zylka24 ya adelantaba la posibilidad de aumentar los valores de adenosina para incrementar la analgesia. Para ello se establecen 3 estrategias: aumentar los valores de precursores de la adenosina y de sus enzimas de transformación; inyectar directamente adenosina en los puntos de acupuntura o reducir la degradación enzimática de la adenosina en el punto de acupuntura, o su secuestro por transportadores específicos. De estas 3 posibilidades, la que parece ser más eficaz es la de la inyección de ectonucleotidasas directamente en el punto de acupuntura, ya que sus efectos duran días en comparación con las pocas horas del resto de posibilidades25.
En un interesante artículo, Hurt y Zylka26 analizaron la manipulación farmacológica del punto de acupuntura Weizhong (V 40). En primer lugar comprobaron que el efecto antinociceptivo de este punto se debe a la activación de receptores de adenosina tipo 1 (A1R) mediante la inyección del agonista N6-ciclopentaadenosina (CPA). En ratones “salvajes” (wild type), que expresan A1R se produce un efecto de reducción de dolor en el test de placa caliente que dura 2 horas. Este efecto desaparece en los ratones que no expresan A1R (ratones knockout).
La ectonucleotidasa fosfatasa ácida prostática (PAP) que hidroliza el AMP a adenosina se localiza en neuronas sensoriales. La aplicación sistémica de esta u otras ectonucleotidasas muestra un claro efecto antinociceptivo al incrementar los valores de adenosina (Street et al., 201127; Zylka, 201125). La inyección directa de PAP en Weizhong (V 40) provoca un aumento de la analgesia de 100 veces respecto a la que se logra aplicando solamente acupuntura y sus efectos se mantienen hasta 6 días. Esto ha llevado a acuñar el término “acupuntura PAP” (Hurt y Zylka, 201226; Sawynok, 201617). La utilización clínica rutinaria de esta técnica podría aportar efectos beneficiosos, al permitir reducir el uso de analgésicos de tipo opiáceo con los efectos secundarios que ello conlleva. Finalmente, este estudio y su aplicación son un nuevo ejemplo de simbiosis entre las medicinas occidental y oriental encaminadas al mantenimiento de la salud.
5ConclusiónNo existe un único mecanismo de acción de la acupuntura y son numerosas las rutas metabólicas implicadas. En cada una de ellas existe un preciso sistema de producción y degradación de principios activos mediante reacciones enzimáticas. En el presente trabajo se hace especial referencia al sistema de señalización purinérgico mediado por adenosina. Al igual que en este neurotransmisor, en muchos otros existen herramientas de manipulación de estas reacciones para potenciar el efecto de la acupuntura y convertirla en una herramienta todavía más eficaz con el objetivo de mejorar el estado de salud.
6Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.