El consumo de hongos silvestres se ha incrementado en los últimos años; sin embargo, no todos son comestibles y algunos son causantes de varios tipos de envenenamiento. Por esto es necesario realizar estudios que aporten información de su toxicidad. Artemia franciscana es un crustáceo que se emplea en ensayos de toxicidad con una gran aplicación en la detección de toxinas fúngicas.
ObjetivosDeterminar el porcentaje de inhibición de la eclosión y mortalidad de quistes de A. franciscana producidos por extractos de hongos de la división Basidiomycota.
MétodosSe prepararon extractos acuosos de basidiomas de 15 especies de basidiomicetos recolectados en Jalisco (México) y se probó el efecto de diferentes concentraciones sobre quistes de A. franciscana. Se utilizaron dicromato de potasio y agua de mar como controles positivo y negativo, respectivamente. Se determinaron los porcentajes de inhibición de la eclosión y de la mortalidad de los quistes de A. franciscana.
ResultadosTrece de las 15 especies estudiadas afectaron en más del 80% la eclosión de los quistes de A. franciscana en todas las concentraciones probadas; en contraste, el dicromato de potasio inhibió la eclosión en menos del 50%. El mayor porcentaje de mortalidad en los quistes fue causado por los extractos acuosos de Amanita virosa, Leucopaxillus amarus y Tylopilus violatinctus, y el menor lo produjo el extracto de Macrolepiota mastoidea.
ConclusionesEl ensayo con A. franciscana demostró ser eficaz en la evaluación de la toxicidad de los hongos, con la excepción de Scleroderma texense, que se considera venenoso, y que no resultó tóxico para este crustáceo.
The consumption of wild mushrooms has increased in recent years. However, not all mushrooms are edible and some of them may cause poisoning. Therefore, their toxicity needs to be studied. Artemia franciscana is a crustacean used in toxicity tests including toxins of fungi.
AimsTo determine the percentage of inhibition and mortality produced by extracts of several basidiomycetes on the hatching of A. franciscana cysts.
MethodsAqueous extracts were prepared from 15 species of mushrooms collected from Jalisco state, Mexico. Different concentrations of the extracts were assayed in order to test their toxicity. Potassium dichromate and artificial seawater were the positive and negative controls, respectively. The percentages of hatching and mortality of the cysts were evaluated.
ResultsInhibition of hatching greater than 80% in all the concentrations tested was found in 13 of the 15 species studied, in contrast to the positive control, which inhibited cyst hatching less than 50% in all cases. The highest percentage of mortality in the cysts was caused by the aqueous extracts of Amanita virosa, Leucopaxillus amarus, and Tylopilus violatinctus, and the lowest by Macrolepiota mastoidea.
ConclusionsThe brine shrimp bioassay appeared to be useful in the evaluation of the toxicity of several basidiomycetes, with the exception of Scleroderma texense, a mushroom considered poisonous, which showed no toxicity over A. franciscana.
El interés por el consumo de hongos silvestres se ha incrementado en los últimos años por su faceta culinaria, sus propiedades antitumorales, antioxidantes, antibióticas y antidiabéticas, y por su gran potencial como fuente de metabolitos secundarios y enzimas16,32,40. Existen diversos mitos en torno al conocimiento de la toxicidad de los hongos, lo que ha provocado que los métodos que se utilizan para discriminar los hongos tóxicos de los comestibles sean empíricos y variables. Guzmán13 indicó que deben dejarse ciertas costumbres para conocer si un hongo es comestible o venenoso, como hervirlo con una moneda de plata o un ajo y determinar su toxicidad en función del color que adquieren estos últimos, y considerar que si se ennegrecen los hongos son venenosos. Asimismo, existen creencias erróneas de que los hongos que coagulan la leche son venenosos o que si están mordisqueados por algún mamífero son comestibles22.
Al mismo tiempo se desconocen las propiedades de muchos macromicetos porque la mayoría de los estudios al respecto se enfocan hacia las especies más abundantes o hacia aquellas relacionadas con algún caso de intoxicación. Por otro lado, algunas especies consideradas comestibles y con un uso gastronómico muy extendido, como Tricholoma flavovirens (Pers.) S. Lundell y Boletus edulis Bull., provocan rabdomiolisis en ratones, incluso efectos cardiotóxicos y hepatotóxicos en el caso de T. flavovirens24,25. Asimismo, dentro de la clasificación tradicional de los macromicetos existen algunos considerados no comestibles por su aspecto y sabor, sin tener en realidad datos sobre su toxicidad. Por todo lo anterior es necesario realizar estudios para recabar información sobre la toxicidad de los hongos.
Artemia franciscana es un crustáceo útil como organismo modelo para pruebas de toxicidad31, valoración de extractos de plantas6,27, de productos naturales marinos3 y de compuestos químicos como el dióxido de cloro29. Asimismo, es un organismo eficiente en la detección de micotoxinas9,10,37, por lo que se ha utilizado con ciertos hongos para este fin15,33,39. Además, A. franciscana tiene una baja variabilidad genética, un ciclo de vida corto y una buena adaptabilidad a diferentes condiciones abióticas y fuentes nutricionales. La disponibilidad de quistes y organismos a bajo coste es continua28, y en los ensayos los resultados muestran correlación con los de otros organismos modelo, como son los embriones de pollo. Por último, los experimentos de toxicidad con Artemia son de bajo coste14.
A partir de la utilidad de A. franciscana como modelo para la evaluación de la toxicidad y la necesidad de estudios para obtener información de la toxicidad de los hongos, en el presente trabajo se determinó en quistes de este crustáceo el porcentaje de inhibición y mortalidad producidos por extractos de algunos hongos de la división Basidiomycota.
Materiales y métodosRecolección de muestras de material fúngico en el campoSe recolectaron hongos macroscópicos en bosques templados en el estado de Jalisco (México). Se registraron los datos morfológicos en fresco para posteriormente ser deshidratados. Para la realización de los extractos se utilizaron 10g en peso seco. Además, se incorporó una muestra representativa al Herbario IBUG de la Universidad de Guadalajara (Jalisco). La identificación de los ejemplares se llevó a cabo mediante la consulta de literatura especializada en la caracterización macro- y micromorfológica18,19,38. La clasificación de los hongos en comestibles, no comestibles, venenosos y venenosos mortales se obtuvo de Guzmán11,12, Ge et al.8 y de Singer34 (tabla 1).
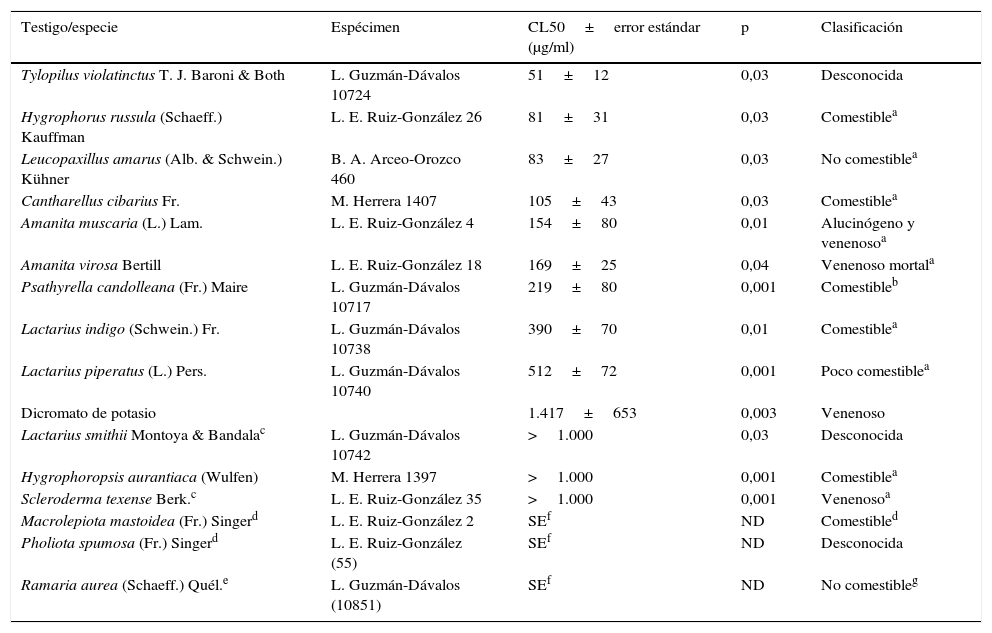
Concentración letal media (CL50±error estándar), valor p de la relación entre las variables concentración del extracto acuoso de los macromicetos y mortalidad de los quistes de Artemia franciscana, y clasificación tradicional de los hongos para consumo humano
| Testigo/especie | Espécimen | CL50±error estándar (μg/ml) | p | Clasificación |
|---|---|---|---|---|
| Tylopilus violatinctus T. J. Baroni & Both | L. Guzmán-Dávalos 10724 | 51±12 | 0,03 | Desconocida |
| Hygrophorus russula (Schaeff.) Kauffman | L. E. Ruiz-González 26 | 81±31 | 0,03 | Comestiblea |
| Leucopaxillus amarus (Alb. & Schwein.) Kühner | B. A. Arceo-Orozco 460 | 83±27 | 0,03 | No comestiblea |
| Cantharellus cibarius Fr. | M. Herrera 1407 | 105±43 | 0,03 | Comestiblea |
| Amanita muscaria (L.) Lam. | L. E. Ruiz-González 4 | 154±80 | 0,01 | Alucinógeno y venenosoa |
| Amanita virosa Bertill | L. E. Ruiz-González 18 | 169±25 | 0,04 | Venenoso mortala |
| Psathyrella candolleana (Fr.) Maire | L. Guzmán-Dávalos 10717 | 219±80 | 0,001 | Comestibleb |
| Lactarius indigo (Schwein.) Fr. | L. Guzmán-Dávalos 10738 | 390±70 | 0,01 | Comestiblea |
| Lactarius piperatus (L.) Pers. | L. Guzmán-Dávalos 10740 | 512±72 | 0,001 | Poco comestiblea |
| Dicromato de potasio | 1.417±653 | 0,003 | Venenoso | |
| Lactarius smithii Montoya & Bandalac | L. Guzmán-Dávalos 10742 | >1.000 | 0,03 | Desconocida |
| Hygrophoropsis aurantiaca (Wulfen) | M. Herrera 1397 | >1.000 | 0,001 | Comestiblea |
| Scleroderma texense Berk.c | L. E. Ruiz-González 35 | >1.000 | 0,001 | Venenosoa |
| Macrolepiota mastoidea (Fr.) Singerd | L. E. Ruiz-González 2 | SEf | ND | Comestibled |
| Pholiota spumosa (Fr.) Singerd | L. E. Ruiz-González (55) | SEf | ND | Desconocida |
| Ramaria aurea (Schaeff.) Quél.e | L. Guzmán-Dávalos (10851) | SEf | ND | No comestibleg |
Los datos del espécimen corresponden al nombre del recolector y a su número de recolecta. Todos los especímenes están depositados en el Herbario IBUG de la Universidad de Guadalajara, Jalisco (México).
Se realizaron extractos acuosos (EA) con la metodología de Vega-Villasante et al.39, que consiste en secar, moler y mezclar con agua de mar artificial (40 unidades prácticas de salinidad) una cantidad de 100mg de hongo seco por cada mililitro, calentar a 80¿C durante 15min y dejar enfriar a temperatura ambiente. La mezcla se centrifugó a 1.500g durante 5min, se recuperó el sobrenadante y se almacenó en frascos color ámbar. A partir del sobrenadante, en concentración de 100mg/ml, se realizaron las diluciones en agua de mar artificial con el fin de obtener concentraciones de 1.000, 500, 250, 100, 50 y 25μg/ml. Se utilizaron hongos secos para preparar los extractos por varias razones: 1) con el fin de que los resultados sean comparables a los de trabajos previos, ya que en ellos se utilizó material deshidratado; 2) en los hongos estudiados previamente la toxicidad se conserva después de varios años de almacenamiento23, y 3) por cuestiones logísticas en el momento de preparar los extractos.
Bioensayo de inhibición de la eclosión de quistes de Artemia franciscanaSe colocaron 40 quistes de A. franciscana (INVE®, Salt Lake City, Utah, Estados Unidos) por tubo de ensayo; con este tamaño de muestra el promedio de eclosión fue constante de acuerdo con los resultados de un experimento piloto. A cada tubo se le agregaron 5ml de EA o de dicromato de potasio (DP) a las concentraciones antes mencionadas y, a un último tubo, agua de mar artificial como control negativo. Después de 48h de exposición con iluminación constante se contaron de forma visual (con ayuda de un microscopio óptico con un aumento de 20×) los organismos que eclosionaron. Se consideraron eclosionados aquellos que alcanzaron el estadio nauplial y los que se encontraban en el estadio de umbrella (el embrión ha salido del quiste pero no se ha separado completamente de él, lo que le confiere aspecto de paraguas)35. Posteriormente se realizó el lavado de los quistes en el tubo con agua de mar artificial; con los quistes sedimentados en el fondo del tubo se decantó la mayor cantidad de líquido posible. Este proceso se repitió tres veces con el fin de llevar la concentración de los residuos del extracto a niveles mínimos. Se añadieron 5ml de agua de mar artificial a los tubos y se contaron de nuevo tras 48h los organismos que eclosionaron. El bioensayo se realizó por triplicado, con un control negativo por cada réplica, en tubos de ensayo con el mismo número de quistes y volumen con agua de mar artificial. También se realizó un bioensayo con diferentes concentraciones de DP como control positivo.
Se realizó un lavado final de los quistes llenando el tubo con agua de mar artificial; nuevamente, con los quistes en el fondo se decantó la mayor cantidad de líquido posible.
Debido a que no todos los quistes suelen eclosionar, el número de organismos que eclosionaron en el control negativo, cuyo promedio se mantuvo constante, se tomó como el 100% de eclosión para cada réplica en todos los bioensayos, y en base a ello se efectuaron los cálculos correspondientes del porcentaje de inhibición de la eclosión.
Análisis estadísticoLos cálculos de la concentración letal media (CL50) y el error estándar se realizaron con el método de Miller y Tainter descrito por Randhawa30. La evaluación de la correlación entre mortalidad y concentración se calculó con el coeficiente de correlación r2 y la significación del mismo se hizo con la prueba de t de Student41. Para el presente trabajo se consideró un nivel de significación estadística α menor o igual al 5%.
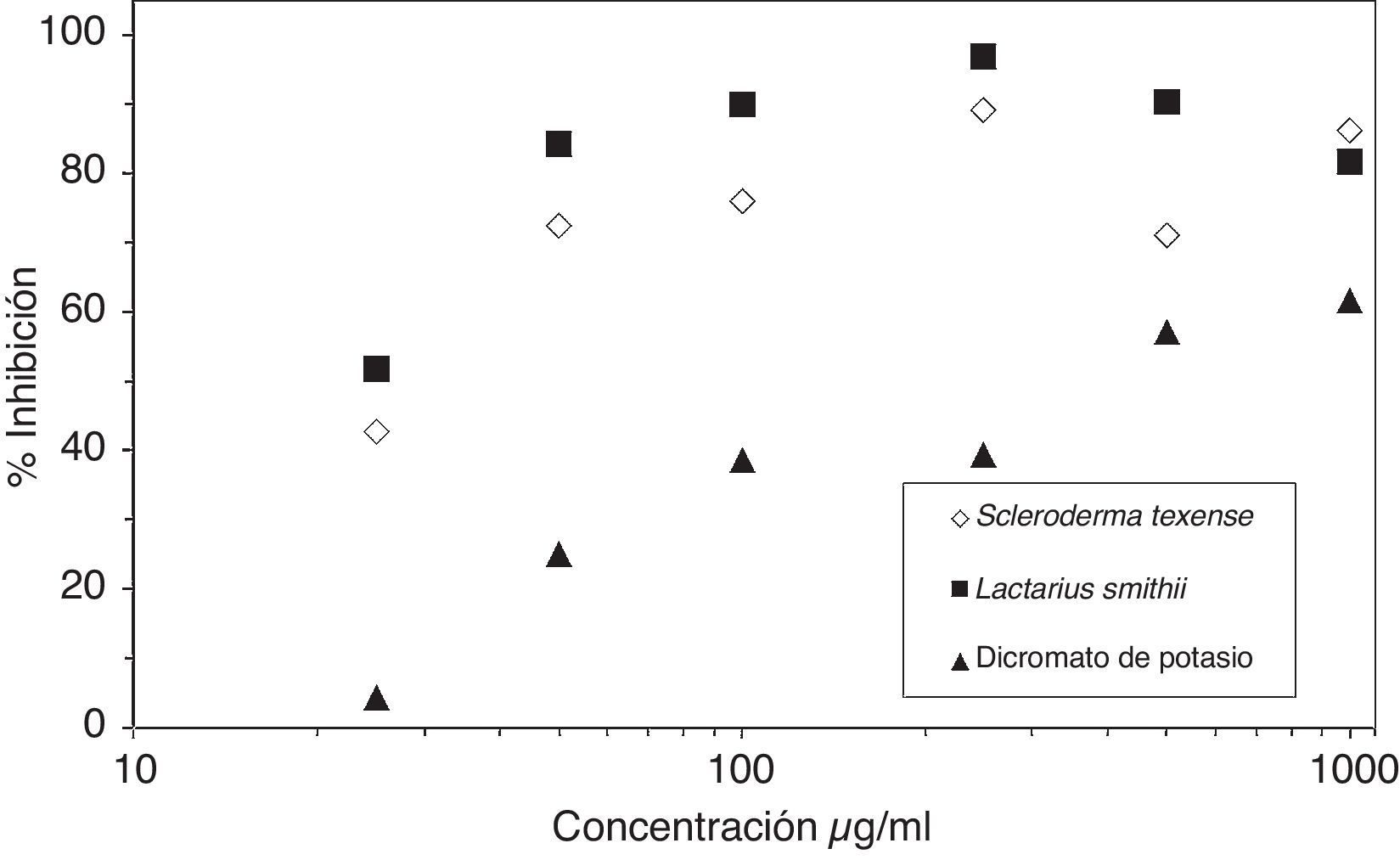
ResultadosInhibiciónLa inhibición de la eclosión con el DP aumentó gradualmente con la concentración de este compuesto control (fig. 1). Los EA de Ramaria aurea y Pholiota spumosa no presentaron efecto alguno sobre los quistes de Artemia; con el EA de Lactarius smithii la inhibición de la eclosión se incrementó gradualmente con la concentración del EA hasta que a 250 μg/ml la inhibición fue del 100% (fig. 1). Con Scleroderma texense la inhibición de la eclosión fue directamente proporcional a la concentración del extracto; sin embargo, hasta la concentración más alta probada de 1.000μg/ml no presentó una inhibición del 100% (fig. 1). Para el resto de los extractos la inhibición de la eclosión de los quistes resultó muy cercana al 100% desde la concentración más baja estudiada, de 25μg/ml.
MortalidadEn la tabla 1 se muestra la CL50 de los EA estudiados sobre los quistes de A. franciscana, la significación de la correlación entre el porcentaje de mortalidad y la concentración del EA, y las propiedades conocidas de los hongos. Tylopilus violatinctus presentó la toxicidad más alta de las 15 especies estudiadas, con una CL50 de 51μg/ml, seguido por Hygrophorus russula, Leucopaxillus amarus, Cantharellus cibarius, Amanita muscaria, Amanita virosa, Psathyrella candolleana, Lactarius indigo y Lactarius piperatus. Con los EA de Lactarius smithii, Hygrophoropsis aurantiaca y Scleroderma texense se observó correlación entre la concentración y la mortalidad; sin embargo, esta última fue muy baja y no permitió un cálculo preciso de las CL50; como el error estándar era mayor que las CL50, se presentan los valores como superiores a 1.000μg/ml. Finalmente, los EA de Macrolepiota mastoidea, Pholiota spumosa y Ramaria aurea no provocaron efecto alguno sobre los quistes; en caso de llegar a tener algún efecto este tendría lugar, probablemente, a concentraciones de los extractos muy superiores a 1.000μg/ml.
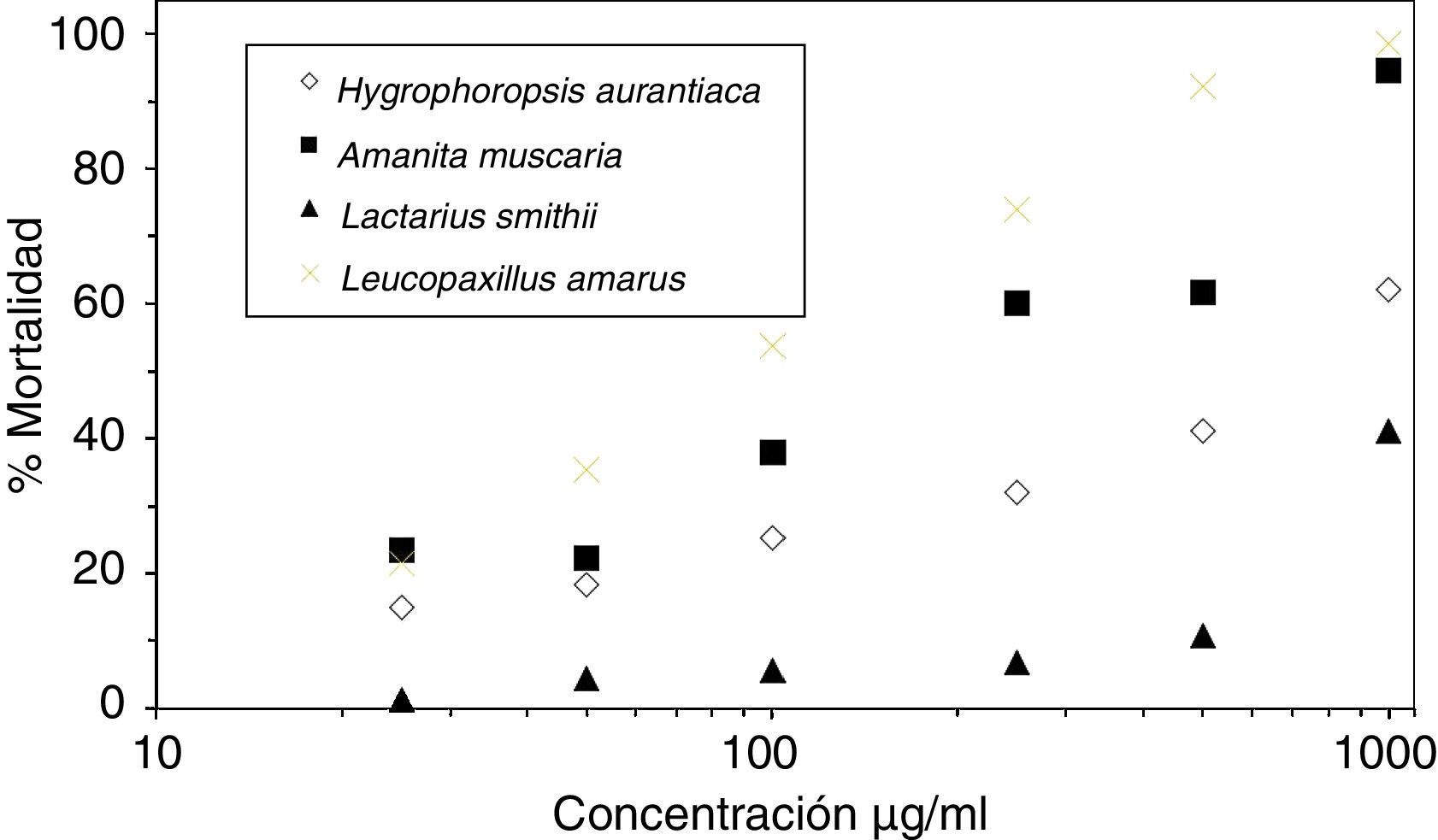
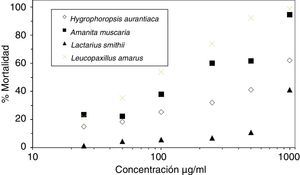
En los bioensayos la concentración del EA presentó, en todos los casos, una correlación positiva con la mortalidad de los quistes (tabla 1). En la figura 2 se muestra la cinética de la mortalidad relacionada con la concentración del EA para Amanita muscaria, Hygrophoropsis aurantiaca, Lactarius smithii y Leucopaxillus amarus. En todos ellos se observa esta correlación entre la mortalidad y la concentración del extracto.
DiscusiónLa luz, el oxígeno disuelto en el medio, la salinidad y la temperatura pueden afectar de diferente manera la eclosión de los quistes de A. franciscana35. En este ensayo se utilizó una iluminación constante durante el tiempo de exposición de los quistes a los extractos. No se proporcionó aeración constante, pero esta no pareció afectar la eclosión, que fue del 100% en todos los controles negativos. La salinidad fue constante, con un valor de 40 unidades prácticas de salinidad, considerada óptima para el desarrollo de A. franciscana36. Los bioensayos se realizaron a una temperatura ambiente de 24 a 30¿C, que favorece la eclosión de los quistes; de acuerdo con Sorgeloos et al.35, los quistes eclosionan en un rango de 4 a 32¿C, y la eclosión es más rápida cuanto más alta es la temperatura. Por todo ello podemos asegurar que los resultados obtenidos reflejan únicamente los efectos provocados por las sustancias presentes en los EA de los hongos estudiados.
En este trabajo solo se utilizaron extractos acuosos y no alcohólicos debido a que estos últimos deben ser mezclados con el agua de mar con ayuda de Tween 80 al 5%26, que permite la emulsión de las moléculas no polares en un medio polar. A través de un experimento piloto en el que se utilizaron concentraciones de 5, 3, 1 y 0,5% de Tween 80 se observó que este afectó la viabilidad de los quistes de A. franciscana.
La mayoría de los EA usados en este estudio provocaron una inhibición de la eclosión de los quistes superior al 80%. Estos resultados son similares a los reportados para los extractos acuosos de Psilocybe cubensis, que inhibieron totalmente la eclosión en las concentraciones probadas39. El quiste de A. franciscana es una estructura de resistencia del embrión en etapa de gastrulación y estado ametabólico, desovado por las hembras cuando las condiciones no son adecuadas para el desarrollo de los nauplios. Los quistes se encuentran en estado de diapausa, lo que les permite ser resistentes a factores de estrés21. El efecto de los EA puede ser: a) reversible, que solo prolonga la diapausa; b) irreversible, que ocasiona la pérdida de viabilidad, o c) acumulativo, que inicialmente ocasiona la inhibición de la eclosión y después la pérdida de viabilidad del quiste. Para distinguir entre las dos primeras posibilidades se analizó la viabilidad de los quistes después de retirar el extracto.
En 10 de los EA estudiados la inhibición de la eclosión fue prácticamente total desde la concentración más baja estudiada (25μg/ml), y al retirarse el extracto se observó una pérdida de la viabilidad del quiste que se correlacionó con la concentración del extracto. Con los EA de Lactarius smithii y Scleroderma texense se presentó una inhibición de la eclosión relacionada con la concentración (no significativa estadísticamente) y las CL50 fueron las más altas encontradas. En ambos casos la inhibición de la eclosión fue superior a la mortalidad a una concentración dada. Esto evidencia que en los otros hongos con EA más tóxicos, donde la inhibición no parecía estar relacionada con la concentración, la alta toxicidad de los extractos no hacía advertir una inhibición parcial ni con la concentración más baja estudiada. Por otro lado, los EA de Pholiota spumosa y Ramaria aurea no provocaron la inhibición de la eclosión ni la mortalidad de los quistes a las concentraciones estudiadas. La respuesta de los quistes parece estar asociada a la toxicidad del extracto de la siguiente manera: a una baja toxicidad los quistes alargan su diapausa pero continúan siendo viables, y con toxicidades altas se produce la pérdida de viabilidad. Con el EA de Macrolepiota mastoidea se produjo la inhibición total de la eclosión desde la concentración más baja; sin embargo, no provocó la mortalidad de los quistes en las concentraciones utilizadas, lo que no excluye la posibilidad de efectos tóxicos a concentraciones más elevadas.
Si bien se ha demostrado que la presencia de metales pesados y otras sustancias tienen la capacidad de inhibir la eclosión de los quistes de A. franciscana2,17, no existen trabajos que evalúen el efecto directo sobre su viabilidad después de retirarlos de la exposición a las sustancias estudiadas y colocarlos en condiciones óptimas para su desarrollo. En este trabajo, bajo la metodología propuesta, se encontró que existen compuestos, así como concentraciones de los mismos, capaces de afectar la supervivencia del embrión y, en contraste, sustancias o concentraciones que a pesar de inhibir la eclosión no afectan la viabilidad de este, ya que al retirar el compuesto continúa con su normal desarrollo.
Los Basidiomycota tienen la capacidad de bioacumular diversos metales pesados, tales como Cd, Cu, Hg y Zn, entre otros1,4,5,7. De acuerdo con Brix et al.2 y Jiménez et al.17, los metales pesados como el Cu y el Ni pueden inhibir la eclosión de los quistes de Artemia a partir de concentraciones de 40μg/ml, porque afectan los mecanismos de osmorregulación e ionorregulación en los crustáceos20, que son esenciales para la eclosión37. Si se tiene en cuenta la posibilidad de bioconcentración de metales pesados y además la presencia de metabolitos tóxicos en los basidiomas, se podría explicar la alta inhibición registrada. En primera instancia, el sistema osmorregulatorio es lo que permite al quiste entrar en fase de rotura. Una vez que el quiste se encuentra en esta etapa el embrión queda expuesto al medio y se inicia un sistema de regulación iónica que le posibilita continuar su desarrollo hasta alcanzar el estadio de nauplio. Si el quiste logra alcanzar la fase de rotura y la regulación iónica falla, el embrión no continuará su desarrollo35. En este trabajo, al igual que en el de Vega-Villasante et al.39, se encontró que el DP y los extractos de los Basidiomycota no son detectados por el sistema de protección del quiste, por lo que bajo las condiciones establecidas en este bioensayo se rompió la diapausa, se activó el metabolismo y el embrión comenzó su desarrollo.
Según lo anterior se puede concluir lo siguiente: 1) algunos hongos comestibles mostraron una toxicidad moderada sobre los quistes de A. franciscana, por lo que es probable que contengan compuestos bioactivos en bajas concentraciones, que pudieran tener un potencial medicinal; 2) las causas por las cuales los extractos de las diferentes especies de Basidiomycota afectaron la eclosión de los quistes y la viabilidad de los embriones de A. franciscana son distintas y de naturaleza diferente, por lo tanto, se infiere que los resultados obtenidos bajo los métodos propuestos se pueden explicar por varias razones para cada uno o para cada grupo de los hongos probados, y no existe una explicación única para todos, y 3) bajo las condiciones establecidas en este protocolo, el uso de quistes de A. franciscana como organismo modelo demostró ser eficaz en la detección de metabolitos fúngicos y otras sustancias que tienen potencial citotóxico. Es necesario realizar investigaciones que permitan aclarar cuáles son las sustancias y los mecanismos por los cuales los extractos de los Basidiomycota afectaron la eclosión y la supervivencia del embrión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.