Las enfermedades fúngicas invasoras por levaduras todavía tienen un importante papel en la morbimortalidad de los pacientes neutropénicos con neoplasias hematológicas. Aunque la incidencia global de la candidiasis invasora ha disminuido debido al amplio uso de profilaxis antifúngica, la incidencia de especies de Candida no-Candida albicans está aumentando y la mortalidad de la candidiasis invasora continúa siendo elevada. Además, se ha producido un incremento de infecciones invasoras por diversas levaduras poco comunes que incluyen especies de los géneros Malassezia, Rhodotorula, Trichosporon y Saprochaete, caracterizadas por su resistencia a las equinocandinas y un mal pronóstico de la enfermedad.
Invasive fungal diseases caused by yeasts still play an important role in the morbidity and mortality in neutropenic patients with haematological malignancies. Although the overall incidence of invasive candidiasis has decreased due to widespread use of antifungal prophylaxis, the incidence of non-Candida albicans Candida species is increasing compared with that of C.albicans, and mortality of invasive candidiasis continues to be high. In addition, there has been an increase in invasive infections caused by an array of uncommon yeasts, including species of the genus Malassezia, Rhodotorula, Trichosporon and Saprochaete, characterised by their resistance to echinocandins and poor prognosis.
La incidencia de candidiasis invasora (CI) ha disminuido considerablemente en el paciente hematológico debido al uso rutinario de azoles en profilaxis desde hace más de dos décadas36. En estudios recientes solo el 1,9% de los pacientes que reciben posaconazol en profilaxis presentan formas invasoras de candidiasis9. Sin embargo, este hecho no se constata en pacientes con tumores sólidos, en los cuales la incidencia es más alta. Pese a disponer de nuevos antifúngicos, las infecciones invasoras por Candida se acompañan de una elevada mortalidad cifrada en diferentes series entre el 20 y el 50%, según el tipo de pacientes18,27,34. Por otra parte, se documentan cada vez más casos de infección por levaduras distintas de Candida en pacientes hematológicos en tratamiento con azoles o equinocandinas. En este documento se analizan la epidemiología y los factores de riesgo, las características clínicas, la evolución y el tratamiento de la CI en pacientes oncohematológicos y en especial en el paciente neutropénico. Asimismo se revisan someramente las infecciones por hongos levaduriformes pertenecientes a géneros distintos de Candida y Cryptococcus que pueden causar infecciones de brecha en pacientes hematológicos.
Candidiasis invasoraEpidemiologíaAunque hay descritas más de cien especies diferentes de Candida, la mayoría (95-97%) de todas las formas invasoras producidas por este género de levaduras están causadas por solo cinco especies (Candida albicans, Candida parapsilosis, Candida glabrata, Candida tropicalis y Candida krusei)29. En el último estudio prospectivo de vigilancia poblacional realizado en España sobre candidemia en el periodo 2010-2011 (CANDIPOP)30, en 29 hospitales de 5 ciudades con una población total de 7.237.228 habitantes, se registraron 752 episodios de candidemia en 729 pacientes, lo que supone una incidencia de 8,1 casos/105 habitantes/año. De los 752 casos, 238 (32,6%) correspondían a pacientes oncohematológicos: 195 (82%) se registraron en pacientes con tumor sólido y 43 (18%) en pacientes con hemopatías malignas. Un total de 35 (15,9%) episodios fueron fungemias de brecha22. La especie más frecuentemente aislada fue C.albicans (41,6%), seguida de C.parapsilosis (19,3%), C.glabrata (17,7%), C.tropicalis (10,3%), C.krusei (2,9%), C.guilliermondii (2,5%) y otras especies (5,8%). En pacientes hematológicos, las especies C.tropicalis y C.guilliermondii fueron más frecuentes que en los enfermos oncológicos (71,6% frente al 55,6%), y la fungemia por C.krusei se relacionó con el uso previo de azoles.
Aunque estos datos epidemiológicos reflejan la situación de nuestro país, pueden existir variaciones locales que condicionen en diferentes centros hospitalarios una epidemiología diferente. Sin embargo, el bajo porcentaje de C.albicans a favor de otras especies del género se ha constatado también en otros estudios2,9,14,20,21, y se atribuye al uso de profilaxis, predominantemente con azoles.
Un total de 67 de las 243 (27,6%) especies aisladas presentaron resistencia o sensibilidad disminuida al fluconazol, sin diferencias entre pacientes hematológicos y oncológicos (28,9% frente al 27,3%). El 85,1% fueron especies con sensibilidad reducida al fluconazol. Solo el 1% de los aislamientos de C.albicans y el 4% de los de C.parapsilosis presentaban sensibilidad reducida o resistencia al fluconazol. Por otra parte, la resistencia a las equinocandinas fue anecdótica (un aislamiento de C.tropicalis y otro de C.glabrata).
Así pues, es necesario conocer la epidemiología propia para tratar de forma correcta a nuestros pacientes. La ausencia de diferencias en cuanto a la sensibilidad de las especies entre los pacientes oncológicos y los hematológicos orienta a que otras variables, además de la exposición previa a los antifúngicos, pueden contribuir en la selección de cepas resistentes (dosis subóptimas, duración de los tratamientos, etc.).
Factores de riesgoLa principal fuente de infección por Candida es la colonización endógena. La supresión de la flora bacteriana habitual del tracto gastrointestinal secundaria al uso de antibióticos de amplio espectro o antineoplásicos facilita la proliferación de levaduras y aumenta el riesgo de fenómenos de translocación y paso al torrente sanguíneo. Los factores de riesgo de CI en los enfermos oncohematológicos se dividen en tres grupos: los relacionados con el huésped (mucositis, colonización previa por Candida), los relacionados con la enfermedad y su tratamiento (neutropenia, catéter venoso central [CVC], nutrición parenteral, cirugía abdominal, esteroides) y los relacionados con las complicaciones (enfermedad del injerto contra el huésped [EICH], infección por citomegalovirus [CMV], etc.)39 (tabla 1).
Factores de riesgo en la candidiasis invasora
| Factores de riesgo generales |
| Edad < 1 año o > 65 años |
| Comorbilidades: diabetes, cirrosis, malnutrición, etc. |
| Cirugía gastrointestinal previa |
| Estancia prolongada en la UCI |
| Dispositivos invasivos (catéteres, sondas) |
| Nutrición parenteral |
| Ventilación mecánica |
| Condicionantes interindividuales o población de mayor riesgo |
| Catéter venoso central |
| Antibióticos de amplio espectro |
| Colonización previa por Candida |
| Insuficiencia renal y/o hemodiálisis |
| Neutropenia |
| Quimioterapia, corticoides, inmunosupresores |
| Pancreatitis, perforación intestinal |
| Politraumatismo |
| Gran quemado |
| Neonato de bajo peso |
Al analizar los factores de riesgo en la población oncohematológica del estudio CANDIPOP31 se observó que los pacientes hematológicos habían recibido con mayor frecuencia quimioterapia o corticoides durante el mes previo, presentaban neutropenia y mucositis al inicio de la candidemia, y eran portadores de catéteres venosos centrales de larga duración. Por contra, los pacientes oncológicos tenían una mayor edad, con mayor frecuencia habían recibido nutrición parenteral o se habían sometido a cirugía abdominal previa (3 meses).
El porcentaje de candidemias relacionadas con el catéter fue similar en los pacientes oncológicos y en los hematológicos (37,2% frente al 36,4%) y aumentaba al 42,9% si se analizaban fungemias de brecha31. Las candidemias de brecha son más frecuentes en pacientes con leucemia, neutropenia y disrupción de barreras mucosas (mucositis), por lo que cabe pensar que la translocación desde el tracto gastrointestinal pueda ser el origen de dichas candidemias. En la mayoría de los casos se aíslan especies resistentes al fluconazol, especialmente C.krusei, en relación con el cambio de colonización que experimentan los pacientes con el uso de azoles. Por otra parte, como se ha comentado, también es más frecuente la candidemia relacionada con los catéteres.
Clínica y diagnósticoLas infecciones invasoras por Candida pueden presentar clínicamente diferentes formas: la candidemia (la más habitual, asociada o no a síntomas de diseminación), la candidiasis crónica diseminada (propia del paciente hematológico cuando se recupera de la neutropenia), poco frecuente en nuestros días, y las diferentes infecciones focales o viscerales invasoras (ocular, cardiaca, sistema nervioso central, urinaria, etc.) secundarias a una diseminación hematógena. La clínica puede oscilar desde cuadros febriles sin focalidad aparente hasta un síndrome séptico indistinguible del bacteriano. Lesiones cutáneas en forma de pústulas con base eritematosa pueden aparecer tanto en pacientes neutropénicos como en no neutropénicos. Las mialgias pueden ser frecuentes y se atribuyen a la formación de microabscesos en diferentes grupos musculares28.
El hemocultivo, a pesar de su escasa sensibilidad global (∼50%), sigue siendo la mejor técnica para el diagnóstico de la candidemia. Para la recuperación de levaduras en la sangre se recomienda el uso de los mismos sistemas automatizados de monitorización continua utilizados para bacterias. La detección de anticuerpos contra los mananos de C.albicans y de anticuerpos contra el micelio de C.albicans se ha evaluado en pacientes críticos pero se dispone de pocos datos en pacientes oncohematológicos28.
Aunque no sea un método comúnmente aplicado en nuestro país, la detección de (1→3)-β-D-glucano, componente no antigénico de la pared celular de la mayoría de los hongos patógenos (excepto Cryptococcus y los zigomicetos), puede servir de ayuda en el diagnóstico de las enfermedades fúngicas invasoras (EFI) por Candida y Aspergillus. Su presencia puede detectarse en suero mediante el método Fungitell® (Associates of Cape Cod Inc., EE.UU.), que posee una sensibilidad del 64,4-87,5%, una especificidad del 89,6-92,4%, un valor predictivo positivo del 70-89% y un valor predictivo negativo del 73-96,3% en el diagnóstico de la EFI si se emplea un punto de corte de 80pg/ml o 160pg/ml, respectivamente26. Pese a presentar resultados falsamente positivos en diferentes situaciones (hemodiálisis, bacteriemia, albúmina o inmunoglobulinas), esta técnica ha sido incluida como criterio diagnóstico en las nuevas definiciones de EFI de la EORTC/MSG y en las últimas guías terapéuticas de la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID)8,28.
Las técnicas de detección de ADN fúngico mediante la reacción en cadena de la polimerasa (PCR) se encuentran muy desarrolladas; aunque parecen útiles en el diagnóstico, la mayoría de ellas no han sido estandarizadas y no han sido todavía recomendadas en las guías europeas8,28.
La combinación de las diferentes técnicas será sin duda de ayuda para el diagnóstico de las diferentes formas de CI. Así, por ejemplo en la candidasis crónica diseminada, en la que los hemocultivos suelen ser negativos, los biomarcadores pueden ayudar en el diagnóstico. En un metaanálisis, la cuantificación de manano y antimanano demostró ser muy útil8,24.
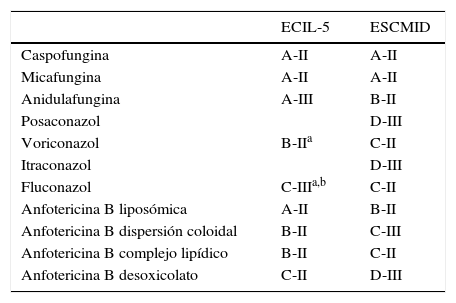
TratamientoAunque la elección del tratamiento dependerá de la epidemiología del centro, de la situación clínica de gravedad del paciente, de la enfermedad de base del paciente (paciente hematológico o trasplantado, o portador de CVC) o del uso de profilaxis previa con azoles, dado el incremento de los aislamientos de especies de Candida diferentes de C.albicans, con una menor sensibilidad al fluconazol, se aconseja iniciar el tratamiento con una equinocandina hasta disponer del fungigrama. En la tabla 2 se muestran los diferentes antifúngicos con el grado de evidencia que presentan en las dos guías más recientes: la de la ESCMID y la de la European Conference on Infection in Leukemia and HSCT (ECIL)16,38. Cabe destacar que el grado de recomendación de la anidulafungina16,38 es siempre inferior al de las otras dos equinocandinas, debido al menor número de pacientes neutropénicos incluidos en los diferentes estudios. Recientemente, y con motivo de una comunicación presentada en el congreso de la European Haematology Association en 201415,en la que se recogen los casos de 46 pacientes neutropénicos que habían recibido dicho fármaco con resultados clínicos y microbiológicos equiparables a los obtenidos con las otras equinocandinas en los estudios pivotales, la anidulafungina ha recibido la autorización para ser utilizada en el paciente neutropénico, y dicha indicación se ha incluido en la ficha técnica. La respuesta global con la anidulafungina resultó en estos pacientes del 56,5%, con claras diferencias entre los que se recuperaban de la neutropenia (con tasas de respuesta del 80%) y los que no (53,8%).
Tratamiento de la candidemia/candidiasis invasora en pacientes oncohematológicos según las guías ECIL y ESCMID
| ECIL-5 | ESCMID | |
|---|---|---|
| Caspofungina | A-II | A-II |
| Micafungina | A-II | A-II |
| Anidulafungina | A-III | B-II |
| Posaconazol | D-III | |
| Voriconazol | B-IIa | C-II |
| Itraconazol | D-III | |
| Fluconazol | C-IIIa,b | C-II |
| Anfotericina B liposómica | A-II | B-II |
| Anfotericina B dispersión coloidal | B-II | C-III |
| Anfotericina B complejo lipídico | B-II | C-II |
| Anfotericina B desoxicolato | C-II | D-III |
Hay tres peculiaridades a tener en cuenta en los pacientes oncohematológicos. La primera es la retirada o no del catéter. Así como en el paciente no neutropénico está claramente demostrado que la retirada precoz del catéter tiene un efecto protector frente a la mortalidad, en el paciente neutropénico no está tan claro, ya que se considera que la fuente de la candidemia puede ser una translocación intestinal16,28,29,38. Por ello, la retirada del catéter según las guías ECIL16 presenta un grado de evidencia B-II en vez de A-II. Lo que sí se recomienda es que, si no se retira el catéter, el paciente debe recibir una equinocandina o anfotericinaB liposómica por el efecto que presentan sobre el biofilm16,38. Está claramente demostrado el mayor efecto de las equinocandinas sobre este17. En el estudio español de vigilancia epidemiológica en pacientes oncohematológicos31 la retirada precoz del catéter (<48h), asociada a un tratamiento antifúngico eficaz administrado de forma temprana, se asociaba a una mayor supervivencia.
El segundo aspecto a considerar, tanto en pacientes neutropénicos como no neutropénicos, es qué sucede si se inicia tratamiento con una equinocandina y la especie causante es C.parapsilosis, que tiene una menor sensibilidad a las equinocandinas. En un reciente trabajo que proviene también del estudio CANDIPOP10 se observó que el tratamiento con equinocandinas durante las primeras 72h en los pacientes que presentaban una candidemia por dicha especie no tenía ningún impacto sobre la respuesta clínica de la candidemia. En esta situación, los azoles, junto con la retirada del catéter, son el tratamiento de elección16,38.
El tercer punto a considerar es el que, una vez conocida la especie y su sensibilidad a los antifúngicos, debe «desescalarse» el tratamiento, si las condiciones del paciente lo permiten. Un reciente estudio41 que incluía 250 pacientes con diferentes formas de CI —aunque solo nueve de ellos presentaban neutropenia— comparaba la respuesta entre los que seguían todo el tratamiento con la anidulafungina y los que por sus condiciones clínicas y a criterio médico pasaban a un tratamiento con un azol a partir del quinto día. La respuesta global de este grupo fue del 83,7%, con independencia de la especie de Candida aislada; no se observaron diferencias con los pacientes que seguían tratamiento intravenoso ni con el estudio pivotal con anidulafungina de Reboli et al.33. Además, la erradicación microbiológica en este estudio se obtuvo como media a los dos días, hecho importante sobre todo en el paciente neutropénico. Así pues, el «desescalar», cuando es posible, constituye una opción válida, más económica y que ayuda a disminuir la aparición de especies resistentes.
Actualmente la candidiasis crónica diseminada se considera un síndrome de reconstitución inmune en relación con el hongo, por lo que suele recomendarse la adición de corticoides al tratamiento antifúngico para el control de la misma19.
Evolución y mortalidadEn el estudio español realizado en pacientes oncohematológicos31 la mortalidad acumulada fue del 12,2% en el día 7 y del 31,5% en el día 30, sin diferencias entre los pacientes oncológicos y hematológicos, datos similares a los globales del estudio CANDIPOP30. En esta población la mortalidad se correlaciona en ocasiones con la enfermedad de base2. En el análisis multivariado, y tras ajuste mediante propensity score, el tratamiento combinado (antifúngico adecuado más retirada de catéter) durante las primeras 48h se relacionó con la mortalidad a los 7días (OR: 0,05; IC95%: 0,01-0,42). Estos datos concuerdan con las guías europeas38 pero no pueden generalizarse a toda la población neutropénica, ya que en el estudio español solo el 6,3% de los pacientes eran neutropénicos. Además, debe tenerse en cuenta que en muchas ocasiones es muy difícil la retirada de los catéteres por las características intrínsecas de los pacientes. La causa de la candidemia (primaria o de catéter) no tenía influencia sobre la mortalidad a la semana. Al estudiar los factores relacionados con la mortalidad a los 30días, nuevamente la retirada precoz del catéter, asociada al uso de antifúngicos eficaces, se asociaba a menor mortalidad, mientras que la candidemia primaria (OR: 3,47; IC95%: 2,05-5,89) y el aislamiento de C.krusei (OR: 12,59; IC95%: 2,46-64,48) podían considerarse factores pronósticos de mortalidad.
PrevenciónDebido a que la mayoría de las CI son secundarias a una diseminación endógena, las medidas que previenen la adquisición de levaduras exógenas no previenen la infección en estos pacientes. A pesar de eso, debido a que diferentes especies de Candida pueden transportarse en las manos de los cuidadores y personal sanitario en contacto con los pacientes de riesgo, se aconseja el lavado de manos (con solución alcohólica o agua y jabón) para evitar la exposición de los pacientes a estos patógenos25,36.
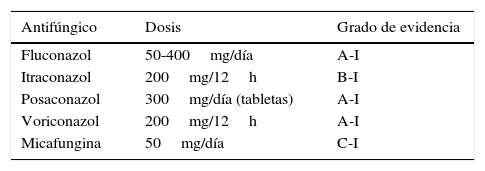
A principios de la década de 1990 se documentó que el uso de fluconazol en el trasplante de progenitores hematopoyéticos reducía la incidencia de infecciones candidiásicas, la mortalidad relacionada con ellas y la mortalidad global en el grupo de pacientes que recibían profilaxis3. Desde entonces, la administración de fluconazol ha constituido una práctica generalizada en la mayoría de centros de trasplante y en pacientes en los que se prevé una neutropenia prolongada. En la actualidad, y tras el uso de los nuevos azoles en la prevención de la infección por hongos filamentosos, verdadero caballo de batalla en el trasplante de progenitores hematopoyéticos, la incidencia de CI se ha reducido a una incidencia por debajo del 5%7,9,27. Otros antifúngicos que han demostrado su eficacia en pacientes hematológicos de riesgo son la micafungina40, el posaconazol7,37 y el voriconazol42.
En la tabla 3 se describen las profilaxis recomendadas en la prevención de la candidemia, englobadas en la profilaxis frente a infecciones fúngicas producidas por hongos filamentosos.
En el paciente oncológico que se somete a quimioterapia no se aconseja profilaxis frente a Candida, y su uso queda restringido a situaciones muy concretas en las que puedan coexistir múltiples factores de riesgo.
Infecciones sistémicas por otras levadurasLas EFI causadas por levaduras distintas al género Candida se han incrementado en frecuencia y gravedad en las últimas dos décadas, especialmente en los grupos de pacientes más inmunodeprimidos1,4,5,23.
Las dos principales especies del género Cryptococcus (Cryptococcus neoformans y Cryptococcus gattii) son la segunda causa de EFI por levaduras después de Candida. Aunque pueden afectar a pacientes inmunodeprimidos, son muy infrecuentes en pacientes neutropénicos, ya que se asocian preferentemente a deficiencia de la inmunidad celular (pacientes con sida, receptores de órganos o corticoterapia).
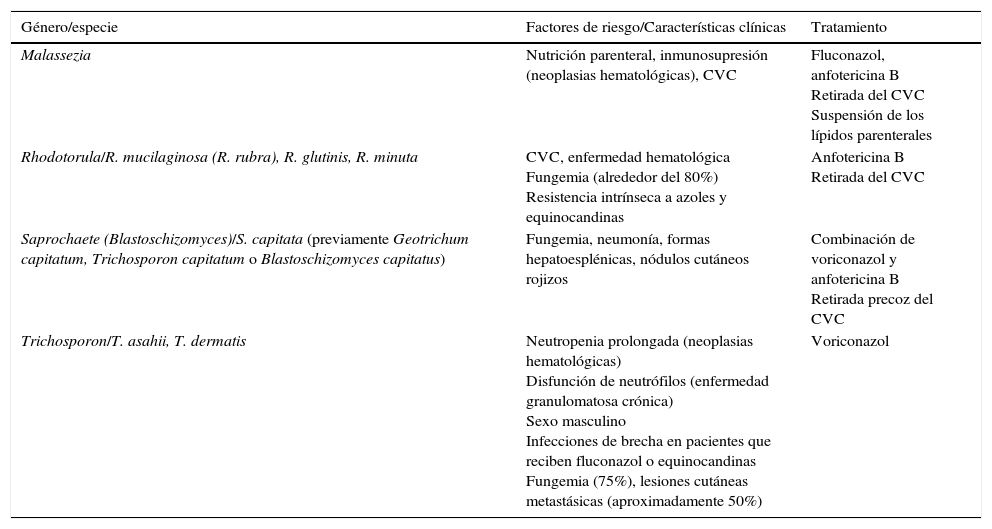
Por su parte, las EFI causadas por otros géneros de levaduras distintas de Candida y Cryptococcus (como Malassezia, Rhodotorula, Saprochaete o Trichosporon) pueden tener lugar en pacientes inmunodeprimidos, sobre todo en pacientes oncohematológicos tratados profilácticamente con azoles o empíricamente con candinas (tabla 4). Aunque estas EFI emergentes son infrecuentes, su importancia reside en la virulencia de su comportamiento, en el grado de inmunosupresión del huésped en el que asientan y en las opciones limitadas del tratamiento antifúngico debido a su amplio perfil de resistencia1,23.
Principales características de las infecciones por levaduras distintas de Candida y Cryptococcus en pacientes neutropénicos
| Género/especie | Factores de riesgo/Características clínicas | Tratamiento |
|---|---|---|
| Malassezia | Nutrición parenteral, inmunosupresión (neoplasias hematológicas), CVC | Fluconazol, anfotericina B Retirada del CVC Suspensión de los lípidos parenterales |
| Rhodotorula/R. mucilaginosa (R. rubra), R. glutinis, R. minuta | CVC, enfermedad hematológica Fungemia (alrededor del 80%) Resistencia intrínseca a azoles y equinocandinas | Anfotericina B Retirada del CVC |
| Saprochaete (Blastoschizomyces)/S. capitata (previamente Geotrichum capitatum, Trichosporon capitatum o Blastoschizomyces capitatus) | Fungemia, neumonía, formas hepatoesplénicas, nódulos cutáneos rojizos | Combinación de voriconazol y anfotericina B Retirada precoz del CVC |
| Trichosporon/T. asahii, T. dermatis | Neutropenia prolongada (neoplasias hematológicas) Disfunción de neutrófilos (enfermedad granulomatosa crónica) Sexo masculino Infecciones de brecha en pacientes que reciben fluconazol o equinocandinas Fungemia (75%), lesiones cutáneas metastásicas (aproximadamente 50%) | Voriconazol |
El género Malassezia incluye 14 especies, la mayoría lipofílicas1,11,23. Las infecciones sistémicas ocurren principalmente en niños que reciben nutrición parenteral, y en niños y adultos con diversas formas de inmunosupresión, entre ellas las neoplasias hematológicas, la mayoría en pacientes con CVC. El diagnóstico puede ser complicado por la dependencia de lípidos de la mayoría de las especies. No existen recomendaciones terapéuticas establecidas, ya que se carece de grandes series de pacientes y, por tanto, de recomendaciones basadas en la evidencia. Los factores clave en el manejo de las infecciones invasoras por Malassezia son la retirada del CVC, la suspensión de los lípidos parenterales y el tratamiento antifúngico sistémico. Los agentes más usados son el fluconazol y la anfotericinaB. La resistencia in vitro a las equinocandinas parece un hallazgo constante, por lo que no se recomiendan.
Género RhodotorulaSe han descrito tres especies de importancia clínica dentro del género Rhodotorula: Rhodotorula mucilaginosa (también denominada Rhodotorula rubra), Rhodotorula glutinis y Rhodotorula minuta. La especie R.mucilaginosa es responsable de la mayoría de estas infecciones (74-79%), seguida de R.glutinis (7,7%). El factor predisponente principal es la presencia de CVC y enfermedad hematológica subyacente. Un número significativo de casos son infecciones de brecha durante tratamientos con fluconazol o equinocandinas. La principal prueba diagnóstica de las infecciones invasoras por Rhodotorula es el hemocultivo, ya que el 79% de las infecciones sistémicas presentan fungemia. Es de destacar que los aislamientos de Rhodotorula tienen reactividad cruzada con C.glabrata y C.krusei en las pruebas automatizadas de identificación de los hemocultivos positivos, lo que podría llevar a un tratamiento inapropiado con equinocandinas. Son intrínsecamente resistentes a los azoles y las equinocandinas pero sensibles a la anfotericinaB y la 5-fluorocitosina. Por tanto, el tratamiento de elección es la anfotericinaB. La mortalidad global en pacientes hematológicos es del 13,8%, desde el 0% en pacientes con linfoma hasta el 21% en pacientes con leucemia aguda. Si está presente un CVC debe retirarse1,23,32.
Género SaprochaeteSaprochaete capitata (previamente denominada Geotrichum capitatum, Trichosporon capitatum o Blastoschizomyces capitatus) es una levadura que puede causar fungemia letal en pacientes hematológicos con neutropenia profunda. Estos pacientes constituyen hasta el 92% de los casos descritos, y el 75% de ellos son de series de Italia, España y Francia1,12,13,22,23. La mortalidad asociada a las infecciones diseminadas en pacientes hematológicos se sitúa en el 57%. El 60-80% de los pacientes presentan afectación profunda. La enfermedad es causa de lesiones cutáneas similares a las observadas en la candidiasis diseminada, así como de abscesos hepatoesplénicos, infecciones pancreáticas, abscesos cerebrales, funguria, fallo renal agudo por oclusión fúngica de los glomérulos y osteomielitis, la mayoría con afectación vertebral.
El CVC es una potencial puerta de entrada. La mayoría de las fungemias por S.capitata se diagnostican en hemocultivo. Puede tener reactividad cruzada con Aspergillus en la prueba del galactomanano. Los datos de sensibilidad in vitro sugieren que S.capitata es sensible a la 5-fluorocitosina, el itraconazol, el voriconazol y el posaconazol, pero no al fluconazol. La CMI para la anfotericinaB es variable, entre 0,5 y 2mg/l. Puede considerarse intrínsecamente resistente a las equinocandinas.
No está establecido el tratamiento de elección en pacientes hematológicos. Se ha sugerido la combinación del voriconazol y la anfotericinaB, así como la retirada precoz del CVC.
Género TrichosporonSolo 16 especies del género Trichosporon se han asociado a infección en el ser humano. La gran mayoría de casos se deben a Trichosporon asahii (74%), seguido de Trichosporon dermatis (12%). En pacientes inmunocomprometidos se han descrito infecciones invasoras como fungemia, endocarditis, peritonitis y meningitis. Los factores de riesgo más frecuentes son la neoplasia hematológica subyacente con neutropenia prolongada o la disfunción de los neutrófilos, como en la enfermedad granulomatosa crónica. Es más frecuente en varones.
Se han descrito infecciones de brecha en pacientes que reciben fluconazol o equinocandinas. La infección se presenta generalmente con fungemia (75%), y en aproximadamente el 50% de los casos con lesiones cutáneas metastásicas. Puede haber afectación renal asociada con hematuria y funguria. En pacientes inmunodeprimidos la mortalidad puede llegar al 80%. Estas especies comparten antígenos con Cryptococcus y Aspergillus, y se ha documentado reactividad cruzada con el antígeno criptocócico o con el galactomanano, por lo que la doble positividad de estas pruebas puede ser un indicador de tricosporonosis invasora. Los azoles son los antifúngicos de elección para el tratamiento de la tricosporonosis invasora. El agente preferido es el voriconazol, ya que muestra buena actividad in vitro y buenos resultados in vivo1,6,13,23,35.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.