La histoplasmosis clásica es una micosis sistémica endémica debida a Histoplasma capsulatum var. capsulatum. En los pacientes VIH/sida afectados por esta infección, la restauración de la respuesta inmune mediante el tratamiento antirretroviral de alta eficacia (TARV) y la profilaxis secundaria con antifúngicos ha reducido su morbimortalidad.
ObjetivosConocer el estado actual del pronóstico y los resultados de los tratamientos de esta asociación mórbida en el Hospital de Infecciosas Francisco J. Muñiz, de Buenos Aires.
MétodosEstudio retrospectivo de los datos demográficos, clínicos, inmunológicos y de tratamiento de 80 pacientes infectados por el VIH con histoplasmosis diseminada.
ResultadosSesenta y cinco pacientes eran varones, la mediana de la edad fue de 36 años, el 73,7% consumía drogas ilegales, el 82,5% no recibía TARV en el momento del diagnóstico y el 58,7% presentaba recuentos de CD4+ inferiores a 50cél/μl. El tratamiento inicial (anfotericina B y/o itraconazol) duró 3 meses y fue exitoso en el 78,7% de los enfermos. Solo 26/63 (41,2%) cumplieron con los controles clínicos posteriores, el TARV y la profilaxis secundaria con itraconazol o anfotericina B. Se suspendió la profilaxis secundaria tras más de un año de TARV si los pacientes estaban asintomáticos, y si presentaban dos recuentos de CD4+ superiores a 150cél/μl y cargas virales indetectables. Después de dos años de control postinterrupción de la profilaxis, ningún caso experimentó recidiva.
ConclusionesEl tratamiento de la histoplasmosis en pacientes infectados por el VIH fue eficaz en el 78,8% de los casos; la asociación de TARV y profilaxis antifúngica es segura, bien tolerada y eficaz. En el futuro debe mejorarse el cumplimiento de la terapia en estos pacientes e incorporar métodos de diagnóstico rápido de la histoplasmosis. Debe estudiarse la utilidad de la profilaxis primaria para la criptococosis y la histoplasmosis en los pacientes infectados por el VIH.
Classic histoplasmosis is a systemic endemic mycosis due to Histoplasma capsulatum var. capsulatum. A significant reduction in the morbidity and mortality of AIDS-related histoplasmosis has been observed since the introduction of highly active antiretroviral therapy (HAART) and secondary antifungal prophylaxis.
AimsThe aim of this study was to determine the current state of prognosis and treatment response of HIV-positive patients with histoplasmosis in the Francisco J. Muñiz Infectious Diseases Hospital in Buenos Aires City.
MethodsA retrospective study was conducted using the demographic, clinical, immunological and treatment data of 80 patients suffering from AIDS-related histoplasmosis.
ResultsOf the 80 cases studied 65 were male, the median age was 36 years, with 73.7% of the patients being drug addicts, 82.5% of the patients was not receiving HAART at diagnosis, and 58.7% of the cases had less than 50 CD4+ cells/μl at the beginning of the treatment. The initial phase of treatment consisted of intravenous amphotericin B and/or oral itraconazole for 3 months, with 78.7% of the cases showing a good clinical response. Only 26/63 patients who were discharged from hospital continued with the follow-up of the HAART, secondary prophylaxis with itraconazole or amphotericin B. Secondary prophylaxis was stopped after more than one year of HAART if the patients were asymptomatic, had two CD4+ cell counts greater than 150cells/μl, and undetectable viral loads. No relapses were observed during a two-year follow up after prophylaxis was stopped.
ConclusionsThe treatment of histoplasmosis in HIV-positive patients was effective in 78.8% of the cases. The combination of HAART and secondary antifungal prophylaxis is safe, well tolerated, and effective. The low adherence of patients to HAART and the lack of laboratory kits for rapid histoplasmosis diagnosis should be addressed in the future. The usefulness of primary antifungal prophylaxis for cryptococcosis and histoplasmosis HIV-positive patients should be studied.
La histoplasmosis clásica es una micosis sistémica endémica producida por el hongo dimorfo Histoplasma capsulatum var. capsulatum. Su distribución geográfica es amplia, abarca más de 60 países, pero predomina ampliamente en América y África. Su agente causal se presenta como un microorganismo saprobio ambiental en su forma micelial. Ha sido aislado de muestras de tierra ricas en sustancias orgánicas, especialmente en aquellas que contienen heces de aves o de murciélagos7,11,18.
Las infecciones del hombre y de otras especies de animales se producen por la inhalación de los microconidios de la forma micelial de H. capsulatum. La mayor parte de estas infecciones son asintomáticas o cursan como procesos respiratorios benignos y autolimitados. La evolución de estas infecciones depende de la carga fúngica infectante y de la respuesta inmunitaria del hospedero, en especial de la inmunidad adaptativa mediada por células18. La primera barrera defensiva es la inmunidad innata, constituida por los leucocitos polimorfonucleares, los macrófagos, las células NK, las presentadoras de antígenos y las proteínas del complemento; sin embargo, estos mecanismos defensivos son incapaces, por sí solos, de controlar la infección7. A las dos o tres semanas del contacto infectante el hospedero genera una respuesta inmune adaptativa mediada por células T CD4+ que producen citoquinas con predominio de las proinflamatorias de tipo Th1, como IL2, IL12, INF-γ y TNF-α. Estas sustancias activan a los macrófagos, que se tornan capaces de lisar las levaduras de H. capsulatum y generan una respuesta inflamatoria consistente en granulomas epitelioides compactos que controlan la infección11,18.
Las formas diseminadas progresivas de la histoplasmosis se producen por fallos en los mecanismos inmunes antes mencionados y son más frecuentes en las edades extremas de la vida (pacientes menores de un año de edad o mayores de 60 años). La incidencia de esta presentación es 10 veces mayor en el sexo masculino y se observa comúnmente en pacientes tratados con corticosteroides, drogas antiblásticas, en pacientes que reciben antagonistas del TNF-α y en las personas infectadas por el VIH con recuentos de células CD4+ inferiores a 200cél/μl7,11. En 1985 la histoplasmosis fue reconocida como enfermedad indicadora de sida4,23. Se observó que alrededor del 80% de los pacientes con histoplasmosis diseminada asociada al sida y con recuentos de células CD4+ inferiores a 150cél/μl presentaban recidivas de esta micosis después de un tratamiento antifúngico exitoso13. Por esta razón se recomendó un tratamiento supresivo o profilaxis secundaria consistente en la administración de 200mg diarios de itraconazol por vía oral o la aplicación intravenosa de 50mg de anfotericina B dos veces por semana13,19.
La introducción del tratamiento antirretroviral de alta eficacia (TARV) en 1996 ha prolongado la supervivencia de estos pacientes y permitido la recuperación de la respuesta inmune22. Gracias a este tratamiento, y como ha sucedido con otras infecciones relacionadas con el VIH, ha podido suspenderse la profilaxis secundaria en aquellos enfermos que presentan dos recuentos de células CD4+ superiores a 150cél/μl en un intervalo de tres meses. En la histoplasmosis esta conducta se adoptó en su momento sin pruebas suficientes12. En 2004 nuestro grupo de trabajo publicó el estudio de 21 enfermos con histoplasmosis asociada a sida que recuperaron la respuesta inmune requerida para la interrupción de la profilaxis secundaria; el tiempo medio de TARV fue de 16,7 meses, y tras dos años de control los pacientes no presentaron recidivas de esta micosis20. Goldman et al. presentaron en 2004 una experiencia similar con 35 pacientes9.
El objetivo de este nuevo estudio es conocer la evolución de 80 nuevos casos de histoplasmosis asociada al sida, observados en el Hospital Francisco J. Muñiz entre enero de 2010 y diciembre de 2012. De esta forma se pretende tener un conocimiento actualizado de la situación de esta micosis en nuestro medio.
Materiales y métodosSe llevó a cabo un estudio descriptivo retrospectivo de las historias clínicas de 80 pacientes con histoplasmosis diseminada asociada al sida, diagnosticados en la Unidad de Micología del Hospital de Infecciosas Francisco J. Muñiz de la Ciudad Autónoma de Buenos Aires, durante el lapso comprendido entre enero de 2010 y diciembre de 2012.
Se confeccionó una base de datos donde se anotaron la edad y el sexo de los pacientes, si estaban recibiendo TARV en el momento del diagnóstico, los factores de riesgo para la infección por VIH, la forma en que se efectuó el diagnóstico de la histoplasmosis, los recuentos de células CD4+ al iniciar el tratamiento antifúngico, la evolución clínica que tuvieron, la condición en la que recibieron el alta hospitalaria, si cumplieron con los controles médicos posteriores, el esquema de TARV que les fue administrado, el tiempo requerido para alcanzar la restitución de la inmunidad que permitiese la interrupción de la profilaxis secundaria con antifúngicos, y la evolución clínica de estos pacientes a los dos años de dicha interrupción.
Todos los enfermos incluidos en este estudio tuvieron el diagnóstico de histoplasmosis confirmado por el hallazgo de H. capsulatum en el examen microscópico directo de diversas muestras clínicas o por su aislamiento en cultivo. Los procedimientos de diagnóstico empleados, así como las técnicas serológicas utilizadas, han sido publicados en trabajos anteriores2,4.
ResultadosDe los 80 enfermos estudiados, 65 (81,2%) eran varones y 15 eran mujeres (18,8%). La mediana de edad fue de 36 años, con un rango entre 18 y 60 años. En 23 pacientes se detectó la infección por VIH tras la realización del diagnóstico de la histoplasmosis subaguda. Cincuenta y nueve pacientes (73,75%) admitieron consumir drogas ilegales y 76 (82,5%) no estaban recibiendo TARV en el momento del diagnóstico. Solo 14 casos (17,5%) presentaron recuentos de células CD4+ superiores a 100cél/μl y en 47 pacientes (58,7%) el recuento fue inferior a 50cél/μl.
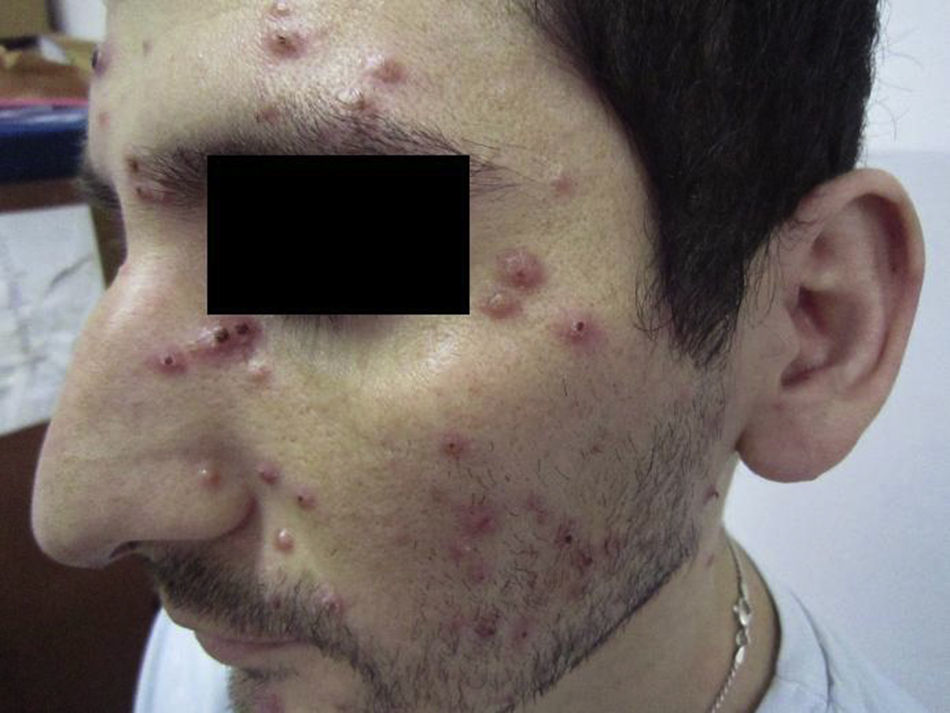
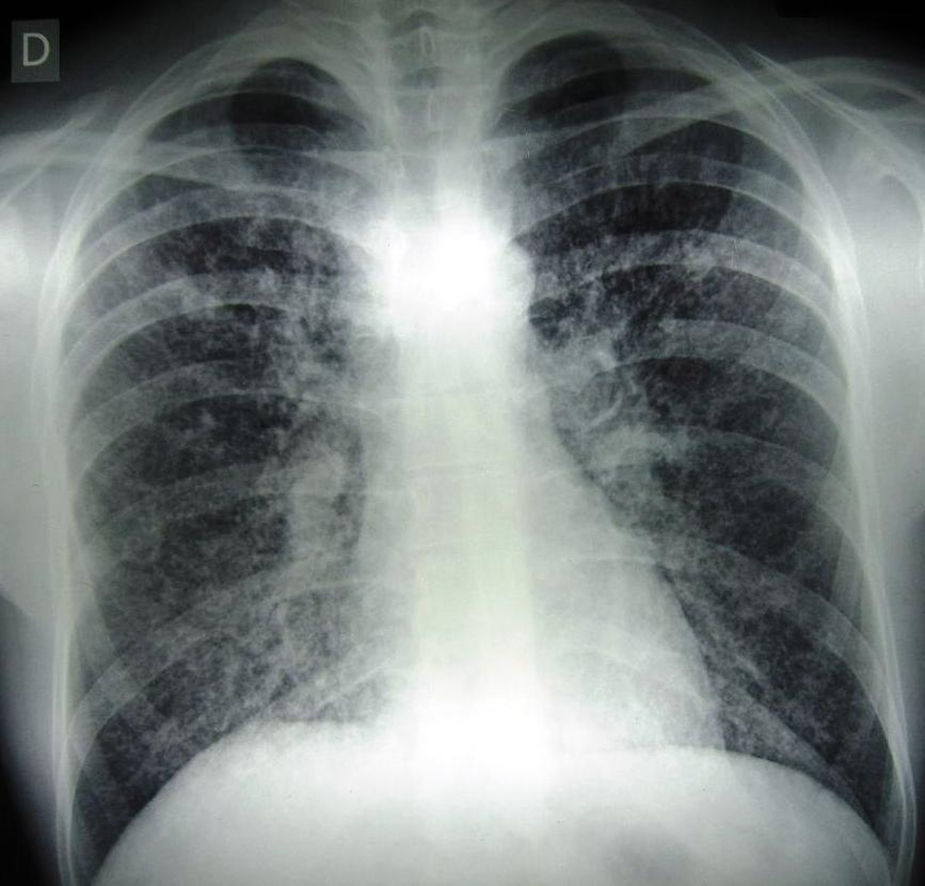
Se observaron lesiones cutáneas o mucosas en el 61,2% de los enfermos (fig. 1) e imágenes radiológicas patológicas en los pulmones en el 68,8% (fig. 2). La técnica de citodiagnóstico de Tzanck permitió la observación de levaduras compatibles con H. capsulatum en 31 muestras de piel y 26 de las membranas mucosas; en algunos enfermos ambas muestras eran positivas. Los hemocultivos por lisis-centrifugación permitieron el aislamiento de H. capsulatum en 53 de 71 casos (74,6%), en tanto que la reacción de contrainmunoelectroforesis con histoplasmina fue positiva en 15/55 pacientes (27,3%).
Cincuenta y nueve pacientes fueron inicialmente tratados con anfotericina B desoxicolato por vía intravenosa a una dosis media de 0,7mg/kg/día, 6 de ellos mantuvieron ese esquema durante 3 meses y los restantes recibieron dicho tratamiento durante un promedio de 2 semanas. Veinte enfermos recibieron itraconazol por vía oral a razón de 400mg/día y un paciente no recibió tratamiento antifúngico.
La anfotericina B como tratamiento inicial fue indicada para los pacientes más graves, en aquellos que padecían trastornos digestivos y en los que recibían otros tratamientos que, como la rifampicina o la fenitoína, interactúan con el itraconazol. En general, la anfotericina B fue reemplazada por el itraconazol cuando el estado general del enfermo mejoraba o era suspendida la medicación que alteraba potencialmente el metabolismo del itraconazol. Esta primera fase del tratamiento duró 3 meses y a partir de ese momento se inició la profilaxis secundaria con itraconazol a razón de 200mg/día o 50mg de anfotericina B dos veces por semana. Veinte pacientes siguieron la profilaxis con itraconazol y 6 lo hicieron con anfotericina B. Los enfermos que no recibían TARV comenzaron dicho tratamiento a los dos meses de iniciada la medicación antifúngica.
Sesenta y tres de los 80 pacientes (78,7%) fueron dados de alta de internación con buena evolución clínica. Un enfermo internado por fiebre y neumonía, cuya histoplasmosis fue diagnosticada por hemocultivo y que tenía un recuento de células CD4+ de 268cél/μl, fue dado de alta antes de llegar el resultado de este hemocultivo a la unidad de internación. Fue examinado nuevamente un año después de este hallazgo y se encontraba en buen estado de salud, sin signos de histoplasmosis activa y sin haber recibido ningún antifúngico; solo recibió TARV.
Dieciséis pacientes (20%), ocho de los cuales presentaban lesiones cutáneas, fallecieron durante la internación; cuatro de ellos llegaron a recibir tratamiento antifúngico un solo día. Es difícil establecer si la causa de la muerte podía atribuirse a la histoplasmosis, dado que la mayoría de estos enfermos presentaba simultáneamente otras infecciones oportunistas. Las más frecuentes en esta serie fueron la tuberculosis, la neumocistosis y la sepsis por Staphylococcus aureus.
Solo 26/63 (41,2%) enfermos dados de alta siguieron sus controles en el consultorio externo de la Unidad de Micología y pudieron ser evaluados para este estudio. De ellos, 20 casos (76,9%) fueron tratados con dos análogos nucleosídicos de la transcriptasa inversa y un inhibidor no nucleosídico de dicha enzima; los restantes seis enfermos (23%) recibieron dos análogos nucleosídicos de la transcriptasa inversa y un inhibidor de proteasas. Los esquemas usados fueron: zidovudina/lamivudina/efavirenz (11 casos), tenofovir/emtricitabina/efavirenz (en 5), lamivudina/abacavir/efavirenz (en 3) y tenofovir/emtricitabina/atazanavir/ritonavir (en 3)18.
Los enfermos que recibían un inhibidor de la proteasa en su TARV comenzaron el tratamiento con anfotericina B, salvo un caso, que recibió itraconazol a razón de 400mg/día. Después del alta de internación todos los pacientes, salvo este último caso, prolongaron el tratamiento con anfotericina B hasta completar 3 meses a razón de 50mg tres veces por semana en el hospital de día. El enfermo tratado inicialmente con itraconazol continuó con este tratamiento en una dosis de 300mg/día hasta completar los 3 meses iniciales. Se adoptó esta conducta para evitar la toxicidad por itraconazol debida al aumento de la biodisponibilidad de este fármaco por el uso simultáneo con inhibidores de las proteasas. Cumplido este lapso los 26 pacientes fueron tratados con itraconazol a razón de 200mg/día (20 casos) o anfotericina B bisemanal hasta presentar dos recuentos de células CD4+ superiores a 150cél/μl en un intervalo de tres meses. Esta condición fue alcanzada a los 12 meses por 12 enfermos, a los 18 meses en 13 casos y un paciente necesitó 21 meses de profilaxis secundaria antifúngica. Todos tenían cargas virales indetectables y estaban asintomáticos cuando la profilaxis antifúngica fue interrumpida. Solo un paciente presentó un síndrome inflamatorio de reconstitución inmune, consistente en adenopatías cervicales que supuraron y evolucionaron hacia escrofuloderma. En el control de estos pacientes dos años después se observó que ninguno había tenido recaídas de la histoplasmosis, ninguno presentó efectos colaterales por los tratamientos instaurados que obligasen a su interrupción y todos estaban en buen estado de salud. No se registraron casos de fracaso virológico.
DiscusiónLa incidencia relativamente alta de la histoplasmosis asociada al sida ha provocado inquietud en las instituciones de salud de algunos países de América Latina debido a la falta de denuncia compulsiva de esta infección fúngica y la escasa cantidad de estudios sobre la situación actual de esta asociación mórbida en los últimos años17. En los países industrializados del área endémica, como los EE. UU., la incidencia de la histoplasmosis ha disminuido y el control de esta micosis resulta posible en la mayoría de los pacientes debido a la alta eficacia de la anfotericina B y el itraconazol, tanto para el tratamiento inicial como para la profilaxis secundaria. El suministro de TARV, la profilaxis antifúngica primaria y secundaria, así como la disponibilidad de procedimientos rápidos de diagnóstico no basados en cultivos o exámenes microscópicos han contribuido a que la histoplasmosis en pacientes infectados por el VIH haya dejado de ser un problema grave de salud, aun en zonas altamente endémicas de los EE. UU.15. En las áreas endémicas de América del Sur la incidencia de la histoplasmosis relacionada con el VIH ha disminuido de forma moderada desde que está disponible el TARV1. En el Hospital Francisco J. Muñiz descendió del 5% de las internaciones debidas a infecciones asociadas al sida al inicio de la pandemia al 2,5% actual en 20046,21. Sin embargo, aún son numerosos los casos de esta asociación mórbida que se observan en nuestro medio, así como en otros países de Centroamérica y Sudamérica17. Las principales causas de estas diferencias son la falta de cumplimiento del TARV, pese a estar disponible en muchos países de la región, la ausencia de equipos de diagnóstico no basados en cultivos –que impide el diagnóstico rápido y oportuno de aquellos pacientes sin lesiones accesibles de manera incruenta para el diagnóstico micológico– y que no se aplica profilaxis antifúngica primaria por considerar que esta micosis no presenta una incidencia suficientemente alta y no tiene una alta tasa de mortalidad como para justificar su indicación1,16,17,21.
En este grupo de enfermos el 82,5% no estaba recibiendo el TARV cuando se diagnosticó la histoplasmosis, y más de la mitad de ellos presentaban recuentos de células CD4+ inferiores a 50cél/μl, valor inaceptable en un país que gratuitamente ofrece a los enfermos tanto el diagnóstico como el tratamiento de la infección por VIH y sus complicaciones. Posiblemente esta situación se debe a que el 73,75% de nuestros pacientes eran adictos a drogas ilegales, y tenían bajos niveles económico-sociales y culturales. Pudimos observar que el tratamiento inicial dio resultados satisfactorios en el 78,7% de los pacientes. Un enfermo que no recibió tratamiento antifúngico y en el momento del diagnóstico tenía un recuento de células CD4+ superior a 200cél/μl presentó una evolución favorable solo con el TARV. La posible explicación de esta involución espontánea de la histoplasmosis es que fue debida a la estimulación de la inmunidad adaptativa mediada por células y la consiguiente activación de los macrófagos; este paciente, que aún conservaba un buen nivel de inmunidad, presentó una infección primaria sintomática, con fiebre y manifestaciones respiratorias, y los hemocultivos fueron positivos. Es conocido que las infecciones primarias respiratorias de esta micosis pueden cursar con hemocultivos positivos, tal como sucedió en este caso18.
Pese a estos resultados aparentemente satisfactorios del tratamiento inicial, se observó una tasa de mortalidad del 20% debido al retraso en la indicación del tratamiento antifúngico y a la existencia de otras enfermedades concomitantes. Los fracasos terapéuticos fueron más comunes en los pacientes que no tenían lesiones cutáneas o mucosas y que fueron diagnosticados por hemocultivo. A pesar de la alta eficacia de los hemocultivos por lisis-centrifugación, cercana al 80%, el diagnóstico por este procedimiento demora entre 12 y 21 días4. Las nuevas técnicas de diagnóstico no basadas en el cultivo, como la detección del galactomanano de H. capsulatum en orina por ELISA, han demostrado unas elevadas sensibilidad y especificidad en el diagnóstico de esta micosis y podrían reducir los fracasos terapéuticos5,14. Otra estrategia que tendría que ser discutida es la implementación del tratamiento empírico de la histoplasmosis, posible una vez que se hayan obtenido las muestras clínicas para su diagnóstico, tal como se hace con frecuencia en la tuberculosis.
La profilaxis primaria como estrategia para reducir la incidencia de micosis asociadas al sida ha sido aplicada de forma universal solo en la neumocistosis. En algunas zonas altamente endémicas de criptococosis, como en el África subsahariana, ha sido utilizada en pacientes con recuentos de células CD4+ inferiores a 50cél/μl; el mismo criterio se ha seguido en el estado de Illinois (EE. UU.) para evitar la histoplasmosis7,11. Se ha comprobado que la profilaxis antifúngica primaria con itraconazol reduce el número de casos tanto de histoplasmosis como de criptococosis en las personas infectadas por VIH que presentan recuentos de CD4+ inferiores a 50cél/μl. Se considera que esta estrategia es justificable para infecciones que presenten una incidencia superior al 10% en estos pacientes. En Argentina no se ha propuesto la profilaxis primaria para ninguna de las dos micosis pese a que la criptococosis superó el 10% de los casos de complicaciones infecciosas que requirieron internación en el Hospital Francisco J. Muñiz durante los años 90 del siglo xx3. Debería estudiarse si la suma de incidencias de estas dos micosis sistémicas justifica o no la indicación de profilaxis primaria.
En el grupo de pacientes estudiados hubo un bajo cumplimiento de los controles médicos posteriores al alta hospitalaria, ya que solo el 41,2% de ellos los siguieron adecuadamente. La eficacia de la aplicación conjunta de TARV y profilaxis secundaria permitió la interrupción segura del tratamiento antifúngico después de un lapso mayor a un año, al igual que lo descrito en otros estudios1,10,15,20.
El itraconazol se metaboliza en el hígado, principalmente a través de la enzima CYP 450 3A4. Varios antirretrovirales utilizan esta misma vía de metabolización, y algunos de ellos presentan interacciones con el itraconazol. La administración conjunta de inhibidores de las proteasas y de itraconazol reduce la metabolización de ambos fármacos y puede elevar sus concentraciones sanguíneas. La administración de saquinavir/ritonavir puede aumentar de forma significativa la concentración de itraconazol, y la dosis de este antifúngico no debería ser superior a 200mg/día. Sin embargo, el itraconazol eleva solo levemente la biodisponibilidad de los inhibidores de las proteasas. Los inhibidores no nucleosídicos de la transcriptasa inversa disminuyen de forma significativa la concentración en sangre del itraconazol y pueden originar el fracaso de la terapéutica antifúngica; por el contrario, este antifúngico no parece modificar las concentraciones de estos antirretrovirales. No se han encontrado interacciones del itraconazol con los inhibidores nucleosídicos de la transcriptasa inversa y con el raltegravir (dentro de los inhibidores de la integrasa). La anfotericina B tiene una farmacocinética poco conocida; se sabe que no utiliza el citocromo P450, pero puede interactuar con fármacos antirretrovirales al potenciar la nefrotoxicidad del tenofovir y el poder anemizante de la zidovudina. Los inhibidores del correceptor CCR5 y los inhibidores de la fusión podrían ser utilizados, pero no se cuenta aún con la suficiente experiencia como para recomendar su prescripción conjunta con el itraconazol; de estos dos grupos hay que poner especial atención en el maraviroc, que es sustrato del CYP 450 3A48,10.
Pese a lo publicado en la literatura8,10, la utilización simultánea de itraconazol con los antirretrovirales empleados en este estudio no produjo fracasos virológicos ni del tratamiento antifúngico, y tampoco fueron comunes los efectos colaterales vinculados al uso simultáneo de estos fármacos.
1ConclusionesEl tratamiento inicial de la histoplasmosis con anfotericina B o itraconazol en pacientes infectados por el VIH es eficaz en el 80% de los casos; los fracasos terapéuticos son más frecuentes en enfermos sin lesiones accesibles para la obtención de muestras clínicas para el estudio micológico. Tal como se observó en otros estudios, la asociación de TARV con la profilaxis antifúngica secundaria permite el control de ambas infecciones y la interrupción segura de la profilaxis secundaria, según los criterios previamente fijados. Ambos tratamientos fueron bien tolerados. Los problemas que aún se deben corregir o mejorar son el bajo cumplimiento de los tratamientos indicados por parte de estos pacientes y la ausencia en el mercado argentino de equipos de diagnóstico de la histoplasmosis no basados en el cultivo. Recomendamos estudiar la utilidad de la profilaxis primaria antifúngica para la criptococosis y la histoplasmosis en esta zona.
2Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.