: Los receptores de trasplante hepático (RTH) pueden ser pacientes de riesgo para desarrollar candidemia o candidiasis invasora durante el período posoperatorio inmediato al trasplante. La profilaxis es la mejor estrategia para disminuir la incidencia de infección fúngica invasora (IFI) producida por Candida spp. en los receptores de riesgo alto. Pero en los casos de sospecha de aparición de IFI de brecha causada por Candida, un proceso de diagnóstico rápido y el tratamiento antifúngico precoz son los factores con un impacto mayor en el pronóstico.
Caso clínico: Presentamos un caso clínico de tratamiento de rescate precoz con anidulafungina en un RTH con curso posoperatorio complicado. Se discuten los factores de riesgo, la profilaxis, la sensibilidad de los biomarcadores y las características del tratamiento antifúngico.
Conclusiones: El tratamiento antifúngico de rescate precoz con candinas mejora sensiblemente el pronóstico en pacientes RTH de alto riesgo con IFI por Candida.
: Some liver transplant recipients could be at risk for candidemia or invasive candidiasis during the immediate postoperative period after transplantation. Prophylaxis is the best strategy to reduce the incidence of invasive fungal infection caused by Candida species in high-risk liver transplant recipients (HR-LTR), but in cases of suspected breakthrough invasive fungal infection due to Candida, both a rapid diagnosis process and early antifungal treatment are the most important factors impacting on the prognosis.
Clinical caseWe report a case of early rescue treatment with anidulafungin in a HR-LTR with complicated postoperative course. We discuss risk factors, prophylaxis, sensitivity of biomarkers, and characteristics of antifungal management.
Conclusions: Early rescue antifungal treatment using candins improves the prognosis in HR-LTR suffering from invasive candidiasis.
Los receptores de trasplante hepático (RTH) son pacientes de riesgo para presentar infección fúngica invasora (IFI) por Candida durante el período posoperatorio inmediato al trasplante [30,35]. Se han descrito factores perioperatorios que incrementan el riesgo de IFI por
Candida en esta población [36]. En los grupos de alto riesgo, la profilaxis se ha mostrado como la estrategia terapéutica con un impacto mayor para disminuir la incidencia de IFI9, [46]. Recientemente se han publica-do guías de práctica clínica que recomiendan el uso de fluconazol o anfotericina B liposomal para la profilaxis [37].
El diagnóstico de IFI por Candida en RTH durante el período poso-peratorio inicial es un reto clínico. La incidencia de colonización en estos pacientes es muy elevada [7,22], y el crecimiento de Candida spp. en muestras no significativas tiene un valor cuestionable. Por otra parte, la sintomatología de la IFI por Candida es inespecífica, presenta criterios de gravedad muy variables dependiendo del estado general de los receptores, desde cuadros clínicos paucisintomáticos —incluso en IFI con importante diseminación—, hasta cuadros de extrema gravedad por síndrome de disfunción multiorgánica secundaria a shock séptico y, con frecuencia, se asocian a infecciones polimicrobianas. Sin embargo, en todos los casos de IFI por Candida la mortalidad atri-buible a la infección es muy elevada (alrededor del 35-40%).
1Caso clínicoPaciente varón de 43 años, diagnosticado de cirrosis hepática de etiología mixta (cirrosis etílica y hepatitis C), en estadio C-12 de Child-Pugh y con puntuación MELD de 30 y MELD-Na de 33 en el momento del trasplante. Se encontraba en lista activa de trasplante desde hacía un año por haber presentado deterioro de la función hepatocelular y epi-sodios de descompensaciones clínicas (ascitis, episodios de peritonitis bacteriana espontánea, encefalopatía y desnutrición). Tras los episodios de deterioro de la función hepática, presentaba criterios de síndrome hepatorrenal de tipo 1, por lo que fue tratado con terlipresina, albúmina y sesiones de hemodiálisis intermitente días antes del trasplante.
El trasplante hepático se realizó sin complicaciones mediante técnica de preservación de cava, pero con necesidad de politrans-fusión de hemoderivados (hematíes 12 unidades de concentrados [UC], plasma 12 UC y plaquetas 2 UC) por hemorragia intraoperato-ria difusa durante la hepatectomía. Tras el trasplante presentó una lesión de isquemia-reperfusión moderada-grave con incremento de las aminotransferasas por encima de 2.000 U/l, aunque con aceptable recuperación de la función de síntesis del injerto en la primera sema-na. Se inició una pauta de inmunosupresión dirigida a la protección renal, con basiliximab, esteroides en dosis decrecientes y micofeno-lato mofetilo, para realizar cuádruple terapia con introducción retar-dada de tacrolimus y profilaxis antimicrobiana con pauta habitual de amoxicilina/ácido clavulánico y cefotaxima, y se añadió profilaxis antifúngica con fluconazol a bajas dosis (200mg/día). Se programó una profilaxis extendida durante 5 días.
A las 48 horas del trasplante precisó una reintervención quirúr-gica urgente por anemización progresiva y presencia de colecciones perihepáticas. Se observaron puntos sangrantes difusos en el lecho quirúrgico, y se realizó una limpieza de cavidad y hemostasia. Tras la reintervención quirúrgica mantuvo la hemodinámica y la tasa de hemoglobina estables, pero aparecieron signos de fallo renal agudo posoperatorio con tendencia a oliguria (nivel RIFLE F) [8]. Fue tratado con repleción intensiva de volumen, albúmina y perfusión continua de bajas dosis de furosemida y eufilina con buena respuesta diuré-tica. Al cuarto día posterior al trasplante se inició la administración de tacrolimus a dosis bajas (1mg cada 12h), alcanzando valores de tacrolimus en sangre de 3,7 ng/ml en estado estable, y se incrementó la dosis para mantenerlos alrededor de 5 ng/ml.
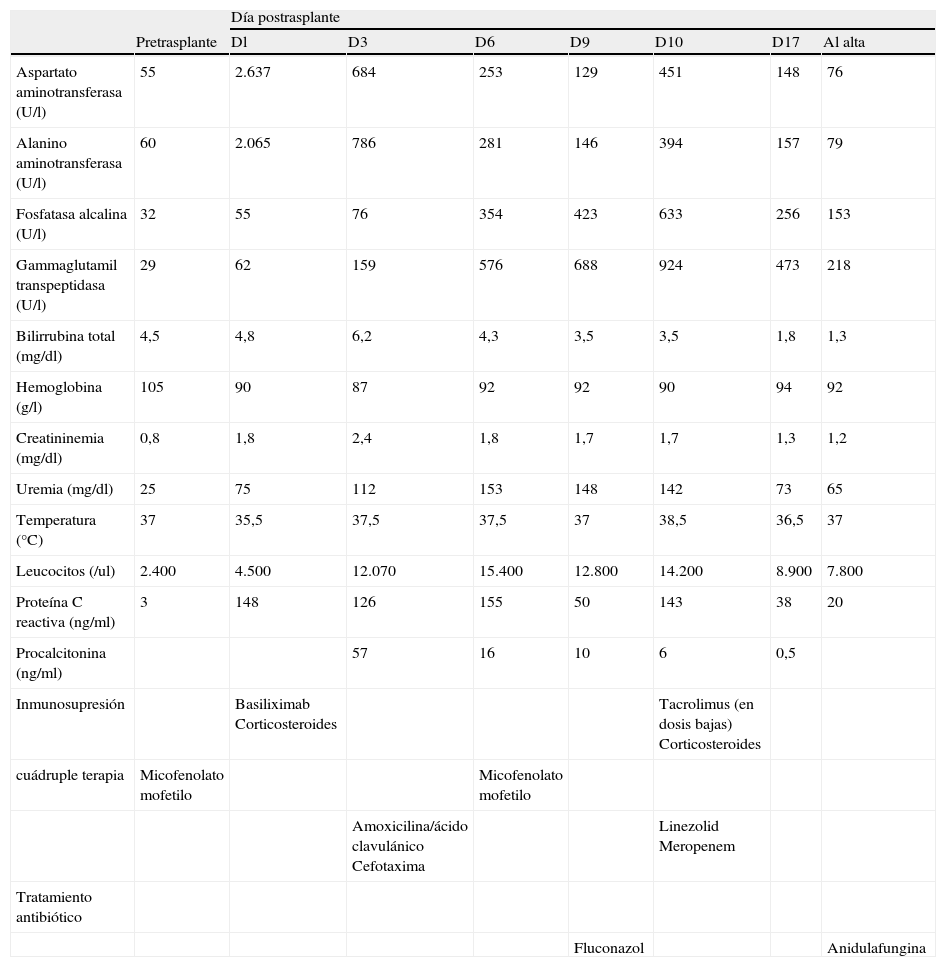
Al sexto día postrasplante, el paciente presentó episodios de ence-falopatía, de causa probablemente multifactorial, y febrícula (< 38°C) de forma intermitente. Se tomaron muestras de sangre para hemo-cultivos y muestras para cultivo del aspirado traqueal, de orina, de la herida quirúrgica y de los drenajes abdominales, y se inició un trata-miento antibiótico de amplio espectro con linezolid y meropenem, por lo que se decidió mantener la profilaxis con fluconazol. Se realizó una tomografía computarizada (TC) craneal que no mostró lesiones focales ni alteraciones densitométricas, ni en hemisferios cerebrales, cerebelo ni en estructuras troncoencefálicas, y una ecografía abdominal que mostraba el hígado sin alteraciones, una pequeña colección subhepática tabicada en su interior, y líquido peritoneal libre entre las asas intestinales, que parecían paréticas y llenas de líquido. Se confirmó una bacteriemia por Staphylococcus aureus resistente a me-ticilina (MRSA) y sensible a linezolid, y una colonización por Candida en tráquea y orina. La muestra de la herida quirúrgica mostró un cre-cimiento de estafilococos coagulasa-negativos, pero el aspecto clíni-co no confirmó el diagnóstico de infección. La radiografía de tórax no mostraba alteraciones parenquimatosas significativas, y sólo se ob-servaba un pequeño derrame pleural en el lado derecho. Se cambió a través de una guía el catéter venoso central cuyo cultivo (de la punta) no mostró crecimiento de microorganismos. La evolución inicial fue favorable, con mejoría clínica, desaparición de la fiebre, y disminu-ción de los biomarcadores de infección (tabla 1).
Parámetros biológicos de la evolución posoperatoria del paciente y tratamiento antimicrobiano
| Día postrasplante | ||||||||
| Pretrasplante | Dl | D3 | D6 | D9 | D10 | D17 | Al alta | |
| Aspartato aminotransferasa (U/l) | 55 | 2.637 | 684 | 253 | 129 | 451 | 148 | 76 |
| Alanino aminotransferasa (U/l) | 60 | 2.065 | 786 | 281 | 146 | 394 | 157 | 79 |
| Fosfatasa alcalina (U/l) | 32 | 55 | 76 | 354 | 423 | 633 | 256 | 153 |
| Gammaglutamil transpeptidasa (U/l) | 29 | 62 | 159 | 576 | 688 | 924 | 473 | 218 |
| Bilirrubina total (mg/dl) | 4,5 | 4,8 | 6,2 | 4,3 | 3,5 | 3,5 | 1,8 | 1,3 |
| Hemoglobina (g/l) | 105 | 90 | 87 | 92 | 92 | 90 | 94 | 92 |
| Creatininemia (mg/dl) | 0,8 | 1,8 | 2,4 | 1,8 | 1,7 | 1,7 | 1,3 | 1,2 |
| Uremia (mg/dl) | 25 | 75 | 112 | 153 | 148 | 142 | 73 | 65 |
| Temperatura (°C) | 37 | 35,5 | 37,5 | 37,5 | 37 | 38,5 | 36,5 | 37 |
| Leucocitos (/ul) | 2.400 | 4.500 | 12.070 | 15.400 | 12.800 | 14.200 | 8.900 | 7.800 |
| Proteína C reactiva (ng/ml) | 3 | 148 | 126 | 155 | 50 | 143 | 38 | 20 |
| Procalcitonina (ng/ml) | 57 | 16 | 10 | 6 | 0,5 | |||
| Inmunosupresión | Basiliximab Corticosteroides | Tacrolimus (en dosis bajas) Corticosteroides | ||||||
| cuádruple terapia | Micofenolato mofetilo | Micofenolato mofetilo | ||||||
| Amoxicilina/ácido clavulánico Cefotaxima | Linezolid Meropenem | |||||||
| Tratamiento antibiótico | ||||||||
| Fluconazol | Anidulafungina | |||||||
Al décimo día postrasplante el paciente presentó de nuevo fiebre de 38-38,5°C con un deterioro progresivo del estado general y un nuevo incremento de los biomarcadores inflamatorios (tabla 1). Se realizaron nuevos hemocultivos, y se tomaron muestras del aspi-rado traqueal, de orina y de los drenajes abdominales para cultivo. La herida presentaba buen aspecto. Precisó aumentar el soporte de ventilación mecánica e iniciar una infusión continua de fármacos vasoactivos (noradrenalina a dosis de 0,2 ug/kg/min). Tras la toma de muestras para cultivos, se modificó el tratamiento antifúngico y se inició un tratamiento con anidulafungina según la pauta habitual, con dosis de carga de 200mg en infusión de 180min y dosis de man-tenimiento de 100mg/día en infusión de 90min. Se realizó una TC abdominal que descartó la perforación de una víscera hueca, y que mostraba un derrame pleural bilateral, líquido libre perihepático en ligamento gastrohepático y gastroesplénico, y una colección subhe-pática de aspecto heterogéneo con tubo de drenaje en su interior. Se decidió realizar una segunda intervención quirúrgica. En quirófano se apreció el hígado con buen aspecto, colección fibrinoide y peritonitis plástica. Se tomaron muestras para microbiología y se realizó una limpieza de la colección subhepática y de cavidades. En los hemocultivos, cultivos de los drenajes abdominales y de las muestras obtenidas en la reintervención quirúrgica se aisló una cepa de Candida albicans resistente a fluconazol (concentración mínima inhibitoria [CMI] 8μg/ml) [12] y sensible a candinas (CMI anidulafungina 0,12μg/ml) y anfotericina B. Se mantuvo el tratamiento antifúngico durante 14 días. El paciente respondió favorablemente, con desaparición de la fiebre y mejoría progresiva del estado general. Durante su evolución no presentó efectos adversos significativos que pudieran relacio-narse con la medicación antifúngica, y no se observó incremento de las aminotransferasas. Se apreció un leve incremento de la gamma-glutamiltranspeptidasa durante los primeros 2 días de tratamiento, difícil de relacionar con la medicación dado que posteriormente los valores sanguíneos disminuyeron de forma significativa. Los cultivos de control, en los días 7 y 14 de tratamiento fueron negativos. El paciente pudo ser dado de alta de la unidad de cuidados intensivos en el día 25 postrasplante.
2DiscusiónLos RTH son pacientes de riesgo para presentar infecciones agudas en el período posoperatorio precoz. Las infecciones bacterianas son las que presentan una incidencia mayor, pero existen factores de riesgo, bien conocidos en los RTH [24,36], que incrementan la incidencia de infecciones fúngicas, producidas por Candida predominantemente. A estos pacientes se les denomina pacientes de riesgo alto de IFI.
En nuestro paciente se inició una profilaxis antifúngica posope-ratoria con fluconazol por presentar dos criterios de riesgo alto: dis-función renal previa con necesidad de hemodiálisis y politransfusión masiva durante la intervención quirúrgica. Posteriormente apareció otro factor de riesgo alto: la reintervención quirúrgica precoz.
En los pacientes de riesgo alto de IFI por Candida, la profilaxis está bien establecida [37], pero el seguimiento de las guías de práctica clí-nica es muy heterogénea [32], posiblemente en relación con los efectos adversos producidos por los fármacos de uso habitual. Aunque se recomienda el uso de fluconazol o anfotericina B liposómica, no están bien establecidas ni la dosis, ni la duración de la profilaxis. El estudio que demostró que la profilaxis con fluconazol produce una disminución significativa de la incidencia de IFI y de la mortalidad atribuible [46,52] utilizaba una dosis de 400mg/día durante un período prolongado (mediana de 72 días). Sin embargo, la recomendación actual en las guías es de 200-400mg/día durante 1-2 semanas, y en la práctica habitual se usan dosis próximas a 200mg/día [32]. Esta práctica puede resultar ineficaz por la necesidad de tratamiento empírico [9], producir una relación farmacocinética y farmacodinámica (PK/PD) subóptima, con incremento de la tasa de aislamientos de Candida resistentes a fluconazol [11,15], bien por desarrollo de resistencia en es-pecies previamente sensibles o por selección de especies resistentes, y tener un potencial grave impacto sobre el pronóstico [4]. En RTH de riesgo alto seleccionados, la profilaxis con candinas puede ser una alternativa [14,48].
El diagnóstico clínico de IFI por Candida puede ser extremadamen-te difícil en estos pacientes. La sintomatología es inespecífica, y los criterios de síndrome de respuesta inflamatoria sistémica aparecen con frecuencia en RTH sin criterios de infección activa. El diagnóstico a menudo es demasiado tardío, lo que condiciona el pronóstico. El hemocultivo, considerado el método de referencia para el diagnóstico de candidemia, tiene baja sensibilidad en los procedimientos automatizados (hasta un 43% de falsos negativos [20]), especialmente cuando existe una baja concentración de unidades formadoras de co-lonias [17,19]. Esto puede ocurrir cuando el paciente ha recibido profilaxis previa. Por otra parte, las muestras de especímenes tomados de lu-gares anatómicos no estériles tienen un valor relative Solo el estudio histopatológico de muestras adecuadas es diagnóstico de confirmación de candidiasis invasora [13,21]. Aunque nuestro paciente presentaba colonización multifocal de sitios no estériles, como es muy frecuente en los RTH, el diagnóstico de candidiasis invasora no puede por ello ser establecido. Pero el crecimiento de Candida en hemocultivos, ade-más de en el lecho quirúrgico, confirma el diagnóstico de invasión.
Se ha estudiado una extensa lista de posibles biomarcadores de infección y sepsis [46] que puedan anticipar el diagnóstico, siendo pro-calcitonina uno de los biomarcadores que muestra la mejor curva característica (ROC de su acrónimo en inglés) para el diagnóstico de sepsis, pero que sin embargo presenta un bajo valor predictivo posi-tivo en pacientes quirúrgicos con candidemia [26]. En nuestro caso se apreció un incremento moderado y difícil de interpretar, dado que el paciente había sido trasplantado, precisó una reintervención quirúr-gica precoz, presentó bacteriemia por MRSA y desarrolló candidiasis invasora en un intervalo de [10] días. La evolución de la proteína C reactiva se mostró más sensible a los cambios clínicos; aunque como otros marcadores de inflamación presenta una buena sensibilidad, su especificidad relacionada con la infección en pacientes quirúrgicos es baja.
También se han estudiado distintos componentes de las levadu-ras como biomarcadores específicos de infección fúngica [6,7,34,40,47]. Ac-tualmente sólo se acepta el betaglucano como marcador panfúngico de infección [13], pero es una prueba difícil de implementar de forma sistemática en el laboratorio, con falsos positivos en el período po-soperatorio precoz, y su uso es poco frecuente en la práctica clínica en España. La detección de ácidos nucleicos mediante la reacción en cadena de la polimerasa posiblemente se convertirá en la herramien-ta más útil para el diagnóstico precoz cuando se consiga una técnica estándar [6]. En nuestro centro no disponemos de la determinación de betaglucano, pero los ensayos preliminares de estudios moleculares para infección por Candida son esperanzadores, aunque en este caso no se realizaron.
La existencia de un biomarcador vicario de infección por Candida spp. o una técnica microbiológica de diagnóstico precoz no basada en el cultivo posibilitará en el futuro el inicio precoz del tratamiento an-tifúngico. Dado que todavía no existe ningún biomarcador que cum-pla esta función, el tratamiento precoz ha de ser siempre instaurado de forma empírica ante la sospecha clínica de IFI por Candida, y re-tirado en ausencia de criterios de diagnóstico clínico-microbiológico positivo. Esta pauta de tratamiento se ha mostrado muy efectiva en la práctica clínica (observación personal).
La evolución de nuestro paciente (de alto riesgo) fue favorable tras el tratamiento de una infección bacteriana y se mantuvo la profilaxis con fluconazol a bajas dosis para evitar las interacciones con tacro-limus. Pero ante la presentación de un nuevo deterioro clínico, se realizó la toma de cultivos y se modificó el tratamiento antifúngico. La confirmación de candidemia y candidiasis invasora se estableció tras recibir los resultados microbiológicos 3 días después. La resis-tencia a fluconazol de distintas especies de Candida, y especialmente en C. albicans, obliga a la determinación de la especie y el punto de corte de sensibilidad a los antifúngicos de todos los aislamientos en pacientes con candidiasis invasoras [49].
En la situación actual puede existir evidentemente riesgo de sobretratamiento, pero en pacientes de riesgo alto queda de sobra compensado por la elevada mortalidad atribuible a la IFI. Por otra parte, los estudios moleculares entre pacientes con candidiasis pro-badas o probables fueron positivos en el 85% (78-91%) de los casos, mientras que los hemocultivos lo fueron sólo en el 38% (29-46%) [6]. El tratamiento tardío, una vez recibidos los resultados de los estudios microbiológicos, conlleva un incremento significativo de la mortali-dad [16,25,31]. En nuestro medio, los resultados microbiológicos comple-tos, con sensibilidad a los antifúngicos, tienen un retraso aproximado de 72-96h desde la obtención de las muestras, aunque se han pro-puesto técnicas rápidas, como realizar un Etest directo [18].
En la mayoría de los casos el tratamiento de la peritonitis por Candida debe ser mixto, tanto quirúrgico (de limpieza) como médico (con antifúngicos adecuados), dado que en otros casos los resultados pueden ser muy pobres [29].
Aunque no se ha observado un incremento significativo de la resistencia global a fluconazol en el transcurso de los años, sí se ha producido un incremento de resistencias en poblaciones específicas. Además, los puntos de corte para considerar la sensibilidad a los antifúngicos han variado para conseguir una mejor correlación con el resultado clínico [38,39,43]. Una relación dosis/CMI>75 se asoció con el éxito terapéutico, con una sensibilidad del 93%, una baja proporción de falsos positivos (29%), y con una curva ROC de 0,83 [11]. Por ello, el uso de dosis bajas puede predisponer a la aparición de infecciones de brecha durante la profilaxis.
El tratamiento recomendado por las guías de práctica clínica en pacientes que han recibido fluconazol o presentan cuadros clínicos graves son las candinas [37]. Actualmente se conoce que no existe una resistencia cruzada entre fluconazol y candinas, y prácticamente to-dos los aislamientos de Candida resistentes a fluconazol son sensibles a las tres candinas, con CMI<0,25 ug/ml [27,41].
No hay evidencia científica que demuestre la superioridad de una candina frente a otra [28], aunque sí que existen diferencias en cuanto a la tolerabilidad y los efectos adversos, especialmente en relación con la hepatotoxicidad [51]. En el metaanálisis de Wang et al. [51], la anidu-lafungina presentó la menor tasa de riesgo de elevación de las enzi-mas hepáticas y no precisó el cese del tratamiento por la aparición de efectos adversos.
La anidulafungina, como la caspofungina o la micafungina, pre-senta un buen espectro de acción frente a Candida y tiene una inten-sa actividad fungicida in vitro con efecto antifúngico prolongado [2,33]. Es un lipopéptido que se distribuye ampliamente en el organismo y exhibe una actividad dependiente de la concentración. El mayor volumen de distribución y su metabolismo extrahepático son carac-terísticas diferenciales respecto a la caspofungina y la micafungina. La anidulafungina se metaboliza por rotura fisiológica del anillo y degradación de éste por esterasas plasmáticas no específicas, por lo que su farmacocinética no se ve afectada por la función hepática ni presenta interacciones con fármacos que se metabolizan en el siste-ma del citocromo P450. Los valores de tacrolimus en sangre se com-portaron de forma bastante previsible.
El parámetro PK/PD de las candinas que mejor se correlaciona con el pronóstico clínico es el área bajo la curva respecto a la CMI (ABC/CMI), aunque también se ha utilizado la concentración máxima (Cmax)/CMI. De forma global, una ratio Cmax/CMI mayor de [10] pare-cía correlacionarse con el éxito terapéutico [3], pero también se manifestó que no existía una clara correlación entre la actividad fungicida en suero, la CMI y el resultado clínico [41,50], por lo que se recomendaba utilizar la respuesta clínica como el principal determinante para el tratamiento de la candidiasis [38]. Sin embargo, estudios farmacodiná-micos más recientes demuestran que existe una dependencia espe-cífica de especie, por lo que en casos de infecciones por Candida serecomienda una ratio de fármaco libre ABC0-24/CMI de 5-7 para Candida parapsilosis y Candida glabrata y entre 10 y 20 para C. albicans, [1,23]. Además, el EUCAST [5] y el CLSI [44] han publicado nuevos puntos de corte de sensibilidad dependiente de especie -integrando datos molecula-res, clínicos y microbiológicos para cada una de las candinas-, que se comportan de forma más sensible para predecir el riesgo de fracaso clínico, y detectar la aparición de resistencias asociadas a mutaciones fks. La anidulafungina muestra una buena correlación entre la CMI y el pronóstico clínico, siendo sensibles el 99% de los aislamientos de C. albicans con los nuevos puntos de corte publicados y con un 93% de eficacia clínica.
En conclusión, en RTH de riesgo alto de IFI por Candida que han re-cibido previamente fluconazol a bajas dosis como profilaxis, pueden aparecer infecciones de brecha por especies resistentes a fluconazol. En estos casos, el tratamiento antifúngico de rescate precoz con candinas es efectivo, y posiblemente el factor con un impacto mayor en el pronóstico. La anidulafungina muestra un excelente perfil de seguridad con mínimos efectos adversos incluso en receptores con disfunción del injerto o disfunción renal, presenta una exposición al fármaco previsible y, en nuestro caso, una buena correlación con el pronóstico clínico.
3Declaración de los autoresLos autores declaran que el contenido del presente artículo es original, no ha sido publicado previamente, ni está enviado ni sometido a consideración por ninguna otra publicación, ni en su totalidad ni en parte alguna.
Conflicto de interesesJuan Carlos Pozo-Laderas ha recibido pagos por su participación en actividades de formación patrocinadas por Pfizer, Gilead y MSD, y participa en un estudio de investigación financiado por Astellas. Antonio Pontes-Moreno no declara conflicto de intereses.
Uncited references