El trasplante de órgano sólido ha presentado un aumento en la supervivencia en las últimas décadas en relación con el perfeccionamiento de la técnica quirúrgica, la protocolización del manejo inmu-nosupresor y el uso de profilaxis antimicrobiana. A pesar de ello, la infección fúngica invasiva (IFI) es la mayor causa de morbimortalidad en este grupo de pacientes. En el trasplante renal, la IFI más frecuente es la candidiasis invasiva, que habitualmente se asocia al empleo de nutrición parenteral total, de tratamiento antibiótico de amplio espectro y a la cirugía abdominal.
Caso clínicoPresentamos el caso de una paciente con trasplante renopancreático reciente que desarrolla una candidemia persistente asociada a catéter, causada por Candida glabrata, que se trata con anidulafungi-na. Presentó una buena evolución clínica y no se observaron interacciones farmacológicas relevantes.
Se discuten las posibles causas y las alternativas diagnóstico-terapéuticas de este tipo de infección.
In recent decades, there has been an increase in the survival of recipients of solid organ trans-plants related to the improvement of the surgical technique, the introduction of protocols for immunosu-ppressive therapy, and the use of antimicrobial prophylaxis. Nonetheless, invasive fungal infection (IFI) is currently the major cause of morbidity and mortality in this group of patients. Invasive candidiasis is the most common IFI found after renal transplantation and is usually associated with total parenteral nutrition, broad-spectrum antibiotic therapy and abdominal surgery.
Clinical caseWe report the case of a recent kidney-pancreas transplant recipient who developed a persis-tent catheter-related candidemia caused by Candida glabrata. The patient was treated with anidulafungin and had a good clinical course with no significant drug interactions.
We discuss the possible causes and diagnostic and therapeutic alternatives of this kind of infection.
En las últimas décadas el trasplante de órgano sólido (TOS) ha presentado un aumento de la supervivencia en relación tanto con el perfeccionamiento de la técnica quirúrgica, como del tratamiento inmunosupresor y de la profilaxis antimicrobiana. A pesar de ello, la infección fúngica invasiva (IFI) sigue siendo la mayor causa de mor-bimortalidad en este grupo de pacientes. En el trasplante renal, la IFI más frecuente es la candidiasis invasiva, que aparecerá sobre todo en los individuos que, además de la cirugía abdominal, han recibido nu-trición parenteral total o tratamiento antibiótico de amplio espectro. Las candidiasis invasivas se asocian a una alta mortalidad atribuible (35-40%). La instauración de un tratamiento antifúngico temprano y adecuado es fundamental para mejorar el pronóstico de estos pacien-tes. En este sentido, el conocimiento de la flora microbiana de nues-tro entorno, del origen y de la extensión de la infección, nos ayudará a seleccionar el antifúngico más correcto y a ajustar la duración del tratamiento.
Caso clínicoMujer de 34 años diagnosticada de diabetes mellitus de tipo 1 desde los 13 años, que había desarrollado un síndrome metadiabéti-co avanzado con retinopatía diabética, polineuropatía e insuficiencia renal crónica en fase terminal. A los 32 años entró en programa de hemodiálisis convencional. Desde entonces se encontraba en lista de espera para trasplante renopancreático, que acaba realizándose 2 años después.
La fase postoperatoria temprana del trasplante transcurre sin complicaciones relevantes. En ese momento se inició inmunosupre-sión con tacrolimus, micofenolato mofetilo y corticoides, además de profilaxis antifúngica con fluconazol (100mg/día), según el protoco-lo de nuestro centro.
En el segundo día postrasplante, la paciente presenta un pico fe-bril, por lo que se inicia de forma empírica cobertura antibiótica de amplio espectro con imipenem y vancomicina, y se realizan cultivos de sangre, orina y frotis de la herida quirúrgica. De todos los cultivos, sólo resulta positivo este último, identificándose Staphylococcus au-reus sensible a la meticilina.Posteriormente, la paciente comienza con un cuadro de dolor ab-dominal e intolerancia digestiva, que obliga a instaurar nutrición pa-renteral total a través del catéter venoso central (CVC) colocado en la vena yugular izquierda durante la intervención. En ese momento se descartan complicaciones abdominales mayores mediante pruebas de imagen (tomografía computarizada [TC] y ecografía abdominal). En el 10.° día postrasplante, además de la persistencia de la clí-nica abdominal y de la nutrición parenteral, y en el seno del trata-miento con imipenem y vancomicina, se presenta un nuevo episodio febril acompañado de afectación del estado general e inestabilidad hemodinámica que obliga a su ingreso en la unidad de cuidados in-tensivos (UCI).
En este momento, con la paciente en situación de shock de ori-gen séptico, se realizan nuevos cultivos de sangre y de orina, y se retira el CVC de localización yugular, cuya punta también se culti-va. Además, se cambia el tratamiento antibiótico previo por imipe-
nem, daptomicina y amikacina. Por otra parte, teniendo en cuenta los múltiples factores de riesgo presentes en la paciente para el desarrollo de alguna IFI, se decide añadir cobertura antifúngica de amplio espectro con una equinocandina. En este caso, se eligió ani-dulafungina a dosis habituales (dosis de carga de 200mg y mante-nimiento con 100mg/día). Unas 48 horas después del ingreso en la UCI, y ya sin datos de alteraciones en la coagulación que preci-pitasen complicaciones hemorrágicas graves, se retira también un catéter tunelizado para hemodiálisis que portaba la paciente en la vena subclavia derecha.
La evolución clínica posterior fue buena, sin que apareciesen más fallos orgánicos y pudiéndose retirar el apoyo inotrópico iniciado al ingreso. En la punta del catéter colocado en el acto quirúrgico y en los hemocultivos periféricos creció Candida glabrata, con una con-centración mínima inhibitoria (CMI) para anidulafungina de 0,03mg/l (caspofungina, 0,06mg/l; micafungina, 0,015mg/l; anfoterici-na B, 0,38mg/l; fluconazol, 64mg/l; voriconazol, 0,5mg/l; Yeastone Sensititre®-Trek Diagnostic System). El cultivo de la punta del catéter tunelizado para hemodiálisis resultó negativo. Se realizaron hemo-cultivos seriados de control cada 48 horas para valorar la respuesta terapéutica, y se demostró la persistencia de una candidemia durante 96 horas. Se seguía aislando la misma C. glabrata identificada al in-greso en nuestra unidad.
Se realizó un ecocardiograma que descartó la presencia de datos compatibles con endocarditis fúngica, y en la exploración del fondo de ojo tampoco había signos de endoftalmitis. Ambos estudios se re-pitieron a los 5-7 días y siguieron resultando normales.
La paciente es dada de alta de la UCI en el día 16.° postrasplante, se encuentra afebril y con normalización de los parámetros analíti-cos relacionados con la infección. La cobertura antifúngica con ani-dulafungina a dosis de 100mg/día se mantuvo durante 4 semanas, con buena tolerancia de ésta y sin que se observaran interacciones farmacológicas ni efectos secundarios relevantes. Se realizaron he-mocultivos de control en los días 7.°, 14.° y 21.° de tratamiento, que fueron negativos.
La paciente fue dada de alta del hospital en el día 45.° postrasplan-te sin evidencia de nuevas complicaciones infecciosas.
DiscusiónEl TOS ha presentado un aumento progresivo de la supervivencia en las últimas décadas en relación con una mejora en la conservación de los órganos y en la técnica quirúrgica, con el desarrollo de nuevos inmunosupresores y con la profilaxis antimicrobiana. Especialmente, se ha conseguido disminuir de forma significativa la mortalidad aso-ciada al rechazo. Sin embargo, como consecuencia del aumento de la inmunosupresión, están cobrando gran importancia las complicacio-nes infecciosas. Entre ellas, la IFI se ha convertido en la más relevante, por el aumento de incidencia que ha presentado y por ser la mayor causa de morbimortalidad en el TOS23.
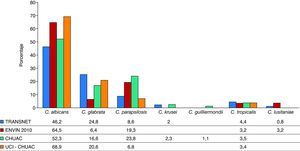
La candidiasis invasiva es la IFI más habitual (53%) en los recepto-res de TOS, seguida de la aspergilosis (19%) y, ya con menor frecuencia, de la criptococosis (8%) o la zigomicosis (2%)23. También se sabe que el tiempo postrasplante es otro aspecto clave a tener en cuenta ante la sospecha de infección en este grupo de pacientes. Dentro de las IFI, las candidiasis invasivas son las que se presentan de forma más tem-prana, con una mediana de tiempo desde el trasplante hasta su apa-rición en torno a los 3,5 meses (103 días), seguidas de la aspergilosis, que tiene una mediana de 184 días, y de la criptococosis (mediana de 575 días)23. Por otra parte, el tipo de órgano trasplantado condiciona igualmente la etiología de las IFI. En el trasplante de intestino delgado, el 85% de ellas van a ser candidiasis, mientras que en el trasplante pulmonar tan sólo suponen el 23%; en este caso predominan la as-pergilosis (44%) y la infección por otros mohos. En el trasplante renal la candidiasis representa el 49% de las IFI, seguido de la aspergilosis con un 14%23. Por último, conviene tener muy en cuenta la epidemio-logía local. En las últimas décadas se ha producido un aumento de los aislamientos de especies de Candida diferentes de Candida albicans, pasando de un 45% en Estados Unidos a finales de la década de 1990, a un 62% en la actualidad15,25. Esta evolución temporal se ha observado en todas las localizaciones geográficas, aunque de forma menos mar-cada en nuestro medio, donde C. albicans aún constituye el 53,89% de los aislamientos según el informe ENVIN del año 201020. Dentro del conjunto de infecciones causadas por otras especies de Candida, la especie que se aísla con más frecuencia suele ser C. glabrata (12-27%), seguida de Candida parapsilosis (8-10%) y Candida tropicalis (6-9%), aunque si analizamos las candidemias de forma aislada, C. parapsilosis puede ser la especie más frecuente (después de C. albicans), llegan-do a suponer el 20% del total de las candidemias15,20. Este hecho es importante, ya que va a condicionar la elección de los tratamientos antifúngicos. Mientras que C. albicans y C. parapsilosis son sensibles a fluconazol, en torno al 23% de los aislamientos de C. glabrata son re-sistentes a éste (resistencia a voriconazol, 8%; itraconazol, 52%)15. A su vez, C. albicans y C. glabrata suelen ser sensibles a las equinocandinas, pero C. parapsilosis tiene una sensibilidad disminuida1.
En la figura 1 se presentan las etiologías de las candidemias/candidasis invasivas observadas en distintas situaciones (TOS y pacientes de UCI del Complexo Hospitalario Universitario A Coruña).
Distribución de Candida spp. en distintos grupos de pacientes. CHUAC: candidemias en el conjunto del Complexo Hospitalario Universitario de A Coruña (años 2009-2011), datos no publicados; ENVIN4: candidemias primarias y asociadas a catéter en las unidades de cuidados intensivos (UCI) españolas; TRANSNET1: candidiasis invasiva en pacientes trasplantados; UCI-CHUAC: candidemias en la UCI del Complexo Hospitalario Universitario de A Coruña (años 2009-2011), datos no publicados.
En el caso clínico que nos ocupa, la paciente desarrolla una fun-gemia en el postoperatorio de un trasplante renal, aunque había re-cibido profilaxis previa con fluconazol. Tanto por la situación clínica de gravedad, como por el uso previo de un azol, se decidió iniciar tratamiento con equinocandinas, considerando su potente actividad fungicida de amplio espectro22. La caspofungina y la micafungina se metabolizan a nivel hepático, la primera mediante hidrólisis y N-ace-tilación, mientras que la micafungina lo hace a través de la vía aril-sulfatasa, catecol-O-metiltransferasa e hidroxilación vía CYP3A, te-niendo poca afinidad por la vía del CYP450. Ambas presentan menos interacciones medicamentosas que los azoles12. Sin embargo, cuando se evalúa la coadministración de caspofungina con tacrolimus, se observa una reducción de la concentración sérica en torno al 20%6.
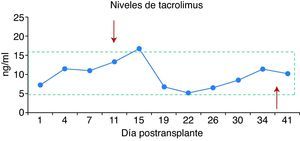
Por el contrario, la anidulafungina no tiene metabolismo hepático, metabolizándose por rotura fisiológica del anillo y degradación de éste por esterasas plasmáticas no específicas, con lo que no produce interacciones clínicamente significativas con otras medicaciones12. Por eso, tratando de evitar interferencias en los niveles de tacrolimus —el anticalcineurínico de elección en el protocolo de trasplante renal de nuestro hospital—, se decidió iniciar tratamiento con esta última candina. En la figura 2 se puede observar cómo los niveles de inmu-nosupresión se mantuvieron en el rango terapéutico durante todo el tratamiento con anidulafungina (en nuestro centro no se evalúan los niveles de micofenolato mofetilo).
Una vez identificada C. glabrata en los hemocultivos/punta de ca-téter, y conocida su sensibilidad, decidimos mantener el tratamiento con la candina inicial. Conviene destacar que nuestra paciente tenía todos los factores de riesgo identificados como predictores de candi-demia por C. glabrata en el modelo predictivo desarrollado por Tapia et al29 (ausencia de fracaso renal, estancia hospitalaria menor de 7 días, cirugía abdominal y utilización previa de fluconazol). Este modelo se desarrolló en pacientes críticos, pero tiene las limitacio-nes de haberse hecho de forma retrospectiva y en un solo centro, por lo que ha de ser validado en estudios multicéntricos, prospectivos e, idealmente, que incluyan también a otras poblaciones.
Otro aspecto destacable en nuestro caso es la persistencia de he-mocultivos positivos tras el inicio del tratamiento antifúngico co-rrecto. Clásicamente, se habla de bacteriemia o fungemia persistente cuando los hemocultivos continúan siendo positivos más allá de 72h de iniciar un tratamiento antimicrobiano adecuado8,17,18. Sin embargo, no hay un consenso claro en esta definición, ya que en algunos estu-dios se considera candidemia persistente al aislamiento de la misma especie de Candida durante el tratamiento, independientemente del tiempo de evolución14,21. Por otra parte, si se revisa la bibliografía, se observa que los tiempos medios de aclaramiento de la candidemia son habitualmente más largos (50% al 5.° día)19.
La persistencia de cultivos positivos nos obligó a plantearnos cier-tas situaciones, como la posible persistencia del foco infeccioso. La tromboflebitis asociada a catéter es una de las causas más frecuentes de candidemia persistente. En este caso es importante recordar que la exploración física tiene una baja sensibilidad para detectar la trom-bosis venosa. Sólo el 24% de los pacientes con bacteriemia por catéter que presentaban trombosis venosa asociada, y que fue diagnosticada por eco-Doppler, tenía datos de tromboflebitis en la exploración físi-ca5. De ello se puede concluir que es necesario realizar un eco-Doppler vascular o una TC ante la presencia de una fungemia persistente, aun-que la exploración física sea normal18. En caso de tromboflebitis supu-rativa, se recomienda la retirada del catéter y drenaje o la resección de la vena, si es factible (venas superficiales, infección que se extiende a la pared de la vena o fracaso terapéutico a pesar de tratamiento ade-cuado)18. Incluso, aunque no se documente tromboflebitis, en caso de candidemia relacionada con catéter en las guías IDSA para el manejo de la candidiasis se recomienda la retirada del catéter, con un grado de recomendación A-II18,22, a partir de la disminución de la duración de la candidemia (5,6 ± 0,8 días frente a 2,6 ± 0,5 días; p < 0,001) y en la reducción de la mortalidad9,16,26. Estas recomendaciones se apoyan
en estudios con diferentes limitaciones (pequeño tamaño muestral, retrospectivos, interferencia por factores de confusión o que incluyen pacientes con candidiasis diseminada o pacientes con candidemia sin CVC en el momento del diagnóstico). Además, recientemente se han publicado trabajos que ponen en cuestión la mencionada recomenda-ción. Nucci et al19 analizaron a 842 pacientes con candidemia y CVC en el momento del diagnóstico, procedentes de dos estudios aleato-rizados, doble ciego, en los que se comparaba el uso de micafungina frente a la anfotericina B y la caspofungina, respectivamente. En su análisis, examinaron los efectos de retirar el CVC en las primeras 24h o en las primeras 48h, frente a un grupo control en el que no se reti-raba el catéter durante el tratamiento de la fungemia. No encontraron diferencias entre los diferentes grupos en cuanto a la presentación de candidemias persistentes o recurrentes, al éxito terapéutico, o al tiempo de erradicación microbiológica. Aunque en el análisis univa-riante se apreciaba asociación entre la retirada temprana del CVC y la supervivencia a los 28 y 42 días, esta relación desaparecía en el aná-lisis multivariante, donde sólo se asoció a factores del huésped, como la edad, una puntuación de APACHE II elevada y la persistencia de la neutropenia. Los autores concluyen que la retirada temprana del CVC en adultos no neutropénicos con candidemia no influye en el pronós-tico y que la recomendación de retirar todos los catéteres en estos pa-cientes puede no estar justificada. Apoyan un manejo individualizado de los CVC, retirando los que sean innecesarios y valorando el riesgo-beneficio del recambio de éstos en los pacientes que no responden al tratamiento antifúngico óptimo19. Este estudio presenta, al menos, dos limitaciones: a) es un análisis de subgrupos, no es un trabajo dise-ñado con el objetivo primario de estudiar la relación entre la retirada del catéter y la supervivencia, y b), por otro lado, todos los pacientes estaban tratados con equinocandinas o anfotericina B liposomal, que presentan mejor actividad frente al biofilm de Candida respecto al flu-conazol7, lo que podría compensar el posible efecto beneficioso de la retirada del catéter cuando se usen otros antifúngicos.
Otros focos a descartar en caso de candidemia persistente son los abscesos a distancia, para lo que se recomienda la realización de una TC de cabeza, tórax y abdomen en función de la clínica del individuo. Tam-bién hay que excluir la presencia de una endocarditis infecciosa (EI), ya que, aunque es poco frecuente (sólo el 1,2% de las endocarditis se deben a Candida)2, se ha visto que el 3,7% de las candidemias se pueden complicar con ella28. Además, el 33,3% de los casos de endocarditis in-fecciosa por Candida cursa con candidemia persistente y presenta una mortalidad superior (el 30,3 frente al 17%) a la endocarditis bacteriana2. Para confirmar o descartar este tipo de infección, es preciso realizar un estudio ecocardiográfico de calidad (preferiblemente transesofágico) en los casos siguientes: presencia de prótesis valvulares, utilización de CVC de corta duración, origen nosocomial de la infección (son factores de riesgo asociados a la endocarditis por Candida)2, así como cuando haya datos clínicos indicativos de endocarditis, tromboflebitis o metás-tasis sépticas a distancia, existencia de una valvulopatía, antecedente de un episodio de EI, y persistencia de la fiebre o de la positividad de los hemocultivos al tercer día de tratamiento antimicrobiano apropiado17.
Al mismo tiempo, en caso de candidemia, se recomienda realizar una exploración del fondo de ojo para descartar la presencia de en-doftalmitis22. En los pacientes que no presentan signos de afectación ocular en la primera fundoscopia, es preciso repetir la exploración al cabo de 2 semanas, ya que, aunque es poco frecuente (menos del 2%), es diagnóstica de candidiasis invasiva incluso en ausencia de candi-demia, y nos obliga a prolongar el tratamiento hasta las 4-6 semanas o hasta la estabilización o la resolución de las lesiones documentadas en el fondo de ojo22. En nuestra paciente, los estudios de imagen rea-lizados, así como el fondo de ojo, fueron repetidamente negativos.
Otra situación a considerar es la aparición de resistencia en el microorganismo. La actividad fungicida es similar para las tres equi-nocandinas, aunque hay algunas series en las que la anidulafungina presenta valores de CMI para C. parapsilosis y C. glabrata más bajos que los de la caspofungina o la micafungina4,7. En caso de candidemia persistente, es importante testar la evolución de la CMI de la cepa identificada, ya que puede cambiar a lo largo del tratamiento. Se han descrito casos de incremento progresivo de la CMI de C. glabrata du-rante el tratamiento con micafungina, relacionado con una menor afi-nidad de la micafungina por la 1→3-β-D-glucano sintetasa de las cepas aisladas y que condicionó un fallo terapéutico10. Finalmente, aunque se desconoce su significación clínica exacta, debemos conocer la exis-tencia, al menos in vitro, de la posibilidad de aparición de un efecto paradójico (reducción estadísticamente significativa en el efecto an-tifúngico cuando se usan concentraciones de fármaco mayores de las estándares). Este fenómeno se ha observado con todas las equinocan-dinas, pero es más frecuente en el caso de la caspofungina3.
Y, por último, debe considerarse una inadecuada elección o dosi-ficación del antifúngico. Al seleccionar un antifúngico hay que tener en cuenta su capacidad de penetrar en el foco de infección, porque puede ser causa de fallo terapéutico. En estudios in vitro se ha de-mostrado que la anfotericina B puede tener una actividad reducida frente a especies de Candida en biofilm13, y también se ha visto una mala penetración de ésta en las vegetaciones y coágulos en modelos experimentales de endocarditis infecciosa27. Las equinocandinas, es-pecialmente la anidulafungina, presentan una potente actividad in vitro frente a aislamientos de Candida en biofilms11,24.
También es preciso asegurarse de que las dosis usadas son las co-rrectas, en función del paciente y de la situación clínica a la que nos enfrentamos. Así, por ejemplo, en comparación con las que se em-plean para el tratamiento de una fungemia no complicada, se precisan dosis mayores de equinocandinas cuando se utilizan en endocarditis por Candida22. Del mismo modo, la interacción con otros fármacos puede obligarnos a modificar la dosis de los antifúngicos. En este sentido, es preciso aumentar la dosis de caspofungina a 70mg/día, ya que aumenta su aclaramiento, cuando se coadministra con rifampici-na, dexametasona, fenitoína, carbamazepina, efavirenz o nevirapina. En el caso de la ciclosporina, conviene saber que la coadministración con equinocandinas aumenta el área bajo la curva de caspofungina y anidulafungina, aunque no se requiere ajuste de dosis, mientras que con la micafungina, al actuar como inhibidor del metabolismo de la ciclosporina, se necesita controlar sus niveles séricos12.
Con la elección de anidulafungina, a las dosis empleadas, se ha podido solucionar este tipo de problemas en nuestra paciente.
En conclusión, el presente caso clínico nos recuerda la importan-cia de la candidemia en los pacientes con TOS. La instauración de un tratamiento antifúngico temprano y adecuado ayudará a disminuir la morbimortalidad elevada que tienen este tipo de infecciones. En este sentido, el conocimiento de la epidemiología local y el estado clínico del paciente son factores determinantes al seleccionar el tratamiento inicial, que habrá de ajustarse en función de los resultados microbio-lógicos. Es imprescindible realizar hemocultivos de control para con-firmar la buena respuesta al tratamiento. En caso de una candidemia persistente, hay que investigar las posibles causas (identificación del foco y de las posibles complicaciones; confirmar la sensibilidad de la cepa aislada frente al antifúngico empleado; ajustar las dosis en fun-ción del foco de infección y de las posibles interacciones medicamen-tosas). Se precisan nuevos estudios que ayuden a definir el papel de la retirada sistemática de los CVC en presencia de candidemia asociada, al menos cuando se usan equinocandinas como tratamiento.
Conflicto de interesesLuis Álvarez Rocha ha recibido honorarios de Pfizer en relación con el desarrollo de este manuscrito.