El propósito de esta revisión era presentar las bases bilógicas y fisiopatológicas de la formación de neuromas como causa de los síndromes dolorosos regional (SDRC) tipo II y el uso de la monitorización neurofisiológica intraoperatoria en el tratamiento de los SDRC tipo II secundarios a neuromas en continuidad y en nervios adheridos en cicatrices tras cirugías previas.
The purpose of this review article was to present the biological and physiological bases of the Complex Regional Pain Syndrome (CRPS) type II and the use of iIntraoperative neurophysiological monitoring in the treatment of CRPS type II secondary to neuroma-in-continuity and scar-tethered nerves.
El síndrome de dolor regional complejo (SDRC) es una condición de las extremidades que se caracteriza por dolor desproporcionado (en duración o intensidad) para el curso habitual de una lesión particular. El dolor es regional y se asocia con cambios motores, sensoriales, vegetativos (sudomotores, vasomotores) y/o tróficos (en etapas más tardías) de las extremidades.
La nueva terminología de la “IASP” (Asociación Internacional para el Estudio del Dolor) define a estos cuadros como síndrome doloroso regional complejo (SDRC) y se clasifica en dos grandes grupos: uno es el síndrome doloroso regional complejo tipo I que coincide con la antigua “distrofia simpático refleja”, y el síndrome doloroso regional complejo tipo II conocido antiguamente como “causalgia”. La nueva terminología de los SDRC ha sido desarrollada por un comité especial en consenso1 para reemplazar a los antiguos términos de distrofia simpático refleja y causalgia ya que existía un uso indiscriminado de estos términos sin un diagnóstico preciso, sin existir criterios de descripción del proceso, y sin unas reglas consistentes sobre la participación del sistema nervioso simpático en el desarrollo de estos cuadros.
Síndrome doloroso regional complejo tipo II (antigua causalgia)El SDRC tipo II es aquel síndrome doloroso que surge después de una lesión nerviosa. Se puede decir que puede ser similar clínicamente al tipo I en todos los aspectos. Dolor espontáneo de reposo, incluso alodinia, pero lo que lo diferencia es que está limitada al territorio nervioso que está lesionado. Se pueden observar cambios tróficos como en el SDRC tipo I (antigua distrofia simpática refleja) como edema, cambios del flujo de la piel, cambios de temperatura, actividad sudorosa anormal e incluso se puede observar también rigidez igual que en el otro cuadro. Característicamente se puede observar pérdida de sensación o sensibilidad en dicha zona o déficit neurológicos en dicho territorio y raramente pérdida de función motora a no ser que sea una lesión de un nervio proximal. Suele existir un signo de Tínel positivo indicando el lugar de la lesión. El diagnóstico se va a basar en la existencia de déficit nervioso en dicho territorio.
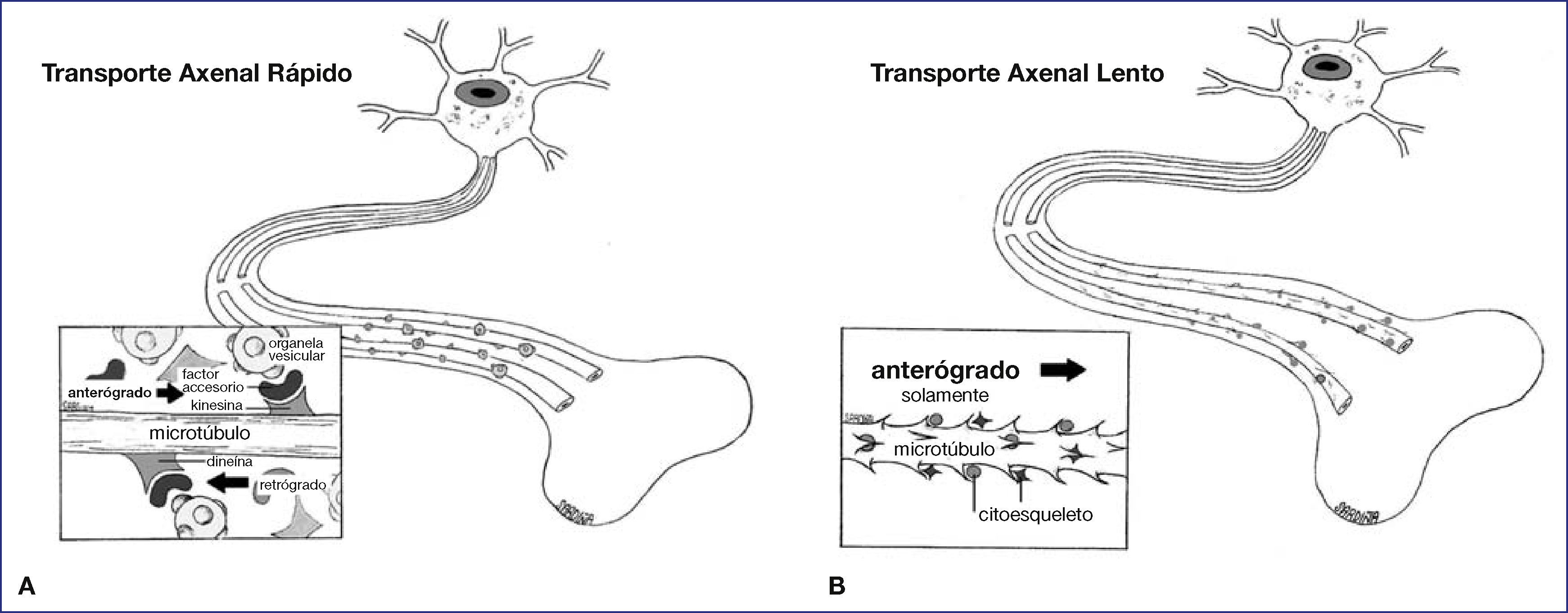
FisiopatologíaMorfológicamente, los nervios están constituidos por la prolongación de cada neurona localizada en la médula espinal que se denomina axón o fibra nerviosa; cada fibra nerviosa está rodeada de un tejido conjuntivo llamado endoneuro. El conjunto de axones se reúne para formar los grupos fasciculares los cuales estarán limitados anatómicamente por el perineuro. Finalmente, la suma de los diferentes grupos fasciculares dará lugar al nervio periférico limitado en su periferia por el epineuro. Todo este mecanismo se mantiene gracias a la existencia de un equilibrio perfecto en el axón que es controlado por el soma neuronal, desde una distancia que puede llegar a ser de un metro de longitud. No existe ninguna célula de la economía humana que tenga su soma con su núcleo y presente una prolongación celular de dichas dimensiones. Para ello, la neurona debe tener algún sistema para mantener funcionando esta maquinaria a tal distancia y ello lo consigue gracias al flujo o transporte axonal.
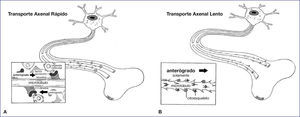
Existe un transporte interno dentro del axón, denominado flujo o transporte axonal, que puede ser de dos tipos: anterógrado y retrógrado. El conocimiento del flujo axonal va a ser fundamental para entender la fisiopatología de la formación de neuromas y de los SDRC tipo II. Dentro del transporte axonal anterógrado se objetiva un flujo rápido de vesículas sinápticas, precursores de membrana y vesículas del retículo endoplásmico rugoso, que son transportados a un ritmo de 410mm/día. En condiciones normales, estos materiales son pre-empaquetados por el aparato de Golgi y el retículo endoplásmico rugoso. Las organelas vesiculares son desplazadas distalmente mediante una proteína, la kinesina citoplasmática, que interacciona con el microtúbulo del axón, siendo la interacción modulada por una serie de factores proteicos denominados “factores accesorios”. Conjuntamente, existen evidencias científicas de la existencia de otro flujo axonal rápido, de carácter retrógrado (desde distal hacia el soma neuronal), a un ritmo de 210mm/día, cuyo motor es otra proteína denominada “Dyneina citoplasmática” y que transporta factores neurotróficos. Este transporte juega un papel fundamental en el mecanismo de regeneración nerviosa, de tal forma que tras una lesión axonal se transporta diferentes factores, desde el lugar de la lesión hacia proximal, que funcionan como mensajes de trofismo para estimular la reparación y regeneración. Pero si la lesión nerviosa no es reparada este transporte axonal retrógrado rápido es el que iniciara la formación de neuromas (figs. 1A y 1B). Diferentes sustancias han sido identificadas como factores de trofismo como la proteína NGF, neuroleukin, apolipoproteína E, laminin, fibronectina, IGF I (insulin-like growth factors), GDNF (glia-derived nexin factor), FGF (fibroblast growth factor) y EGF (epidermal growth factor). La consecuencia de las señales de trofismo, que llegan al soma neuronal por flujo axonal rápido retrógrado, es que la neurona cambie su función. Se disminuye la síntesis de neurotransmisores y disminuye el flujo axonal anterógrado rápido, el núcleo del soma neuronal se desplaza a la periferia y aumenta la actividad de síntesis proteica (predominan retículo endoplásmico rugosos y mitocondrias en el citoplasma neuronal) como paso inicial para la fabricación de todos los elementos necesarios para la regeneración como citoesqueleto, microtúbulos, etc. Todos estos materiales estructurales se transporta mediante un flujo axonal diferente, el flujo anterógrado lento, que se mueve a una velocidad de 1 a 8mm/día, para reparar la lesión de los axones a distancia2.
Si las nuevas yemas axonales, que han sido regeneradas gracias al transporte axonal lento anterógrado, no encuentran cabo distal estas se escaparan formando el neuroma. Los neuromas en continuidad ocurren dentro de un nervio intacto en respuesta a una lesión interna de fascículos o grupos fasciculares.
Desde el punto de vista microscópico existe una proliferación aberrante de axones agrupados en múltiples fascículos de pequeño diámetro, separados entre sí por un gran número de células perineurales, fibroblastos y miofibroblastos. Los neuromas dolorosos contienen un gran número de fibras no mielínicas de pequeño diámetro y en mayor proporción que las fibras con mielina. Este predominio de fibras sin elemento aislante mielínico permite el fenómeno de señales cruzadas y la generación de focos supernumerarios que actuarían como puntos de amplificación de los estímulos nociceptivos3.
Etiología y clasificaciónCon la excepción de los síndromes compresivos, la mayoría de los cuadros dolorosos en relación con los NNPP (SDRC tipo II) que los cirujanos de la mano vamos a encontrar comúnmente se pueden clasificar en tres grupos diferentes4,5:
- 1.
Neuromas terminales (fig. 2A)
- 2.
Neuromas en continuidad (fig. 2B)
- 3.
Atrapamiento de NNPP en cicatrices (fig. 2C).
Los neuromas terminales son el grupo más fácil de entender y de tratar. Ocurren por el desarrollo y crecimiento de fascículos axonales tras la sección distal de un nervio. Son una forma desregulada de regeneración nerviosa. Los factores neurotróficos provenientes de los tejidos que rodean el nervio cortado son transportados hacia el soma neuronal por transporte axonal retrógrado rápido y estimulan la síntesis de proteínas para fabricar citoesqueleto y microtúbulos que son transportados por transporte axonal anterógrado lento para reparar la lesión. Cuando las nuevas yemas regeneradas no encuentran el cabo distal estas siguen creciendo, formando el neuroma terminal.
Los neuromas en continuidad ocurren dentro de un nervio intacto donde ha existido la lesión de fascículos nerviosos o grupos fasciculares. Yuksel y cols.6 establecieron la hipótesis de que un perineuro intacto es una barrera para que los axones regenerados escapen. Cuando esta barrera conjuntiva está dañada entonces es cuando ocurre el escape de axones regenerados a través del tejido epineural de una forma desorganizada, acompañado de proliferaciones de fibroblastos, células de Schawnn, y vasos sanguíneos formando el neuroma7.
Los nervios adheridos a cicatrices, son muy similares al anterior grupo y muchos investigadores y clínicos los consideran a ambos como variantes del mismo problema. De hecho, cuando nos encontramos neuromas en continuidad, estos siempre se acompañan de cicatrices y adherencias alrededor. Un importante factor que juega en estos dos grupos de lesiones nerviosas, es la falta de deslizamiento que ocurre en condiciones normales en los nervios y que según Millessi8,9 podría jugar un factor importantísimo en el desarrollo de neuropatía por tracción y SDRC tipo II en estos nervios con neuromas en continuidad y adheridos a cicatrices. Los estiramientos son una posible causa de por sí de neuromas7.
Los neuromas en continuidad y la adherencia de NNPP en cicatrices son las causas de SDRC tipo II en los que la monitorización neurofisiológica intraoperatoria (MNI) puede jugar un papel fundamental.
Tratamiento quirúrgico de los neuromas en continuidadLos neuromas en continuidad suceden cuando es lesionado parcialmente un nervio existiendo grupos fasciculares intactos. En muchas ocasiones suceden tras una mala reparación primaria del nervio7. El problema ocurre cuando nos enfrentamos a nervios mixtos (sensitivo-motor) donde aparte del dolor que caracteriza al SDRC tipo II, vamos a tener un importante déficit neurológico. Los diferentes tratamientos deberían encaminarse a quitar el dolor, así como si es posible a recuperar el déficit neurológico. Los tipos de tratamiento van a depender del tiempo transcurrido desde la lesión. Así en fases tardías, solo podemos hacer cirugía paliativa ya sea con recubrimiento de tejidos autólogos como colgajos fasciales, colgajos de grasa, envoltorios de vena, etc. Solo en las fases iniciales es donde podemos hacer cirugía reconstructiva y es en este tipo de lesiones, en donde la MNI se inició con los trabajos de Van Beek y cols.10,11. En ellos se sentaron las bases de la MNI y el uso del ordenador para obtener la señal promedio de los potenciales nerviosos en el manejo de los problemas de los NNPP.
Reconstrucción mediante injertos nerviososEste es el tratamiento deseable y ello va a depender del tiempo desde la lesión y si existe o no degeneración Walleriana del cabo distal. Cuando un nervio periférico se secciona, aparecen unos trastornos distales y otros proximales al punto de la lesión. Los trastornos distales reciben el nombre de “degeneración Walleriana” (en honor a Waller que describió estas alteraciones anatomopatológicas en 1850), mientras que los que ocurren en el cabo proximal del axón y en la neurona se conocen como “degeneración axonal”.
Degeneración wallerianaSi una fibra nerviosa se secciona por completo se observan, a las pocas horas, alteraciones tanto en el cabo proximal como en el distal. En el cabo distal se van a afectar todas las estructuras del nervio: la vaina de mielina se hincha y posteriormente se fragmenta y con el axón ocurre lo mismo, se edematiza y fragmenta debido a su desconexión con el correspondiente soma neuronal. Poco después se inicia una proliferación de macrófagos que fagocitan y eliminan los restos de mielina y del axón. Este proceso tiene como misión retirar el tejido nervioso del cabo distal, ya inservible. Al mismo tiempo, aparece una proliferación de células de Schwann que inicialmente ayudan en los fenómenos de fagocitosis y luego continúan proliferando hasta formar unos cordones gruesos (de hasta tres veces el grosor normal del nervio), denominados “cordones de Bungner”. Estos cordones, en los que las células de Schwann se disponen en forma tubular, permanecen en esta situación, en espera de la posible llegada de nuevos axones, durante varios meses. Sí después de meses, no ha habido regeneración, los cordones de Bungner se van atrofiando, convirtiéndose en un tejido conectivo residual, esclerosado, sin células de Schwann y sin función útil. Un fenómeno similar ocurrirá en las fibras musculares correspondientes al nervio lesionado, si no ha habido reinervación, degeneran y se atrofian quedando convertidas en tejido conectivo y graso.
Degeneración axonalEn el cabo proximal de la lesión también ocurren cambios, aunque menos pronunciados. Aparece un edema neuronal, así como alteraciones en el citoplasma, con aumento del número de vacuolas y de mitocondrias. Hoy se sabe que estos cambios iniciales no constituyen una degeneración sino una reacción del cuerpo neuronal para aumentar el metabolismo y preparar la célula para intentar reconstruir el axón. Si existe regeneración axonal, esta alteración regresa; pero si no, evoluciona y conduce a la atrofia celular.
Si durante los primeros meses después de ocurrida la lesión, afrontamos ambos cabos y los mantenemos en posición por medio de suturas, ocurrirá el fenómeno de la regeneración: los axones del cabo proximal crecen y tienden a buscar los cordones de Bungner, del cabo distal, penetrando por ellos hasta llegar a la placa motora en caso de fibras motoras, o llegando a reinervar primero los receptores de adaptación lenta (órganos de Ruffinni para la temperatura y cuerpos dendríticos de Merkel para el dolor) y luego los receptores de adaptación rápida (corpúsculos de Meissner que se estimulan con un diapasón a 35 Hertz y finalmente los de Paccinni que se estimulan a 256 Hertz).
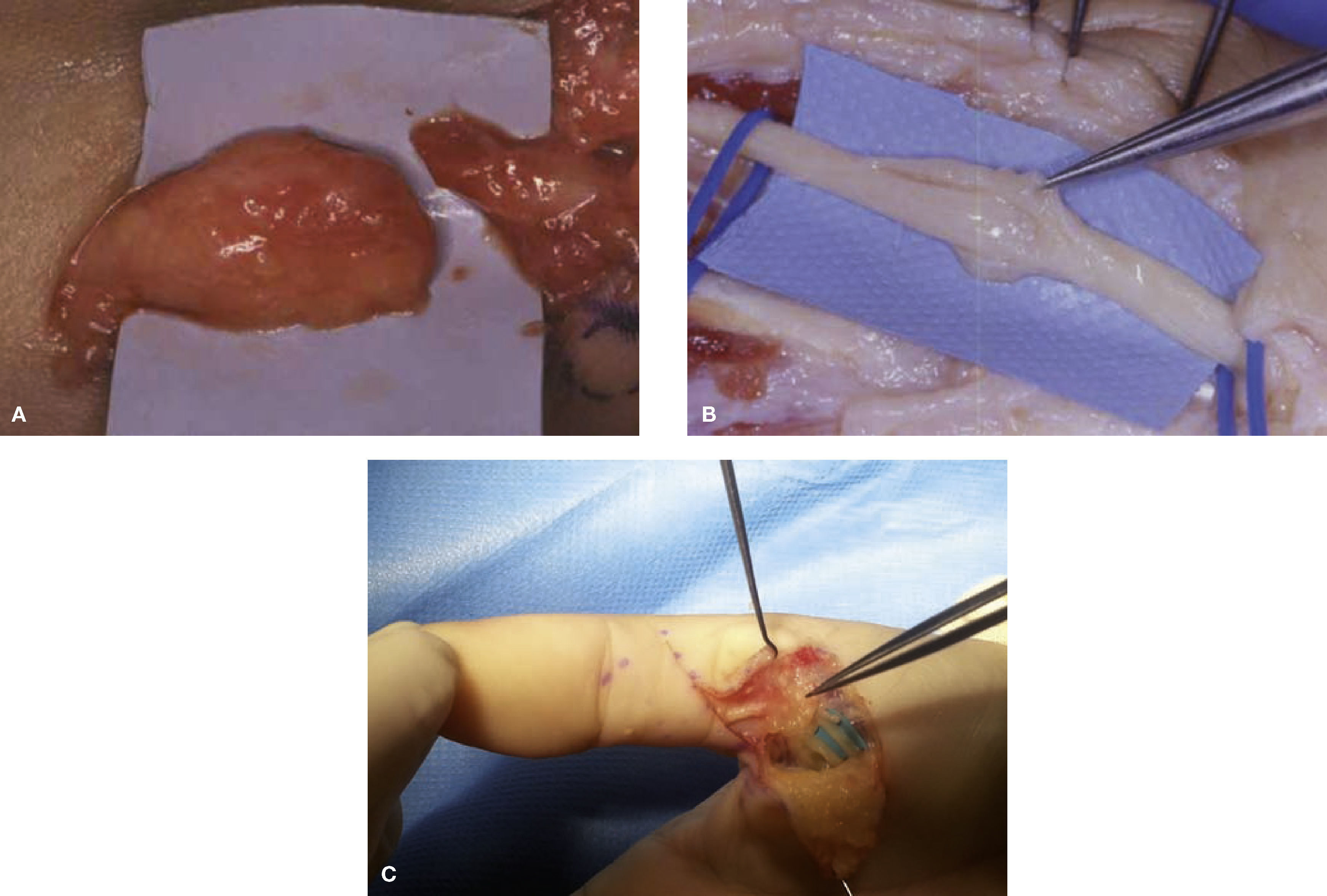
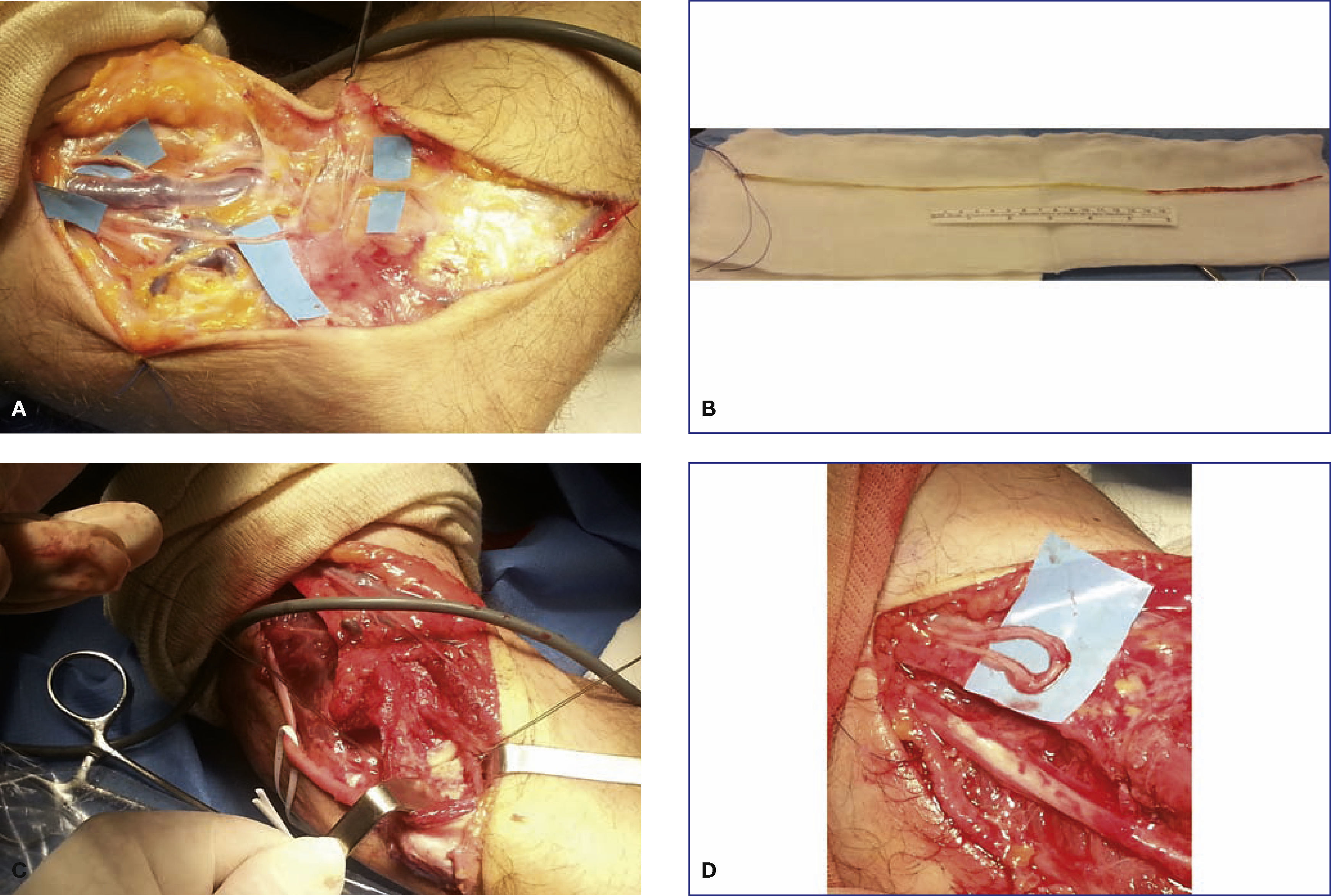
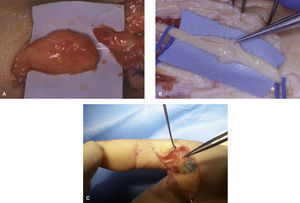
En los casos en que la sección nerviosa es parcial, con una pérdida de sustancia de solo una parte del nervio, se producirá un mecanismo mixto de regeneración- neuroma. En algunos casos de contusión grave del nervio o de lesión por estiramiento en los que se hayan producido daños dentro del nervio, pero conservándose el epineuro, la regeneración nerviosa puede conducir a la formación de un neuroma interno que va a conferir al nervio una estructura fusiforme. En este caso la función nerviosa puede estar parcialmente conservada. En los casos de nervios digitales o interdigitales sensitivos la indicación es clara, el injerto nervioso de sural con puntos de 10/0 bajo microscopio quirúrgico mejora la clínica, desaparece el dolor, los pacientes pueden dormir toda la noche ya en las primeras 48 horas tras la cirugía y los signos distróficos paulatinamente desaparecen. En los casos de neuromas en continuidad en nervios mixtos, de corta evolución (menos de 3 meses caso favorable) (3 -6 meses caso menos favorable) nosotros recomendamos la exploración microquirúrgica con registro neurofisiológico intra-operatorio (MNI) y reconstrucción con injertos nerviosos tomados del sural. Casi nunca tomamos como donante, injertos nerviosos de nervios cutáneos de MMSS debido a que ya el paciente padece un SDRC y cualquier toma de injerto en el MS afecto puede ser factor de co-morbilidad del SDRC (fig. 3). En este caso de nervios mixtos la MNI nos ayuda no solo en la disección, sino que además nos evalúa la conducción de los grupos fasciculares de cara a decidir qué grupo fascicular está lesionado y necesita injerto nervioso; y que grupo hay que preservar. Los detalles técnicos de la MNI se describirán más adelante.
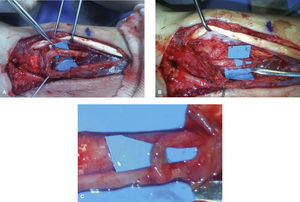
(A) Lesión del n. mediano, distal a la salida de la rama motora, con afectación de los grupos fasciculares: dorso radial, que aporta los nervios sensitivos para el 2.° EID; y el grupo fascicular cubital, que aporta los nervios sensitivos para el 3.er EID. (B) Monitorización neurofisiológica intraoperatoria (MNI). (C) Se confirmó que el grupo fascicular ventrorradial (musculatura motora del pulgar más nervios sensitivos del pulgar y primer EID) estaba indemne. Se reseca los neuromas de los grupos fasciculares para el 2.° y 3.er EID. (D) Dos injertos nerviosos tomados del sural contralateral.
Elliot y cols.12 refieren que, de los 300 neuromas tratados en su serie, solo se tuvieron que enfrentar a 40 neuromas en continuidad del nervio mediano y cubital, la mayoría en el tercio distal del antebrazo. La larga evolución desde la lesión inicial, hacía no recomendable la reconstrucción con injertos. Este hecho, junto con la gran cicatriz asociada al neuroma en continuidad y un mal lecho con adherencias a tejidos circundantes como tendones, llevaron a tratar 14 nervios (12 medianos, 2 cubitales) mediante envueltas de colgajos fasciales. Elliot y cols.12 no consideran que sea necesarios colgajos libres vascularizados para tratar dichas lesiones y consideran suficientes, dos colgajos fasciales de rutina tipo pediculados como el Becker y el colgajo anterior del antebrazo fascial, para tratar la mayoría de los neuromas en continuidad de los nervios mediano y cubital. En su estudio cohortes con tan solo 14 neuromas tratados con colgajos fasciales, solo un paciente no encontró mejoría en cuanto al dolor con este tipo de tratamiento.
Recubrimientos con venaLa única serie de casos con un tamaño poblacional aceptable ha sido la publicada por Masear y Colgin13 usando el enrollamiento de los nervios con neuromas en continuidad mediante injerto de vena autólogo en 119 nervios, de los cuales 94 fueron fracasos tras liberación del STC, refiriendo dichos autores buenos resultados. Resultados similares han sido publicados por otros autores con series de casos de menor tamaño muestral14,15. A nivel experimental, Xu y cols.16,17 han expuesto que el enrollamiento con injerto de vena, produce a nivel de la rata como animal de experimentación, menos cicatriz alrededor del nervio entre el epineuro y el endotelio de la vena, pero no ha demostrado un mejor deslizamiento del nervio lesionado con respecto al tejido cicatricial circundante. Sin embargo, Masear y Colgin13 usando vena umbilical preservada en glutaraldehído afirman que el deslizamiento es mucho mejor.
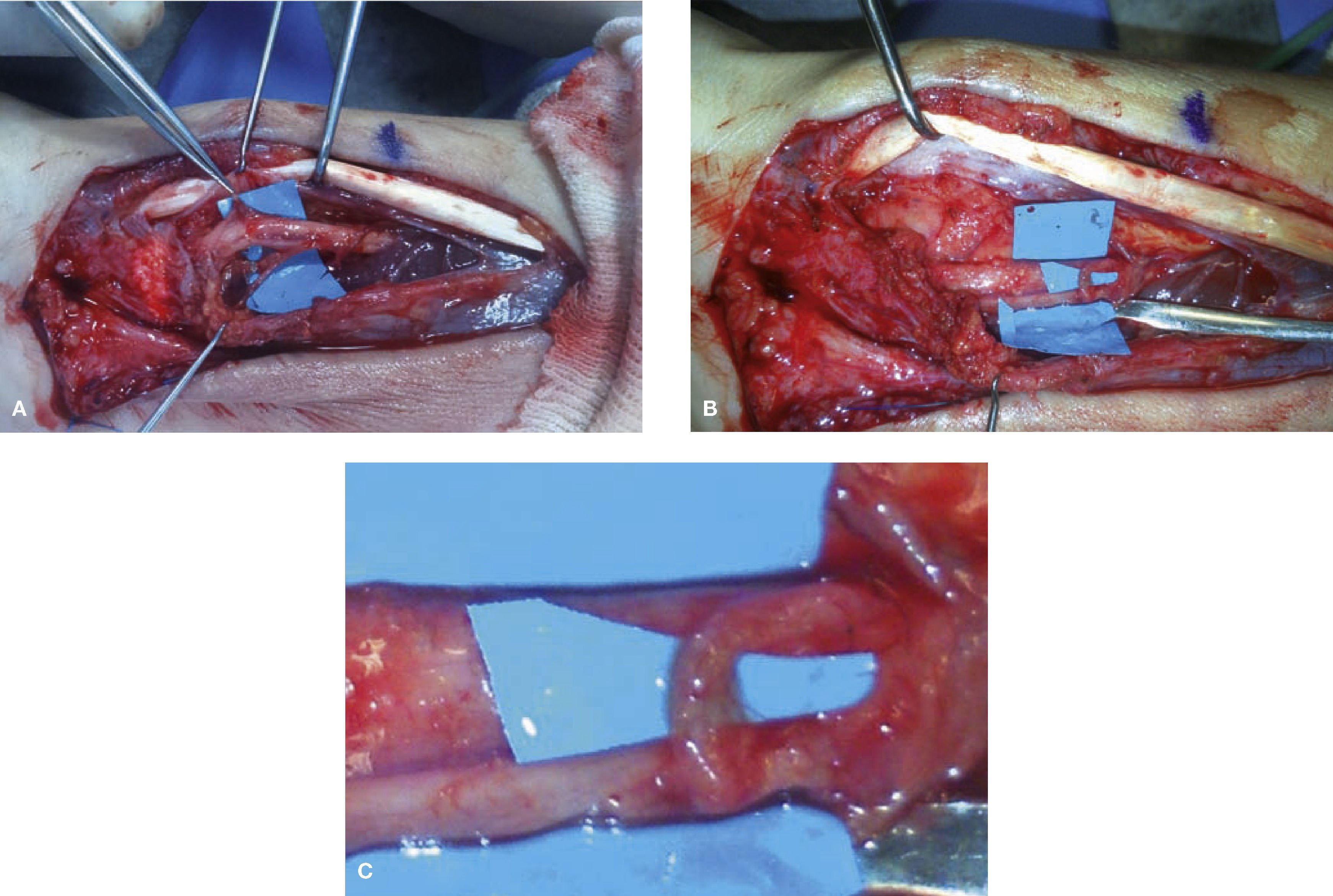
En nuestra opinión, no tenemos experiencia con dicha técnica, los resultados clínicos publicados no son definitivos y preferimos usar un colgajo de grasa vascularizada a partir de pequeños pedículos arteriales (fig. 4D) para prevenir la adherencia sobre nervios en cicatriz o neuromas en continuidad.
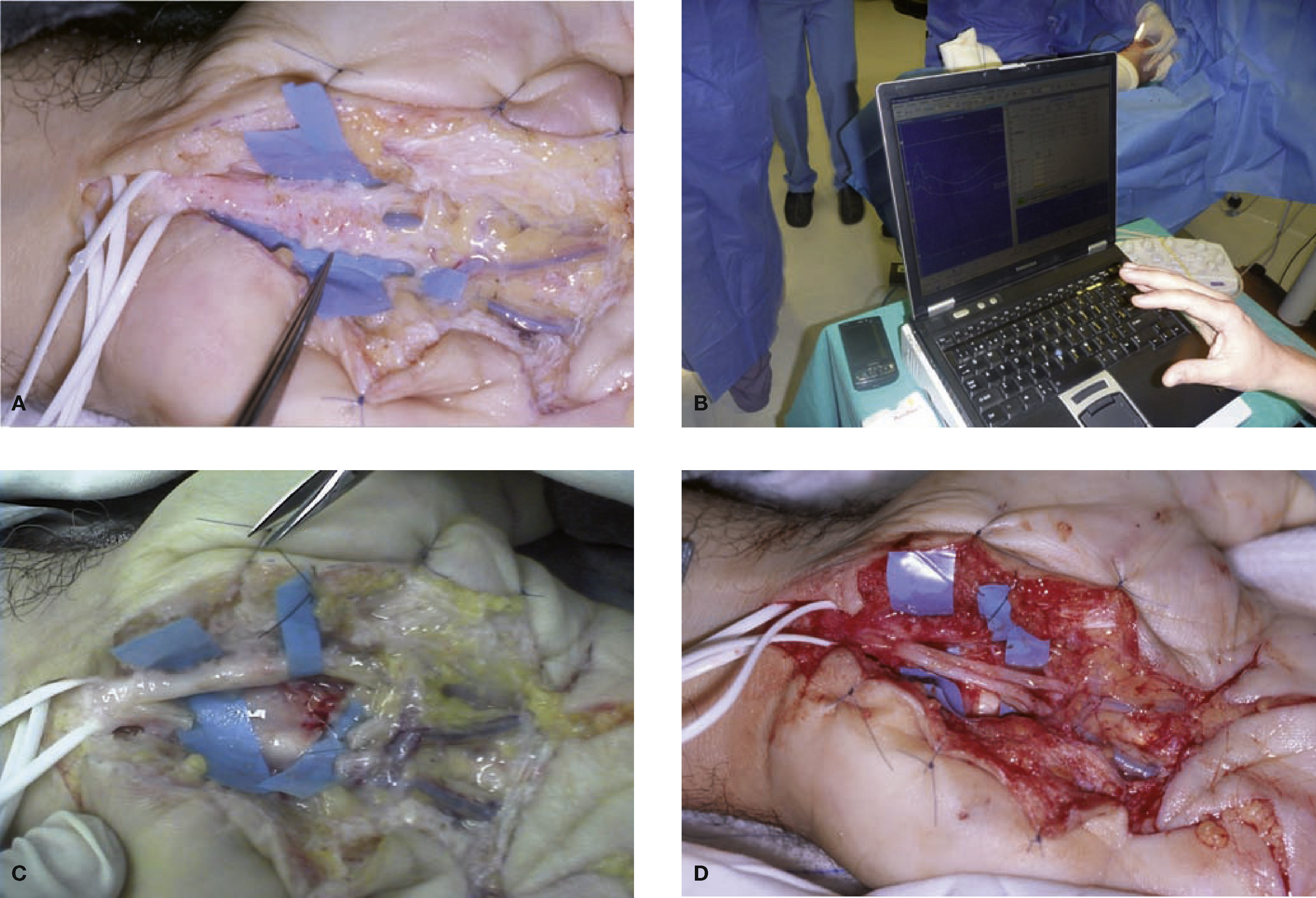
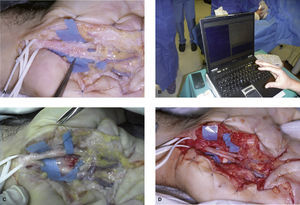
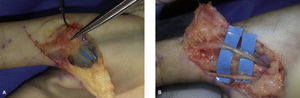
(A) SDRC tipo II secundario tras una laceración en la muñeca tratada en otro centro. (B) Lesión del nervio mediano completa proximal al canal carpiano, con parálisis del APB y posible afectación de la rama cutánea para el triángulo palmar. (C) La MNI objetiva lesión de los tres grupos fasciculares. Se realiza injerto nervioso del Sural, mediante tres cables, uno para el grupo fascicular ventrorradial que es mixto (sensitivo-motor) que recoge la sensibilidad del pulgar y mitad radial del índice y la musculatura intrínseca del pulgar inervada por el mediano. Y otros dos cables para cada uno de los otros dos grupos fasciculares. (D) Colgajo de grasa vascularizada por dos pequeños pedículos arteriales ramas del cubital para recubrir los injerto y evitar su adherencia. (E-G) Resultados. Recuperación del APB y cierre del puño.
En la mayoría de los casos que nos enfrentamos a un neuroma en continuidad, independientemente de si realizamos reconstrucción o no con injertos nerviosos, es útil aportar un colgajo de grasa vascularizada, preferiblemente pediculado sobre libre, sobre dicha reconstrucción (fig. 4).
Tratamiento quirúrgico de los síndromes de dolor regional complejo tipo II secundario a nervios atrapados en cicatrizFormas de presentaciónSunderland18,19 describió la respuesta de los NNPP a la tracción. Cuando un nervio es gradualmente traccionado, las ondulaciones de los fascículos dentro del nervio son eliminadas primeramente, pero no se ven afectados inicialmente los axones o las fibras nerviosas que permanecen en tensión dentro del nervio. A medida que la tracción progresa puede aparecer la ruptura del perineuro lo que permite el escape de axones y desencadena la respuesta antes descritas en los neuromas en continuidad7.
Esta situación se suele dar combinada con neuromas en continuidad, como veíamos en el apartado anterior, donde se objetiva un déficit neurológico a la exploración, que acompaña al cuadro de SDRC tipo II. También se puede dar aislada, con solo dolor, sin neuroma en continuidad por lesión directa. Se observa tras algún tipo de tratamiento quirúrgico previo, por ejemplo en nervios cutáneos como el nervio cutáneo medial del antebrazo tras cirugía previa por epitrocleitis (fig. 5), en la rama sensitiva del nervio mediano tras cirugía de reducción abierta y osteosíntesis con placa volar por fractura distal de radio (fig. 6), en nervios digitales tras cirugía de dedos en resorte (fig. 7) y en el nervio mediano o cubital tras cirugía previa por neuropatía compresiva (figs. 8 y 9).
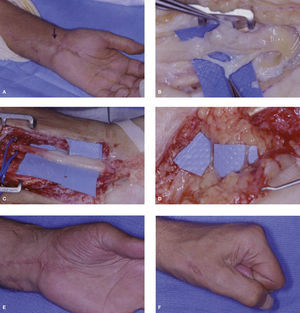
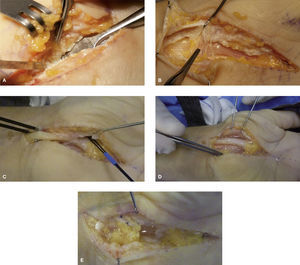
Paciente, varón de 40 años de edad, marinero de profesión que sufre un traumatismo en valgo del codo al traccionar del cabo de un barco. Es intervenido de epitrocleitis en otro centro. Tras la cirugía comienza con un SDRC tipo II secundario a lesión de la rama del nervio cutáneo medial del antebrazo (NCMA) junto con una neuropatía cubital desmielinizante secundaria a inestabilidad medial del codo por insuficiencia del ligamento colateral ulnar (LCU). (A) Disección de las ramas cutáneas del NCMA, obsérvese el desplazamiento en “zig-zag” de la rama más posterior por lesión y adherencia en cicatriz. (B) Injerto del Palmaris Longus y (C) reconstrucción del LCU del codo. (D) Conexión Centro-central para tratar la lesión de la rama del NCMA y nervio cubital ya liberado y listo para su transposición subcutánea anterior.
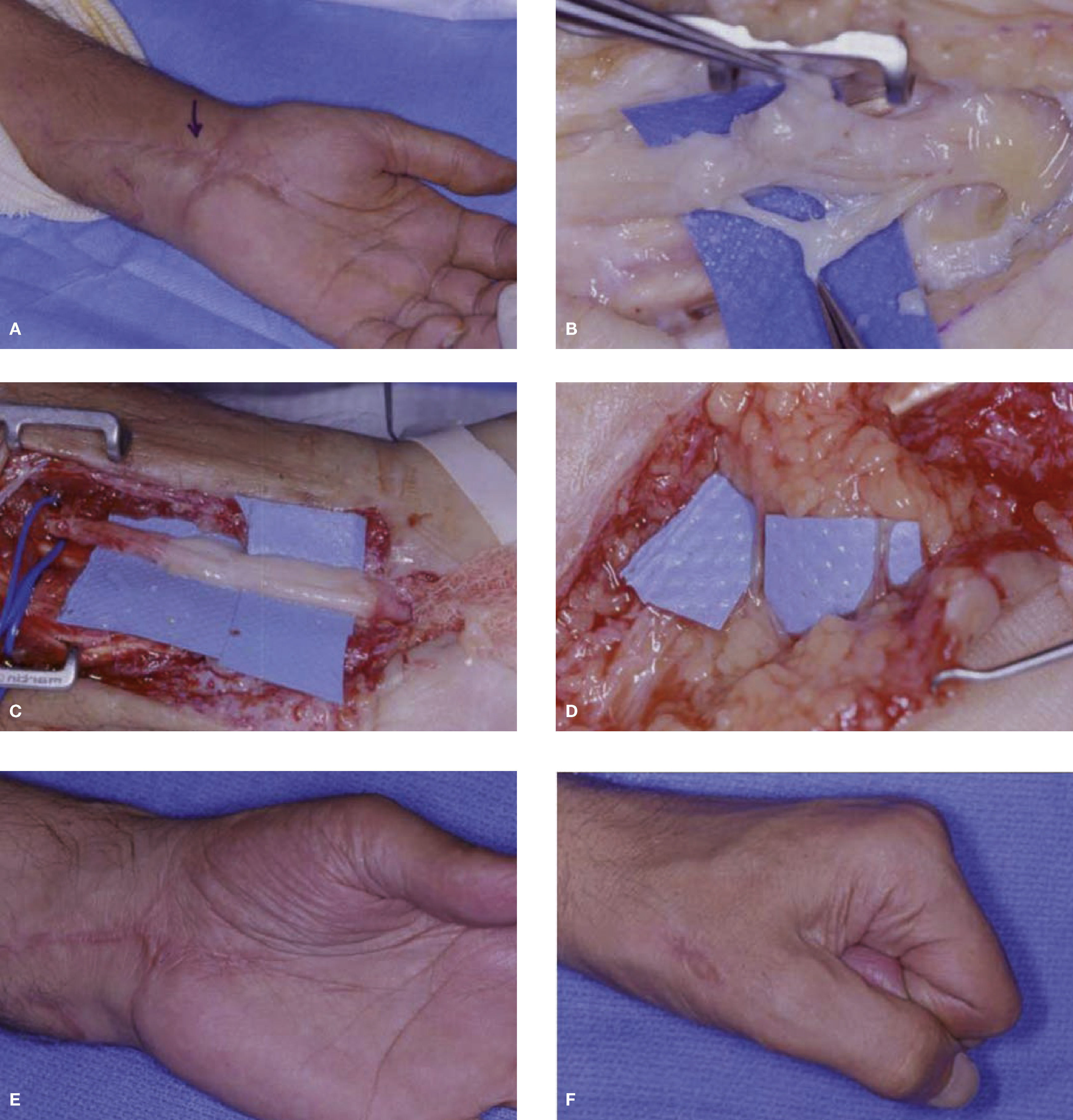
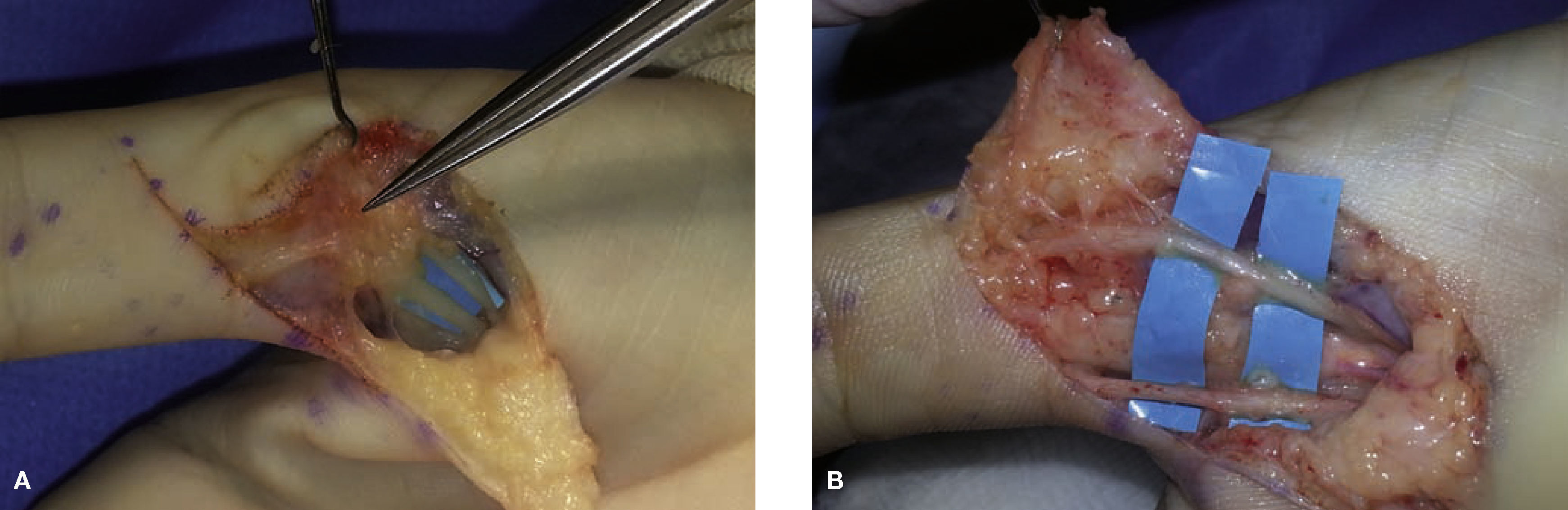
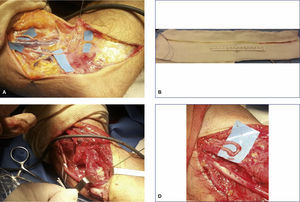
(A) Paciente mujer de 50 años intervenida de liberación del túnel carpiano (TC). Tras la cirugía continua con parestesias y despertares nocturnos, añadiéndose síntomas distróficos importantes como edema, rigidez en dígitos, alodinia. En la 2.ª cirugía observamos una liberación incompleta del ligamento transverso y (B) una adherencia del N mediano en cicatriz quirúrgica. (C) Liberación de la cicatriz quirúrgica alrededor de la rama motora del N mediano con ayuda de la MNI. (D) Aspecto final tras la liberación completa del N Mediano. (E) Colgajo de grasa cubital anclado a la cara más dorsal del rectángulo radial del ligamento transverso escindido.
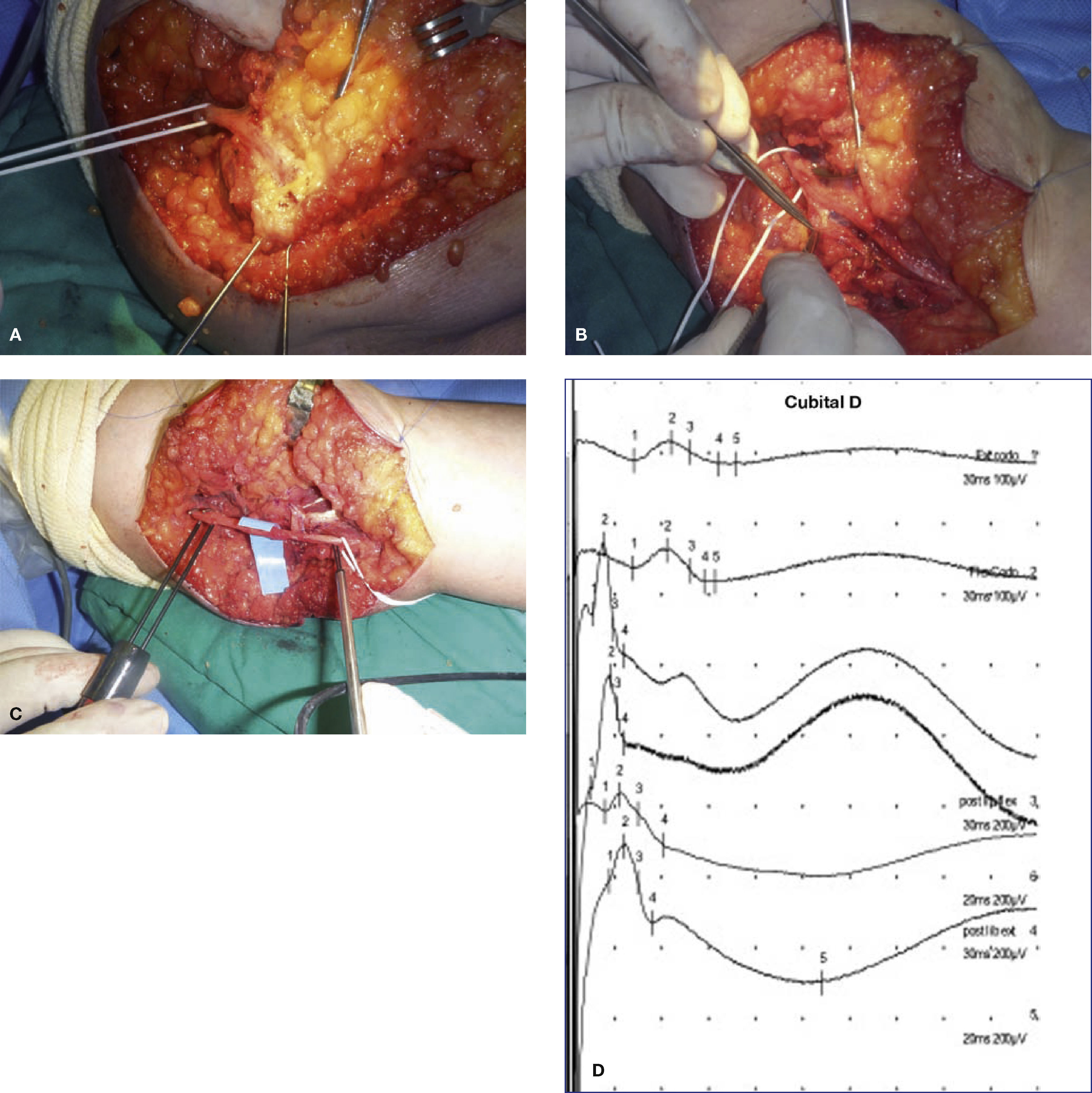
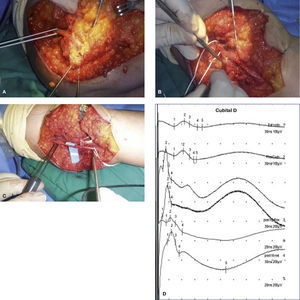
(A) Paciente mujer con un cuadro de dolor de reposo que se exacerbaba con la en extensión del codo tras dos cirugías previas de túnel cubital con una transposición anterior en la última cirugía. Adherencia completa del n. cubital en la cara anterior del codo con incurvación del mismo. (B) Liberación del n. cubital y las ramas motoras para el flexor carpi ulnaris con ayuda de la MNI. (C) Registro final tras liberación para establecer pronóstico. (D) Los estudios intraoperatorios, muestra presencia de una respuesta PAN a través de la lesión (registros 1 y 2). Una vez se libera el nervio, de una trama fibrosa que lo comprime, se observa un PAN de mayor amplitud y menor latencia/duración, indicando mejor sincronía y por tanto mejoría del componente mielínico (registro 3 y 4). En los trazos inferiores no se observa significativa modificación tras la neurolisis (registros 5 y 6).
El cuadro se caracteriza por el desarrollo de una neuropatía por tracción. La adherencia a la cicatriz quirúrgica impide el deslizamiento normal del nervio, produciendo un cuadro de dolor neuropático, acompañado de mayor o menor medida de síntomas distróficos, junto con la persistencia de síntomas irritativos como sensaciones parestésicas. Estas se ven exacerbadas con ciertas maniobras como la extensión de la muñeca, codo y la retropulsión del hombro cuando el nervio mediano está adherido dentro del túnel carpiano o bien con la extensión del codo cuando es el nervio cubital está adherido en su nueva ubicación tras fracaso de una cirugía de transposición anterior.
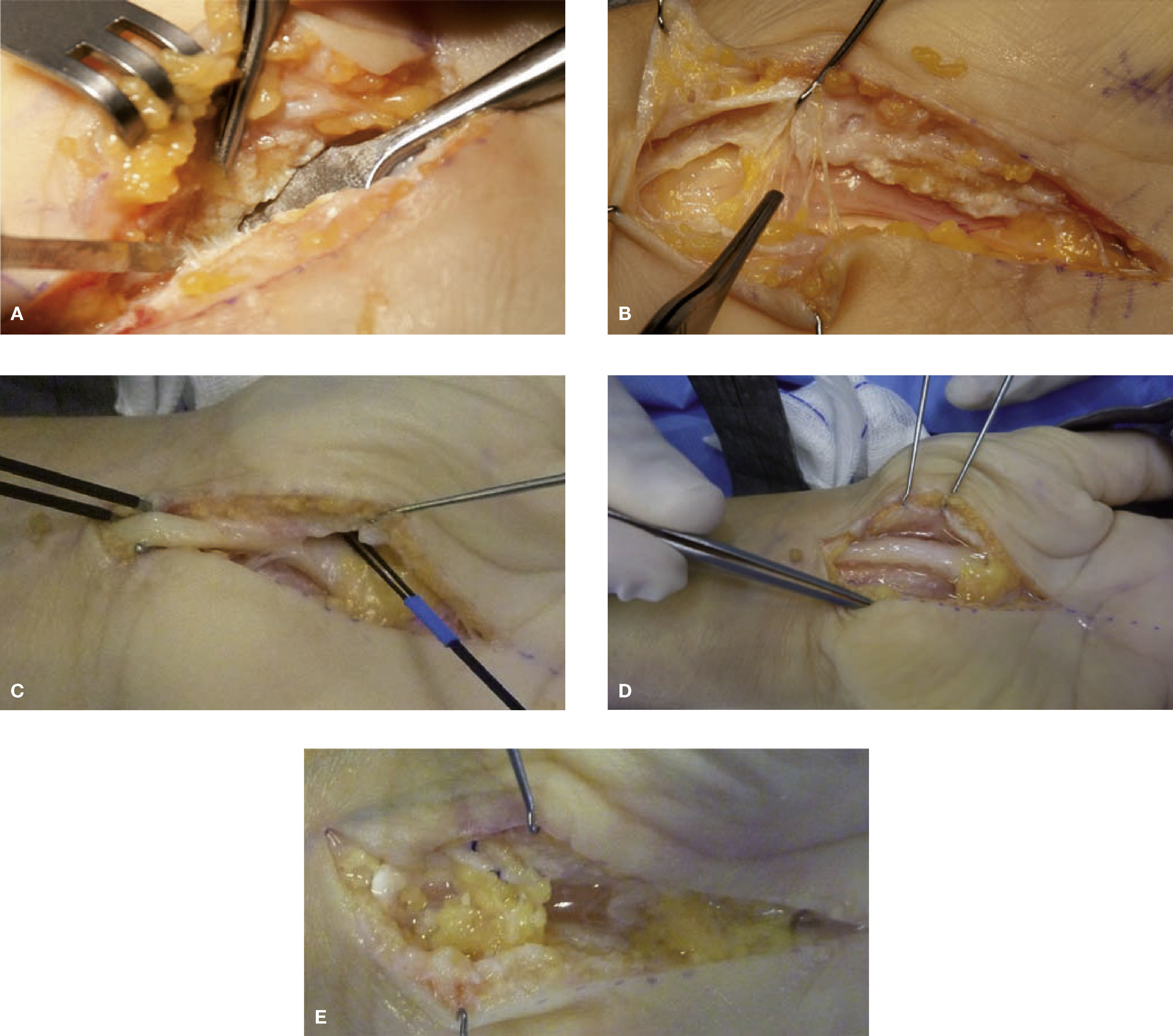
Tratamiento quirúrgico en nervios digitales o cutáneosEn estos casos no es necesario el uso de la MNI. Es fundamental la utilización de microscopio quirúrgico para realizar la disección. Solo la liberación del nervio y la neurolisis microquirúrgica es suficiente para mejorar los resultados (fig. 7). En caso de observar que no solo existe cicatriz, sino que además hay una posible lesión con neuroma en continuidad, sería deseable la reconstrucción mediante injertos nerviosos en caso de afectar la pinza digital y el tiempo transcurrido asegure una buena regeneración. En caso contrario se debería tratar como neuromas terminales con relocalización ya sea muscular20,21, intraósea5,22–26 o bien mediante una conexión centro-central27.
En caso de nervios cutáneos con adherencia y posible lesión neural una buena opción terapéutica que usamos en nuestro servicio es la conexión centro-central y la conexión termino-lateral.
La técnica de conexión centro-central (CCC) fue descrita por primera vez por Gorkichz28, y consiste en la conexión microquirúrgica de dos extremos proximales nerviosos. También se puede aplicar para un solo cabo proximal en el que se hace disección intraneural para obtener dos grupos fasciculares proximales y estos son conectados entre sí. No se conoce el mecanismo íntimo del funcionamiento de esta técnica, pero la teoría del cese de la formación de axones está basada en que para formarlos es necesario un correcto flujo axonal en las dos direcciones, en ausencia de presión intraneural. Se piensa que dicha conexión centro-central, altera el flujo axonal en las dos direcciones, debido al aumento de presión intraneural. Se suprime la síntesis de proteínas y su transporte anterógrado y por ende el crecimiento de axones28. Belcher y Pandia27 demostraron en un estudio aleatorizado de 61 dígitos en el que compara la CCC con la sección distal de los nervios digitales durante la revisión-amputación, que el dolor medido mediante escala visual, fue menor en el grupo de CCC aunque con mayor pérdida de sensibilidad. Problemas en el diseño del estudio, como las pérdidas en las cohortes (solo llegaron a valorarse 31 de los sesenta dígitos), constituyeron limitaciones importantes del estudio. En nuestro caso, la CCC es muy útil en el tratamiento de cualquier nervio cutáneo con múltiples ramas en vecindad (por ejemplo, la rama sensitiva del radial, el nervio cutáneo lateral del antebrazo, el nervio cutáneo medial del antebrazo) y realizamos la CCC conjuntamente con su reubicación en un plano muscular o de grasa (fig. 5).
Aplicación similar la constituye las conexiones término-laterales. A pesar de que el auge de la conexión término-lateral sucedió al comienzo del siglo xx, el concepto de la conexión término-lateral fue descrita por primera vez, en un libro del siglo xix llamado “Traité des Sections Nerveuses” y publicado por Létiévant (1873). Tras casi 50 años olvidado, primero Sunderland29 y sobre todo posteriormente Lundborg30,31, popularizaron de nuevo el uso de esta técnica. A nivel de los neuromas es de gran utilidad en nervios cutáneos cuando son dañados en la proximidad de su salida del tronco principal.
Un uso en nuestra unidad es en los neuromas y adherencias cicatriciales de la rama sensitiva del triángulo palmar en las cercanías de su salida del nervio mediano. Esta lesión aparece tras el tratamiento de fracturas distales de radio mediante osteosíntesis por vía palmar. En estos casos, se reseca el neuroma y la cicatriz que lo engloba, y se realiza una conexión termino-lateral, al tronco proximal del nervio mediano (fig. 6).
Tratamiento quirúrgico en troncos principales mediano o cubital tras fracaso de cirugía por neuropatía compresivaUn importante aspecto en el tratamiento de estas lesiones, por adherencia de un nervio periférico en la cicatriz tras fracaso de una cirugía previa, es la ayuda de la monitorización neurofisiológica intraoperatoria (MNI). Es útil tanto a la hora de realizar la disección del nervio englobado en la cicatriz como para aportar información pronostica (figs. 8 y 9). Se recomienda realizar la disección comenzando proximal y distal a donde esperamos tener la lesión. Nunca se debe comenzar la disección en tejido cicatricial ya operado, no tocar el nervio pegado a la cicatriz. Se realiza un primer registro MNI o registro base y a continuación con ayuda de microscopio se lleva la disección desde proximal y distal hacia la lesión teniendo en cuenta las ramas motoras del APB en el mediano (fig. 8) a nivel de la muñeca y las ramas motoras para el FCU (fig. 9) en el cubital a nivel de codo. Si es necesario se realizan registros de MNI para confirmar dichas ramas motoras para que no sean lesionadas durante el procedimiento de liberación. Sucesivos registros nos va dando una idea del avance en nuestra liberación.
Neurofisiología intra-operatoriaGeneralidadesLa monitorización neurofisiológica intraoperatoria (MNI) de nervios periféricos, es un procedimiento extremadamente útil, que proporciona una información vital y en tiempo real al cirujano, cuyo objetivo es conservar las estructuras neurológicas en riesgo de lesión, así como dar “consejo” del procedimiento quirúrgico, para evitar un déficit neurológico.
Los estudios preoperatorios proporcionan datos al cirujano para decidir que técnica quirúrgica realizar, sin embargo, hay información que no puede obtenerse en dichos estudios y ahí sí que ayuda la MNI. Para llevarla a cabo se necesita un equipo altamente cualificado en el aspecto de tecnológico, junto a una buena comunicación con el cirujano (a veces podemos cambiar el plan quirúrgico diseñado) y con el anestesista (ciertos anestésicos pueden provocar efectos adversos).
Los usos de la MNI de nervio periférico son: Identificar el nervio periférico, ayudar a su disección y liberación de una cicatriz, localizar un segmento enfermo del nervio a lo largo del curso de este, determinar la continuidad funcional a lo largo de una lesión preexistente, determinar una avulsión de la raíz y prevenir el daño nervioso durante la cirugía.
Los estudios de conducción nerviosa intraoperatoria se realizan estimulando y registrando en un nervio motor, sensitivo o mixto, lo que da un potencial de acción nervioso. Estos potenciales se pueden registrar sobre un vientre muscular (CMAP), sobre un nervio periférico (PAN) o a nivel de la médula espinal o córtex (potenciales evocados). Para la estimulación del nervio periférico quirúrgicamente expuesto, podemos emplear diferentes estimuladores: bipolar (muy específico), tripolar (muy específico y menor artefacto), monopolar (poco preciso) y tipo gancho (muy útil ya que saca el nervio del campo y minimiza la cantidad de corriente que tenemos que dar para estimular el nervio).
Consideraciones técnicasUna estimulación excesiva puede producir una gran difusión-dispersión de corriente que puede estimular nervios cercanos o incluso músculos también y además producir un gran artefacto de estímulo, que puede estar magnificado por la corta distancia entre estimulación-registro. Tenemos que emplear pulsos cuadrados de estímulo, con una duración de 0.05ms:
- •
Normalmente, con 1-5mA o 20-25V son suficientes para lograr un potencial supramaximal (preferentemente se activan axones motores).
- •
En nervios enfermos, tenemos que aumentar la intensidad, llegando incluso a los 20-25mA; sin embargo, esto incrementa el artefacto de estímulo y puede estimular nervios adyacentes.
- •
La amplitud del PAN es de microvoltios, de forma que muchas veces tenemos que promediarlo, para ver una respuesta fiable.
- •
El registro del PAN se puede realizar a lo largo del curso del nervio.
- •
La distancia entre el cátodo y el activo del registro, debería rondar los 4cm, para minimizar el artefacto del estímulo. El registro debe ser de forma bipolar con una distancia inter-electrodo de 3-5mm.
- •
Si es posible podemos realizar tanto la estimulación como el registro fuera del campo quirúrgico, y siempre debemos tener confirmación visual de la correcta colocación de los electrodos.
- •
El PAN contiene frecuencias en el rango de 1 Khz, usaremos filtros de baja frecuencia (paso alto) en torno a 5-10Hz y de 2-3 Khz para las frecuencias altas (paso bajo).
- •
La amplitud del PAN ronda los 100 microV.
- •
La latencia, dependerá de la distancia entre estimulación-registro, y asumiendo una velocidad de conducción de 50 m/s, pondremos el tiempo de barrido a 0.5ms por división.
- •
La baja temperatura del quirófano puede producir una disminución de la VC y descenso de la amplitud de las respuestas, se debe tener en cuenta. De todas formas, lo que se busca es presencia o ausencia de respuestas o cambio de morfología de la onda en la cercanía de los sitios de registro. Estos parámetros no se suelen afectar significativamente por la temperatura.
- •
La isquemia, puede impedir la conducción nerviosa, debería desinflarse el torniquete durante 20 min, cada 60 min y siempre antes de iniciar la MNI.
- •
El artefacto del estímulo. Tenemos que asegurarnos que el campo quirúrgico esté lo más seco posible. Intentar dar estímulos de muy pocos mA y duración del estímulo, para alcanzar estimulación supramaximal.
Cuando el objetivo de la MIN de nervio periférico, es determinar el grado de continuidad o localizar exactamente la lesión en el nervio periférico, la estimulación y el registro deberá hacerse en ambos lados la lesión. En estos casos es importante saber que unos pocos axones grandes mielinizados, pueden darnos una respuesta de velocidad de conducción, latencia y umbral relativamente normal; por lo tanto es muy útil valorar la amplitud del PAN, para determinar el número de axones funcionantes a lo largo de una lesión. Un PAN, de amplitud media (100 microV) indica que hemos obtenido una respuesta de unos 4.000 axones de tamaño medio, mielinizados y funcionantes. Si el PAN no se registra o es muy difícil registrarlo, es muy útil hacer un registro en una porción normal del nervio, esto actúa como control para asegurarnos que funciona bien nuestro equipo. Lo mismo lo podemos hacer sobre un músculo, que produce una contracción muscular, y nos asegura que el estimulador funciona. Una cuestión que hay que tener en cuenta al realizar los registros operatorios del CMAP, es que puede que no encontremos respuesta, y esto puede deberse a que el axón no haya reinervado todavía, o porque todavía estos axones no son funcionalmente útiles (axones inmaduros). Por esta razón, los registros de CMAP, no son útiles en valorar la continuidad nerviosa, siendo el registro del PAN más útil para localizar la lesión32.
Si al realizar una estimulación proximal en el terminal nervioso, vemos una respuesta con gran duración o de amplitud disminuida, y/o que alcanza el electrodo de registro con una latencia más larga de lo esperado, podemos estar ante la presencia de un enlentecimiento focal, que en su mayor parte se debe a una lesión desmielinizante. Una técnica que se puede realizar también para lograr la localización precisa de una lesión focal, es la técnica del “Inching” (estimulación cm a cm, de proximal a distal de la lesión en busca de un cambio en la morfología del potencial y/o latencia del mismo). Las lesiones en las que nos encontramos con una ausencia de PAN a través de ella, probablemente no tendrán recuperación espontánea, y acabarán en una aproximación quirúrgica de los filetes nerviosos o en trasferencia-injertos nerviosos33.
ResultadosHemos objetivado con la MNI que la liberación del nervio adherido a la cicatriz se acompaña de una mejoría de la amplitud del potencial de acción nerviosa (PAN) con una disminución de la latencia con respecto al registro intra-operatorio inicial o registro base previo a la liberación. Estos hallazgos se correlacionan con una mejoría clínica tras tratamiento a nivel del dolor y discapacidad de MMSS medidos con el DASH. La neurolisis externa del nervio liberado no mejora la amplitud ni disminuye la latencia del PAN (fig. 9).
ConclusionesEn suma, los SDRC tipo II se caracterizan por dolor predominantemente de reposo, acompañado, en mayor o menor medida, de síntomas distróficos y característicamente son definidos por la existencia de déficit en algún territorio nervios (sensitivo, motor o mixto). El componente simpático mantenido puede jugar o no papel concomitante. Las lesiones en los NNPP causantes de SDRC tipo II pueden ser: neuromas terminales, neuromas en continuidad o bien por adherencia en cicatriz. Su tratamiento varía en función del nervio afecto y su localización. La MNI juega un importante papel hoy en día como ayuda al cirujano en su tratamiento quirúrgico así como factor pronóstico sobre todo en las SDRC tipo II secundarias a neuromas en continuidad o adherencias en cicatriz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.