La existencia de variabilidad en la utilización de los recursos sanitarios es un hecho bien conocido1,2. La constatación de esta variabilidad tiene una gran importancia, ya que diferentes estudios han demostrado que la existencia de variabilidad en la práctica clínica tiene consecuencias en el desenlace de la enfermedad3,4. En este sentido, el estudio emAR fue diseñado para conocer el grado de variabilidad existente en el empleo de recursos sanitarios en España como paso preliminar o complementario al desarrollo de la guía de práctica clínica para artritis reumatoide (AR).
El estudio emAR no sólo ha constatado la existencia de variabilidad en el manejo de la AR, sino que también ha servido para analizar los facto res que condicionan su presencia en España. El origen de la variabilidad en el uso de recursos sanitarios es multifactorial, pero podemos establecer tres grandes grupos de causas: a) en primer lugar, el amplio espectro clínico de la AR, así como las comorbilidades y preferencias de los enfermos, dan lugar a una variabilidad en el uso de recursos que se considera aceptable; b) la existencia de incertidumbre en torno a qué procedimiento se debe emplear en cada situación también supone una fuente de variabilidad comprensible, y c) las variables relacionadas con el ámbito geográfico, la institución o el servicio, y el propio médico pueden asociarse con la mayor parte de lo que se considera variabilidad inaceptable, de forma que la falta de habilidad o la ignorancia del médico, la mala organización de las instituciones o la decisión de no utilizar prácticas cuya superioridad ha sido claramente demostrada pueden conducir a un peor desenlace de la enfermedad que no debería ser tolerado.
El estudio emAR
El objeto de estudio fueron las historias clínicas de pacientes mayores de 16 años diagnosticados de AR. Se revisaron 1.379 historias clínicas (HC) seleccionadas, de forma aleatoria y proporcional a la población de cada comunidad autónoma, de entre los pacientes atendidos en 48 hospitales que también fueron seleccionados de forma aleatoria en cada comunidad autónoma (CA). La recogida de datos se centró en los 2 años previos a la revisión de la HC, en concreto 1998-1999, y se recogieron datos tanto sobre la utilización de recursos sanitarios (procedimientos terapéuticos en el caso que nos atañe), como características de los pacientes, la enfermedad, los centros hospitalarios y los médicos.
Variabilidad en el uso de fármacos modificadores de la enfermedad (FAME)5
La utilización de FAME a lo largo de los 2 años del estudio osciló entre el 81 y el 100% de los pacientes según las CA. Estas cifras son similares o algo superiores a las descritas en otros estudios en los que se analizan poblaciones de AR en seguimiento por reumatólogos6-9, que en el estudio emAR fueron el 89% de los pacientes.
La variabilidad regional en la prescripción de FAME no tuvo significación estadística significativa en el análisis multivariante, sino que las diferencias fueron debidas a características del paciente o de la enfermedad. Así, su utilización fue significativamente menos frecuente en pacientes mayores de 65 años (odds ratio [OR] 0,34); por el contrario, tuvo una frecuencia más significativa si la enfermedad tenía más de 10 años de evolución frente a menos de 5 años (OR = 7,29), así como en las formas seropositivas (OR = 2,14) y en caso de enfermedad activa (OR = 3,23). Por último, se observó que la utilización de FAME fue más frecuente entre los pacientes en seguimiento por reumatólogos que entre los seguidos por internistas (OR = 3,15).
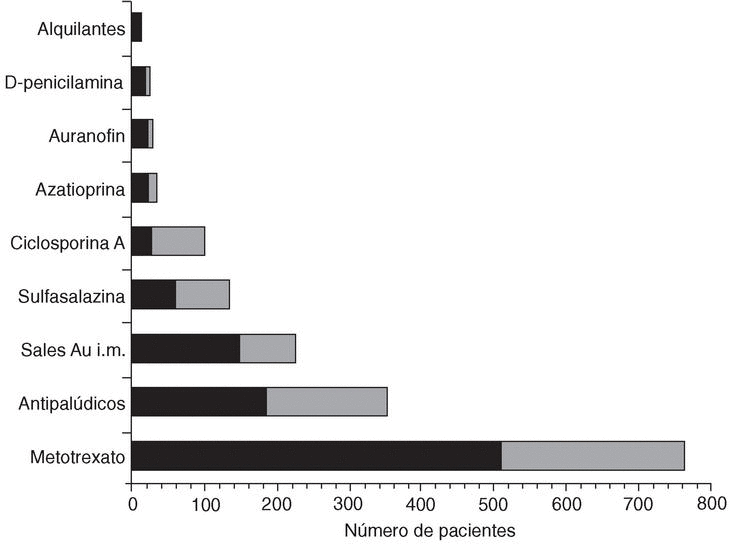
El fármaco más utilizado fue metotrexato, tanto en monoterapia como en terapia combinada. En la figura 1 se expone la frecuencia de utilización de FAME. Se analizó la variabilidad regional en el uso de los 5 fármacos más empleados. El uso de metotrexato osciló entre el 27,6 y el 71,8% de los pacientes según las comunidades autónomas. Esta variabilidad fue igual de marcada para el resto de los FAME analizados: antipalúdicos (3,5-60%), sales de oro (2,6-32,6%), sulfasalzina (0-23,1%) y ciclosporina A (0-30,7%). Estas diferencias se asociaron de forma significativa tanto a variables dependientes de la enfermedad como de los pacientes, así como del servicio o individuales del médico. Por lo que respecta a estos últimos, en la actualidad, la información disponible es que todos los FAME disponibles son mejores que placebo, pero no existe suficiente evidencia que compare todos los FAME entre sí10. Por tanto, es normal que la decisión sobre qué FAME utilizar dependa en gran parte de las preferencias del médico.
Figura 1.Frecuencia de uso de fármacos modificadores de la enfermedad en el estudio emAR. La parte negra de la barra corresponde al uso en monoterpia y la parte gris al uso en terapia combinada.
También se observó variabilidad en la dosificación de metotrexato, cloroquina, aurotiomalato sódico, sulfasalazina y ciclosporina A. En la tabla 1 se exponen las medianas de las dosis máximas y mínimas de estos 5 FAME. Como se puede apreciar, las sales de oro por vía intramuscular se utilizaron de acuerdo con el estricto patrón recomendado para su uso. Por el contrario, en el caso de metotrexato y ciclosporina A, la mediana de la dosis máxima se aleja mucho de las dosis máximas recomendadas11. El análisis multivariante puso de manifiesto que, además de factores propios del paciente y la enfermedad, existieron diferencias regionales estadísticamente significativas. Así, en algunas CA se optimizaba la dosificación de estos fármacos, mientras que en la mayoría no se alcanzaban las dosis máximas recomendadas10. Nos encontramos, pues, ante una situación de variabilidad inaceptable, máxime cuando en el estudio EMECAR (manuscrito en preparación) se ha observado que los pacientes en tratamiento con metotrexato presentan un peor control de la actividad de la enfermedad que aquellos en tratamiento con otras monoterapias (antipalúdicos, sales de oro y sulfasalazina).
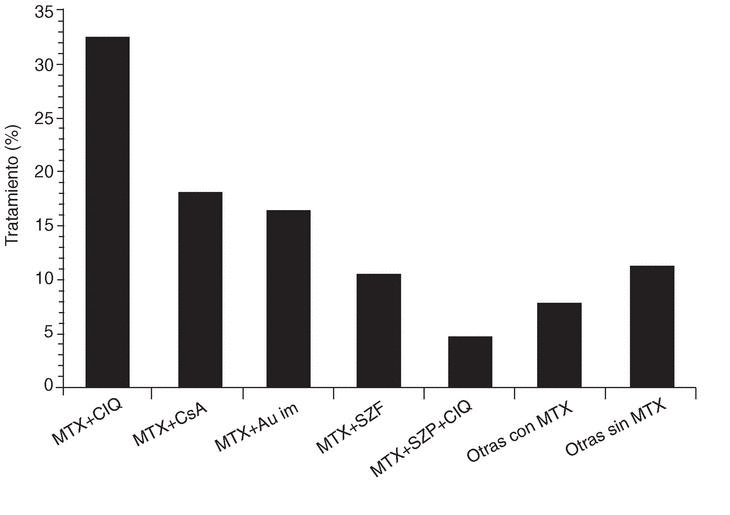
En el empleo de terapia combinada también se constató la presencia de variabilidad geográfica, ya que su empleo varió entre el 9 y el 52% de los pacientes, dependiendo de las CA. Estas diferencias regionales fueron estadísticamente significativas e independientes de variables relacionadas con el paciente y la enfermedad. La mayor parte de las combinaciones utilizaron metotrexato como base (fig. 2), siendo la cloroquina el fármaco que con mayor frecuencia se añadió a metotrexato. Este dato es llamativo, ya que en la bibliografía existe una mejor calidad de evidencia sobre el beneficio que supone combinar metotrexato y ciclosporina A, o de la triple terapia (metotrexato más sulfasalazina más hidroxicloroquina), que respecto de metotrexato y cloroquina12-15.
Figura 2. Utilización de combinaciones de fármacos modificadores de la enfermedad en el estudio emAR. MTX: metotrexato; ClQ: cloroquina; CsA: ciclosporina A; Au i.m.: sales de oro por vía intramuscular; SZP: salazopirina.
Variabilidad en el uso de antiinflamatorios no esteroides (AINE)
La utilización de AINE osciló entre el 67 y el 100% de los pacientes, según las comunidades autónomas. Estas diferencias fueron atribuibles a las características de los pacientes y/o la enfermedad, sin que se detectaran diferencias significativas atribuibles a los médicos responsables. Así, la utilización de AINE fue menos frecuente en pacientes mayores de 65 años (OR = 0,51), o con antecedentes de hipertensión arterial (OR = 0,64), enfermedad péptica (OR = 0,53) o insuficiencia renal crónica (OR = 0,4). También se usaron estos fármacos con menor frecuencia cuando la enfermedad estuvo inactiva a lo largo de los 2 años del estudio (OR = 0,3) o en pacientes en estadio funcional IV (OR = 0,45).
Asimismo, se observó una gran variabilidad en el tipo de AINE utilizados, aunque de nuevo no existen estudios que demuestren de forma concluyente que alguno de ellos sea mejor que el resto16 y, por tanto, de nuevo resulta totalmente comprensible que cada facultativo utilice aquellos con los que tiene mejor experiencia.
Variabilidad en el uso de corticoides
Entre un 61 y un 100% de los pacientes, según las comunidades autónomas, habían recibido corticoides durante los 2 años revisados en el estudio emAR. Estas diferencias regionales fueron estadísticamente significativas y no puede considerarse variabilidad inaceptable ya que, a pesar de que los corticoides se usan en la AR desde hace muchos años, en la actualidad todavía no está claro qué papel deben desempeñar dichos fármacos en el manejo de esta enfermedad17. Por tanto, la utilización o no de los corticoides dependerá de las preferencias del médico responsable.
Otros factores que influyeron en la prescripción de corticoides se relacionaron con las características de la enfermedad, con un mayor uso en las formas activas de la enfermedad (OR = 2,13) y en casos en estadio funcional IV (OR = 3,6), mientras que su empleo fue menos frecuente en pacientes con una enfermedad de más de 10 años de evolución (OR = 0,5).
Variabilidad en el uso de protección gástrica
Dado el elevado empleo de AINE registrado en emAR, es lógico que también resultase elevada la utilización de protección gástrica: un 65,5% de los pacientes habían recibido este tipo de medicación durante los años que abarca el estudio. Sin embargo, también la utilización de este recurso terapéutico fue variable desde el punto de vista regional, oscilando entre el 47,6 y el 100% de los pacientes según las CA. Estas diferencias regionales fueron estadísticamente significativas e independientes de otros factores relacionados con el paciente o la enfermedad.
Los otros factores con los que se relacionó de forma significativa e independiente el uso de protección gástrica fueron: edad mayor de 65 años, antecedentes de enfermedad péptica y consumo de AINE y/o corticoides. Todos éstos son conocidos factores de riesgo para el desarrollo de gastropatía por AINE18,19. Sin embargo, dada la amplia variabilidad existente en la prescripción de protección gástrica, es posible que en algunas CA se efectuase una escasa prescripción de estos fármacos y en otras se utilizasen en exceso.
Variabilidad en el uso de tratamiento o profilaxis de la osteoporosis
Por lo que respecta a este apartado, a pesar de que la población estudiada era mayoritariamente femenina (73%), con una edad media de 63 años y consumo de corticoides a lo largo del período estudiado en el 72,4% de los pacientes, sólo se detectó prescripción de fármacos para el tratamiento o prevención de la osteoporosis en el 39,8% de la población. La realización de profilaxis de osteoporosis osciló entre el 8 y el 66,6% de los pacientes, según las diferentes comunidades autónomas y, aunque se asoció de forma significativa con enfermedad en estadio funcional IV y los conocidos factores de riesgo antes mencionados, las diferencias regionales fueron estadísticamente significativas e independientes de factores relacionados con el paciente y la enfermedad. Esto significa que en algunas zonas geográficas se hace una inadecuada prevención o tratamiento de la osteoporosis en una población con importantes factores de riesgo20.
Conclusión
El estudio emAR ha puesto de manifiesto una serie de diferencias en el uso de recursos terapéuticos aplicados a pacientes con artritis reumatoide, que en algunos casos pueden considerarse como de variabilidad inaceptable. En concreto se han detectado: a) una inadecuada dosificación de metotrexato; b) una tendencia al empleo de terapia combinada en formas muy evolucionadas, siendo en algunas CA muy escaso su empleo, y c) escasez de protección gástrica y profilaxis de la osteoporosis en algunas zonas.
Agradecimiento
El estudio emAR fue promovido por la Sociedad Española de Reumatología y financiado por Novartis Farmacéutica S.A.