Introducción
En el LES, los abortos y las muertes fetales son más frecuentes. El riesgo de pérdida fetal está directamente relacionado con el título de anticuerpos antifosfolipídicos (AAF)1,2, especialmente de anticuerpos anticardiolipinas (AAC) IgG. El riesgo es aún mayor si presentan a la vez títulos altos de AAC y de anticoagulante lúpico (AL). También otros anticuerpos pueden estar implicados en la patogenia de los abortos, como los anti-ADN, que reaccionan con la laminina, la cual ejerce un papel importante en la implantación del óvulo fertilizado en la placenta3. Otros factores que influyen en los abortos son: la actividad de la enfermedad en el momento de la concepción, la mayor duración de la enfermedad, la hemólisis, las trombosis recurrentes y la toma de azatioprina o ciclofosfamida durante el embarazo4. No obstante, el antecedente de abortos previos es el factor de mayor riesgo para futuros abortos. La tasa de partos prematuros es más alta que en las madres sanas5.
Durante el embarazo y el puerperio (6 semanas a partir del parto), las mujeres con LES presentan más frecuentemente agudizaciones de la enfermedad que las no embarazadas en el mismo período de tiempo6-8, aunque sobre su incidencia existe una gran discrepancia en la bibliografía9-11. El aumento de las agudizaciones durante el embarazo en el LES podría ser debido a que ésta es una enfermedad mediada por inmunocomplejos ligados a un exceso de producción de citocinas Th2: IL-10, al contrario que la artritis reumatoide, que está ligada a un déficit de producción de estas citocinas. En el LES, durante el embarazo no se incrementan los valores séricos de cortisol, progesterona y estrógenos12, lo que altera el balance de las citocinas Th1/Th2, inhibiéndose la inmunidad celular y la producción de citocinas Th1 (IL-12 e interferón gamma) y estimulándose la inmunidad humoral y la producción de citocinas Th2 (IL-4 e IL-10)13. Los valores elevados de anti-ADN se correlacionan con la mayor incidencia de episodios de agudización de la enfermedad y de partos prematuros14.
Ante estos hechos, llegado el embarazo, no podemos tratar la enfermedad de forma rutinaria. Por un lado, aparecen cambios fisiológicos propios del embarazo, que pueden confundirse con síntomas de la enfermedad: cloasma gravídico, cambios analíticos, etc.; por otro lado, se produce una limitación en el uso de la medicación. Con el propósito de mejorar la tasa de nacimientos en estas pacientes, así como para proporcionarles una asistencia y tratamiento integral, evitándose la proliferación de visitas, interconsultas, exploraciones complementarias y una reducción del número de abortos, se creó en 1993 la Unidad de Lupus y Embarazo (en adelante, la unidad) en el Hospital de Basurto, formada por un obstetra, un reumatólogo y una matrona, con los que colaboran estrechamente un cardiólogo infantil, la sección de neonatos y la de hematología.
Pacientes y métodos
A la unidad acceden fundamentalmente las pacientes procedentes del Área Sanitaria de Bilbao y el 11% de los hospitales de las proximidades y de consultas extrahospitalarias. En este tiempo han sido atendidas pacientes con diversas enfermedades autoinmunitarias, como LES, lupus cutáneo subagudo, lupus discoide, síndrome antifosfolipídico primario, enfermedad mixta del tejido conectivo, síndrome de Sjögren, esclerodermia y miastenia graves. El grupo más numeroso ha sido el de LES, sobre el que se centra el presente artículo. Se han atendido a 35 mujeres embarazadas con LES, que tuvieron 46 embarazos atendidos en la unidad. La edad media de las pacientes es de 32,2 años, con un rango de 19-40 años.
Antes del embarazo, o en la primera visita a la unidad, si acuden ya embarazadas, las pacientes son informadas sobre los siguientes riesgos maternos y obstétricos que comporta su embarazo: posibilidad de trombosis, abortos, partos prematuros (nacimientos entre las semanas 28 y 37), preeclampsia (hipertensión arterial, proteinuria, edemas e hiperuricemia), crecimiento intrauterino retrasado (CIR: peso del recién nacido por debajo del percentil 10, correspondiente a su edad gestacional), síndrome HELLP (hemolisis, elevated liver enzimes, low platelets) y lupus neonatal. La fertilidad es normal, excepto en los casos de afección visceral grave, períodos de actividad de la enfermedad y la utilización por parte de la madre o el padre de algunas medicaciones, como antiinflamatorios no esteroideos (AINE)o inmunosupresores, especialmente la ciclofosfamida. El pronóstico mejora después de haber pasado al menos 6 meses de escasa o nula actividad clínica de la enfermedad, o de haber finalizado el tratamiento con inmunosupresores. El pronóstico de la enfermedad no empeora durante el embarazo, excepto en los casos de enfermedad visceral grave o presencia de AAF. El pronóstico del embarazo empeora en los casos de abortos previos. En ocasiones, el síndrome antifosfolipídico se manifiesta por primera vez en forma de aborto, a pesar de ser conocida la presencia de AAF previamente. Asimismo, la frecuencia de crisis renales, hipertensión arterial y preeclampsia aumenta durante el embarazo. Las madres con nefropatía presentan un parto prematuro en casi todos los casos, dos o tres veces más pérdidas fetales que la población general y mayor incidencia de preeclampsia, o CIR15. En las nefropatías graves o fases agudas de la enfermedad pueden requerirse dosis altas de corticoides, que aumentan el riesgo de hipertensión arterial, preeclampsia y osteoporosis, lo que desaconseja el embarazo en ese momento. Por todo ello, se recomienda a las pacientes que procuren quedarse embarazadas después de llevar al menos 6 meses de escasa o nula actividad de la enfermedad. Se contraindica el embarazo en aquellas pacientes con episodios de agudización de la enfermedad o trombosis recientes, aunque no hubieran dejado secuelas, o en aquellas sometidas a diálisis renal o en tratamiento con inmunosupresores, aunque presenten buen estado general.
Se procura la mayor integración posible de las pacientes en la unidad, participando en las decisiones que sobre ellas se toman.
Las consultas tienen lugar en dos salas contiguas, de forma que las mujeres son valoradas a la vez por el ginecólogo y el reumatólogo, quienes deciden de forma consensuada sobre las exploraciones complementarias, los tratamientos y el calendario de visitas16.
También es informada la paciente sobre los resultados de los embarazos atendidos en la unidad.
Protocolo de asistencia durante el embarazo
Plan de atención antenatal
Durante el embarazo la paciente es siempre atendida en la unidad por el obstetra, la matrona y el reumatólogo. La frecuencia de las visitas depende de la gravedad de su enfermedad y de la historia obstétrica previa. La paciente acude por primera vez a esta consulta tan pronto como tiene conocimiento de su embarazo. El plan básico consiste en acudir posteriormente cada 4 semanas hasta la semana 28, quincenalmente, entre las semanas 28 y 32, y semanalmente a continuación (tabla 1). En todas las visitas se determina el peso y la presión arterial, se lleva a cabo una exploración clínica y obstétrica y se realiza un análisis elemental de orina.
En la primera visita se realiza la siguiente analítica: hemograma, perfil bioquímico, complemento (C3, C4), ANA, anti-ADN, ENA, AAF y rutina en orina. Posteriormente, en el cuarto y séptimo mes se realiza una analítica, que comprende, al menos, los siguientes parámetros: hematimetría, creatinina, complemento, ANA, anti-ADN, APTT, orina, ENA, AAC IgG e IgM y AL y, en caso de nefropatía, proteinuria de 24 h y aclaramiento de creatinina. A esto hay que añadir las pruebas sistemáticas solicitadas por el obstetra, que comprenden: en el primer trimestre, serología de lúes, rubéola, toxoplasmosis y VIH, grupo sanguíneo y Rh; en el segundo, test de O'Sullivan entre las semanas 24 y 28, y en el tercer trimestre, serología de lúes y HBsAg.
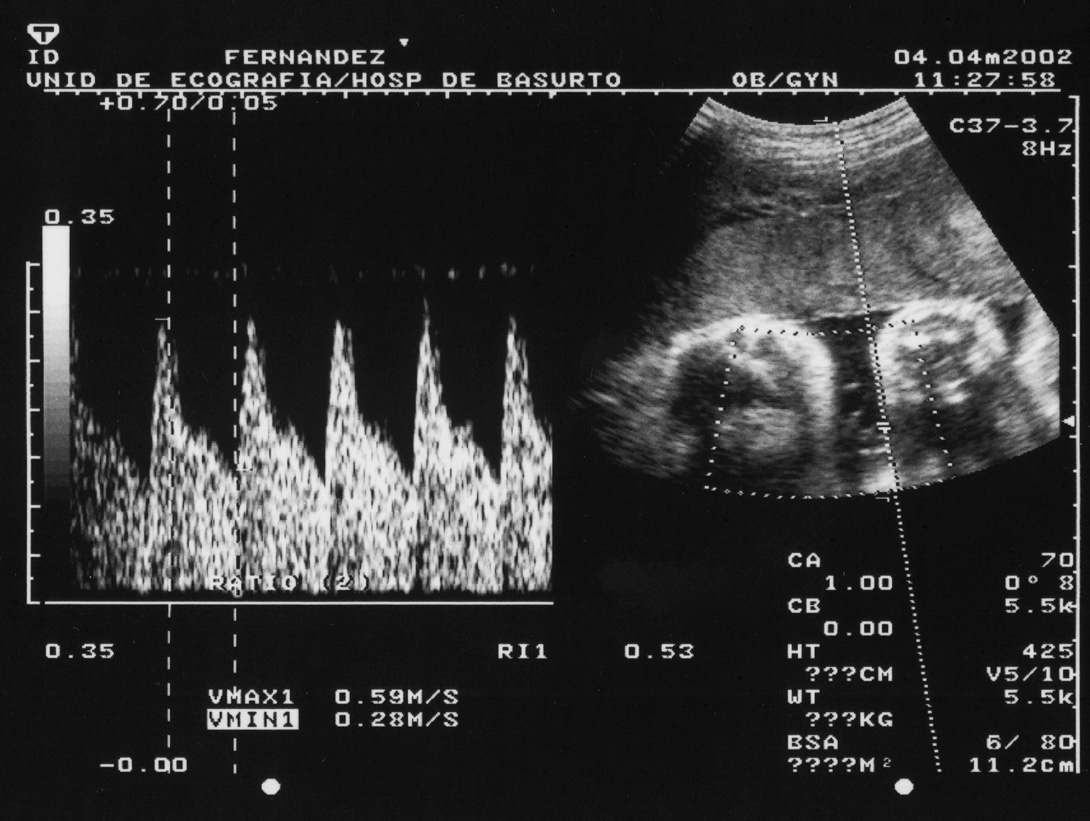
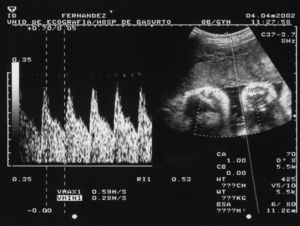
El obstetra realiza una ecografía en cada visita. A partir de la semana 20, se realiza un eco-Doppler de la arteria umbilical (fig. 1) en cada consulta, para determinar su índice de resistencia al flujo sanguíneo17,18. Su aumento refleja la presencia de fenómenos trombóticos en dicha localización, que reducen el aporte sanguíneo al feto, con el consiguiente riesgo de aborto.
Figura 1. Eco-Doppler de la arteria umbilical.
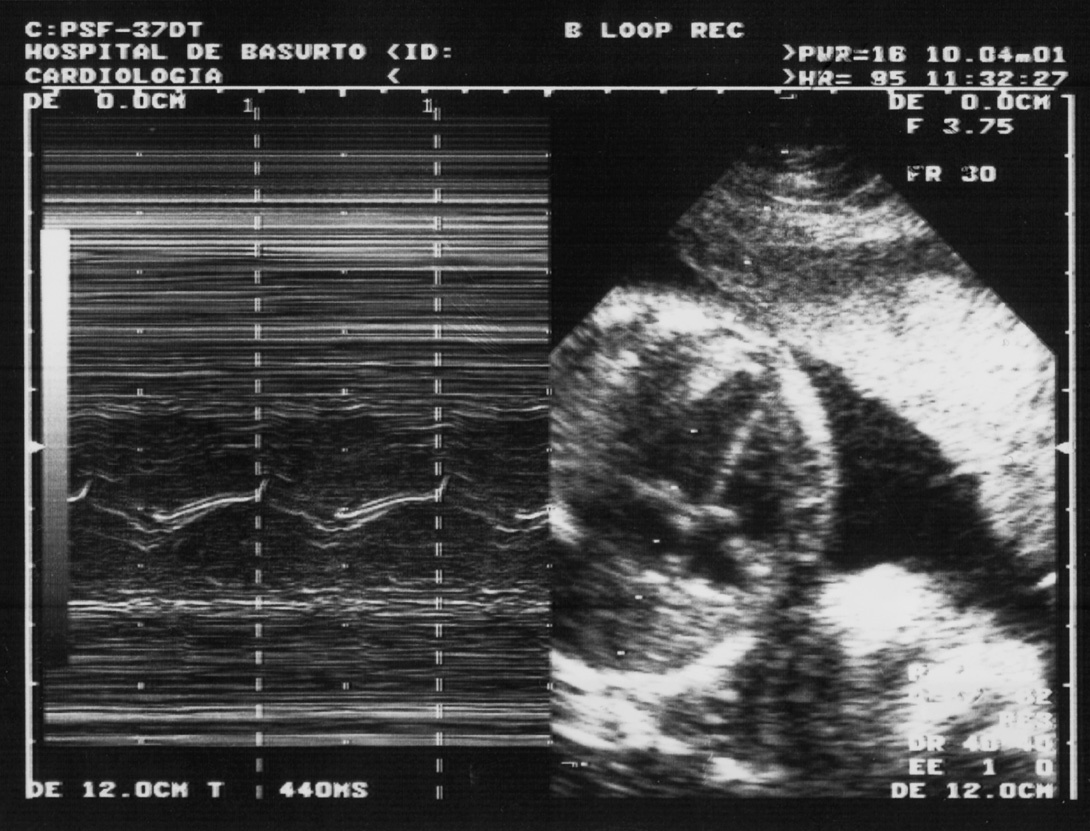
A partir de la semana 28 se realiza una cardiotocografía en todas las citas. El ritmo cardíaco fetal debe estar entre 120 y 160 lat/min. En caso de presencia de ASSA/Ro y/o SSB/La, o de trastornos del ritmo cardíaco fetal en la cardiotocografía, se realiza una ecocardiografía fetal (fig. 2) en las semanas 26, 28 y 30, para excluir un bloqueo auriculoventricular, que se repetirá en caso de enfermedad cardíaca fetal. El ritmo cardíaco fetal se obtiene por el recuento de las contracciones de las paredes ventriculares y/o apertura de las sigmoideas en la ecocardiografía fetal.
Figura 2. Ecocardiografía fetal; apertura de válvula mitral.
Todos los datos analíticos, clínicos y demás exploraciones complementarias son anotados en una hoja de seguimiento, en cada visita, que servirá para la valoración de la actividad del LES y de la evolución del embarazo19.
Medicación. Anticoagulantes y antiagregantes, desde 6 meses antes del embarazo y hasta 6 semanas después del parto se administran 100 mg/día de ácido acetilsalicílico (AAS) a aquellas pacientes que hayan tenido un aborto o fenómenos trombóticos previos, o sean portadoras de AAF, por su efecto estimulador de la producción de IL-3, a través del aumento de la producción de leucotrienos, que explica su efecto antiagregante y preventivo de las manifestaciones del síndrome antifosfolipídico (SAF)20. En caso de pacientes con antecedentes de abortos o fenómenos trombóticos previos y presencia de AAF, se administra, junto con los 100 mg de AAS, heparina de bajo peso molecular (HBPM): 5.000 U/24 h de dalteparina (Fragmin), o 40 mg/24 h de enoxaparina (Clexane), en una sola dosis diaria, desde el principio del embarazo y hasta al menos 2 meses después, por la persistencia del ries-
go de tromboembolia peri o posparto21. En caso de antecedentes de trombosis arteriales pueden doblarse estas dosis a partir de la semana 2022. Todas las pacientes en tratamiento con heparina deben tomar un suplemento de 1 g de calcio y 400 U de vitamina D al día, durante el embarazo y la lactancia23, como prevención de la osteoporosis. Las pacientes que estén en tratamiento con cumarinas (Sintrom), deben cambiar a heparina tan pronto como conozcan su embarazo, debido a sus efectos teratógenos, sobre todo entre las semanas sexta a doceava y al riesgo de hemorragias y pérdidas fetales. Tampoco se utilizan las cumarinas en el primer trimestre24, debido a que atraviesan el corion en las primeras semanas y la barrera placentaria posteriormente. Su uso, excepcional, en el segundo y tercer trimestre, en casos de antecedentes de trombosis arteriales previas, obliga a una vigilancia extrema de la madre y del feto; se debe mantener el INR entre 2,5 y 3,5, cambiando a heparina una semana antes de la fecha prevista del parto, para permitir su eliminación de la madre y del feto, y reintroduciéndolo una semana después del mismo.
Si a lo largo del embarazo se observa un aumento patológico de las resistencias de la arteria umbilical en la eco-Doppler, se actuará de la siguiente manera: a) si no se había antiagregado previamente, se tratará con 100-200 mg/día de AAS y si no se normaliza el índice de resistencias al cabo de 2 o 3 semanas, se asociará heparina; b) si ya tomaba AAS, se le añadirá HBPM al tratamiento. Estas pautas se mantienen al menos hasta el final del puerperio. La monitorización de la heparina se realiza determinando mensualmente los niveles de actividad del antifactor Xa de coagulación. Durante el embarazo el rango terapéutico de actividad del antifactor Xa se debe mantener entre 0,25 y 0,4 U/ml, determinado media hora antes de la administración de la HBPM, o bien ajustando la dosis en función del peso de la madre. No obstante, dado que la anticoagulación con HBPM es muy predictible a dosis constante, no es imprescindible su monitorización. Hay que tener en cuenta que la heparina puede causar trombopenia, en cuyo caso puede anticoagularse con r-hirudina25.
Durante el embarazo se administran a las pacientes las mismas dosis de corticoides, hidroxicloroquina (HCQ) y antiagregantes que tomaban antes del mismo, y deben ajustarse a las necesidades que demande la enfermedad en cada momento26,27. La interrupción de la HCQ durante el embarazo puede precipitar episodios de agudización de la enfermedad28-30. Tampoco está justificado el inicio de la administración de HCQ, por el solo hecho de estar la paciente embarazada31. La HCQ es la medicación más frecuentemente utilizada en nuestra serie, por su efecto ahorrador de corticoides y el control que efectúa de la actividad de la enfermedad, en ausencia de efectos secundarios sobre la madre y el feto32. Las agudizaciones de la enfermedad se tratan normalmente con incrementos de la dosis de corticoides, o con HCQ.
No se utilizan habitualmente AINE33, sobre todo en el tercer trimestre, por el riesgo de oligohidramnios, cierre prematuro del ductus arteriosus e hipertensión pulmonar.
Todos los inmunosupresores atraviesan la placenta, con el riesgo de producir malformaciones fetales. La azatioprina es el inmunosupresor utilizado, en caso necesario, por su menor toxicidad fetal34,35. Hay una amplia experiencia con ciclosporina en mujeres trasplantadas, sin efectos teratógenos.
No se inicia ni se incrementa la dosis de ninguna medicación para el LES por el hecho de quedar la paciente embarazada.
Los tipos de medicación compatible con el embarazo se recogen en la tabla 2.
Respecto a la medicación durante la lactancia, no pasan a la leche materna los siguientes fármacos: heparina, cumarinas, warfarina, aminoglucósidos, AAS, AINE y prednisona por debajo de 20 mg/día.
Plan de atención durante el parto
Al ingreso. Se realiza una analítica, con hematimetría y estudio de coagulación.
Antes del parto. Se suspende el AAS desde el ingreso y, si éste es programado, desde 5 días antes de la fecha prevista, aunque hay evidencias de que el AAS a dosis bajas no afecta la utilización de la anestesia regional durante el parto36. Se le administran a la madre 100 mg de succinato de hidrocortisona intramuscular cada 6 h intraparto, si tomaba previamente más de 7,5 mg/día de prednisona.
Durante el parto. No existe contraindicación para la realización de una anestesia epidural por la presencia de AAF o haber estado la paciente antiagregada y/o anticoagulada. La heparina y el AAS se reanudarán al día siguiente del parto, si lo tomaba previamente, debido a la persistencia de un mayor riesgo de reagudizaciones y de fenómenos trombóticos durante el puerperio.
Después del parto. El recién nacido ingresa en la unidad de neonatos, donde se toma una muestra de sangre del cordón umbilical, para la determinación de pH, ANA y AAF, que será determinado de nuevo al cabo de los 6 meses de vida para comprobar su negatividad, dentro del programa de seguimiento que realizan a estos niños los neonatólogos, en el que incluye, además, un test de desarrollo psicomotriz. A la madre se le administra en los primeros días el doble de la dosis de prednisona que tomaba antes del parto, hasta ser valorada por el reumatólogo. En caso de no tomar prednisona por estabilidad de la enfermedad, tampoco se le administra durante el puerperio. Se suspende la lactancia materna, si toma más de 20 mg/día de prednisona.
Tratamiento del bloqueo cardíaco fetal
El bloqueo cardíaco completo fetal tiene una incidencia del 10% en los embarazos de madres con ARo/La37 y su mortalidad alcanza hasta el 31%38, según lo recogido en la bibliografía. Está relacionado con la presencia de ASSA/Ro y/o ASSB/La circulantes en la madre, aunque ésta se encuentre clínicamente en remisión. El método más fiable para la detección y el estudio de las arritmias es la ecocardiografía fetal39. El bloqueo cardíaco fetal se trata administrando a la madre 4 mg/día de dexametasona o betametasona o, menos frecuentemente, con salbutamol40, en caso de síntomas de insuficiencia cardíaca y control por el servicio de cardiología infantil con ecocardiograma fetal cada 4 semanas, hasta el parto. Se debe inducir el parto tan pronto como el feto sea viable41-45. La mayor parte de los niños precisan el implante de un marcapasos en los primeros 3 meses de vida.
Diagnóstico diferencial durante el embarazo
Durante el embarazo se producen variaciones analíticas, consideradas fisiológicas, que no deben confundirse con el LES46:
VSG. Se encuentra moderadamente elevada en el embarazo.
Proteinuria. Durante el embarazo puede alcanzar hasta 500 mg/24 h en mujeres sanas. En caso de afección renal por LES, suele haber disminución de los valores de complemento47, presencia de cilindros en el sedimento urinario, aumento de los valores de anti-ADN o presencia de otros datos de actividad del LES. Todas las formas de afección renal predisponen a la preeclampsia.
Trombopenia:
a) Leve, en el último trimestre, no relacionada con el LES.
b) Moderada, de 50 a 120.000, relacionada con la actividad del LES, que responde a corticoides.
c) Inferior a 50.000, durante el primer trimestre, relacionada con AAF, que remite después del parto y puede revertir con AAS a dosis bajas.
d) Inferior a 50.000, durante el tercer trimestre, relacionada con preeclampsia o HELLP, que empeora progresivamente. Debe inducirse el parto.
e) Grave, inferior a 10.000, en casos de púrpura trombopénica idiopática (PTI), normalmente sin otros signos de actividad de LES. Se trata con corticoides, no debe usarse AAS, por el riesgo de hemorragia.
f) Síndrome HELLP48.
Anemia. Moderada durante el segundo y tercer trimestres, por la hemodilución producida a causa del aumento del volumen plasmático.
Complemento. Durante el embarazo en mujeres sanas se produce un aumento gradual de las cifras de C3, C4 y CH50. En las pacientes con LES embarazadas, un descenso de C3, C4 o CH50 ayuda a diferenciar entre una agudización del LES, respecto a una complicación del embarazo49.
Falsos positivos en el triple test de detección del síndrome de Down, que incluye alfafetoproteína, beta-HCG, y estriol no conjugado. Las pacientes con LES embarazadas pueden presentar un aumento de alfafetoproteína, que está relacionado con el parto pretérmino, mayores dosis de prednisona y AAF50,51.
Embarazo y otras enfermedades autoinmunitarias
En la unidad de lupus y embarazo han sido tratadas también mujeres embarazadas con síndrome antifosfolipídico primario, síndrome de Sjögren, enfermedad mixta del tejido conectivo, esclerodermia y miastenia grave. El plan de atención y la medicación compatible con el embarazo y la lactancia es superponible a todo lo expuesto para el LES. En ninguna de ellas está contraindicado de antemano el parto vaginal, siendo las razones obstétricas las que determinarán la actuación.
En la miastenia grave se utilizan las dosis de piridostigmina y prednisona que requiera su enfermedad. La última dosis de piridostigmina se administra 30 min antes del parto. Se aconseja la anestesia epidural, pues disminuye la fatiga y facilita la extracción instrumental. En el puerperio pueden aparecer agudizaciones o remisiones. La lactancia materna está contraindicada si la madre toma piridostigmina, pues se excreta por la leche, y en casos de tasa de anticuerpos muy elevada52.
Resultados
Se ha atendido a 35 mujeres con LES, que han tenido un total de 66 embarazos, de los cuales 46 fueron atendidos en nuestra unidad. De estos 46 embarazos, 6 (13%) finalizaron en aborto y nacieron 40 (87%) hijos sanos. Nueve de estas mujeres habían tenido 20 embarazos previos, con 15 (75%) abortos y 5 (25%) nacidos vivos. En el momento del embarazo todas las mujeres, excepto una que presentaba nefritis lúpica, se encontraban en remisión clínica. Ninguna mujer requirió hospitalización durante su embarazo.
Dos mujeres presentaban nefritis lúpica antes de acudir a la unidad. Una de ellas recibió una dosis de ciclofosfamida i.v. en las primeras semanas de su embarazo, por desconocimiento del mismo, desarrollándose éste sin complicaciones.
La frecuencia de cesáreas se eleva al 32% y la de partos inducidos al 74%, alguno de los cuales con cesárea, en nuestra serie.
Catorce (40%) pacientes eran portadoras de AAF y 12 (34%) de ARo y/o La.
De 14 mujeres con AAF+, 7 presentaron abortos. Cuatro de ellas los tuvieron antes de acudir a la unidad y 3 fueron atendidas por nosotros. De las 7 mujeres que tuvieron abortos, sólo una tuvo un hijo fuera del control de la unidad.
De las 21 mujeres AAF, cuatro tuvieron abortos, una de ellas en la unidad.
En ningún caso de las 12 mujeres que presentaban ARo/La hubo lupus neonatal, y sólo una, que era también AAF+, tuvo un aborto.
En nuestra unidad se produjeron 5 abortos y una muerte fetal, en 4 mujeres, 3 de las cuales eran portadoras de AAF. La muerte fetal fue causada por una vuelta de cordón. Una mujer con AAF tuvo un accidente isquémico transitorio en el segundo trimestre del embarazo, por lo que se le asoció heparina al AAS que tomaba previamente. Cuatro mujeres tuvieron hijos con CIR (8,7%), una de ellas con parto gemelar. El índice de resistencia en la eco-Doppler de la arteria umbilical aumentó en 6 embarazos. Dos fueron tratadas con AAS y a 4 se les asoció heparina al AAS que tomaban previamente, por persistencia de las anomalías en la eco-Doppler. Dos mujeres presentaron preeclampsia, una de ellas con embarazo gemelar y otra con nefropatía. No se han presentado casos de lupus neonatal. El desarrollo de los niños ha sido normal, hasta la fecha.
Discusión
Debido a los avances en el diagnóstico precoz y en el tratamiento del LES, progresivamente más eficaz y menos tóxico, su pronóstico ha mejorado en los últimos años. Asimismo, las mujeres con LES embarazadas se han beneficiado de estos logros. La formación de equipos multidisciplinarios, en los que colaboran los distintos especialistas implicados, permite avanzar en la aplicación de criterios de selección de la situación clínica favorable para recomendar el momento del embarazo, la aplicación de un protocolo experimentado de seguimiento y el tratamiento durante el mismo. Todo ello ha ayudado a reducir la morbilidad de la madre y del feto y a mejorar el pronóstico del embarazo. No obstante, el número de complicaciones durante el embarazo sigue siendo superior al de la población sana. La tasa de nacimientos en nuestra serie es similar a lo publicado en los últimos años53-56.