La fibromialgia (FM) es una entidad que ha sido aceptada por la OMS en 1992. Los criterios diagnósticos han sido postulados inicialmente en 1990 y modificados recientemente. El cuadro clínico se caracteriza por dolor crónico osteoarticular, muscular y del tejido celular subcutáneo, con fluctuaciones a lo largo del tiempo; se asocia a patologías crónicas dolorosas y trastornos del sueño, atención y del estado de ánimo. Suele llevar varios años de evolución en el momento del diagnóstico, provocando disminución de las capacidades funcionales y conflictos psico-sociales. Afecta entre el 2 y 4,7% de la población entre los 20 y 60 años y en un 80% al sexo femenino. Los pacientes perciben dolor con estímulos de menor intensidad que la mayoría de los individuos. Si bien no se ha detectado un parámetro biológico indicador de FM, estudios con resonancia magnética funcional detectan imágenes que se correlacionan con una mayor percepción del dolor y se postulan factores genéticos y fallos en el sistema nervioso central, en los circuitos inhibitorios del dolor. Estos fenómenos son criticados por investigadores que postulan factores psicógenos de mala adaptación al dolor. El tratamiento debe contemplar fármacos: pregabalina, duloxetina y milnacipram combinados con tratamiento educacional, psicoterapéutico y ejercitación física controlada. En esta revisión se plantea una visión crítica de la FM dirigida al neurólogo que en su práctica diaria asiste a pacientes con FM.
Fibromyalgia (FM) was accepted as an entity by WHO in 1992. Diagnostic criteria were stated initially in 1990 and modified recently in 2010. The clinical feature is characterized by widespread chronic pain in muscles, joints, and in soft tissues and is associated to sleep, attention and mood disorders. Moreover, FM affects functional activities and decrease quality of life and leads to psycho-social conflicts. The course of the disease fluctuates along months to many years. There is a long delay between the onset of the symptoms and its correct diagnosis. FM involves 2 - 4.7% of the general population with a high prevalence in women. Patients feel pain at lesser stimulation intensity than most healthy subjects. Not specific biological marker has been found to diagnose FM, but through brain Functional Magnetic Resonance, focal hyperactivity has been identified, which correlates with clinical features in FM. Different patophysiological mechanisms have been proposed as genetic predisposition and a failure of the central inhibitory pathway of pain. Several authors have objected to that theory and have postulated psychogenic factors as poor pain adaptation. FM treatment includes pregabalin, duloxetine and milnacipran, combined with educational, psychotherapy and gradual physical exercising. This review presents a critic vision of FM aimed at the practitioner Neurologist who assists daily patients with FM.
Podríamos decir, sin riesgo de equivocación, que los neurólogos en general tenemos una educación dedicada a reconocer y tratar primordialmente enfermedades de causas orgánicas demostrables, con marcadores biológicos alterados que nos dan una certeza de daño orgánico en gran parte de los casos. En la fibromialgia (FM) la situación es distinta y requiere mayor atención, tanto en los aspectos teóricos, como en la práctica delante del paciente. A pesar de que en los últimos años se ha identificado su cuadro clínico, sus criterios diagnósticos han evolucionado y disponemos de recursos terapéuticos, no se ha podido identificar hasta el momento un parámetro biológico inequívoco indicador de la enfermedad.
En el presente trabajo presentamos al neurólogo elementos a favor y en contra sobre la validez de considerar a la FM como una entidad nosológica con base orgánica, a pesar de que ha sido aceptada como tal por la OMS desde 1992.
La FM es un desorden crónico caracterizado por dolor corporal diseminado, con puntos dolorosos a la palpación en ausencia de inflamación o de anormalidades estructurales músculo-esqueléticas. Frecuentemente se acompaña de otros síntomas como deterioro del sueño, depresión, alteración cognitiva, rigidez matinal, fatiga y otros múltiples síntomas somáticos. Su etiología aún hoy es incierta, aunque se considera que es el resultado de un síndrome genético, que en parte involucra un procesamiento anormal del dolor a nivel central y un deterioro en el sistema endógeno inhibitorio del dolor.
La FM puede ser identificada en el 2-4,7% de la población general, mayoritariamente entre los 20-60 años de edad1,2, y con un franco predominio femenino (aproximadamente el 80%)3,4.
Se encuentran descripciones publicadas que concuerdan con las características de la FM actualmente aceptadas en la primera mitad del siglo pasado5,6, y fue formalmente definida por Smythe y Moldofsky en 19777. En los años subsiguientes se comienza a estudiar y describir con mayor precisión esta condición, hasta que en el año 1990 el American College of Rheumatology (ACR) respalda los criterios diagnósticos para la FM publicados por Wolfe et al.8, reconociéndola como una entidad clínicamente definida y otorgándole jerarquía académica. Dos años más tarde la Organización Mundial de la Salud (OMS) incluye la FM en la décima revisión de su clasificación International Statistical Classification of Diseases and Related Health Problems (ICD-10) dentro del grupo de «reumatismo y fibrositis», originalmente como M79.0 y en la actualidad clasificada como una entidad separada con el código M79.79. El día 12 de mayo fue proclamado como el «día de la fibromialgia»” (Fibromyalgia Awareness Day), en por lo menos 8 Estados de los Estados Unidos y Canadá, y el congreso estadounidense ha requerido al Instituto Nacional de la Salud (National Institutes of Health [NIH]) que apoye su investigación10. En los últimos años el interés científico sobre la FM se ha incrementado de forma notable, llegándose a encontrar actualmente más de 6.300 artículos en PubMed.
Es importante destacar que 17 años después de la publicación de los criterios diagnósticos, la Food and Drug Administration (FDA) de los EE.UU. aprueba el primer fármaco para el tratamiento de la FM, la pregabalina, seguido en los años siguientes por la duloxetina (2008) y el milnacipran (2009).
La FM está caracterizada por una gran heterogeneidad subjetiva, principalmente dada por el dolor y por la carencia hasta la fecha de un parámetro biológico de utilidad diagnóstica11. Como ya hemos mencionado, además del dolor la FM se acompaña de un extenso espectro de otros síntomas y comorbilidades12.
Etiología y fisiopatologíaLa etiología de la FM hoy es aún incierta, aunque se considera que es el resultado de un síndrome genético exacerbado por múltiples factores, que en parte involucra un procesamiento anormal del dolor a nivel central y un deterioro en el sistema endógeno inhibitorio del dolor.
Aunque estos mecanismos no están bien definidos, se cree que los pacientes con FM presentan un deterioro en los sistemas analgésicos endógenos, particularmente en las vías inhibitorias descendentes serotoninérgicas (médula rostral ventral) y noradrenérgicas (pontina dorsolateral) comprometiendo la percepción y el procesamiento del dolor13.
Algunas de las teorías postuladas que justifican la causa de la FM son:
Factores centralesVarias investigaciones apoyan la teoría de génesis central de la FM, ya que han sido descritas alteraciones cognitivas en pacientes con FM14 y se ha detectado una pérdida acelerada de la sustancia gris cerebral en la resonancia magnética nuclear (RMN) en pacientes afectados, que si bien no se trata de una alteración específica, se estableció que los pacientes con edades comprendidas entre 27 y 61 años presentaban una disminución anual del volumen de la sustancia gris de más de 3, mayor que el grupo control15.
La comprobación de una sensibilización central al dolor se logró valorar mediante el uso de RMN funcional16,17. Los pacientes con FM detectan la sensación de dolor a una intensidad del estímulo significativamente menor que los sujetos control, activándose áreas comunes de incremento de la actividad neuronal en la corteza sensitiva contralateral, el gyrus temporal superior, el putamen, la ínsula y la región ipsilateral del cerebelo.
Factores periféricosTambién se ha relacionado la FM con mecanismos vinculados a un daño osteoarticulomuscular: Katz et al.18 sugieren que el dolor de la FM es producto de una hipoperfusión muscular secundaria a una desregulación regional vasomotora, siendo la misma posiblemente inducida por los reducidos niveles de óxido nítrico y el estrés oxidativo19. También se ha encontrado una vinculación estadística con traumatismos cervicales20.
Factores genéticosRecientemente se ha reportado una alta frecuencia de antecedente de desorden de déficit atencional/hiperactividad (ADHD) en la infancia en un gran grupo de mujeres con FM21.
La existencia de una alta agregación de FM en familias de pacientes con esta condición fomentó la idea de una base genética. La FM aparece como un síndrome genético de desregulación con potencial disfunción de los sistemas neuroendocrino, neuromodulador, neurotransmisor, neurotransportador, bioquímico y neurorreceptor13. El tipo de herencia es desconocida, aunque probablemente sea poligénica. Hay evidencia de polimorfismos de genes22 de las vías serotoninérgicas23, dopaminérgicas24 y catecolarminérgicas25, y se cree que la deficiencia de serotonina y el aumento de la sustancia P también desempeñan un rol importante en la patogénesis de la FM26,27.
Factores inmunitariosSe ha encontrado una asociación con lupus eritematoso sistémico y artritis reumatoidea28. En los últimos años se ha demostrado que alteraciones inmunológicas podrían causar la FM. Se ha reportado un alto nivel de IL-10, IL-8, factor de necrosis tumoral α29 y de IL-6, la cual induce hiperalgesia, síntomas de fatiga y depresión30. Además, se encontraron alteraciones en los niveles de glutamato y neurotrofinas31, IL-1 y NMDA.
Fibromialgia y sueñoLos resultados de algunos estudios indican que los trastornos del sueño ocupan un lugar central en la FM. Una hipótesis interesante enfatiza la alteración de la cuarta fase del sueño (no-REM) en las personas con FM, ya que la misma, bajo condiciones fisiológicas, estimula la síntesis de IGF-1, sustancia responsable de mantener un adecuado estado muscular32.
Aspectos clínicos y diagnósticoLa FM aparece como una constelación de síntomas, siendo el cardinal el dolor crónico diseminado. El dolor es prolongado, de varios meses o años de duración, con características variadas: desde dolor constante, sordo, referido a los tejidos blandos, músculos y articulaciones, hasta tener componentes intermitentes breves, con parestesias y a veces alodinia. La intensidad es variada y suele haber marcadas oscilaciones a lo largo de los meses, con mejorías y empeoramientos. Las remisiones espontáneas son raras, y si bien el dolor raramente provoca un cuadro de discapacidad por impotencia funcional, suele acompañarse de disminución marcada del rendimiento funcional del paciente.
Si bien muchos de los síntomas neurológicos o reumatológicos que son parte de este síndrome son manifestaciones que en otro contexto se considerarían irrelevantes; el cuadro clínico espontáneamente es favorable33 en términos de discapacidad medida objetivamente. En general el dolor crónico y la impotencia funcional, asociados a la gran cantidad de síntomas acompañantes, llevan al paciente y su entorno a una disminución en la calidad de vida.
En la práctica diaria se suele observar frecuentemente la presencia de fatiga, trastornos en el sueño, deterioro en las funciones cognitivas y alteraciones emocionales (ansiedad, depresión, distimia, enojo, frustración, estrés, etc.). Además, otros potenciales síntomas incluyen rigidez matinal, disfunción sexual, diarrea, síndrome de piernas inquietas, desorden en la articulación temporomandibular, aumento del índice de masa corporal y diaforesis.
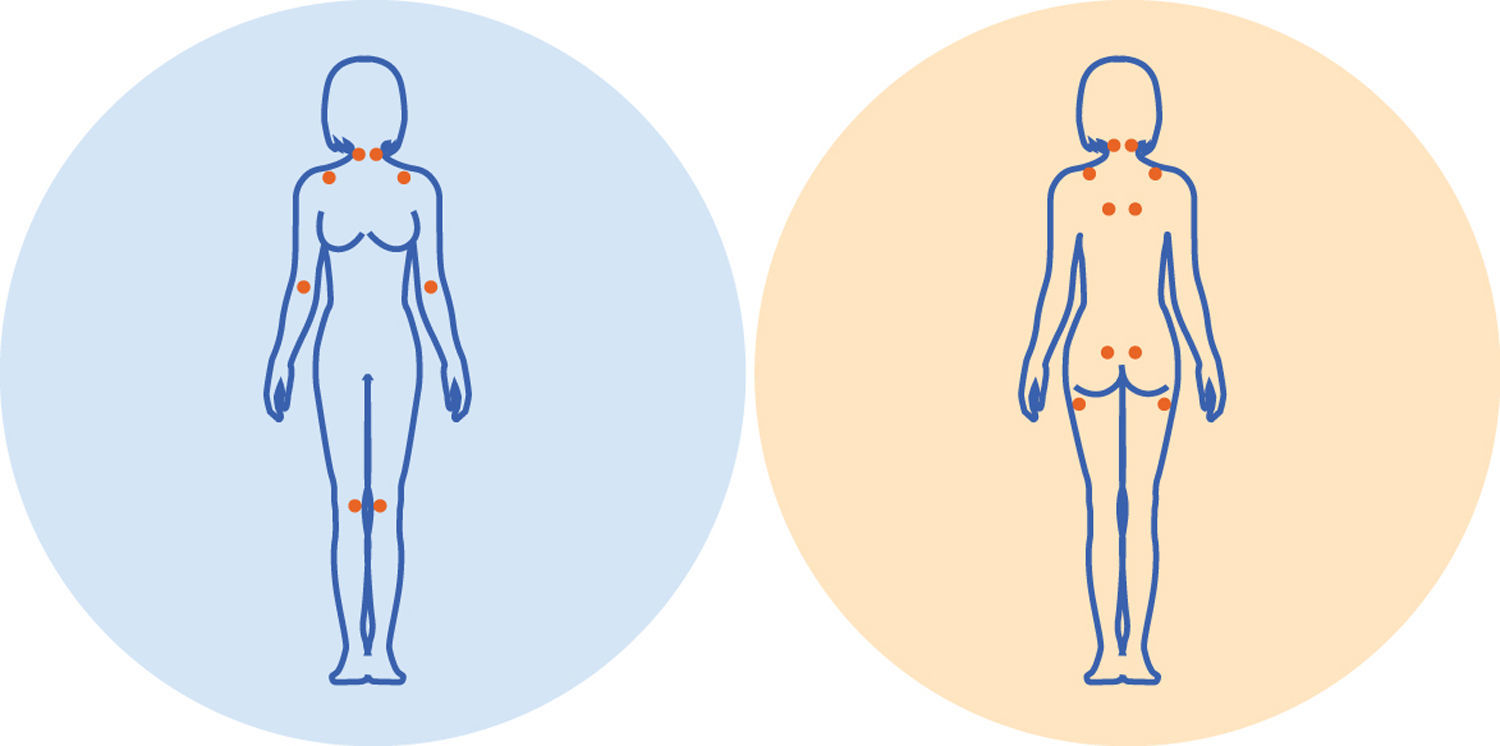
El examen físico y los test de laboratorio son irrelevantes, salvo por la presencia de los puntos dolorosos o tender points (TP). Los TP son puntos definidos y distribuidos en el cuerpo, los cuales se consideran positivos cuando la presión de 4kg/cm2 provoca dolor (fig. 1). La presión de 4kg/cm2 es la necesaria para que se logre blanquear el lecho ungueal del dedo pulgar.
Los criterios diagnósticos establecidos en el año 1990 por el ACR definen a la FM por la presencia de:a) dolor diseminado durante más de 3 meses en la mitad izquierda y derecha del cuerpo, por arriba y por debajo de la cintura, y en la región axial; y b) 11/18 TP positivos8.
Con el paso de los años comenzó a reconocerse el complejo y extenso grupo de síntomas somáticos presentes en la FM. El mejor entendimiento de los mismos obligó a considerar una revisión sobre los criterios diagnósticos, pues estos síntomas no estaban incluidos originalmente en su definición. Además, se constató que los médicos en su práctica diaria raramente evaluaban los TP, ya fuese por falta de tiempo, porque no los recordaban o por ignorancia sobre cómo examinarlos (cuánta presión es la necesaria, etc.). También se tuvo en cuenta que muchos pacientes no cumplían con los criterios diagnósticos con alta sospecha de FM, por ejemplo aquellas personas que presentaban TP positivos pero a una presión> 4kg/cm2, o que tenían menos de 11/18 puntos positivos. Por estos motivos surgió la necesidad de establecer nuevos criterios para la FM que integraran a los síntomas comórbidos y que no requirieran la aplicación de los TP. Así, después de dos décadas, se publica el nuevo criterio diagnóstico preliminar de FM por Wolfe et al.34, con una fuerte intervención de los aspectos clínicos, en donde el dolor diseminado es dividido por áreas, debiéndose contabilizar la cantidad afectada de las mismas, no requiriendo la identificación de los TP y, además, incluyendo una escala de valoración de los síntomas (tabla 1).
Criterios diagnósticos de fibromialgia (2010)
| Los pacientes con fibromialgia deben reunir las tres siguientes condiciones: |
| 1) DD≥7+EESS≥5 o DD 3-6+ESS≥9 |
| a)DD: contar el número de áreas en donde el paciente tuvo dolor en la última semana. La puntuación será entre 0 y 19. |
| Áreas: tórax, abdomen, cuello, espalda superior, espalda inferior, derecho/izquierdo: hombro, brazo superior, brazo inferior, cadera (trocanter, glúteo), pierna superior, pierna inferior, maxilar inferior |
| b)ESS: es la suma de de la severidad de los tres síntomas (fatiga, sueño no reparador, síntomas cognitivos) y de los síntomas somáticos. La puntuación será entre 0 y 12. |
| Fatiga, sueño no reparador, síntomas cognitivos. En cada uno de ellos, indicar el nivel de severidad en la última semana: |
| 0=Sin problemas |
| 1=Ligeros o leves problemas, generalmente leves o intermitentes |
| 2=Moderado, considerable problema, frecuentemente presente y/o nivel moderado |
| 3=Severo, continuos problemas que perturban la vida |
| Considerando los síntomas somáticos en general, si el paciente tiene: |
| 0=Ningún síntoma |
| 1=Pocos síntomas |
| 2=Un moderado número de síntomas |
| 3=Un gran número de síntomas |
| Síntomas somáticos: dolor muscular, colon irritable, fatiga/cansancio, problemas en el recuerdo o en el pensamiento, debilidad muscular, cefalea, dolor/calambres en el abdomen, parestesias, vértigo, insomnio, depresión, diarrea, dolor en el abdomen superior, náuseas, nerviosismo, dolor torácico, visión borrosa, fiebre, sequedad de boca, pinchazos, respiración con silbidos (wheezing), fenómeno de Raynaud, urticaria/ronchas, acúfenos, vómitos, acidez, úlceras orales, pérdida o cambio en el gusto, crisis convulsivas, sequedad de ojos, respiración entrecortada, pérdida del apetito, rash, fotosensibilidad, dificultades en la audición, fragilidad capilar, caída del cabello, micción frecuente o dolorosa, espasmos vesicales. |
| 2)Los síntomas están presentes en un nivel similar por lo menos los últimos tres meses |
| 3)El paciente no tiene una enfermedad o desorden que pueda explicar el dolor. |
DD: dolor diseminado; ESS: escala de severidad de los síntomas.
Los diagnósticos diferenciales más frecuentes de la FM son el síndrome de fatiga crónica, el hipotiroidismo, la polimialgia reumática, la artritis reumatoidea, y el lupus eritematoso sistémico.
Varios síndromes dolorosos crónicos se asocian a FM, como intestino irritable, disfunción temporomandibular y vulvodinia, entidades que son evaluadas por diversas especialidades con diferencias en el deterioro funcional35,36.
A su vez, numerosas enfermedades reumatológicas con mecanismos conocidos cumplen entre el 10 al 30% de los casos con criterios de fibromialgia37, lo que resalta el aspecto inespecífico de las manifestaciones clínicas consideradas en los criterios diagnósticos.
Aspectos socialesLa FM representa un importante problema social, pues afecta en gran medida la calidad de vida, pudiendo influenciar negativamente las relaciones personales, la propia carrera y la salud mental38, y se ha encontrado asociada al estrés postraumático39. El 10-25% de los pacientes no son capaces de trabajar por el dolor crónico, y esto adquiere especial relevancia considerando el hecho de que las remisiones espontáneas son raras40. El 62% tiene dificultad para subir escaleras, el 55% para caminar 200 metros y el 35% en las actividades de la vida diaria41. Un estudio realizado en España, el estudio EPISER42, encontró que los pacientes con FM poseían peor deterioro psicológico en comparación con aquellos que padecían artritis reumatoidea, pero con similar deterioro físico. Recientemente ha sido publicado por Wolfe et al. un trabajo sobre mortalidad en FM14. Con datos provenientes de 8.186 pacientes con FM entre los años 1974 y 2009, los autores concluyeron que la mortalidad no pareciera estar incrementada en los pacientes que sufren de FM, pero sí el riesgo de muerte por suicidio y accidentes.
Algunos investigadores como George Ehrlich, de la Universidad de Pensilvania43, consideran que la FM es un cuadro de falta de adaptación al dolor, a diferencia de otras personas que toleran algunas molestias sin jerarquizarlas43–45.
Un tercio de los pacientes con FM son referidos al neurólogo por síntomas inespecíficos, no tienen evidencia de organicidad, aun después de 6 meses de seguimiento, y este grupo se asocia en mayor medida a expresión somática, dolor, alteración de funcionamiento social, ansiedad y depresión34.
Por otro lado, un tercio de los pacientes con FM referidos al reumatólogo tiene síntomas que no tienen explicación ni evidencias de organicidad. Las quejas son dolor, dishabilidad y alteraciones emocionales semejantes a los pacientes con enfermedad reumática.
La relación encontrada por Maiden entre síntomas inexplicados y variables socio-económicas46 contribuye a la polémica sobre la FM y sus criterios diagnósticos.
El valor diagnósticoLa intervención del médico y la información al paciente en el momento del diagnóstico es también tema de debate. Muchos investigadores consideran que informar al paciente el diagnóstico de FM e indicar un tratamiento suele ser tranquilizador, y establece un freno en la búsqueda incesante de un diagnóstico, asistencia médica y de estudios complementarios; otros autores, muy por el contrario son muy críticos al respecto y expresan que formular el diagnóstico de FM surge solo porque el paciente y el médico se sienten disconformes sin el mismo, se atenúan molestias subjetivas inexplicables a cambio de elevados gastos en tratamiento farmacológico y los efectos adversos de los medicamentos son más reales que los síntomas de la enfermedad. Ehrlich43 considera que en la búsqueda de una etiología cualquier antecedente se transforma en una causa. Según S. Benjamin47 la expectativa del tratamiento de un síntoma y la mejoría atribuible a solo un agente farmacológico actuaría de alguna manera iatrogénica, exacerbando conductas y pensamientos que complican más aún la solución del problema. Nortin Hadler, de la Universidad de Carolina del Norte48, opina que rotular la enfermedad contribuye a padecerla, señala que definirle a un paciente el diagnóstico de FM contribuye a agravar el sufrimiento, y que las personas que encuentran un «rótulo o etiqueta» para sus molestias ven favorecida la obsesión de padecer dolores que el común de la gente puede tolerar sin demasiado problema.
TratamientoEl tratamiento de la FM implica un esfuerzo comunitario, incluyendo un abordaje farmacológico, cognitivo/emocional, educacional, físico (ejercitación, actividades complementarias) y de los trastornos del sueño. Es primordial remarcar el hecho que el mayor logro terapéutico se obtiene con la aplicación conjunta de estos distintos abordajes, y no con la aplicación aislada de alguno.
Tratamiento farmacológicoLa FDA aprobó el uso de 3 fármacos para la FM: la pregabalina, la duloxetina y el milnacipran.
La pregabalina es un fármaco antiepiléptico aceptado como terapia adjunta de las crisis parciales, con o sin generalización secundaria, para la neuropatía dolorosa diabética y la neuralgia postherpética. Es un análogo del GABA; se une a la subunidad α2-δ de los canales de calcio voltaje dependientes. Estos canales se pueden encontrar en varios tejidos, entre ellos el cardíaco, el periférico y el sistema nervioso central. La absorción es≥90% y es independiente de la dosis. No se une a las proteínas plasmáticas. El mecanismo de eliminación es renal, excretándose≥98% sin cambios, con una vida media de eliminación de 6,3 horas. La dosis máxima es 600mg/día. El aclaramiento plasmático y renal de la pregabalina son directamente proporcionales al de la creatinina, por lo cual es necesario un ajuste de la dosis en pacientes con función renal alterada o en hemodiálisis49. Los efectos adversos más frecuentes son vómitos, vértigo, somnolencia, xerostomía, visión borrosa, edema periférico, angioedema, aumento de peso, prolongación del intervalo PR, confusión, disminución de la libido, irritabilidad, ansiedad, mareos, cefalea, ataxia, deterioro de la memoria, parestesias, trastorno del equilibrio, constipación, artralgia, disfunción eréctil y fatiga. También, como otros fármacos antiepilépticos, se ha detectado un riesgo mayor de suicidio. Häuser et al.50 realizaron un metaanálisis de 4 estudios sobre este fármaco en pacientes con FM, observándose una mejoría significativa (p<0,001) en el dolor, en los trastornos del sueño y en la calidad de vida, pero no en los síntomas depresivos.
La duloxetina es un inhibidor selectivo de la recaptación de la serotonina-noradrenalina (considerado antidepresivo «dual»). Está indicado para la depresión mayor, la neuropatía dolorosa diabética y el trastorno de ansiedad generalizado. Después de su administración por vía oral se absorbe por el tracto digestivo y alcanza su pico plasmático máximo a las 6 horas. Posee una vida media plasmática de 12 horas, y una elevada unión con las proteínas plasmáticas (>90%). Sufre una importante biotransformación metabólica que incluye al citocromo P450 1A2 y 2D6 (oxidación, conjugación). Su principal vía de eliminación es a través de la orina (>70%) como metabolitos51. La dosis es entre 60 y 120mg/día. Los efectos adversos que pueden ocurrir son náuseas, diarrea, xerostomía, somnolencia, disminución del apetito, aumento de la sudoración, visión borrosa, insomnio, fatiga, disfunción sexual, vértigo, cefalea, insomnio, hiperhidrosis, incremento de la TA y riesgo de suicidio. Cuatro estudios placebo-controlados demostraron que la duloxetina mejoró significativamente (p<0,001) el dolor, la calidad de vida y los síntomas depresivos medidos por la 17-ítem Hamilton Depression Rating Scale (HDRS-17)52.
El milnacipran es un antidepresivo también «dual». Su absorción por vía digestiva alcanza una elevada biodisponibilidad (>85%). Presenta una baja unión proteica (13%), sufre metabolismo hepático (glucuronoconjugación) y se elimina predominantemente por vía renal (90%). Su vida media de eliminación plasmática es de 8 horas53. La dosis máxima es de 200mg/día. Los fenómenos reportados como efectos adversos son generalmente de carácter leve, e incluyen vértigo, hiperhidrosis, sofocos, xerostomía, náuseas, cefaleas, temblor, palpitaciones, vómitos, ansiedad, nerviosismo y diarrea. Hay varios trabajos que muestran una mejoría en el dolor, la calidad de vida y la fatiga54–56.
Recientemente se ha publicado un trabajo comparativo sobre la pregabalina, la duloxetina y el milnacipran que incluyó el análisis de 17 estudios aleatorizados y controlados con una población total de 7.739 pacientes, en el cual se observó que los 3 fármacos fueron superiores al placebo, excepto la duloxetina para la fatiga, el milnacipran para los trastornos del sueño y la pregabalina para los síntomas depresivos. Además se encontraron algunas diferencias entre estos agentes: pregabalina y duloxetina fueron superiores a milnacipran en la reducción del dolor y en los trastornos del sueño; duloxetina fue superior a pregabalina y milnacipran en la disminución de los síntomas depresivos; pregabalina y milnacipran fueron superiores a duloxetina en reducir la fatiga57.
Existe un gran número de fármacos que si bien no presentan una fuerte evidencia para el tratamiento de la FM, algunos reportes aislados muestran potenciales beneficios: fluoxetina, paroxetina, antidepresivos tricíclicos, gabapentina, opioides, pramipexole y tizanidina13,41. Recientes publicaciones han mostrado mejoría del dolor con dolasetron, un antagonista sertoninérgico58, y esreboxetina, un inhibidor de la recaptación de noradrenalina59.
Tratamiento no farmacológicoSurgen diferentes líneas de abordajes: educacional, ejercitación física y/o actividades complementarias, terapias cognitivas y del comportamiento combinadas60.
Rooks et al.61 completaron un estudio controlado aleatorizado con 207 mujeres con FM, en donde concluyeron que el ejercicio aeróbico, de estiramiento y de flexibilidad combinado con un curso de autoayuda, mejoraban en gran medida a estos pacientes.
En relación con la ejercitación física, el resultado de un metaanálisis mostró mejoría en el dolor, la fatiga, la depresión y la calidad de vida; no así en los trastornos del sueño. El beneficio fue observado tanto en los ejercicios practicados en la tierra como en los acuáticos, con una intensidad de leve a moderada, y con una frecuencia de 2-3 veces/semana durante por lo menos 4 semanas. Los ejercicios en tierra abarcaban boxing, danzas, bicicleta, caminatas y trote62.
En la revisión de 23 estudios aleatorizados controlados entre los años 1992-2007 sobre los distintos tipos de actividades complementarias o alternativas, se obtuvo mejor evidencia para la balneoterapia/hidroterapia. Resultados positivos también se encontraron para la homeopatía, luz infrarroja y meditación. Resultados controvertidos fueron hallados para la acupuntura, y no se observaron beneficios con las técnicas de biofeedback, quiropraxia, musicoterapia ni dieta vegetariana63.
Wang et al.64 publicaron un estudio aleatorizado sobre la práctica de Tai-chi con una frecuencia de 2 horas semanales durante 3 meses, en donde se observó una mejoría en la calidad de vida, la cual se sostenía al término de 6 meses.
ConclusionesEste cuadro clínico heterogéneo, caracterizado por dolor crónico y otros síntomas asociados, ha sido reconocido como enfermedad por la OMS en 1992, y como en muchas entidades análisis posteriores han replanteado los criterios diagnósticos, incorporando aspectos clínicos más precisos que los TP. En los últimos años algunos expertos han propuesto denominarla como «síndrome de sensibilidad central»65 o la «migraña del cuerpo»66, considerando que el aspecto del dolor crónico «fibro-muscular» es solo un aspecto clínico de este cuadro más complejo.
Las causas todavía no han sido dilucidadas, pero se esgrimen factores genéticos en su aparición. Los cambios descritos en la RMN funcional y la pérdida de sustancia gris y reducción volumétrica en áreas específicas, que apoyarían el diagnóstico de FM, han sido también puestos en duda, ya que se han identificado en otras enfermedades dolorosas crónicas67–70 y han sido considerados por algunos autores como inespecíficos, con un significado clínico controvertido71.
Si el concepto de FM como una condición específica merece críticas, ya que hasta el momento no se ha demostrado una patología física, salvo hallazgos de alteraciones cerebrales en la RMN funcional, también debería ser criticada la consideración de entidad nosológica de la migraña, el colon irritable o la cefalea tensional, entre otras.
El riesgo es interpretar los síntomas como de origen psicológico, sentenciando al paciente a la incertidumbre, a la potencial desacreditación social o laboral, y al peregrinaje médico que puede durar 5 años o más hasta su correcto diagnóstico72.
Si bien la FM permanece pobremente entendida y diagnosticada, la combinación de tratamiento farmacológico y no-farmacológico mejora la evolución clínica de quienes la padecen, ya que este cuadro puede producirles un marcado deterioro de su calidad de vida. Aunque no conozcamos exactamente su fisiopatogenia y permanezca en debate si se trata de un fenómeno de mala adaptación al dolor o un determinante genético que lleva a una falta de control central del mismo, si disponemos de tratamientos farmacológicos y no farmacológicos que contribuyen a mejorar a los dolientes, estos serán bienvenidos.
Conflicto de interesesLa Dra. Cintia Marchesoni ha sido oradora sobre el tema «fibromialgia» en colaboración con el laboratorio Pfizer.
El Dr. Federico Buonanotte ha sido orador sobre el tema «dolor» en colaboración con los laboratorios Pfizer y Janssen.
El Dr. Roberto Rey ha sido orador sobre el tema «dolor neuropático» en colaboración con los laboratorios Novartis y Pfizer.
Los autores agradecen la colaboración de Pfizer en la publicación de este artículo. Parte del material presentado en el presente trabajo ha sido mencionado en el simposio «Controversias sobre fibromialgia», del cual participaron los autores en el xlvii Congreso Argentino de Neurología en Mar del Plata en noviembre de 2010.