No es ninguna novedad que en el suero de los pacientes afectados de artritis reumatoide existen autoanticuerpos. El más conocido y utilizado hasta la fecha es el factor reumatoide, un autoanticuerpo dirigido contra la fracción constante de las inmunoglobulinas (Ig) G. Este autoanticuerpo ha sido ampliamente utilizado en el diagnóstico de la artritis reumatoide (basta recordar que es el único marcador serológico incluido en los criterios de clasificación del American College of Rheumatology [ACR])1. Pero no sólo se ha utilizado en el diagnóstico, ya que diversos trabajos han demostrado que la presencia de factor reumatoide tiene también valor en el pronóstico de la enfermedad2. Sin embargo, su sensibilidad y su especificidad limitadas ha hecho que se buscasen otros marcadores serológicos más sensibles y específicos para el diagnóstico de la artritis reumatoide.
De entre todos los anticuerpos estudiados, los anticuerpos contra los péptidos citrulinados han sido los que han adquirido una mayor relevancia en los últimos años. Pero ¿qué entendemos por anticuerpos contra péptidos citrulinados?
En 1964, Nienhuis y Mandema describieron por primera vez los anticuerpos antifactor perinuclear (APF)3, y en 1979, Young et al definieron los anticuerpos antiqueratina (AKA)4. Ambos autoanticuerpos, detectados mediante técnicas de inmunofluorescencia indirecta, presentan una gran especificidad para la artritis reumatoide, entre el 90 y el 98% en la mayoría de los trabajos, y característicamente un gran solapamiento entre las dos técnicas. Sin embargo, debido a su sensibilidad limitada (40-55%), junto a las dificultades técnicas para su determinación y la falta de estandarización de la técnica, estos autoanticuerpos se vieron relegados a grupos de investigación y laboratorios de inmunología especializados, por lo que no se utilizaron en la práctica clínica diaria de una manera mayoritaria.
En 1994, Despres et al describieron los anticuerpos anti-Sa5. Utilizando técnicas de inmunoblot y antígenos de bazo y placenta, detectaron unos autoanticuerpos con gran especificidad para la artritis reumatoide (98,9%), aunque con una sensibilidad similar a la de los autoanticuerpos anteriormente citados (42,7%). Trabajos posteriores también demostraron un solapamiento entre APF, AKA y anti-Sa.
Fue en 1995 cuando Sebbag et al6 consiguieron demostrar que tanto los AKA como los APF iban dirigidos contra moléculas relacionadas con la filagrina y la profilagrina humanas. Utilizando técnicas de inmunotransferencia consiguieron una sensibilidad y una especificidad para la artritis reumatoide similar a las obtenidas con los anticuerpos anteriormente citados. Sin embargo, el entusiasmo inicial decayó cuando se comprobó que los resultados entre los distintos grupos de investigación eran discordantes y dependían del sustrato y de los métodos utilizados para la purificación de la filagrina.
En 1998, Schellekens et al publicaron que son necesarios los residuos de citrulina para que los anticuerpos específicos de la artritis reumatoide reconozcan la molécula de filagrina7, y aquí se inició la era de los anticuerpos contra los péptidos citrulinados. A partir de aquí se desarrollan unas técnicas de enzimoinmunoanálisis (ELISA) con péptidos citrulinados lineales, obteniendo mediante la combinación de varios péptidos una sensibilidad del 76% para la artritis reumatoide con una especificidad del 96%. Si bien la técnica de ELISA es sencilla y reproducible, el hecho de precisar varios péptidos para llegar a la citada especificidad dificultaba su aplicación clínica. Este problema se solucionó mediante el ciclado de estos péptidos, lo que aumentó considerablemente la sensibilidad diagnóstica de la técnica. En la actualidad disponemos del ELISA de segunda generación con péptidos citrulinados cíclicos, que es el que se utiliza para la determinación de anticuerpos antipéptidos citrulinados cíclicos (anti-PCC).
Así pues, cuando hablamos de anticuerpos anti-PCC nos referimos a un grupo de autoanticuerpos específicos de la artritis reumatoide dirigidos contra proteínas citrulinadas. Las distintas técnicas utilizadas para su identificación consiguen la identificación de una fracción de éstos, si bien ninguna de las técnicas existentes hasta la fecha ha sido capaz de incluir el 100% de los anticuerpos determinados por las demás técnicas. Las ventajas de la determinación mediante ELISA anti-PCC respecto a las otras técnicas son: mayor sensibilidad (determinación de un mayor número de casos), tratarse de una técnica cuantitativa, de fácil realización y gran reproducibilidad, lo que permite su estandarización y la posibilidad de ser utilizada por la mayoría de los laboratorios de inmunología y, por tanto, permitir su aplicación en la clínica diaria.
Los péptidos citrulinados son proteínas que contienen residuos de citrulina. Pero ¿qué es la citrulina?
La citrulina es un aminoácido postraduccional, sintetizado a partir de la modificación de otros aminoácidos como la arginina mediante la intervención de la enzima peptidil arginina deiminasa (PAD). El paso de arginina a citrulina comporta una ligera variación en cuanto al peso molecular del aminoácido, pero con cambio de las cargas existentes, ya que pasa de ser un aminoácido cargado positivamente a un aminoácido neutro. Este cambio en las cargas comporta una variación en la estructura terciaria (tridimensional) de la proteína, haciendo que puedan variar sus propiedades antigénicas8.
Diversos trabajos han podido demostrar la sensibilidad y especificidad de los anticuerpos anti-PCC en la artritis reumatoide. En resumen, todos ellos muestran una sensibilidad del ELISA de segunda generación de aproximadamente entre el 50 y el 75% para la artritis reumatoide, con una alta especificidad que ronda el 95-98%9-11.
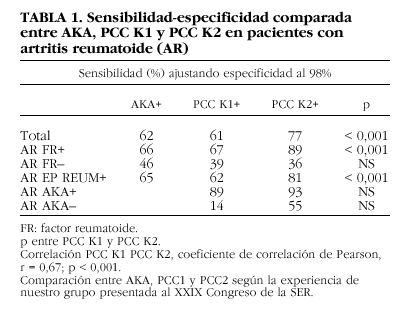
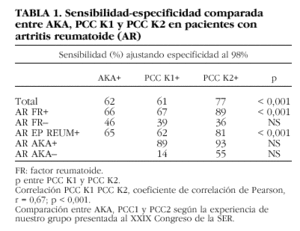
En nuestro grupo comparamos la sensibilidad de la determinación de los AKA, los anti-PCC con el kit de primera y segunda generación en pacientes con artritis reumatoide. Como se puede comprobar en la tabla 1, la sensibilidad de la determinación de AKA mediante inmunofluorescencia indirecta (IFI) fue similar a la obtenida mediante el ELISA de primera generación y claramente inferior a la obtenida mediante el ELISA de segunda generación. Esta ganancia de sensibilidad se produce a expensas de los pacientes con factor reumatoide positivo, mientras no se observaron diferencias significativas entre los pacientes con factor reumatoide negativo. Como se puede observar, un porcentaje no despreciable de pacientes seronegativos para el factor reumatoide tienen anticuerpos anti-PCC.
Sin embargo, la sensibilidad y la especificidad no son los mejores parámetros para evaluar la utilidad diagnóstica de una técnica. Lee et al estudiaron el valor predictivo de la determinación de los anti-PCC en un grupo de pacientes consecutivos diagnosticados de enfermedades reumáticas inflamatorias, y observaron que la determinación de los anti-PCC tendría un valor predictivo para positivos del 83% para el desarrollo de una artritis reumatoide y un valor predictivo para negativos del 79%12. Es decir, tener los anti-PCC positivos otorga al paciente una probabilidad del 83% de padecer una artritis reumatoide, y no presentar anti-PCC positivo otorga al individuo una probabilidad del 79% de no padecer artritis reumatoide en la población estudiada.
Otro estudio, más interesante si cabe, es el comunicado por Steiner et al13, en el que estudian a 180 pacientes con artritis de menos de 3 meses de evolución; 100 de estos pacientes acabaron desarrollando una artritis reumatoide con el tiempo, mientras que 80 desarrollaron una enfermedad distinta de la artritis reumatoide.
La determinación de los anti-PCC en estos pacientes al inicio de los síntomas tuvo un valor predictivo para positivos para el desarrollo de artritis reumatoide del 97% y la determinación conjunta de anti-PCC y factor reumatoide al principio de los síntomas mostró un valor predictivo para positivos del 100%.
En estos 2 estudios se demuestra la indudable utilidad de estos autoanticuerpos, sobre todo en las clínicas de artritis de inicio.
Otro de los aspectos útiles de la determinación de los anti-PCC es la posibilidad que ofrecen estos autoanticuerpos para distinguir procesos que podrían confundirse con una artritis reumatoide, sobre todo al inicio de la enfermedad. Entre los trabajos realizados al respecto cabe destacar la comunicación de Martínez-Taboada et al al ACR en 200314 y el trabajo publicado por Kesel et al en 200015. En ellos se muestra la utilidad de los anti-PCC para poder realizar el diagnóstico diferencial entre la polimialgia reumática y la artritis reumatoide del anciano al inicio de una poliartritis en personas mayores, y la diferenciación entre las poliartralgias o poliartritis asociadas a la infección crónica por virus de la hepatitis C (en muchas ocasiones con factor reumatoide positivo) y una verdadera artritis reumatoide, respectivamente.
Sólo en una enfermedad distinta de la artritis reumatoide se han encontrado títulos elevados de anticuerpos anti-PCC: el reumatismo palindrómico (RP). Como se puede comprobar en un trabajo publicado por nuestro grupo de investigación16, hallamos una prevalencia de anticuerpos anti-PCC del 56,3% utilizando técnicas de ELISA de primera generación entre los pacientes afectados de reumatismo palindrómico no asociado a otra enfermedad. La presencia de estos autoanticuerpos no permitía distinguir el subgrupo con artritis reumatoide iniciada en forma de reumatismo palindrómico de aquellos que presentaron reumatismo palindrómico persistente, aunque es de destacar que ninguno de los pacientes que desarrollaron una enfermedad distinta de la artritis reumatoide después de una presentación inicial como reumatismo palindrómico presentaron anti-PCC en su suero.
Demostrada, sin duda, la utilidad de los anti-PCC en el diagnóstico de la artritis reumatoide, ¿qué podemos decir de su papel en el pronóstico?
¿Pueden distinguir estos autoanticuerpos una enfermedad más agresiva?
¿Pueden estos autoanticuerpos distinguir grupos de pacientes con distinta respuesta al tratamiento?
En un intento de responder a la primera pregunta se han realizado diversos trabajos, con resultados discordantes.
Así, Meyer et al17 encuentran que los anti-CCP tienen la mayor OR (odds ratio) a la hora de explicar la progresión radiológica de la enfermedad a los 5 años.
En el otro extremo, el estudio llevado a cabo por nuestro grupo de trabajo, en el que en pacientes con artritis reumatoide de corta evolución sometidos a un mismo protocolo de tratamiento, al cabo de un año no encontramos relación entre progresión y presencia de anticuerpos anti-PCC18, si bien estos resultados son provisionales dado que la muestra se limitaba a los primeros 60 pacientes que completaron el año de seguimiento. Estos dos trabajos podríamos considerarlos como los extremos de un continuo, y puede observarse que, aunque diversos trabajos han abordado el tema del valor pronóstico de los anti-PCC, no existe unanimidad a la hora de valorar la utilidad como factor pronóstico de dichos autoanticuerpos.
Quizá con el mensaje que nos debamos quedar sea con el que publicaron Kroot et al19 que, tras seguir una cohorte de 273 pacientes durante 6 años, comprobaron que los anti-PCC tenían un valor pronóstico moderado a los 6 años, aunque junto con el factor reumatoide eran los únicos factores estudiados que mostraban valores pronósticos significativos.
En cuanto a si los anti-PCC pueden distinguir grupos de pacientes con distinta respuesta a los tratamientos recibidos, existen en la actualidad muy pocos trabajos, por no decir ninguno, que aborde este tema. Éstos son los resultados provisionales obtenidos por nuestro grupo al intentar responder esta pregunta (datos no publicados presentados al EULAR 2004). En la cohorte de pacientes con artritis reumatoide de corta evolución, pudimos comprobar que cuando dividíamos a los pacientes entre los que presentaban títulos altos de anti-PCC antes de iniciar el tratamiento con fármacos antirreumáticos modificadores de la enfermedad (FAME) y los que presentaban títulos bajos (utilizando como punto de corte la mediana de los anti-PCC), los primeros presentaban al cabo de 1 año peores tasas de respuesta ACR 50 que los segundos.
Asimismo, pudimos observar que los títulos de anti-PCC se redujeron de forma significativa (desde una media de 605 U a una media de 306 U, p < 0,05) después de 1 año de tratamiento con FAME. En estos momentos estamos analizando si esta reducción se correlaciona también con una mejoría clínica o respuesta terapéutica.
Asimismo, también pudimos comprobar el descenso de los títulos de anticuerpos anti-PCC en los pacientes con artritis reumatoide de larga evolución sometidos a tratamiento con infliximab (679 U antes del inicio del tratamiento y 575 U a las 30 semanas [p < 0,05]). Sin embargo, ni la presencia de anti-PCC ni la magnitud del descenso de anti-PCC se correlacionaron con la respuesta al tratamiento. El número de pacientes es pequeño para sacar conclusiones; no obstante, existe un estudio de próxima publicación donde se confirma este descenso, y los autores lo asocian a una mejor respuesta terapéutica.
¿Tienen algún significado fisiopatológico o son simples epifenómenos?
Diversos trabajos han reflexionado sobre este tema20, y aunque no queda clara la respuesta, existen algunos datos que pueden sugerir la intervención de los PCC en la fisiopatología de la artritis reumatoide.
La aparición precoz de anticuerpo anti-PCC mucho antes del inicio sintomático de la enfermedad, produciéndose un incremento importante en los títulos de dichos anticuerpos en los 2 años previos al inicio de las manifestaciones clínicas21.
La demostración de la secreción local en la sinovial de anticuerpo anti-PCC en el pannus sinovial22.
El hecho de que sólo el modelo humano produzca anticuerpos anti-PCC ante el estímulo de los péptidos citrulinados23.
El descubrimiento de polimorfismos de la PAD predominantes en la artritis reumatoide24, lo que parece indicar la posibilidad de la intervención del proceso de citrulinización y/o la respuesta a los péptidos citrulinados en la fisiopatología de la artritis reumatoide.
Un posible mecanismo fisiopatológico es el que presentan Vossenaar et al, sugiriendo que una agresión articular desencadenaría una respuesta inflamatoria en la que se produciría un daño celular y muerte de células del sistema granulocitario. Con la muerte y destrucción de dichas células, enzimas intracelulares como el PAD pasarían al medio extracelular, produciendo la citrulinización de determinadas proteínas. Estas proteínas citrulinadas se comportarían como neoantígenos y serían presentadas por las células presentadoras de antígeno unidas a moléculas del HLA (antígenos de histocompatibilidad) DR. Esto, a su vez produciría una estimulación de las células T, que a su vez estimularían las células B para producir autoanticuerpos anti-PCC. Estos anticuerpos se unirían a las proteínas citrulinadas produciendo una estimulación del sistema mononuclear fagocítico que, a su vez, estimularía la presencia de granulocitos. Pequeñas alteraciones en este proceso pueden llevar a una respuesta anómala perpetuando la inflamación, produciendo, en definitiva, una artritis reumatoide25.
Así, como resumen final podemos decir que los anticuerpos anti-PCC son los marcadores más específicos de la artritis reumatoide que se conocen.
Estos autoanticuerpos han demostrado su utilidad en el diagnóstico de la artritis reumatoide (sobre todo en el contexto de las clínicas de artritis de reciente comienzo). Aunque existen datos contradictorios, estos anticuerpos podrían tener implicaciones pronósticas, distinguiendo subgrupos de pacientes con peor respuesta clínica o mayor agresividad erosiva. Y como han postulado diversos autores, podrían ser algo más que un epifenómeno y verdaderamente desempeñar un papel importante en la etiopatogenia de la artritis reumatoide.